Журнал «Болезни и антибиотики» 1 (04) 2011
Вернуться к номеру
Университеты практических врачей. Антибактериальная терапия внебольничных инфекций дыхательных путей и ЛОР-органов Материалы научно-образовательного проекта
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Окончание. Начало в № 1, 2010
Тема 7. Внебольничные пневмонии: лечение в стационаре
Целесообразность разграничения нетяжелой и тяжелой внебольничной пневмонии (ВП) у госпитализированного больного:
— определение места лечения пациента: общетерапевтическое отделение или отделение реанимации и интенсивной терапии (ОРИТ);
— оптимизация использования ресурсов ОРИТ;
— запоздалый перевод больных в ОРИТ в связи с дыхательной недостаточностью и/или септическим шоком ассоциируется с увеличением смертности;
— этиология тяжелых и нетяжелых ВП несколько отличается, что обусловливает различия в терапевтической тактике;
— необходимость идентификации больных с ВП, которым показана иммуномодулирующая терапия (это прежде всего больные с сепсисом).
Критерии тяжелой внебольничной пневмонии
Общепринятых критериев в настоящее время нет.
Критерии тяжелой ВП Американского торакального общества (ATS) и Американского общества инфекционистов (IDSA) (2007 г.): «большие» и «малые».
«Большие» критерии (каждый из которых является абсолютным показанием для госпитализации в ОРИТ):
— искусственная вентиляция легких с интубацией трахеи;
— септический шок и потребность во введении вазопрессоров.
«Малые» критерии:
— число дыхательных движений і 30 в 1 мин;
— PaO2 /FiO2Ј 250 (отношение напряжения кислорода в артериальной крови к фракции кислорода во вдыхаемом воздухе);
— инфильтрация двух и более долей легких;
— спутанность сознания/дезориентация;
— уремия (азот мочевины і 30 мг/дл, или 7,0 ммоль/л);
— лейкопения как результат инфекции (число лейкоцитов < 4,0 Ч 109/л);
— тромбоцитопения (число тромбоцитов < 100 Ч 109/л);
— гипотермия (температура тела < 36 °С);
— гипотензия и потребность в энергичном возмещении жидкости.
Интерпретация. Наличие і 3 «малых» критериев является основанием для госпитализации в ОРИТ.
Предложенные критерии можно использовать в качестве рабочего инструмента при определении места лечения госпитализированного больного с ВП.
Время введения первой дозы антибиотика после постановки диагноза внебольничной пневмонии
В стационарах антибиотики больным с ВП следует вводить неотложно — в случае госпитализации в ОРИТ или палату интенсивной терапии и желательно в приемном покое больницы — при госпитализации в общетерапевтическое отделение.
Путь введения антибиотиков
Госпитализированным больным с ВП антибиотики рекомендуется назначать парентерально. Только для пациентов с нетяжелой ВП, госпитализированных в терапевтические отделения, допускается назначение макролидов внутрь — в отсутствие нарушений всасывания в кишечнике. При этом b-лактамные антибиотики, которые назначаются данной категории пациентов в комбинации с макролидами, предлагается вводить парентерально.
Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія. Затверджений наказом МОЗ України від 19.03.2007 р. № 128.
В действительности продемонстрировать превосходство парентерального введения антибиотиков над пероральным у госпитализированных больных с нетяжелой ВП не удалось. В метаанализе 7 сравнительных исследований у пациентов с обычным уровнем иммунитета назначение антибиотиков внутрь не сопровождалось ни снижением клинической эффективности, ни увеличением смертности больных.
Marras T.K. et al. // Am. J. Med. 2004; 116: 385-93.
Больным с тяжелой ВП антибиотики на начальном этапе назначаются внутривенно. После стабилизации клинического состояния больного рекомендуется перевод на непарентеральный (как правило, пероральный) путь введения антибиотиков.
Ведение госпитализированных больных с внебольничными пневмониями
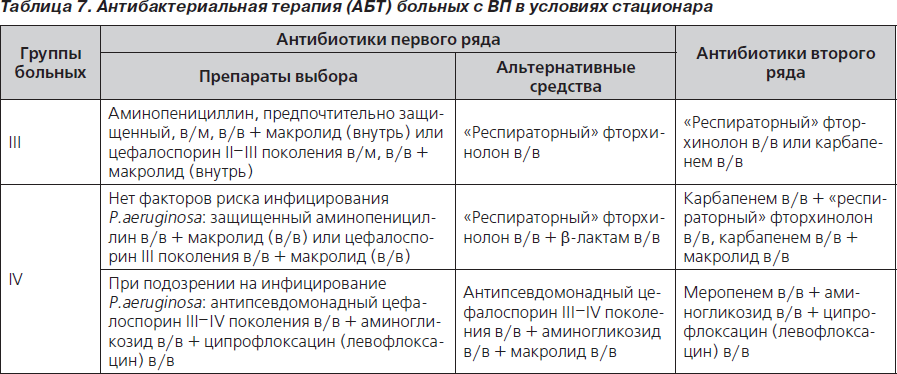
В соответствии с действующим в Украине протоколом оказания помощи больным с ВП различают пациентов III (нетяжелое течение заболевания, госпитализация в общетерапевтические отделения) и IV группы (тяжелое течение ВП, госпитализация в ОРИТ или палаты интенсивного наблюдения).
Длительность антибактериальной терапии в стационаре
Ориентировочная продолжительность АБТ при нетяжелой ВП составляет 7 дней.
Больных с тяжелой ВП (возбудитель при микробиологическом исследовании не выявлен) предпочтительнее лечить на протяжении 10 дней антибиотиками в/в. При ВП, вызванных Legionella spp., S.aureus, грамотрицательными энтеробактериями, длительность АБТ может достигать 14–21 суток.
В США внебольничная пневмония официально зарегистрирована как показание для кратких (на протяжении 5 суток) высокодозовых (750 мг 1 раз в сутки) курсов лечения левофлоксацином.
Длительность пребывания больных с внебольничными пневмониями в стационаре
В обсервационных исследованиях не выявлено преимуществ продолжения наблюдения за больными в стационаре, если пациент становился клинически стабильным.
Причины клинических неудач при лечении больных с внебольничными пневмониями
Определение ранней клинической неудачи: недостаточный эффект лечения либо ухудшение клинического состояния и/или рентгенологических признаков через 48–72 ч от начала терапии, требующие изменения АБТ либо проведения инвазивных процедур.
Факторы риска ранних клинических неудач у госпитализированных больных с ВП:
— IV–V классы риска по шкале PSI;
— поражение і 2 долей легких;
— легионеллезная пневмония;
— грамотрицательная пневмония;
— наличие сопутствующей опухоли;
— наличие неврологического заболевания.
Тема 8. Ступенчатая терапия при лечении бактериальных инфекций
Определение
Ступенчатая терапия (sequential therapy, switch therapy, step-down therapy, streamline therapy, follow-on therapy) — двухэтапное применение антиинфекционных препаратов с переходом с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента.
Страчунский Л.С., Розенсон О.Л. // Клин. фармакол. тер. — 1997. — 6(4).
Варианты ступенчатой терапии
Собственно ступенчатая терапия (sequential therapy) — перевод с парентерального на пероральное введение одного и того же медикамента.
Пример: перевод пациента с парентерального введения 500 мг левофлоксацина 1 раз в сутки на прием внутрь этого же антибиотика в той же самой дозе и с такой же кратностью введения. Обе лекарственные формы левофлоксацина терапевтически эквивалентны.
Последовательная терапия (switch therapy) — перевод с парентерального введения медикамента на прием внутрь другого препарата, который относится к тому же классу лекарственных средств (ЛС) и оказывает сопоставимое терапевтическое действие.
Примеры: перевод с парентерального введения пенициллина на прием внутрь феноксиметилпенициллина или перевод с парентерального введения ванкомицина на прием внутрь тейкопланина.
Нисходящая терапия (step-down therapy) представляет собой перевод с парентерального введения медикамента на пероральный прием препарата, принадлежащего к другому классу лекарственных средств либо относящегося к ранее использовавшемуся классу, но с иной частотой применения, дозой или спектром активности (в случае антибиотиков).
Примеры: перевод больного с парентерального введения ампициллина/сульбактама по 1,5 г каждые 6 ч на прием внутрь амоксициллина/клавуланата по 875 мг каждые 12 ч либо перевод с парентерального введения цефтриаксона на пероральный цефалоспорин III поколения (цефподоксим проксетил и др.).
Комментарий. В медицинской литературе эти терминологические различия нередко игнорируются и обыкновенно под термином «ступенчатая терапия» понимают и последовательную, и нисходящую. Взаимозаменяемость терминов обусловлена тем, что они базируются на едином принципе: антибиотики, которые вводятся парентерально и применяются внутрь, должны иметь сходный или идентичный спектр активности.
Биодоступность антибиотиков при парентеральном введении и при приеме внутрь
Биодоступность характеризует долю от принятого внутрь лекарства, которая попадает в системный кровоток больного. При внутривенном введении препарата в системное кровообращение попадает 100 % дозы. У медикаментов, которые принимаются внутрь, биодоступность нередко ниже, что связано с различиями в скорости и степени растворения препарата в пищеварительном тракте и в количестве лекарства, которое достигает системного кровотока после всасывания. Ступенчатую терапию одним и тем же антибиотиком следует рассматривать как субоптимальную, если биодоступность лекарственной формы для приема внутрь < 60 %.
Комментарий. Биодоступность лекарственных форм для приема внутрь некоторых современных антибиотиков составляет почти 100 % (офлоксацин) или равна 100 % (левофлоксацин).
Какие антибиотики могут использоваться для ступенчатой терапии?
Оптимальными антибиотиками для назначения внутрь при ступенчатой терапии являются препараты: 1) обладающие спектром действия, сопоставимым с ранее использовавшимся парентеральным антибиотиком, либо активные в отношении выделенного возбудителя; 2) отличающиеся высокой биодоступностью (> 80 %) и хорошей переносимостью; 3) эффективность которых подтверждена в качественных клинических исследованиях, включая рандомизированные. Повышению комплаентности способствуют и потому весьма желательны такие характеристики препарата, как наличие многих лекарственных форм для приема внутрь (например, таблеток и сиропов) и кратность применения, соответствующая (или меньше) таковой при использовании парентеральной формы препарата.
Критерии исключения пациентов из числа кандидатов на перевод на пероральный прием антибиотиков
1. Тяжесть заболевания (до улучшения клинического состояния после начальной парентеральной терапии).
2. Локализация инфекционного процесса: инфекционный эндокардит, менингит, абсцесс мозга, орбитальный целлюлит, другие инфекции центральной нервной системы и эндофтальмит.
3. Нарушения всасывания в желудочно-кишечном тракте:
— наличие назогастрального зонда и отсасывание через него содержимого желудка;
— тяжелая/стойкая тошнота и рвота;
— синдром мальабсорбции, перенесенная резекция желудка или гастрэктомия, синдром короткого кишечника и другие состояния, при которых ускоряется время прохождения медикаментов через пищеварительный тракт и/или снижается всасывание;
— (продолжающееся) желудочно-кишечное кровотечение;
— введение высоких доз вазопрессоров (особенно в условиях шока);
— затруднения при глотании или нарушения сознания при отсутствии непосредственного доступа в желудок (например, через назогастральный зонд);
— документированная кишечная непроходимость;
— продолжающееся энтеральное питание, которое нельзя прекратить, а больной нуждается в приеме медикаментов, нарушающих всасывание.
Критерии отбора больных для проведения ступенчатой терапии
В обязательном порядке включают в себя:
1) интактный и функционирующий желудочно-кишечный тракт;
2) улучшение клинического состояния после начальной парентеральной терапии.
Правила перевода больного с парентерального на непарентеральный путь введения медикаментов при наличии постоянного энтерального зонда
— Для введения через назогастральный зонд следует выбрать наиболее пригодную лекарственную форму препарата для приема внутрь. Растворы и суспензии предпочтительнее таблеток. Если такая возможность отсутствует, таблетку следует размельчить (при условии, что эта таблетка не относится к числу форм с постепенным высвобождением препарата или с кишечнорастворимым покрытием). Далее таблетку растворяют в небольшом количестве жидкости для приготовления суспензии и с помощью большого шприца вводят через зонд. После завершения процедуры все оборудование, использовавшееся для приготовления и введения препарата, ополаскивают и полученные смывы снова вводят через зонд.
— Перед введением и после завершения введения медикамента зонд, через который осуществляется введение, промывают водой во избежание закупорки.
— Ни в коем случае медикаменты не добавляются непосредственно к питательным смесям, вводимым через зонд.
— При введении пероральных фторхинолонов следует прекратить энтеральное питание за 2 ч до введения и возобновить его не ранее чем через 2 ч после окончания процедуры.
Ступенчатая терапия: преимущества для стационаров
— снижение расходов на лечение;
— сокращение длительности пребывания больных в стационаре.
Ступенчатая терапия: преимущества для пациентов
— уменьшение количества инъекций и, следовательно, более комфортное лечение;
— уменьшение риска постинъекционных осложнений (абсцессы, флебиты, катетер-ассоциированные инфекции);
— ранняя выписка и продолжение лечения в более привычных и удобных домашних условиях в сочетании со снижением риска нозокомиальных инфекций.
Сроки перевода больных с парентерального пути введения антибиотиков на пероральный
Два подхода к определению сроков перевода больных с парентерального введения антибиотиков на прием их внутрь:
1) после достижения стабилизации клинического состояния пациента;
2) волевой перевод спустя определенный срок парентеральной антибиотикотерапии (обычно і 2 суток), вне зависимости от достигнутого эффекта.
Примеры. Критерии перевода больных с внебольничной пневмонией на пероральный прием антибиотиков (Украина):
— нормальная температура тела во время двух последних измерений с интервалом 8 ч;
— уменьшение выраженности одышки;
— отсутствие нарушений сознания;
— позитивная динамика других симптомов заболевания;
— отсутствие нарушений всасывания в пищеварительном тракте;
— согласие (настроенность) больного на прием препаратов внутрь.
Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія. Затверджений наказом МОЗ України від 19.03.2007 р. № 128.
Критерии стабилизации клинического состояния пациента с внебольничной пневмонией (IDSA/ATS):
— температура тела Ј 37,8 °С;
— частота сердечных сокращений Ј 100 ударов в 1 мин;
— частота дыхательных движений Ј 24 в 1 мин;
— систолическое артериальное давление і 90 мм рт.ст.;
— насыщение артериальной крови кислородом (SaO2) і 90 % или напряжение кислорода в артериальной крови (PaO2) > 60 мм рт.ст. при дыхании комнатным воздухом;
— способность принимать препараты внутрь;
— отсутствие нарушений сознания.
Mandell L.A. et al. // Clin. Infect. Dis. 2007; 44 (suppl): S27-S72.
Примечание ко второму примеру. Два последних критерия имеют значение: 1) для решения вопроса о выписке больного или 2) перевода его на прием антибиотиков внутрь, но не являются необходимыми для суждения об отсутствии эффекта от антибактериальной терапии.
Ранний перевод больных с внебольничной пневмонией с парентерального введения антибиотиков на прием их внутрь
Достоинства раннего перевода на пероральный прием:
— снижение стоимости лечения;
— возможность ранней выписки из стационара для долечивания в амбулаторных условиях.
Возможные недостатки раннего перевода:
— возрастание риска клинических неудач, повторных госпитализаций и смертности;
— увеличение нагрузки на членов семьи и работников системы здравоохранения, оказывающих помощь больному в амбулаторных условиях.
Результаты метаанализа ранней ступенчатой терапии (перевод спустя 2–4 суток от начала антибиотикотерапии) у госпитализированных больных со среднетяжелой и тяжелой внебольничной пневмонией:
— эффективность лечения — у 86,2 % больных в группе ранней ступенчатой терапии и у 86,5 % пациентов из группы постоянной внутривенной терапии;
— смертность в обеих группах сопоставима;
— переносимость ступенчатой терапии лучше, а длительность пребывания в стационаре меньше.
Athanassa Z. et al. // Drugs. 2008; 68: 2469-2481.
Отличие ступенчатой терапии от деэскалационной
Деэскалация — один из компонентов современной стратегии лечения больных с тяжелыми инфекциями («Лечи сразу правильно»):
— раннее применение антибиотиков широкого спектра действия;
— использование оптимальной дозы и пути введения препарата;
— выбор антибиотиков базируется на знании локального профиля резистентности ключевых возбудителей;
— ранняя коррекция или прекращение антибактериальной терапии в зависимости от результатов микробиологического исследования (деэскалация);
— адекватная длительность антибактериальной терапии.
Сущность деэскалации:
— уменьшение количества и/или сужение спектра антибиотиков;
— незамедлительная отмена антибиотика(-ов) у больных с подтвержденной неинфекционной этиологией заболевания:
– снижение расходов на лечение;
– снижение риска возникновения резистентности.
Masterton R.G. // Int. J. Antimicrob. Agents 2009; 33: 105.e1-105.e8.
Тема 9. Приверженность к приему антибиотиков и пути ее повышения при бактериальных инфекциях
Термины, характеризующие прием медикаментов пациентами
Комплаентность
Недостатки: термин указывает на пассивное выполнение больным назначений врача и на тот факт, что план лечения не был согласован врачом с пациентом.
Приверженность к лечению: термин более гибкий и позволяет оценивать долю от выписанных доз медикаментов, которые действительно были приняты пациентом за определенный промежуток времени.
Этот термин позволяет учитывать также сведения о приеме (принимались ли ежедневно все выписанные таблетки?) и времени приема лекарств (принимались ли медикаменты в указанные промежутки времени?).
Osterberg L., Blaschke T. // N. Engl. J. Med. 2005; 353: 487-497.
Плохая (низкая) приверженность к лечению
Намеренная: больной осознанно отказывается от приема лекарств из-за различных причин — финансовых (невозможность приобретения выписанного препарата из-за отсутствия средств), личностных (ощущение себя выздоровевшим или здоровым либо безразличное отношение к своему здоровью) и т.д.
Непреднамеренная: пропуск приема (очередной) дозы препарата чаще всего связан с забывчивостью или затруднениями при приеме медикамента из-за неудобной упаковки или формы выпуска.
Приверженность к приему лекарств:
— является одной из черт личности человека;
— низкая приверженность не связана ни с возрастом, ни с полом больного, ни с его семейным или социальным положением, уровнем образования, доходами, ни даже со стоимостью препарата или отсутствием необходимости платить за лекарство.
Kardas P. // J. Antimicrob. Chemother. 2002; 49: 897-903.
Ошибки больных во время лечения антибиотиками
— Пропуск приема очередной дозы антибиотика:
- непреднамеренный;
- намеренный — например, из-за опасений взаимодействия антибиотика с алкоголем или с другими медикаментами;
— Прием дополнительных доз антибиотика, особенно в начале лечения:
- возможные причины: тяжесть симптомов заболевания, желание добиться скорейшего улучшения;
— Досрочное прекращение приема лекарств:
- возможные причины: 1) наступление субъективного улучшения до завершения предписанного курса терапии; 2) возникновение побочных эффектов в процессе лечения; 3) затруднения при проглатывании или неприемлемые для больного органолептические свойства таблеток антибиотиков (неприятный вкус или запах); 4) «обманутые ожидания» — отсутствие значительного улучшения в ожидавшиеся пациентом сроки и т.д.
— Самостоятельное изменение режима дозирования (например, прием антибиотика 2 раза в сутки вместо 3):
- возможные причины: несовпадение режима дозирования с образом жизни или работы пациента.
— Отказ от приобретения антибиотика:
- возможные причины: экономические соображения, опасения негативного воздействия препарата на желудочно-кишечный тракт, иммунную систему и др.
— Задержка с началом лечения:
- возможная причина: надежда на самостоятельное разрешение инфекции без приема антибиотика.
Kardas P. // J. Antimicrob. Chemother. 2002; 49: 897-903.
Подходы к повышению приверженности к приему антибиотиков при бактериальных инфекциях
1) Уменьшение кратности приема антибиотиков.
2) сокращение продолжительности терапии.
3) выбор приемлемой для пациента или его родителей/опекунов лекарственной формы либо упаковки препарата.
4) выведение на рынок медикаментов с улучшенной переносимостью.
5) выдача пациенту (либо его родственникам и/или опекунам) письменных инструкций по приему антибиотиков.
6) обучение больного.
7) использование разных форм напоминания о времени приема очередной дозы.
Тема 10. Межлекарственные взаимодействия при использовании антибактериальных средств
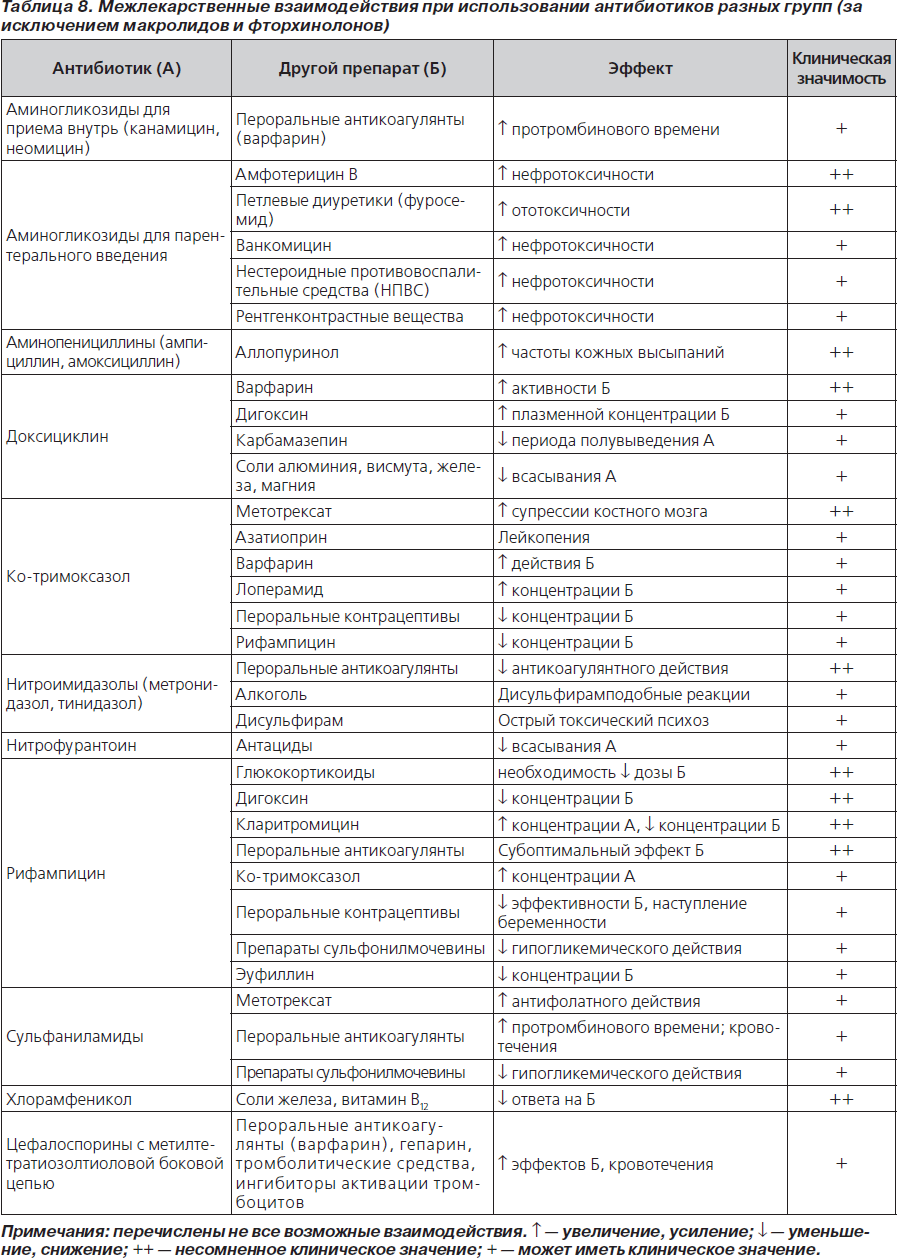
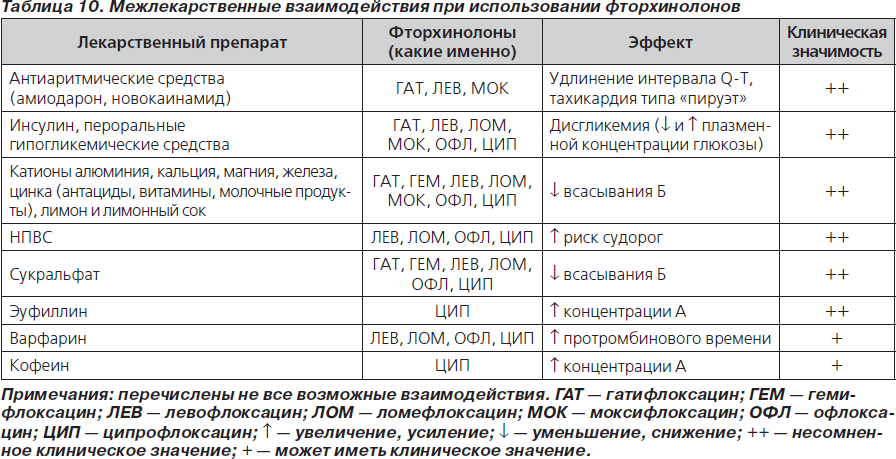
Под лекарственным взаимодействием понимают усиление (синергизм) или ослабление (антагонизм) терапевтического эффекта при одновременном или последовательном применении двух или нескольких лекарственных препаратов (табл. 8–10).
По клинической значимости выделяют 4 типа лекарственных взаимодействий:
1) не имеющие клинического значения;
2) клиническое значение в настоящее время не известно;
3) в результате взаимодействия изменяется терапевтический эффект, что требует коррекции дозы препарата;
4) высокий риск тяжелых нежелательных реакций или терапевтической неэффективности, вследствие чего комбинировать такие лекарственные средства не рекомендуется.
Выделяют два уровня взаимодействия: фармацевтическое и фармакологическое. Фармацевтическое взаимодействие развивается до введения лекарственного средства (ЛС) в организм — при совместном приготовлении, хранении, смешивании в одном шприце или инфузионной системе и относится к категории нецелесообразных взаимодействий. Предупреждение данного типа взаимодействий заключается в правильном приготовлении раствора ЛС, использовании индифферентных растворителей ЛС.
К фармакологическому взаимодействию относятся фармакокинетическое и фармакодинамическое взаимодействие ЛС. Фармакокинетические взаимодействия возникают, если всасывание, транспорт, метаболизм или выведение препарата — объекта воздействия (ПОВ) изменяется другим медикаментом. В частности, всасывание ЛС и, соответственно, их биодоступность может изменяться при изменении рН желудка, на фоне применения антацидов, адсорбентов, прокинетиков, приема пищи и т.д. При фармакодинамических взаимодействиях «провоцирующий» препарат изменяет активность/действие ПОВ в точке приложения.
Наиболее значимое клиническое взаимодействие происходит во время метаболизма препарата (чаще в печени). Такое взаимодействие наблюдается, если метаболизм препарата-объекта угнетается или ускоряется другим препаратом.
Основой процессов метаболизма является окисление, зависящее от присутствия НАДФН+ и гемсодержащего белка — цитохрома Р450. Индуктором микросомальных ферментов является рифампицин, ингибиторами — некоторые макролиды, ципрофлоксацин и т.д.
Наиболее часто взаимодействия провоцируют лекарства, активно связывающиеся с белками и вытесняющие ПОВ из комплекса с этими белками, например ацетилсалициловая кислота, сульфаниламиды и др.
В некоторых случаях синергизм может приводить к повышению риска развития нежелательных лекарственных явлений (например, кровотечений при приеме антибиотиков разных классов совместно с непрямыми антикоагулянтами). Риск нефротоксичности и ототоксичности повышается при одновременном использовании аминогликозидов или гликопептидов с петлевыми диуретиками.
При взаимодействии некоторых антибиотиков (цефоперазон, метронидазол) с алкоголем развивается дисульфирамподобная реакция: головная боль, покраснения кожи, тошнота и головокружение.
Тема 11. Применение пробиотиков для профилактики антибиотикоассоциированных диарей (ААД) и инфекций дыхательных путей (ИДП)
Определение
Пробиотики — это живые микроорганизмы, которые при использовании в адекватных количествах оказывают положительный эффект на здоровье организма-хозяина.
Food and Agriculture Organization of the United Nations and the World Health Organization. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Cordoba, Argentina; 2001.
Антибиотикоассоциированная диарея
Пробиотики:
— снижают риск возникновения ААД на 52 % (данные метаанализа 19 исследований);
— наилучший эффект отмечался в случае использования пробиотиков в первые 72 ч от начала антибиотикотерапии;
— данные получены в исследованиях с L.rhamnosus, L.acidophilus, S.boulardii, причем выраженность эффекта при использовании разных штаммов различалась незначительно.
Sazawa S. et al. // Lancet Infect Dis. 2006; 6 (6): 374-382.
Относительный риск возникновения ААД при использовании пробиотиков по сравнению с плацебо равен 0,43 (метаанализ 25 РКИ с общим числом включенных больных 2810 чел.):
– L.rhamnosus, S.boulardiiи смеси из двух и более видов пробиотиков в равной степени эффективны в предотвращении возникновения ААД;
– эффективность пробиотиков существенно выше в исследованиях с использованием более 10 млрд колониеобразующих единиц (КОЕ) микроорганизмов в сутки;
— S.boulardii дозируется из расчета 250–500 мг в сутки;
— у людей, принимавших пробиотики, на 41 % снижался риск развития инфекций, вызванных Clostridiumdifficile;
— снижение частоты рецидивов инфекций, вызванных C.difficile, продемонстрировано только при использовании S.boulardii.
McFarland L.V. // Am. J. Gastroenterol. 2006; 101 (4): 812-822.
Предварительные данные свидетельствуют, что прием пробиотиков в виде ферментированного молока, содержащего L.casei DN-114 001, и йогуртов, содержащих L.bulgaricusи S.thermophilus, может быть полезным компонентом диеты и снижать риск развития ААД и образование токсинов C.difficile у госпитализированных больных.
Применение пробиотиков для предупреждения инфекций дыхательных путей (ИДП) или улучшения состояния при этих заболеваниях:
— профилактический прием пробиотиков здоровыми людьми не уменьшает заболеваемость ИДП;
— пробиотики оказывают позитивное влияние на длительность и тяжесть последующих ИДП;
— пробиотики обладают хорошим профилем безопасности;
— у взрослых больных, госпитализированных в ОРИТ, использование пробиотиков не способствует снижению заболеваемости нозокомиальными инфекциями, сокращению длительности пребывания в ОРИТ и снижению госпитальной летальности.
Vouloumanou E.K. et al. // Int. J. Antimicrob. Agents. 2009; 34: 197.e1-197.e10;
Watkinson P.J. et al. // Clin. Nutr. 2007; 26: 182-192.