Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Синдром капиллярной утечки
Авторы: Курсов С.В., Михневич К.Г. Харьковский национальный медицинский университет
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Введение
В 1960 г. Bayard Clarkson, David Thompson, Melvin Horwith и E. Hugh Luckey в Американском медицинском журнале впервые описали клинический случай рецидивирующего отечного синдрома, сочетающегося с проявлениями гиповолемического шока, у молодой женщины. Патология заключалась в периодической и необъяснимой потере части плазмы крови из сосудистого русла в интерстиций, которая происходила в предменструальном периоде. Пагубные последствия внезапно повторяющегося резкого повышения капиллярной проницаемости в итоге привели к гибели пациентки. В настоящее время известно не более 1000 описанных случаев идиопатической формы синдрома капиллярной утечки (СКУ) с частотой смертельного исхода, составляющей 21 %.
Основными признаками синдрома считают:
1) артериальную гипотензию вследствие гиповолемии;
2) рост гемоконцентрационных показателей — гематокритного числа и концентрации гемоглобина в крови;
3) гипоальбуминемию без альбуминурии;
4) появление генерализованного отека.
Однако, как очень скоро выяснилось, капиллярная утечка в той или иной мере однозначно присутствует в подавляющем числе случаев критических состояний организма человека и животных. Наиболее сильно она выражена в условиях сепсиса и шока. Поэтому под синдромом капиллярной утечки на современном этапе чаще всего понимают наблюдающееся в условиях критических состояний (сепсис, шок, ожоги, респираторный дистресс-синдром) прогрессирующее патологическое нарастание капиллярной проницаемости, ведущее к потере жидкой части крови в интерстициальный сектор внеклеточного водного пространства, с дальнейшим развитием гиповолемии, гипоперфузии органов и тканей, затруднением транспорта кислорода и быстрым формированием полиорганной дисфункции.
В возникновении СКУ главная роль принадлежит нарушению функций сосудистого эндотелия, связанным с ним иммунным реакциям и целому ряду медиаторов воспаления.
Функции эндотелия и роль составляющих уравнения Старлинга в развитии синдрома капиллярной утечки
Эндотелий представляет собой внутреннюю выстилку кровеносных сосудов, отделяющую кровоток от более глубоких слоев сосудистой стенки. Это непрерывный монослой эпителиальных клеток, формирующих ткань, масса которой составляет у человека 1,5–2,0 кг. Эндотелий непрерывно вырабатывает огромное количество важнейших биологически активных веществ, являясь таким образом гигантским паракринным органом, распределенным по всей площади человеческого организма. Эндотелий синтезирует субстанции, важные для контроля свертывания крови, регуляции тонуса и артериального давления, фильтрационной функции почек, сократительной активности сердца, метаболического обеспечения мозга, контролирует диффузию воды, ионов, продуктов метаболизма, реагирует на механическое воздействие текущей жидкости, кровяное давление и ответное напряжение, создаваемое мышечным слоем сосуда. Эндотелий чувствителен к химическим и анатомическим повреждениям, которые могут приводить к повышенной агрегации и адгезии циркулирующих клеток, развитию тромбоза, оседанию липидных конгломератов.
Основной же функцией эндотелия является барьерно-транспортная, но осуществление этой функции на всем протяжении микрососудов происходит по-разному. Транспорт веществ через эндотелий различных звеньев сосудистого русла происходит неодинаково. Стенки венозных компонентов микроциркуляторного русла более проницаемы для белка, чем стенки других микрососудов. Проницаемость посткапиллярных венул для воды значительно превосходит таковую у прекапилляров и капилляров. Значительные вариации переноса белка через эндотелиальную выстилку наблюдаются даже вдоль отдельно взятого микрососуда.
Транспорт внутрисосудистой жидкости через эндотелий происходит: 1) непосредственно через эндотелиальные клетки — через систему их микровезикул и трансэндотелиальных каналов (трансцитоз, трансэндотелиальный перенос); 2) через межэндотелиальные щели — участки соединения эндотелиальных клеток.
Обмен жидкости между внутрисосудистым и интерстициальным сектором подчинен закону Эрнста Генри Старлинга. Согласно этому закону, жидкость перемещается в соответствии с градиентом давления, создаваемым, с одной стороны, гидростатическим внутрисосудистым давлением и коллоидно-осмотическим давлением интерстициальной жидкости, с другой — гидростатическим интерстициальным давлением и коллоидно-осмотическим давлением плазмы крови.
По классической концепции Старлинга, внутри капилляра, приблизительно в 2/3 длины от его начала, имеется точка равновесия всех вышеописанных сил, проксимальнее которой преобладает экстравазация жидкости, а дистальнее — резорбция. В идеальной точке равновесия обмена жидкости нет. Реальные измерения показывают, что определенная зона капилляра пребывает в околоравновесном положении, но и в ней выход жидкости все же преобладает над резорбцией. Этот избыток транссудата возвращается в кровь по лимфатическим сосудам.
При увеличении гидростатического давления в микроциркуляторных обменных сосудах зона равновесия сдвигается в сторону посткапиллярных венул, увеличивая поверхность фильтрации и уменьшая площадь резорбции. Падение гидростатического давления ведет к обратному сдвигу околоравновесной зоны. Общая объемная скорость фильтрации в отдельном гистионе определяется главным образом суммарной площадью поверхности функционирующих капилляров и их проницаемостью. Количественную оценку объемной скорости транскапиллярного перемещения жидкости можно произвести по формуле:
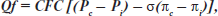
где Qf — объем жидкости, фильтруемый через капиллярную стенку, на единицу площади;
CFC — коэффициент капиллярной фильтрации, характеризующий площадь обменной поверхности (число функционирующих капилляров) и проницаемость капиллярной стенки для жидкости. Коэффициент имеет размерность мл/мин/100 г ткани/мм рт.ст., т.е. показывает, сколько миллилитров жидкости в 1 мин фильтруется или абсорбируется в 100 г ткани при изменении капиллярного гидростатического давления на 1 мм рт.ст.;
s — осмотический коэффициент отражения капиллярной мембраны, который характеризует реальную проницаемость мембраны для воды и растворенных в ней веществ;
Рс — величина гидростатического давления внутрисосудистой жидкости;
Рi — величина гидростатического давления интерстиция;
pс — величина коллоидно-осмотического давления внутрисосудистой жидкости;
pi — величина коллоидно-осмотического давления интерстиция.
Величина гидростатического давления в капиллярах, которое выдавливает жидкость в ткани, на артериальном конце капилляров составляет около 30 мм рт.ст. По ходу капилляров оно снижается за счет трения до 10 мм рт.ст. на их венозном конце. Среднекапиллярное давление оценивается в 17 мм рт.ст.
Коллоидно-осмотическое давление плазмы не совпадает с общим осмотическим давлением на клеточных мембранах. Его оказывают лишь те частицы, которые не проходят свободно через капиллярную стенку. Это исключительно молекулы белка, главным образом альбумина и a1-глобулинов. Характерно, что фибриноген почти не участвует в создании онкотического давления. Суммарное осмотическое давление на клеточной мембране создают все растворенные и взвешенные частицы, и оно в 200 раз выше своей коллоидно-осмотической составляющей. Но именно белковая составляющая общего давления оказывается единственно значимой для перехода жидкости через сосудистую стенку, так как солевые и неэлектролитные компоненты общего осмотического давления по обе стороны гистогематических барьеров уравновешены диффузией соответствующих относительно низкомолекулярных веществ, скорость которой в тысячи раз больше скорости фильтрации жидкости. В норме плазменная концентрация белков более чем в 3 раза превышает интерстициальную. В мышцах и мозге тканевая концентрация онкотических эквивалентов еще ниже. Поэтому белки плазмы создают онкотическое давление не менее 19 мм рт.ст., удерживающее жидкость в сосуде. К этому добавляется еще около 9 мм рт.ст. за счет эффекта Ф.Дж. Доннана — электростатической фиксации анионными белковыми молекулами избытка катионов во внутрисосудистом пространстве. Таким образом, общее удерживающее давление 28 мм рт.ст. существует вдоль всего капилляра.
Среднее онкотическое давление тканевой жидкости составляет в обычных условиях 6 мм рт.ст. и удерживает воду в тканях. Если бы избыток белка, попадающего в ткань путем трансцитоза и при воспалениях, не реабсорбировался через лимфатическую систему, градиент онкотического давления между кровью и тканями был бы постепенно утрачен.
Гидростатическое давление интерстициальной жидкости, как полагали в течение почти 70 лет после Старлинга, должно быть положительной величиной, сопротивляющейся выходу жидкости из сосуда. Эксперименты Артура Гайтона показали, что под кожей между сосудами существует отрицательное (то есть субатмосферное) присасывающее давление. В нормальных условиях давление свободной жидкости в большинстве тканей — от –2 до –7 мм рт.ст. (в среднем –6).
Присасывание тканями жидкости из капилляров и посткапиллярных венул фактически значительно облегчает работу сердца по перфузии тканей и оказывает определяющее воздействие на пути нормальной микроциркуляции. Давление связанной тканевым гелем воды также находится на субатмосферном уровне, но оно на 1–2 мм рт.ст. выше, чем в свободной фазе. Положительным тканевое давление является только в органах, находящихся в замкнутом объеме, например в головном мозге. В остальных тканях оно становится выше атмосферного только при заметных отеках. Частичный вакуум под кожей способствует компактному состоянию клеток в здоровых тканях даже в отсутствие скрепляющих соединительнотканных структур. При его утрате в отечной, например воспаленной, ткани ослабевают связи между клетками.
Более высокая проницаемость и увеличенная площадь венозных концов капилляров по сравнению с артериальными уравновешивает встречные потоки, несмотря на почти вдвое меньшую абсолютную величину результирующего вектора резорбции по сравнению с вектором транссудации. Вышеописанный механизм регулирует фильтрацию и реабсорбцию. Однако на гистогематической границе происходят и другие процессы — диффузия и трансцитоз, которые вносят важный вклад в определение состава тканевой жидкости.
Диффузия является основным механизмом транскапиллярного обмена. Скорость фильтрационного потока значительно ниже скорости капиллярного потока крови. Однако подсчитано, что скорость гистогематического обмена воды очень велика, следовательно, она не определяется фильтрацией, а может быть связана лишь с диффузией. В результате обмен собственно воды в тканях в основном не соответствует механически переменчивым характеристикам капиллярного кровотока. Величина диффузии зависит от числа функционирующих капилляров (прямая зависимость), градиента концентраций растворенных веществ (прямая зависимость) и скорости кровотока в микроциркуляторном русле (обратная зависимость).
Дополнительной защитой интерстиция от чрезмерного накопления жидкости и формирования отеков служит дренажная система лимфатических сосудов. Отек — это типовой патологический процесс, заключающийся в создании избытка жидкости в интерстициальном секторе внеклеточного водного пространства. Термин «отек» не применяется по отношению к внутриклеточной гипергидратации (для ее обозначения более приемлем термин «набухание клетки»). При отеке всегда не только имеется избыток внеклеточной тканевой воды, но и повышается содержание натрия в тканевой жидкости. При отеке присасывающее тканевое давление всегда снижается, а при выраженной гипергидратации ткани — становится положительным. Клинически начальному отеку с отрицательным тканевым давлением жидкости соответствует симптом образования ямки при нажатии на отечную ткань. Если ямка от нажатия не образуется — давление в ткани положительное, что соответствует «напряженному», или далеко зашедшему, отеку. А. Гайтон подсчитал, что отрицательное давление в тканях (5,3 мм рт.ст.), дренажная функция лимфы в отношении жидкости (около 7 мм рт.ст.) и резорбция тканевого белка в кровь через лимфу (еще 5 мм рт.ст.) суммарно создают «буферный резерв» порядка 17 мм рт.ст., предохраняющий от немедленного развития отека при повышении фильтрующего и снижении онкотического давления. Поэтому отек начинает формироваться, когда среднее внутрикапиллярное давление повысится (или онкотическое давление плазмы снизится) на 17–18 мм рт.ст., то есть по достижении минимум 35 мм рт.ст. — для капиллярного гидростатического или 10 мм рт.ст. — для плазменного онкотического давления. Отек — проявление несовершенного приспособления. Приспособительную роль отеков можно усматривать в том, что они предохраняют организм от развития гиперволемии, которая может иметь опасные для жизни острые последствия, заключающиеся в нарушении системной гемодинамики. Местный отек оказывает дилюционное действие на тканевую жидкость, что потенциально уменьшает концентрации патогенов, токсинов и аутокоидов при повреждении ткани. Отек — один из механизмов ограничения зоны воспаления. В то же время в отечных тканях сдавливаются сосуды, дополнительно нарушается микроциркуляция, затруднена диффузия нутриентов, такие ткани легче инфицируются и хуже заживают. Подобно другим типовым патологическим процессам, отек полиэтиологичен.
Механизмы утраты внутрисосудистой жидкости в интерстиций
Таким образом, наиболее очевидными механизмами потери внутрисосудистой жидкости в интерстиций являются: 1) увеличение градиента гидростатического давления в артериальной части капилляра; 2) снижение градиента коллоидно-осмотического давления в венозном конце капилляра; 3) нарушение лимфатического дренирования. Из перечисленных механизмов в формировании СКУ при критических состояниях, безусловно, наиболее серьезное значение имеют первый и второй. Утечка жидкости возрастает и благодаря повышенной капиллярной проницаемости, опосредуемой действием медиаторов воспаления. В табл. 1 приводится перечень хорошо известных медиаторов, вызывающих выход декстрана из посткапиллярных венул.
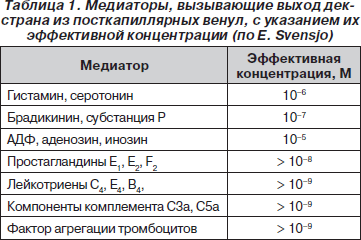
В многочисленных экспериментах показан выход плазменных белков или флюоресцирующих декстранов, имеющих такие же размеры молекул, из посткапиллярных венул в интерстиций после локальной аппликации гистамина, брадикинина и других медиаторов воспаления. Этот выход, как предполагалось ранее, происходит через широкие межэндотелиальные соединения или щели, которые образуются путем сокращения клеток эндотелия. Часть щелей находится в «открытом» состоянии еще до начала агрессивного действия медиатора. В процессе действия медиатора количество «открытых» щелей возрастает, однако только до определенного предела. Дальнейшее повышение концентрации медиатора не приводит к росту количества функционирующих щелей. «Открытие» щелей может быть приостановлено введением целого ряда лекарственных препаратов — антигистаминных средств, глюкокортикоидов, b-адреномиметиков, вазопрессина, ксантинов, блокаторов медленных кальциевых каналов.
Патологическое повышение сосудистой проницаемости наблюдается и при действии других медиаторов воспаления — цитокинов (фактор некроза опухоли альфа (TNF-a), интерлейкинов-2 и -6, фактора сосудистой проницаемости (сосудистый эндотелиальный фактор роста А)), активных протеаз, свободных радикалов, бактериальных токсинов и др. Серьезная роль в регуляции сосудистой проницаемости в настоящее время отводится тромбину.
Как указывалось выше, капиллярная утечка жидкой части крови может обусловить развитие значительной гиповолемии, вплоть до развития гиповолемического шока. В свою очередь, само состояние шока, которое характеризуется системной гипоперфузией тканей, гипоксией эндотелия, высвобождением большого количества агрессивных медиаторов, тяжелыми нарушениями обменных процессов, обязательно способствует формированию СКУ. В этом смысле весьма показательными являются результаты экспериментальных исследований. Известно, что при постановке опытов на крысах, в которых моделировался геморрагический шок, комбинированный с термическими повреждениями, заместительная объемная терапия кристаллоидными плазмозаменителями сопровождалась увеличением содержания жидкости в интерстициальном секторе внеклеточного водного пространства в 3 и даже в 3,5 раза (Беляев А.Н.). Клинические наблюдения ежедневно показывают, что в условиях критических состояний отечный синдром может прогрессировать чрезвычайно быстро, а ликвидация отеков порой происходит очень медленно, требуя применения эфферентных методов коррекции (ультрафильтрация). Опираясь на эти данные, ряд ученых (В.В. Беляев и др.), изучающих особенности процессов транскапиллярного обмена, справедливо отмечает, что значительную капиллярную утечку с точки зрения теории Старлинга объяснить не всегда возможно.
Во-первых, прогрессирующий переход жидкости из сосудов в интерстиций способствует повышению в нем гидростатического давления, а следовательно, и уменьшению одноименного градиента на уровне «артериола — интерстиций». Во-вторых, так как основную часть утрачиваемой из сосудов жидкости составляет вода, при ее накоплении в интерстиции в нем закономерно произойдет снижение концентрации протеина, следствием чего будет снижение коллоидно-осмотического давления интерстициальной жидкости и увеличение градиента онкотического давления на уровне «венула — интерстиций». Повышенная капиллярная проницаемость, как следует из уравнения Старлинга, может способствовать как переходу жидкости из сосудов в интерстиций, так и ее возврату — направление тока жидкости совпадает с направлением результирующего вектора. Таким образом, нарастание отека всегда ограничено и он должен разрешиться сам собой.
Другие сомнения возникают при более детальном рассмотрении механизмов трансэндотелиального транспорта жидкости и ультраструктуры эндотелия и интерстиция. В стенках любых артериол и венул, а также капилляров большинства органов нет сквозных отверстий, поскольку их эндотелий принадлежит к сплошному типу и цитоплазматические отростки его клеток перекрываются и формируют над базальной мембраной, содержащей нефибриллярный коллаген 4-го типа, ламинин и протеогликаны, непрерывный слой. Открытый тип эндотелия имеется лишь в капиллярах селезенки, печени и костного мозга. В кишечнике, почечных клубочках и эндокринных железах эндотелий имеет окончатое строение. Но окна — не участки отсутствия цитоплазматического слоя над базальной мембраной, а лишь области, где эндотелиоциты крайне истончены. В большинстве случаев эти окна (фенестры) закрыты однослойной диафрагмой, имеющей центральное утолщение. Морфологически эта диафрагма очень похожа на диафрагмы, которые также закрывают устья эндотелиальных микровезикул и трансэндотелиальных каналов. Кроме того, под эндотелием повсюду имеются непрерывные базальные мембраны, напоминающие плотный плетеный коврик из коллагена и связанных с ним белков и гликозаминогликанов, а межэндотелиальные щели не зияют, они заполнены протеогликанами.
Интерстиций также представляет собой отнюдь не пустоту, а состоит из коллагенового матрикса, заполненного прилегающими друг к другу протеогликановыми филаментами. В физиологических условиях интерстиций малорастяжим, а его структура препятствует свободному перемещению жидкости. Опираясь на вышеописанные факты, с позиции теории Старлинга трудно представить возможность увеличения количества жидкости в интерстиции в 3 раза. Между тем выраженный отечный синдром без трудностей моделируется в эксперименте и достаточно часто встречается в клинике у пациентов с гиповолемическим шоком, сепсисом, обширными ожогами.
Появлению ясности в вопросе о содержании понятия «капиллярная проницаемость» во многом способствовало открытие, указывающее на то, что помимо механизмов, связанных с межклеточными щелями, решающее значение при экстравазации жидкости имеет ее трансцитоз — транспорт в пиноцитотических везикулах прямо через цитоплазму эндотелиоцитов, а не между ними. Когда за каким-то медиатором признают такой эффект, как повышение проницаемости, это означает, что данный агент увеличивает интенсивность трансцитоза, способствует образованию трансцитотических везикул или ускоряет их перетягивание к наружной стороне клетки ее цитоскелетом с последующей экструзией. В настоящее время общепризнанным является отождествление микропиноцитотических везикул и крупных пор эндотелия. Не исключено, что и мелкие поры, особенно в капиллярах, — это условное название одной из разновидностей трансцитотического механизма. В этом случае транскапиллярные канальцы представляют электронно-микроскопический эквивалент слившихся между собой трансцитотических пузырьков (R. Cotran).
Определенную сложность представляют вопросы о том, что может заставить механизмы трансцитоза «работать на интенсивную откачку жидкости из сосудов в интерстиций без ее адекватного возврата» и как изменяются механические свойства интерстиция, позволяющие накопить в нем значительное количество жидкости.
Диаметр капилляров может изменяться в 2–3 раза. При максимальном сужении они не пропускают кровяных телец, в них находится только жидкая часть крови — плазма. Когда же капилляр расширен, клетки крови проходят по нему медленно, по одной, изменяя свою шарообразную форму на более удлиненную. Это имеет большое физиологическое значение, так как удлинение формы кровяных клеток увеличивает площадь их соприкосновения со стенкой капилляра, а медленное продвижение крови удлиняет время ее контакта со стенкой сосуда. Все это облегчает проникновение кислорода и питательных веществ из крови в ткани.
В условиях развития в организме системной воспалительной реакции под действием таких веществ, как, например, гистамин, брадикинин, субстанция Р, ионы водорода, происходит вазодилатация периферических микрососудов и усиливается доставка лейкоцитов в капилляры. В норме нейтрофилы не задерживаются и минуют артериолы, капилляры и венулы. При гиперцитокинемии, сопутствующей генерализованным формам воспаления, изменение морфологии эндотелиальной выстилки венул создает условия для задержки нейтрофилов в этой части сосудистого русла с их последующей активацией. Из всех провоспалительных цитокинов фактор некроза опухоли альфа наиболее значительно усиливает адгезию циркулирующих гранулоцитов и моноцитов к клеткам эндотелия сосудов и стимулирует процессы их миграции в ткани. Усиление миграции клеток в ткани является следствием активации процессов роллинга («катания» по эндотелиальной выстилке) и последующей адгезии лейкоцитов к трансформированному эндотелию микрососудов. При этом клетки эндотелия избыточно экспрессируют расширенный спектр молекул клеточной адгезии — мембранных белков, участвующих в связывании клетки с внеклеточным матриксом и другими клетками.
Лейкоциты активируются на протяжении последовательно развивающихся фаз этого процесса и приобретают способность выделять медиаторы, а также участвовать в воспалительных реакциях. Следовательно, гиперцитокинемия не только активирует эндотелий, инициируя системную эндотелиальную дисфункцию, но и способствует развертыванию в близлежащих тканях не имеющей защитного значения воспалительной реакции, которая сопровождается альтерацией.
Значительный вклад в альтерацию эндотелия и стенок микрососудов вносят также иммунные механизмы, реализуемые по механизму цитолиза, опосредованного комплементом и направленного к антигенам, клеткам и иммунным комплексам, которые фиксированы на эндотелии или базальной мембране стенок сосудов. Дегрануляция базофилов и нейтрофилов, а также фрустрированный фагоцитоз агрегированных тромбоцитов — это те процессы, которые создают избыточные концентрации биоактивных аминов, протеаз, липидных медиаторов воспаления, анафилатоксинов (С5а, С4а, С3а), активных форм кислорода и других реакционно-способных радикалов и вносят дополнительный вклад в альтерацию. В итоге развивается генерализованый септический васкулит, а также образуются множественные микротромбозы сосудов. На более поздних стадиях генерализованого васкулита активированные мононуклеарные клетки высвобождают провоспалительные цитокины и факторы агрегации тромбоцитов. Эти клетки приобретают также способность к фагоцитозу различных биообъектов и экзоцитозу свободных кислородных радикалов и протеаз. Это, в свою очередь, еще более усиливает экспрессию адгезивных молекул на цитоплазматических мембранах нейтрофилов и эндотелиоцитов, приводит к росту проницаемости стенок венул и усугубляет явления альтерации их эндотелия. Адгезия лейкоцитов дополнительно увеличивает степень обтурации венул. Способствует этим процессам и сладжирование форменных элементов крови, ведущее к замедлению скорости кровотока. В связи с разной скоростью кровотока явления сладжа наблюдаются преимущественно в венулах, реже распространяются на капилляры. Сладж-феномен в артериолах отмечается исключительно редко и свидетельствует о тяжелых, как правило, необратимых расстройствах системной микроциркуляции. При уменьшении просвета венул клетками крови в капиллярах возрастает гидростатическое давление, а в интерстиции накапливается избыток жидкости, то есть формируется отек. Адгезия и агрегация тромбоцитов по типу сосудисто-тромбоцитарного гемостаза усугубляют возникающие нарушения кровотока в мелких сосудах. Этому противодействуют биологически активные вещества с вазодилататорной активностью. В итоге развивается дальнейшее замедление кровотока, нарастают реологические нарушения с явлениями агрегации, секвестрации крови и капиллярной утечки. При больших скоростях сдвига в потоке крови, которые наиболее характерны именно в микроциркуляторном русле, резко возрастает активность фактора Виллебранда как агента адгезии и агрегации лейкоцитов. При тяжелом сепсисе и септическом шоке описанные процессы одновременно развиваются в различных микроциркуляторных регионах, представленных практически во всех органах, что предопределяет формирование и углубление полиорганной дисфункции.
Для воспаления характерна инфильтрация ткани лейкоцитами. Лейкоциты все время покидают кровоток и выходят в ткани и без воспаления. Для этих форм выселения используются специализированные участки сосудистого русла, представленные во многих его областях, — высокоэндотелиальные венулы. Выход из кровеносного русла в ткани — естественный этап жизнедеятельности моноцитов, восполняющих пул разнообразных тканевых макрофагов, а также для полиморфонуклеаров. Однако при наличии воспалительного очага происходит селективная фокусировка эмиграции лейкоцитов, и в некоторых случаях более половины ежедневной продукции фагоцитирующих клеток оказывается в зоне воспаления, при относительном понижении масштабов эмиграции в других участках сосудистого русла. Выселение лейкоцитов из сосуда происходит в очаге воспаления на большой площади, охватывающей посткапиллярные венулы и капилляры, но не артериолы. В лимфатических сосудах воспалительного очага эмиграция тоже возможна. Следовательно, под влиянием медиаторов воспаления эндотелий всех этих сосудов (а не только высокоэндотелиальных венул) значительно усиливает или же приобретает способность пропускать эмигрирующие лейкоциты.
Перемещаясь в субэндотелиальные структуры, лейкоциты продолжают продуцировать и выделять биологически активные вещества. Выделение их направлено в первую очередь на защиту организма от воспалительного агента, однако эти же вещества изменяют и структуру интерстиция, меняя его механические свойства. В результате нарушается структура коллагенового матрикса интерстиция и уменьшается величина гидростатического интерстициального давления. Рост гидростатического капиллярного давления вследствие роста сопротивления кровотоку в венулах и обусловливает капиллярную утечку. Утерянная жидкость не распределяется в интерстиции равномерно, а формирует участки «жидкостных инфильтратов». В состав вышеуказанных «инфильтратов» включено значительное количество утерянного протеина, который удерживает в нем воду. Следовательно, возврат жидкости в сосуды сопряжен с серьезными трудностями.
Выделяют три типа динамики сосудистой проницаемости в ходе воспаления:
1. Ранняя преходящая фаза, которая заключается в быстром и непродолжительном увеличении проницаемости малых и средних венул (с диаметром до 100 мкм). Проницаемость возрастает до максимума за 5–10 минут после повреждения. Исключительную роль в этой фазе играет гистамин, поскольку она блокируется его антагонистами. Вспомогательную роль могут выполнять другие медиаторы воспаления, такие как брадикинин, лейкотриены и простагландины. Механизмы ранней фазы повышения проницаемости больше связаны с расширением межклеточных промежутков за счет сокращения эндотелиоцитов, чем с усилением трансцитоза. Запасы гистамина в тканях невелики, он инактивируется гистаминазой, кроме того, происходит понижение чувствительности его рецепторов. Поэтому проницаемость снова понижается через 30 минут.
2. Поздняя продленная фаза повышения сосудистой проницаемости начинается через 1–2 часа после повреждения васкуляризованной ткани и достигает пика через 4–6 часов. Это особенно ярко проявляется при солнечных ожогах. В некоторых случаях, например при гиперчувствительности замедленного типа, латентный период длится намного дольше — от 4–6 до нескольких десятков часов или даже до 6–8 суток. Поздняя фаза имеет длительность не менее 24 часов. В позднюю фазу повышается проницаемость и капилляров, и венул. Происходит активация клеточного цитоскелета эндотелиальных клеток. В повышении проницаемости участвуют и ускорение трансцитоза, и межклеточные процессы, в частности втягивание эндотелиоцитами отростков, участвующих в соединении клеток, из-за чего между ними появляются промежутки. Заметного округления эндотелиоцитов не наблюдается. В эксперименте поздняя стадия не воспроизводится или сильно ослаблена у животных, лишенных лейкоцитов. Предполагается, что она обеспечивается в основном полипептидными медиаторами воспаления, в том числе цитокинами макрофагального и лимфоцитарного происхождения (интерлейкин-1, кахексин, g-интерферон).
3. Раннее стойкое повышение проницаемости. При значительной и распространенной первичной альтерации, например, при тяжелых ожогах, инфекциях эндотелиотропными возбудителями, сосудистая проницаемость растет на протяжении первых 30–45 минут до максимума и не снижается в течение нескольких часов. Затем следует ее медленное снижение, длящееся несколько суток. Затрагиваются артериолы, капилляры и венулы, наблюдаются некроз, слущивание эндотелия и разрывы базальных мембран, стабилизация проницаемости наступает по мере тромбоза сосудов и нового сосудообразования. Этот паттерн повышения проницаемости зависит от массированного действия первичного альтерирующего фактора, влияния гидролаз и от других, в основном лейкоцитарных, механизмов вторичной альтерации на сосуды.
Лечение синдрома капиллярной утечки
Лечение СКУ невозможно представить без мероприятий, направленных на ликвидацию причины, вызвавшей развитие синдрома системного воспалительного ответа. При хирургических заболеваниях, которые могут стать причиной СКУ, необходима своевременная и адекватная их коррекция с антибактериальной терапией. Антибактериальная терапия — безусловно, главный компонент лечения многих инфекционных заболеваний, ее задачами являются как непосредственное уничтожение возбудителей, так и предупреждение развития бактериальной суперинфекции.
В ряде случаев формирование СКУ может быть приостановлено назначением антагонистов действия медиаторов воспаления. Наиболее показательным является назначение блокаторов Н1-гистаминовых рецепторов при острых аллергических реакциях, применение ингибиторов протеаз у больных с тяжелыми формами острого панкреатита, травматическими повреждениями, ожогами, кровотечениями. Продукция лейкотриенов, реализующаяся по липоксигеназному пути окисления арахидоновой кислоты, блокируется введением в организм кверцетина (корвитина). Ксантины (теофиллин, пентоксифиллин), являющиеся антагонистами аденозина и его производных, также могут ограничивать прогрессирование СКУ.
Хорошо известно, что снижению капиллярной проницаемости способствует назначение b-адреномиметических препаратов. Известны работы, описывающие уменьшение интенсивности СКУ при длительных постоянных инфузиях дофамина и добутамина. Селективный b1-адреномиметик тербуталин используется для длительного лечения пациентов с идиопатическим СКУ.
Еще совершенно недавно в клинической практике с целью снижения сосудистой проницаемости наиболее часто использовались глюкокортикоиды. Глюкокортикоиды стабилизируют мембраны клеток и лизосом, ограничивая тем самым выход из них активных гидролаз, в результате чего ограничивается повреждение тканей при воспалении. Они способствуют поддержанию целостности клеточной мембраны даже в присутствии токсинов, что снижает отечность клеток. Глюкокортикоиды усиливают синтез липомодулина — эндогенного ингибитора фосфолипазы А-2, угнетая этим ее активность. Фосфолипаза А-2 способствует мобилизации арахидоновой кислоты из фосфолипидов клеточных мембран и образованию метаболитов этой кислоты (простагландинов и лейкотриенов), которые играют ключевую роль в процессе воспаления. Кроме того, глюкокортикоиды стимулируют синтез межклеточного вещества — гиалуроновой кислоты, понижающей проницаемость сосудистой стенки. Уменьшение экссудации также связывают со снижением секреции гистамина и с изменением чувствительности адренорецепторов к катехоламинам (повышение чувствительности адренорецепторов к адреналину и норадреналину). В результате происходит повышение сосудистого тонуса и снижение проницаемости сосудистой стенки. Глюкокортикоиды также способствуют ограничению миграции лейкоцитов в ткани. Однако надежды, возлагавшиеся на применение глюкокортикоидов при сепсисе, не оправдались. Результаты последних исследований доказательной медицины свидетельствуют, что как малые, так и большие дозы глюкокортикоидов уменьшения смертности больных с сепсисом не обеспечивают.
Определенные надежды на уменьшение интенсивности СКУ при различных патологических состояниях связывают с применением препаратов эсцина. Эсцин — тритерпеновый гликозид, который является основным действующим веществом экстракта семян конского каштана. Обладает выраженным венотонизирующим эффектом и используется для местного и системного применения при нарушениях венозного кровообращения, и прежде всего при венозной недостаточности, устраняя венозный застой.
Эсцин препятствует активации лизосомальных ферментов, расщепляющих протеогликан, повышает тонус венозной стенки, устраняет венозный застой, уменьшает проницаемость и ломкость капилляров. Усиление венозного кровотока оказывает благоприятный эффект при заболеваниях, сопровождающихся венозным застоем, отеками, трофическим повреждением стенок кровеносных сосудов, воспалительными процессами и тромбозом вен, способствует репарации органов и тканей. Венотонизирующее действие осуществляется за счет активации сократительных свойств эластичных волокон венозной стенки (т.е. воздействия метаболитов эсцина), а также за счет стимулирования выделения гормонов надпочечников, образования простагландинов F2a в стенках сосудов и высвобождения норадреналина в синапсах нервных окончаний. Как капилляропротектор, эсцин нормализует состояние сосудистой стенки, повышает устойчивость капилляров, снижает их ломкость. Эффект обусловлен угнетением активности лизосомальных ферментов, что предупреждает расщепление протеогликана (мукополисахаридов) капиллярной стенки. Эсцин ингибирует активность гиалуронидазы, оказывает и выраженное противоотечное действие, снижая проницаемость капилляров (прежде всего проницаемость плазмолимфатического барьера), препятствует экссудации низкомолекулярных белков, электролитов и воды в межклеточное пространство; облегчает опорожнение варикозных узлов, увеличивает содержание сухого остатка лимфы. Опосредованно антиэкссудативное влияние реализуется через стимуляцию выработки и высвобождение простагландинов. Благодаря способности увеличивать резистентность капилляров эсцин влияет преимущественно на первую фазу воспаления за счет снижения сосудистой проницаемости и уменьшения миграции лейкоцитов.
Эсцин проявляет антиагрегационный (улучшает микроциркуляцию) и анальгезирующий эффекты, способствует репарации органов и тканей, обладает антиоксидантной активностью. При местном использовании устраняет боль, отечность, ощущение напряжения, ускоряет рассасывание поверхностных гематом. Содержащиеся в экстракте конского каштана стеролы (стигмастерол и альфа-спинастерол) снижают выраженность воспалительной реакции. В рандомизированных двойных слепых и перекрестных исследованиях отмечалось снижение транскапиллярной фильтрации и значительное уменьшение отеков, уменьшение чувства тяжести, усталости, напряженности, зуда и боли. В клинической практике интенсивной терапии в качестве препарата эсцина широко используется раствор L-лизина эсцината, предназначенный для внутривенного болюсного и внутривенного капельного введения. В наших исследованиях было обнаружено, что терапия L-лизина эсцинатом у пациентов с признаками наличия системной воспалительной реакции способствовала увеличению удельного объема внутрисосудистой жидкости при одновременном сокращении объема жидкости во внеклеточном водном пространстве.
Наконец, уменьшение потери жидкости из сосудов в интерстиций достигается применением коллоидных плазмозаменителей, имеющих способность в течение нескольких часов удерживать воду в сосудах. Кристаллоидные плазмозаменители в этом смысле значительно уступают коллоидным растворам. Несостоятельность восполнения дефицита внутрисосудистой жидкости большим количеством кристаллоидных растворов в условиях гиповолемического шока наиболее ярко проявилась при оказании неотложной помощи раненым солдатам американской армии во время войны во Вьетнаме. Попытки сохранить достаточный объем внутрисосудистой жидкости в условиях травматического шока с помощью непрерывной быстрой инфузии раствора Рингера, количество которого достигало 5–6 литров в сутки, быстро приводило к задержке значительного количества жидкости в интерстиции легких и ускоряло развитие респираторного дистресс-синдрома. Весь медицинский мир понял, что в критических ситуациях организм пострадавших нуждается во введении плазмозаменителей, которые покидают сосудистое русло более медленно. Использование с этой целью растворов альбумина связано со значительным увеличением стоимости лечения и бывает недоступным даже в странах с современной мощной экономикой. Поэтому большую перспективу имеет создание и усовершенствование синтетических коллоидных плазмозаменителей. На современном этапе из этой группы препаратов выделяются производные декстрана, модифицированной желатины и гидроксиэтилированного крахмала (ГЭК). Для ограничения капиллярной утечки серьезное практическое значение имеет применение ГЭК. Молекулы ГЭК не только удерживают жидкость в сосудах, но и воздействуют на механизмы системной воспалительной реакции.
В настоящее время уже имеется достаточное количество свидетельств, полученных на основании экспериментальных исследований и клинических наблюдений, о противовоспалительном эффекте производных ГЭК. J. Tien et al. (2004) при исследовании эффектов 0,9% раствора NaCl и ГЭК 200/0,5 в возрастающих дозировках в условиях эндотоксического шока у крыс обнаружили дозозависимое снижение капиллярной проницаемости капилляров легких вместе с уменьшением аккумуляции нейтрофилов и протеина нейтрофилов в легких. Это сочеталось с устранением активации нуклеарного фактора каппа-В, который ответственен за активацию цитокинового каскада и концентрация которого особенно увеличивается в крови при летальных случаях.
В исследовании D. Rittoo et al. (2005) участвовало 40 пациентов, которые были оперированы по причине инфраренальной аневризмы аорты. В сравнении с модифицированной желатиной (гелофузином) инфузия ГЭК 200/0,5 способствовала значительному и достоверному уменьшению в крови больных уровня С-реактивного протеина и фактора Виллебранда.
J. Verheij et al. (2006) изучали изменения капиллярной утечки у 67 кардиохирургических пациентов, находящихся на искусственной вентиляции легких. В качестве плазмозаменителей были использованы 0,9% раствор NaCl, 6% ГЭК 200/0,5, 5% раствор альбумина и 4% раствор модифицированной желатины. Повреждения сосудов легких оценивали по утечке трансферрина, меченного 67Ga. Потребовалось значительно больше 0,9% раствора NaCl, чем коллоидов, для поддержания эффективного объема циркулирующей крови. Утечка жидкости из сосудов уменьшалась в большей мере при применении ГЭК, чем желатины. В 30 % случаев изменений после ресусцитации не обнаруживали.
В сравнительном изучении действия ГЭК 200/0,5 и ГЭК 130/0,4, которое проведено G. Marx et al. (2006) на модели септического шока у свиней, было выявлено, что ГЭК 130/0,4 эффективнее уменьшал капиллярную утечку, хотя системная оксигенация органов и тканей достоверно не отличалась.
X. Feng et al. (2006) при изучении влияния ГЭК 130/0,4 на утечку жидкости в капиллярах легких, продукцию цитокинов и активацию нуклеарного фактора каппа-В в организме крыс с абдоминальным сепсисом выявили, что ГЭК 130/0,4 уменьшал легочную капиллярную проницаемость и соотношение «жидкость/сухой вес». При этом констатировано снижение продукции провоспалительного IL-6 и нарастание концентрации противовоспалительного IL-10. Также уменьшались активность миелопероксидазы (лизосомального фермента нейтрофилов, способного образовывать гипохлорит-анион, который, будучи сильным окислителем, обладает неспецифическим бактерицидным действием; при многих воспалительных заболеваниях нейтрофильная миелопероксидаза способна, однако, вызвать повреждение ткани), концентрация TNF-a в крови и активность нуклеарного фактора каппа-В. В другом исследовании X. Feng et al. (2007) ГЭК 130/0,4 в условиях полимикробного абдоминального сепсиса в сравнении с 0,9% раствором NaCl способствовал уменьшению концентрации воспалительных медиаторов в ткани кишечника, снижению концентрации TNF-a и макрофагального воспалительного протеина-2 (MIP-2) в крови, нарастанию продукции IL-10 и уменьшению активации нуклеарного фактора каппа-В.
Затем X. Feng et al. (2007) провели сравнительное изучение эффектов ГЭК 200/0,5 и модифицированной желатины у крыс при моделировании полимикробного абдоминального сепсиса. Как ГЭК 200/0,5, так и желатина дозозависимо уменьшали капиллярную утрату внутрисосудистой жидкости, однако ГЭК 200/0,5 проявил заметное противовоспалительное действие, которое не прослеживалось при использовании желатины. ГЭК 200/0,5 достоверно способствовал снижению концентрации в крови TNF-a, провоспалительного IL-1b, MIP-2, снижал количество адгезивных молекул, препятствовал активации миелопероксидазы и нейтрофильной инфильтрации.
В работе J. Boldt et al. (2008), которая была выполнена на 50 кардиохирургических больных старческого возраста (> 80 лет), перенесших вмешательства с применением искусственного кровообращения, периоперационное снижение коллоидно-осмотического давления корригировалось введением 5% раствора альбумина и ГЭК 130/0,4. Изучение воспалительного ответа включало исследование концентрации в крови IL-6 и IL-10. Не выявлено преимуществ 5% раствора альбумина. Констатировано наличие меньшей степени эндотелиальной активации при применении ГЭК 130/0,4.
S.A. Kozek-Langenecker et al. (2008) проводили сравнительное изучение эффектов ресусцитации ГЭК 200/0,5 и ГЭК 130/0,4 у хирургических больных. Результаты исследования показали, что больные, которым вводили ГЭК 130/0,4 имели больший объем циркулирующей крови, меньшие потери по дренажам, реже требовали трансфузии эритроцитарной массы, имели нормальные показатели активированного парциального тромбопластинового времени и меньший уровень фактора Виллебранда в плазме крови.
В исследовании P. Wanga et al. (2009) в модели геморрагического шока на крысах изучались эффекты ресусцитации с помощью раствора Рингера лактата, ГЭК 130/0,4 и реинфузии крови. Выявлено безусловное преимущество влияния ГЭК 130/0,4 и реинфузии крови на состояние капиллярной проницаемости. В указанных случаях уменьшалась продукция TNF-a, IL-6, активность миелопероксидазы и активация нуклеарного фактора каппа-В. Но если при использовании реинфузии эритроцитов прослеживалось четкое нарастание концентрации продуктов свободнорадикального окисления, то в условиях применения ГЭК 130/0,4 концентрация малонового диальдегида и соотношение между окисленным и восстановленным глутатионом существенно и достоверно снижалось.
В источниках научной информации можно найти еще не одно свидетельство о противоспалительных эффектах производных ГЭК и об уменьшении капиллярной проницаемости и СКУ под влиянием их применения. К сожалению, множественные методы лечения, которыми располагают специалисты по интенсивной терапии в настоящее время, не позволяют обеспечить 100% устранения СКУ. Его лечение продолжает представлять серьезную проблему.
1. Беляев А.В. Синдром капиллярной утечки // Мистецтво лікування. — 2005. — № 24. — С. 92-101.
2. Беляев А.Н. Нарушение транскапиллярного обмена при комбинированной травме: пути патогенетической коррекции // Патологическая физиология и экспериментальная терапия. — 2003. — № 2. — С. 31.
3. Медицина-инфо [электронный ресурс] / http://meditsina-info.ru.
4. Свенсье Э. Очевидность регуляции микромолекулярной проницаемости в посткапиллярных венулах посредством медиации эндотелиальных клеток // Журнал АМН СССР. — 1988. — № 2. — С. 57-62.
5. Mehta D., Malik A.B. Signaling mechanisms regulating endothelial permeability // Physiological Reviews — 2006. — Vol. 86. — P. 279-367.
