Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Заместительная иммунокоррекция при хирургическом сепсисе: осознание патогенетической целесообразности
Авторы: Нестеренко А.Н. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
В ходе нерандомизированного когортного контролируемого обсервационного клинического исследования 241 пациента 1100-коечного Донецкого областного территориального медицинского объединения (01.1995–04.2010) с хирургическим сепсисом выполнено параллельное нерандомизированное ретроспективное когортное аналитическое исследование 68 умерших вследствие тяжелого сепсиса и септического шока. Проведенный клинико-патоморфологический анализ танатогенеза хирургического сепсиса позволил объективно подтвердить существование трех фаз его течения и обосновать патогенетическую целесообразность проведения заместительной иммунокоррекции препаратами внутривенных иммуноглобулинов, рекомбинантными цитокинами — интерфероном-α-2b, интерлейкином-2 как компонента разработанного нами алгоритма экстренной целенаправленной органопротективной терапии (ЭЦОТ) сепсиса. Внедрение алгоритма ЭЦОТ позволило статистически значимо снизить в сравнении с контролем (без ЭЦОТ) риски и шансы летального исхода у 82 пациентов с тяжелым хирургическим сепсисом (p = 0,038): отношение рисков (RR) = 1,76 [95% ДИ 1,06–2,92]; абсолютное снижение рисков (ARR) = 15,74 % [95% ДИ 2,0–28,7]; число больных, которых необходимо лечить (NNT), = 6,4 [95% ДИ 3,5–50,1]; отношение шансов (OR) = 0,46 [95% ДИ 0,23–0,91], х2 = 5,28 > х2крит. = 3,84 (контроль: 85 человек) и у 21 пациента с септическим шоком (p = 0,046): RR = 2,28 [95% ДИ 1,08–4,81], ARR = 36,43 % [95% ДИ 6,0–58,9]; NNT = 2,7 [95% ДИ 1,7–16,8]; OR = 0,23 [95% ДИ 0,06–0,81], p = 0,043; х2 = 4,10 > х2крит. = 3,84 (контроль: 20 человек).
Хирургический сепсис, клинико-патоморфологический анализ танатогенеза, стадии сепсиса, иммунный дистресс, заместительная иммунокоррекция.
Сепсис — глобальная проблема здравоохранения чрезвычайной важности, он входит в десятку ведущих причин смерти в цивилизованном мире. В структуре всех разновидностей сепсиса доминирует хирургический сепсис (ХС). Развитие тяжелого сепсиса — сепсис + синдром полиорганной недостаточности (СПОН), неудовлетворительные результаты его лечения даже в высокоразвитых странах предопределены не только ростом вирулентности микроорганизмов и продолжающейся селекцией устойчивых к антибиотикам штаммов бактерий, но и очевидным ослаблением иммунологической резистентности человеческой популяции. В условиях «гонки антибиотикорезистентности» прогнозируется кризис антибактериальных препаратов — в ближайшем будущем не ожидается появления принципиально новых антимикробных препаратов, активных в отношении проблемных госпитальных грамотрицательных штаммов [1, 17, 23]. Это вызвало возрождение интереса к давно известным в медицине препаратам иммуноглобулинов для внутривенного введения (IVIG) [1, 2, 4, 8–10, 13, 14, 16–19, 22].
Немотивированная фобия и агрессивное неприятие подавляющим большинством отечественных врачей препаратов заместительной иммунокоррекции: рекомбинантных цитокинов — интерферонов (IFN-a-2b), интерлейкинов (IL-2) и, конечно же, донорского иммуноглобулина для внутривенного введения при тяжелых бактериальных инфекциях, сепсисе, септическом шоке (СШ) — препарата с безусловно доказанной высокой эффективностью рядом метаанализов, проведенных специалистами Кохрейновской группы [13, 14, 19, 21], опытом отечественных ученых [1, 2] побудили нас выполнить данное исследование.
Цель работы — клинико-морфологическое обоснование патогенетической целесообразности заместительной иммунокоррекции в интенсивной терапии (ИТ) пациентов с хирургическим сепсисом.
Материал и методы
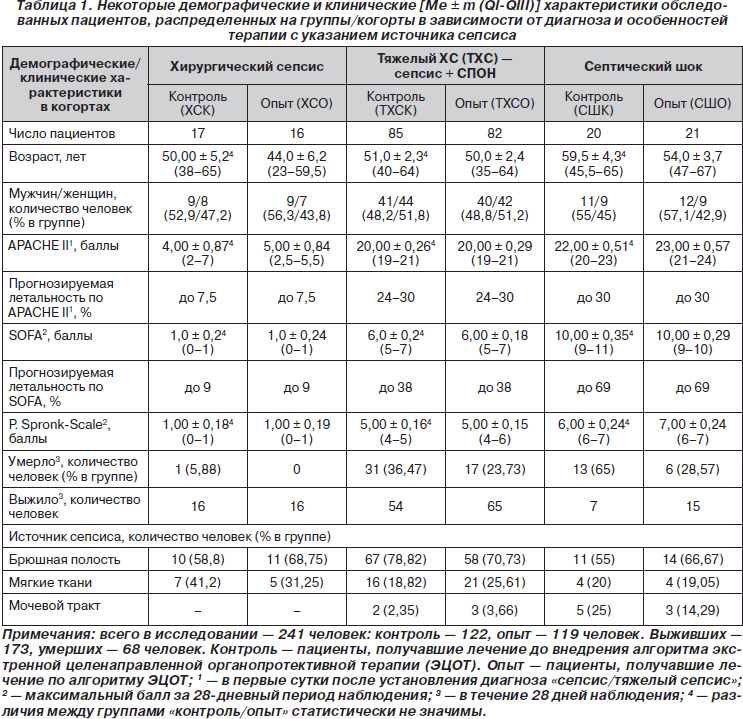
В рамках нерандомизированного когортного контролируемого обсервационного клинического исследования 241 пациента, которые находились на лечении в отделениях хирургического профиля 1100-коечного Донецкого областного клинического территориального медицинского объединения с января 1995 по апрель 2010 г. по поводу хирургического сепсиса, проведено параллельное нерандомизированное ретроспективное когортное аналитическое исследование 68 умерших пациентов (табл. 1). Из 68 умерших перитонит отмечен у 43, гнойники брюшной полости — у 5, флегмона забрюшинного пространства — у 7, диабетическая флегмона/гангрена нижних конечностей — у 8, уросепсис — у 5 пациентов. Развитие органных дисфункций отмечено у всех, септический шок - у 19 из 68 умерших. Состояние шока определяли по шкале P.E. Spronk с соавт. (2005). Диагностика сепсиса, тяжелого сепсиса, септического шока проводилась согласно определениям и рекомендациям SCCM/ESICM/ACCP/ATC/SIS ISDC [15]. Прогнозирование исхода проводили по шкале APACHE II, динамику органной дисфункции оценивали по SOFA. Всем пациентам (241 человеку) проводили инфузионно-трансфузионную, антибактериальную терапию; респираторную, вазопрессорную, инотропную поддержку, хирургическую санацию очага инфекции.
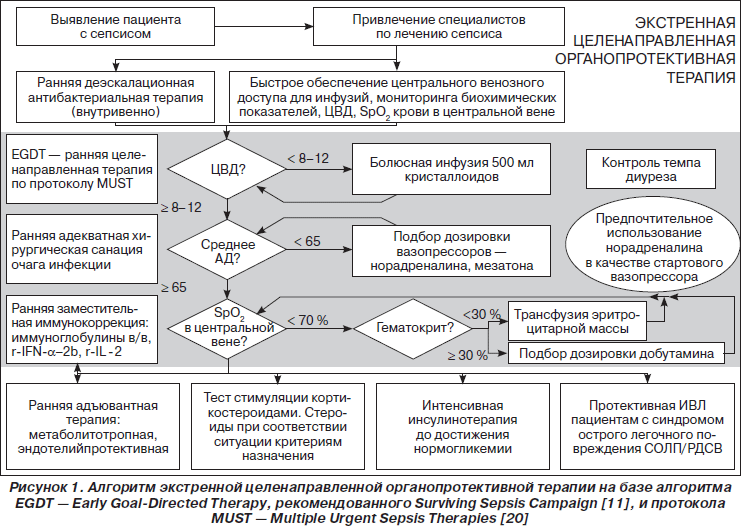
У 122 пациентов контрольной группы (подгрупп ХСК, ТХСК, СШК) отмечены те или иные несоответствия принципам ИТ сепсиса, изложенным в Руководстве SSC [11]. 119 пациентам группы «опыт» (подгрупп ХСО, ТХСО, СШО) проводили лечебный комплекс по протоколу MUST [20] с позиций разработанного нами алгоритма экстренной целенаправленной органопротективной терапии — ЭЦОТ (рис. 1), включавшего не только раннюю диагностику сепсиса, определение его фазы, предполагаемых осложнений, хирургическую санацию очага инфекции, проведение ранней целенаправленной (EGDT) инфузионно-трансфузионной, ранней антибактериальной, вазопрессорной, инотропной, метаболической, детоксикационной, нутритивной ИТ [3–8], но и в зависимости от стадии сепсиса выполнение ранней заместительной иммунокоррекции отечественными препаратами IVIG (Биовен-моно®), рекомбинантными цитокинами: IFN-a-2b (Лаферобион®), IL-2 (Биолейкин®). На этапах лечения проводили: мониторинг витальных функций — определение показателей гемодинамики, температуры тела, частоты дыханий, темпа диуреза; изучение клинических, биохимических, иммунологических показателей, микробиологический контроль гемокультур, отделяемого ран, дренажей. Выполнены патоморфологические исследования внутренних органов 68 умерших (патологи — доцент кафедры патоморфологии ДонНМУ Б.Б. Брук, ассистент Ю.К. Гульков).
Статистическая обработка результатов исследований выполнена в лицензионных пакетах: MedStat v. 4. MS 000070-06.07.2009 (Ю.Е. Лях, В.Г. Гурьянов, 2009) и Microsoft Office (X15-74884) for Windows® 7 Home Basic OA CIS & GE (BA 68-05421 A 00346-0EM-8992752-50013). Характер распределения цифровых данных (по закону нормального распределения или по закону распределения, который отличается от нормального) определяли с помощью критерия хи-квадрат (c2) и теста Шапиро — Уилка. Поскольку распределение большинства оцениваемых количественных клинико-лабораторных показателей происходило по закону, который отличался от нормального, для описания этих показателей были использованы следующие оценки: объема выборок, медианы выборок, ошибки медианы, I и ІІІ квартилей [Me ± m (QI-QIII)]; левых и правых границ 95% доверительного интервала (ДИ) оценки медианы, минимального и максимального значений по выборкам. Использованы непараметрические критерии доказательства статистически значимых отличий сравниваемых совокупностей величин. Парные сравнения центральных тенденций независимых выборок проводили с использованием W-критерия Вилкоксона, а двух связанных выборок — с использованием Т-критерия Вилкоксона. Множественные сравнения, когда количество совокупностей для сравнения было более двух, проводили путем рангового однофакторного анализа Крускала — Уоллиса и при наличии статистически значимого различия между группами проводили парное сравнение с использованием критерия Данна.
Для оценки влияния определенных факторов (характера лечения, изменений клинико-лабораторных параметров) на развитие клинических событий — смерти, полиорганных нарушений, дыхательной недостаточности, требовавшей протезирования функции дыхания, были использованы расчеты отношения рисков и шансов развития события, абсолютного и относительного риска развития события в пределах 95% доверительного интервала; для оценки эффективности лечения были использовали расчеты снижения абсолютного и относительного рисков развития события, а также вычисления количества больных, которых нужно лечить [20]. Во всех случаях статистически значимыми считали отличия при условии статистической погрешности, которая не превышает 5 % (p < 0,05). Группа здоровых — доноры- добровольцы.
Результаты и их обсуждение
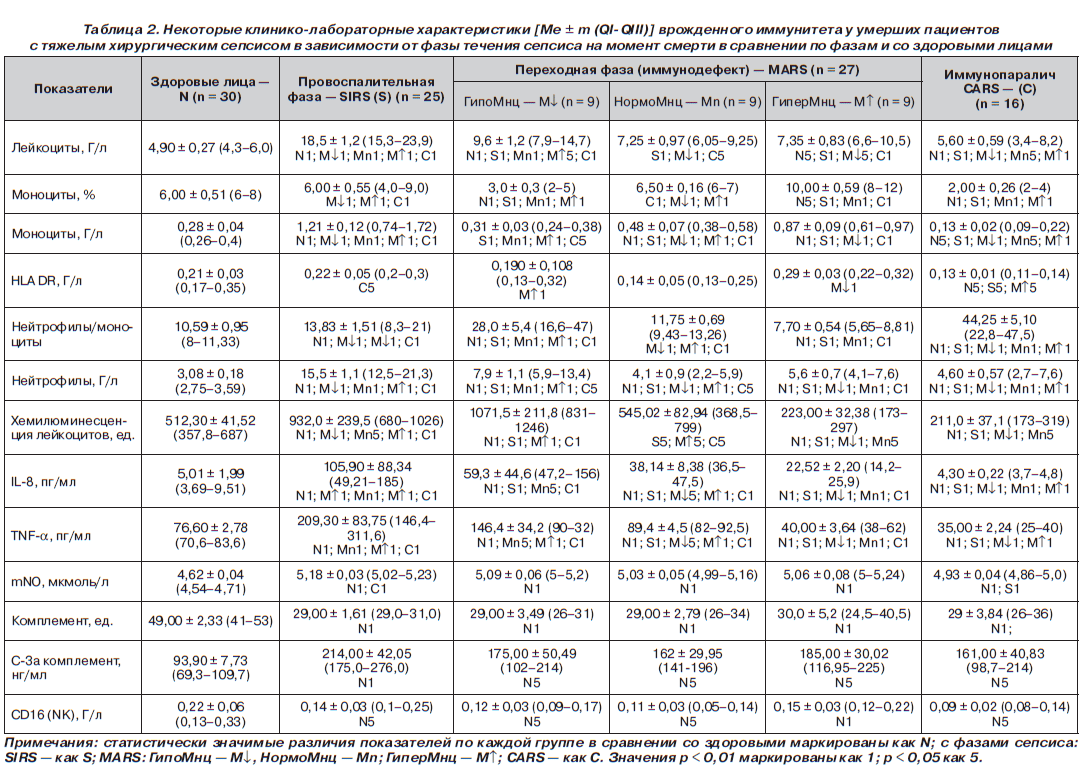
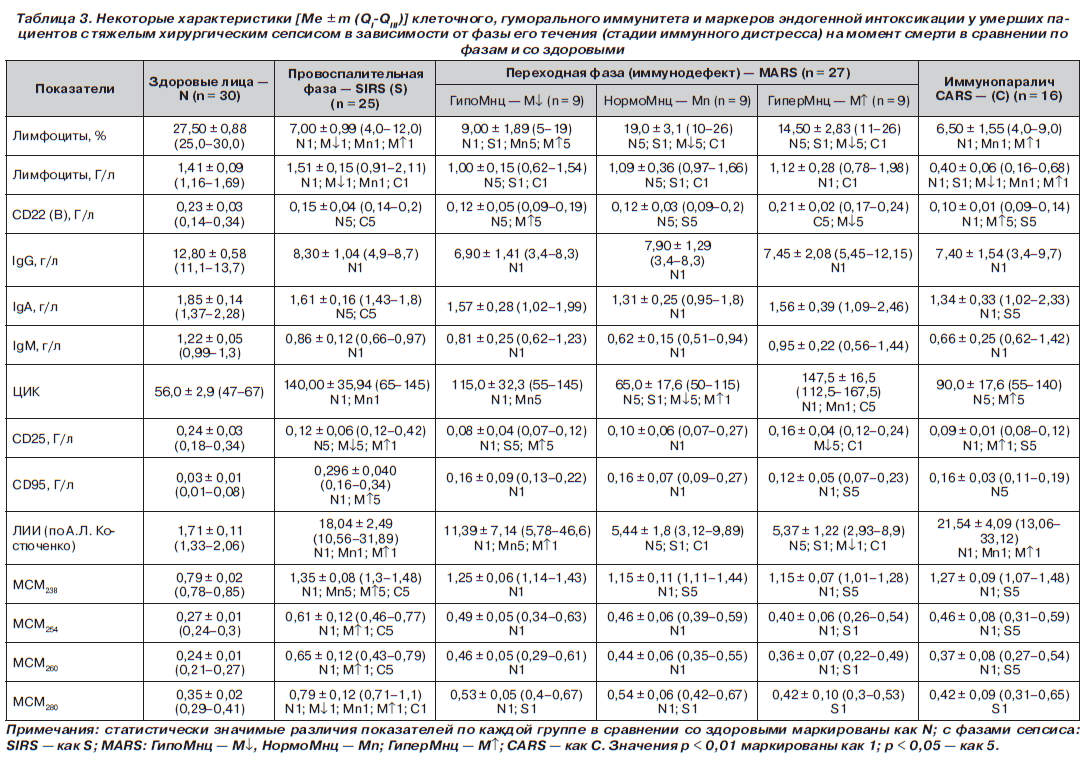
Ретроспективно 68 умерших пациентов были разделены на 3 группы/когорты в зависимости от того, в какую фазу сепсиса наступил exitus letalis. В качестве эмпирических лабораторных критериев фаз сепсиса — провоспалительной (SIRS), иммунопаралича (CARS) и переходной между SIRS и CARS фазы MARS использовали концентрации лейкоцитов и моноцитов (Мнц) периферической крови (табл. 2). Развитие ПОН отмечено у всех 68 умерших. Ведущими клиническими синдромами, определяющими тяжесть состояния всех пациентов, были: циркуляторные нарушения — артериальная гипотония, тахикардия, увеличение времени наполнения капилляров кожи до 5–11 с; снижение темпа диуреза до 0,2–0,35 мл/кг/ч; инфекционно-воспалительный эндотоксикоз — увеличение лейкоцитарного индекса интоксикации (ЛИИ), концентрации молекул средней массы (в нм) — МСМ238, МСМ254, МСМ260, МСМ280, токсико-гипоксическая, дисциркуляторная энцефалопатия; гиперкатаболический синдром, нарушения энергетического обмена и трофического статуса — гипотрофия, вплоть до кахексии с гиперазотемией, гипопротеинемией, гипоальбуминемией (табл. 2, 3).
У умерших в провоспалительную стадию SIRS отмечен гиперлейкоцитоз, абсолютный моноцитоз с увеличением экспрессии HLA-DR, отношения Нф/Мнц, нейтрофилез, лимфоцитоз; гиперсекреция фагоцитами и эндотелиоцитами провоспалительных цитокинов (IL-8, TNF-a), активных форм кислорода и азота — рост интенсивности хемилюминесценции лейкоцитов (ХЛЛ), концентрации метаболитов NO (mNO) — субстратов, повреждающих эндотелий (табл. 2, 3).
Когорта умерших в стадию MARS была разделена на 3 подгруппы в зависимости от содержания циркулирующих Мнц. Их процент (Мнц%) и абсолютное (Мнцабс) количество достоверно отличалось как в сравнении с N, так и между тремя подгруппами MARS и группами SIRS и CARS. Выявлены статистически достоверные разнонаправленные тренды изменений интенсивности ХЛЛ, концентраций IL-8, TNF-a, и Мнц%, Мнцабс (табл. 2), что позволило нам квалифицировать этот феномен и эту стадию как «иммунодефект» [4–8].
У умерших в стадию CARS концентрации в крови лимфоцитов (Лфц%, Лфцабс), Мнц%, Мнцабс, HLA-DRабс, СD22абс, СD3абс, СD25абс, CD16(NK)абс, комплемента, IL-8, TNF-a, уровень интенсивности ХЛЛ были достоверно ниже групп N, SIRS и MARS (табл. 2, 3), что характеризует эту стадию как иммунопаралич.
Во всех группах отмечено достоверное снижение в сравнении с N концентраций в крови CD16 (NK)абс, комплемента, СD3абс, СD25абс, СD22абс, IgG, IgM, IgA и повышение в сравнении с N концентрации в крови маркера апоптоза лимфоцитов СD95абс, ЦИК, анафилотоксина С-3а комплемента, повреждающего эндотелий (табл. 2, 3).
Патоморфологически фаза SIRS характеризовалась повреждением эндотелия с нарушением микроциркуляции; системным воспалением по типу септицемического варианта с развитием негнойного межуточного воспаления; резко выраженными гиперпластическими процессами в костном мозге и селезенке. В лимфоузлах ни в одном случае не отмечено фолликулярной гиперплазии. Фолликулы были мелкими, без герментативных центров. Редко — плазматизация, гистиоцитоз синусов с нерезкой макрофагальной реакцией.
В стадию MARS в костном мозге у 85 % — нерезко выраженная очаговая гиперплазия миелоидных клеток, в селезенке — резкая редукция лимфоидных фолликулов, мелкие очаги миелоидного кроветворения, уменьшение количества плазмоцитов в красной пульпе. В некоторых наблюдениях — увеличение количества бластов в красной пульпе и синусах селезенки — нарушение дифференцировки бластов. В лимфоузлах — выраженная редукция лимфоидных фолликулов без центров размножения, уменьшение количества лимфоцитов в корковой зоне, синусовый гистиоцитоз. Макрофагальная реакция более выражена по сравнению со стадией SIRS. Набухание, десквамация, пролиферация эндотелия выявлены менее чем у 25 % умерших по сравнению с 80 % в группе SIRS. У половины — септикопиемия, очаги гнойного воспаления с абсцедированием в легких, печени, реже — в почках и миокарде; у других 50 % — негнойное интерстициальное воспаление. У умерших в стадию MARS выявлена большая распространенность и интенсивность некробиотических процессов в паренхиме органов в сравнении со стадией SIRS.
«Поздняя» стадия сепсиса (иммунопаралич) клинически проявлялась выраженной иммуносупрессией, патоморфологически — слабо выраженными гиперпластическими процессами в кроветворных органах. В 1/3 наблюдений гиперпластическая реакция костного мозга полностью отсутствовала, в 2/3 — проявлялась единичными очажками гиперплазии миелоидных клеток. В селезенке — резкая редукция миелоидных фолликулов, вплоть до полной атрофии. Только в 40 % случаев в красной пульпе встречались немногочисленные мелкие скопления кроветворных клеток лимфоидного ряда без явлений миелоидной метаплазии. В 60 % наблюдений CARS гиперпластические процессы в селезенке полностью отсутствовали. В лимфоузлах выявлено истощение лимфоидной ткани, редко — синусовый гистиоцитоз. Макрофагальная реакция минимальна, в единичных наблюдениях в лимфоузлах и селезенке, в легких — практически отсутствовала. У умерших в стадию CARS не отмечалось существенных изменений со стороны эндотелия сосудов. Значительно чаще (75 %), чем в стадиях SIRS и MARS, системная воспалительная реакция протекала по септико-пиемическому типу с развитием гнойного миокардита, перикардита, острых абсцессов печени, почек; гнойной пневмонии с абсцедированием, что, вероятно, обусловлено вторичной микробной инвазией на фоне несостоятельности иммунного ответа.
Таким образом, выявленные нами особенности клинической картины течения заболевания, изменений лабораторных показателей иммунитета, морфологической картины иммунокомпетентных органов у 68 умерших в различные стадии течения сепсиса позволили нам квалифицировать состояние иммунитета при сепсисе как иммунный дистресс — неспецифический клинический синдром нарушения механизмов врожденного и адаптивного иммунитета с дисфункцией как иммунокомпетентных органов, так и клеток иммунного реагирования — фагоцитов, антигенпрезентирующих клеток, лимфоцитов, расстройством их межклеточных взаимодействий, дисбалансом в системе про- и противовоспалительных цитокинов, в субпопуляционном составе лимфоцитов и изменением окислительного метаболизма фагоцитов. Выявленные клинико-патоморфологические особенности изучаемой патологии позволяют считать правомочным выделение трех фаз течения сепсиса (трех стадий иммунного дистресса при сепсисе): провоспалительную фазу — иммунотоксикоз, переходную фазу — иммунодефект и фазу иммунопаралича [3–8].
Микроциркуляторно-митохондриальный, метаболический и иммунный дистрессы, эндотоксикоз при сепсисе делают невозможной адекватную организацию иммунной защиты — презентации антигена; межклеточной кооперации; гуморального иммунного ответа в условиях гипопротеинемии и снижения количества клеток, синтезирующих антитела-иммуноглобулины. Очевидна потребность в применении готовых, донорских иммуноглобулинов для внутривенного введения, а в зависимости от фазы сепсиса и рекомбинантных цитокинов: IFN-a-2b, IL-2 [4–8]. То есть необходимо проведение заместительной иммунокоррекции! О какой «иммуностимуляции» в этой ситуации вообще может идти речь?
Ранняя заместительная иммунокоррекция отечественными препаратами иммуноглобулинов: для внутривенного введения (Биовен-моно®), рекомбинантными цитокинами — IFN-a-2b (Лаферобион®), IL-2 (Биолейкин®) в рамках разработанного нами алгоритма экстренной целенаправленной органопротективной терапии (ЭЦОТ) позволила статистически значимо снизить в основной группе (ЭЦОТ, 103 пациента) в сравнении с контрольной группой (без ЭЦОТ, 105 пациентов) риски и шансы летального исхода. Так, в группах пациентов с тяжелым хирургическим сепсисом — в основной (с ЭЦОТ, 82 пациента) в сравнении с контрольной группой (без ЭЦОТ, 85 пациентов) отношение рисков составило 1,76 [95% ДИ 1,06–2,92], p = 0,038; снижение абсолютного риска — 15,74 % [95% ДИ 2,0–28,7], p = 0,038; число больных, которых необходимо лечить — 6,4 [95% ДИ 3,5–50,1], p = 0,038; отношение шансов — 0,46 [95% ДИ 0,23–0,91], p = 0,038, c2 = 5,28 > c2крит. = 3,84. В группах пациентов с септическим шоком — основной (с ЭЦОТ, 21 пациент) и контрольной (без ЭЦОТ, 22 пациента) отношение рисков составило 2,28 [95% ДИ 1,08–4,81], p = 0,046; cнижение абсолютного риска — 36,43 % [95% ДИ 6,0–58,9], p = 0,046; число больных, которых необходимо лечить, — 2,7 [95% ДИ 1,7–16,8], p = 0,046; отношение шансов = 0,23 [95% ДИ 0,06–0,81], p = 0,043; c2 = 4,10 > c2крит. = 3,84.
Выводы
Использование заместительной иммунокоррекции в комплексе интенсивной терапии тяжелого хирургического сепсиса и септического шока патогенетически целесообразно и показано в качестве компонента экстренной целенаправленной органопротективной терапии сепсиса.
1. Белобородова Н.В., Попов Д.А. Эффективность иммуноглобулинов для внутривенного введения при бактериальных инфекциях // Анестезиология и реаниматология. — 2006. — № 6. — С. 72-76.
2. Казмирчук В.Е., Мальцев Д.В. Иммуноглобулинотерапия: эффективность и безопасность // Клінічна імунологія. Алергологія. Інфектологія. — 2009. — № 10. — С. 30-38 (http://immuno.health-ua.com/article/390.html).
3. Нестеренко А.Н. Апоптоз циркулирующих нейтрофилов при хирургическом cепсисе: патогенетическое значение и прогностические возможности // Український журнал хірургії. — 2010. — № 1. — С. 122-131 (http://www.nbuv.gov.ua/portal/chem_biol/ ujkh/2010_1/27_2010-01.pdf).
4. Нестеренко А.Н. Внутривенные иммуноглобулины в неотложной терапии септического шока: клинико-патоморфологическое обоснование целесообразности применения // Острые и неотложные состояния в практике врача. — 2010. — № 4. — С. 57-71 (http://www.biofarma.ua/ru/articles/vnutryvennye-ymmunohlobulyny-v-neotlozhnoy-tera pyy-septycheskoho-shoka-klynyko-patomorfolohycheskoe.html).
5. Пат. UA 56789 А Україна, МПК6 G 01 N 33/48. Спосіб діагностики фази імунного дистрес-синдрому / [Черній В.І., Шано В.П., Нестеренко О.М., Земляний І.В.]; заявник і патентовласник Донецький держ. мед. університет ім. М. Горького. — № 2002097440; заявл. 13.09.2002; опубл. 15.05.2003. Бюл. № 5.
6. Принципы диагностики и интенсивной терапии полиорганных нарушений при тяжелом хирургическом сепсисе / В.И. Черний, А.Н. Нестеренко, Б.Б. Брук, др. // Методические рекомендации МЗ Украины. — Киев, 2010. — 95 с.
7. Черний В.И., Нестеренко А.Н. Нарушения иммунитета при критических состояниях: особенности диагностики // Внутренняя медицина. — 2007. — № 2. — С. 12-23 (http://internal.mif-ua.com/archive/issue-500/article-516/)
8. Черний В.И., Нестеренко А.Н. Иммунокоррекция в комплексе интенсивной терапии хирургического сепсиса: Методические рекомендации МЗ Украины. — Киев, 2010. — 76 с.
9. Berlot G., Bacer B., Piva M. et al. Immunoglobulins in Sepsis // Advances in sepsis. — 2007. — Vol. 6, № 2. — P. 41-46.
10. Cavazzuti I.C., Rinaldi L.R., Donno L.D. et al. Early use of immunoglobulin in septic shock // Critical Care. — 2010. — № 14 (Suppl. 1). — P. 25 (http://ccforum.com/ content/ 14/ S1/P25).
11. Dellinger R.P., Levy M.M., Carlet J.M. et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008 // Intensive Care Med. — 2008. — Vol. 34, № 1. — P. 17-60.
12. Kantari C., Pederzoli-Ribeil M., Witko-Sarsat V. The role of neutrophils and monocytes in innate immunity // Contrib Microbiol. — 2008. — Vol. 15. — P. 118-146.
13. Kreymann K.G., de Heer G., Nierhaus A., Kluge S. Use of polyclonal immunoglobulins as adjunctive therapy for sepsis or septic shock // Crit Care Med. — 2007. — Vol. 35. — № 12. — P. 2677-2685.
14. Laupland K.B., Kirkpatrick A.W., Delaney A. Polyclonal intravenous immunoglobulin for the treatment of severe sepsis and septic shock in critically ill adults: a systematic review and meta-analysis // Crit Care Med. — 2007. — Vol. 35, № 12. —P. 2686-92.
15. Levy M.M., Marshall J.C., Fink M.P. et al. 2001 SCCM/ ESICM/ ACCP/ ATC/ SIS International Sepsis Definitions Conference // Crit. Care Med. — 2003. — Vol. 31, № 4. — P. 1250-1256.
16. Liumbruno G., Bennardello F., Lattanzio A. et al. Recommendations for the use of albumin and immunoglobulins // Blood Transfus. — 2009. — № 7. — P. 216-34.
17. Marshall J.C. Sepsis: rethinking the approach to clinical research // J. Leukoc. Biol. — 2008. — Vol. 83. — P. 471-482 (http://www.jleukbio.org).
18. Schefold J.C., Hasper D., Volk H.D., Reinke P. Sepsis: Time has come to focus on the later stages // Med. Hypotheses. — 2008. — Vol. 71. — P. 203-208.
19. Shapiro N.I., Howell M., Talmor D. et al. Implementation and Outcomes of the Mutliple Urgent Sepsis Therapies (MUST) Protocol // Crit Care Med. — 2006. — Vol. 34. — № 4. — P. 1025-1032.
20. Spitalnic S. Risk Assessment II: Odds Ratio / S. Spitalnic // Hospital Physician. — 2006. — № 1. — P. 23-26.
21. Turgeon A.F., Hutton B., Fergusson D.A. et al. Meta-analysis: intravenous immunoglobulin in critically ill adult patients with sepsis // Ann. Intern. Med. — 2007. — Vol. 146, № 3. — P. 193-203.
22. Werdan K., Pilz G., Bujdoso O. et al. Score-based immunoglobulin G therapy of patients with sepsis: The SBITS study // Crit. Care Med. — 2007. — Vol. 35, № 12. — P. 2693-2701.
23. Xiao H., Siddiqui J., Remick D.G. Mechanisms of Mortality in Early and Late Sepsis // Infection And Immunity. — 2006. — Vol. 74, № 9. — P. 5227-5235.