Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Оптимизация волюмического мониторинга при хирургическом лечении окклюзионного повреждения магистральных сосудов
Авторы: Богун Ю.В. Харьковская медицинская академия последипломного образования ГУ «Институт общей и неотложной хирургии АМН Украины»
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
В работе представлена схема интра- и послеоперационной терапии у пациентов с окклюзионным поражением магистральных сосудов. Целевыми показателями выбраны внутригрудной объем крови (ВГОК), внесосудистая вода легких (ВСВЛ) и коэффициент утилизации кислорода как маркер адекватности транспорта кислорода. Контроль этих параметров производится каждые 12 часов, с последующей коррекцией. Дебютная инфузионная терапия (ИТ) базируется на динамике величины сердечного индекса, индексов ВГОК и ВСВЛ. Недостаточность величины преднагрузки позволяет манипулировать объемными характеристиками инфузионной терапии. На этом фоне в случае повышенной сосудистой проницаемости и/или низкого сердечного выброса ИТ дополняется ионотропной поддержкой. В послеоперационном периоде величина преднагрузки формируется за счет внутригрудного объема крови. Гидродинамические колебания в послеоперационном периоде формируют изменчивость транскапиллярной проницаемости. Данные изменения обусловливают необходимость изучения динамики внесосудистой воды легких.
Инфузионная терапия, сердечный индекс, внутригрудной объем крови, внесосудистая вода легких, тетраполярная реография.
Инфузионная терапия при операциях на магистральных сосудах является одним из основных направлений интенсивной терапии, поскольку именно внутривенная инфузия может обеспечить адекватный сердечный выброс и стабильность гемодинамики на различных этапах оперативного лечения [1]. По данным Е.С. Горобец (2007), в основе адекватной ИТ лежат:
— поддержание достаточной преднагрузки путем интенсивной и опережающей внутривенной инфузии;
— поэтапное манипулирование составом инфузии с ориентированием на уже потерянный объем крови с учетом показателей коагулограммы;
— своевременное использование симпатомиметиков для поддержания пост- и преднагрузки [2].
Особенности хирургического лечения окклюзионного поражения магистральных сосудов сопряжены с временным пережатием брюшного отдела аорты. В этот период возникают резкие гемодинамические колебания, в основе которых лежит:
— снижение сердечного выброса;
— повышение общего периферического сопротивления сосудов;
— повышение — снижение преднагрузки за счет перераспределения объема циркулирующей крови (ОЦК).
В итоге интраоперационная ИТ у данной группы пациентов приобретает новые черты:
— протекция гидродинамического удара;
— обеспечение адекватного органного кровотока;
— профилактика реперфузионных осложнений.
Следует подчеркнуть, что ИТ направлена на поддержание адекватного сердечного выброса для обеспечения перфузии тканей при максимально низком гидростатическом давлении в просвете капилляров. Это необходимо для того, чтобы предупредить утечку жидкости в интерстиций. Согласно R. Zander (2007), ИТ определяется объемным и жидкостным компонентами возмещения потерь, первый из которых восстанавливает внутрисосудистый объем, а второй — компенсирует экстрацеллюлярные и интрацеллюлярные потери [22]. Однако в условиях неадекватности ИТ и/или развития осложнений распределение жидкости и коллоидной части плазмы, в частности альбумина, между секторами перестает быть уравновешенным. Развивающееся под действием цитокинов нарушение микроциркуляции и развитие так называемого эндотелита (повреждение эндотелия, активация эндотелиоцитов с набуханием и экспрессией адгезивных молекул) являются причиной вазодилатации, увеличения проницаемости, капиллярной «утечки» и потери жидкости. Эти патофизиологические изменения приводят к относительной гиповолемии вследствие перераспределения жидкости, что также является причиной снижения преднагрузки. Следовательно, обеспечение стабильности преднагрузки является основополагающим при составлении программы интраоперационной ИТ при хирургическом лечении окклюзионных поражений магистральных сосудов [5].
Тем не менее в силу того, что непосредственно сама величина преднагрузки подвержена влиянию множества факторов (величина сосудистого тонуса, растяжимость миокарда, ортостатические изменения и др.), ее использование как единственного критерия, определяющего ИТ, не представляется возможным. Вклад капиллярной «утечки» в патогенез критических состояний может быть сопоставим по своей значимости с первичными гемодинамическими нарушениями, например со снижением сердечного выброса: все попытки нормализовать преднагрузку вряд ли окажутся эффективными в случае, когда поступающая жидкость быстро оставляет сосудистое русло. Неудивительно, что в этой ситуации, несмотря на признаки дефицита жидкости и положительный прогноз в отношении реакции гемодинамики на инфузионную нагрузку, попытки увеличить ОЦК не ведут к росту сердечного выброса. В лучшем случае кратковременная гемодинамическая стабилизация будет достигнута ценой интерстициального отека тканей и усугублением органной дисфункции [6, 8].
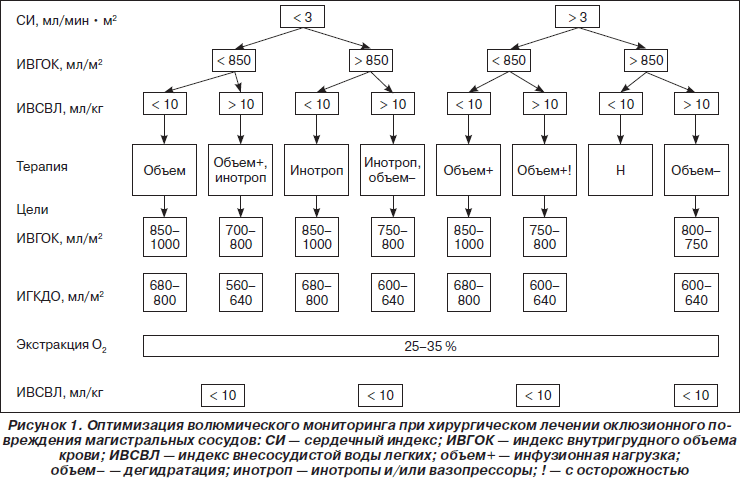
Таким образом, при составлении программы ИТ в интра- и послеоперационном периоде в качестве универсальных критериев следует использовать величину преднагрузки и степень проницаемости капилляров. В качестве объективного критерия преднагрузки оптимально использование сердечного индекса (СИ). Согласно данным В.А. Руднова (2007), снижение СИ менее 3 мл/мин • м2 приводит к циркуляторным и метаболическим сдвигам кислородного транспорта [5]. Следовательно, поддержание СИ выше 3 мл/мин • м2 (по данным Е.Н. Клигуненко (2006), с превышением на 20 % от исходной величины) является определяющим фактором базовой ИТ путем увеличения волюмической нагрузки [3]. Исходное превышение указанной величины позволяет проводить стандартную ИТ. Первый час: кристаллоидные растворы 10–15 мл/кг + восполнение кровопотери эритроцитарной массой или кристаллоидами в соотношении 3 : 1. Последующие часы: базисный почасовой объем + восполнение кровопотери эритроцитарной массой или кристаллоидами в соотношении 3 : 1. Поддерживающий объем 6 мл/кг. Формирование таким образом дебютной ИТ, направленной на поддержание СИ, обеспечивает стабильность кислородного метаболизма в интраоперационном периоде.
Окончание оперативного лечения окклюзионного повреждения магистральных сосудов сопровождается перестройкой гемодинамических параметров системного и микроциркуляторного кровотока в измененных условиях сосудистой системы, трансформацией преднагрузки. Объяснением этого является необходимость интраоперационно контролировать активность левых отделов сердца, характеризующих величину постнагрузки, без учета функциональной активности правых отделов.
Реперфузионные изменения сопровождаются неадекватным изменением конечного диастолического объема правых отделов сердца. Подобные конечные диастолические отношения «давление/объем» приводят к неблагоприятному состоянию кровотока, диастолического наполнения и указывают на снижение толерантности правых отделов к венозным нагрузкам. Одним из маркеров, характеризующих состояние преднагрузки в послеоперационном периоде, может быть величина индекса внутригрудного объема крови (ИВГОК 850–1000 мл/м2). ИВГОК, являясь расчетной характеристикой, включает показатели давления, и представляет объемную характеристику величины преднагрузки. Согласно данным М. Malbrain (2005), снижение величины ИВГОК, определяемой методом тетраполярной реографии, имеет степень корреляции с аналогичной динамикой конечно-диастолического объема, определяемой с использованием катетера Свана — Ганца. Точность метода (среднее различие между измерениями) — 3,28 ± 2,00 мл/м2, а доверительный интервал (среднее различие ± 2SD) — от –0,72 до 7,28 мл/м2 [14]. Хотя показатели ИВГОК демонстрируют некоторое завышение по сравнению с методикой Свана — Ганца, считается, что в целом метод в состоянии обеспечить надежный контроль динамических изменений преднагрузки в послеоперационном периоде. Снижение ИВГОК свидетельствует о наличии емкостного потенциала и позволяет проводить коррекцию гемодинамики путем увеличения объемных компонентов ИТ из расчета 1,5–2,5 мл/кг/ч. Критическим значением, характеризующим регрессию волюмического потенциала, по мнению С.С. Silliman (2007), является значение менее 850 мл/м2. Превышение верхней границы физиологической нормы (ИВГОК более 1000 мл/м2) указывает на перегрузку правых отделов сердца и, соответственно, отсутствие условий для волюмической нагрузки [19].
Отсутствие простого и относительно малоинвазивного метода интраоперационного мониторинга создает предпосылки для возникновения погрешности, связанной с отсутствием контроля степени интерстициальной проницаемости. Классические методы определения сосудистой проницаемости — термохромоделюция и транспульмональная термоделюция в повседневной практике применяются редко, в то же время возможность косвенно судить о направленности величины сосудистой проницаемости предоставляет допплерография с расчетом величины индекса внесосудистой воды легких (ИВСВЛ 4–7 мл/кг). Достоверность результатов исследования до сих пор остается предметом дискуссий. Тем не менее в экспериментальном исследовании на собакахD.G. Ashbaugh(1997) показал, что при остром повреждении легких, индуцированном введением олеиновой кислоты, средний показатель ИВСВЛ/ИВГОК составил 1,64 ± 0,38 по сравнению с 0,81 ± 0,17 при кардиогенном отеке (баллон в левом предсердии) и 0,37 ± 0,12 у здоровых животных [6]. Был сделан вывод, что «….этот параметр может помочь в дифференциальной диагностике кардиогенного и некардиогенного отека легких, позволяет оценить состояние легких на различных стадиях заболевания и дает возможность целенаправленных лечебных воздействий». Для того чтобы предотвратить осложнения, можно использовать стратегию ограничения волюмической нагрузки менее 10 мл/кг/ч. Еще в одном исследовании было продемонстрировано, что пациенты с исходными значениями ИВСВЛ более 14 мл/кг имеют более высокие показатели летальности (87 %, p < 0,01) по сравнению с пациентами с ИВСВЛ в пределах нормальных значений (41 %, p < 0,05). В недавней публикацииJ. Stubbsобнаружил у 373 больных, находящихся в критическом состоянии, что ИВСВЛ, измеренная с помощью тетраполярной реографии, хорошо коррелирует с выживаемостью больных и является независимым фактором, предсказывающим прогноз [20]. Следовательно, ИВСВЛ более 14 мл/кг позволяет увеличивать объемные характеристики волюмической нагрузки более 10 мл/кг/ч.
Исходя из вышесказанного, можно сделать вывод, что целевыми показателями считаются ИВГОК, ИВСВЛ, а также коэффициент утилизации кислорода как маркер адекватности транспорта кислорода. Дебютная ИТ во время хирургического лечения окклюзионного повреждения магистральных сосудов базируется на динамике величины СИ. Недостаточность величины преднагрузки позволяет манипулировать объемными характеристиками ИТ (объем), добиваясь ее нормализации. В случае перегрузки правых отделов сердца дебютная ИТ дополняется инотропной поддержкой симпатомиметиками (объем + инотроп). В послеоперационном периоде величина преднагрузки дополнительно формируется за счет ИВГОК. Редукция ИВГОК обусловливает формирование ИТ на основе объем, а подъем ИВГОК — на основе (объем + инотроп). Гидродинамические колебания в послеоперационном периоде, формируя изменчивость транскапиллярной проницаемости, привносят дополнительный фактор, влияющий на ИТ. Синхронное снижение ИВГОК и ИВСВЛ требует увеличения волюмической нагрузки от исходной (1,5 мл/кг/ч), достигая значения 3–5 мл/кг/ч (объем+). Асинхронизация этих факторов, проявляющаяся в недостаточности преднагрузки (снижение ИВГОК), в сочетании с повышенной транскапиллярной проницаемостью (повышение ИВСВЛ) требует форсирования ИТ, но с осторожностью (объем+!). Опасность возникновения некардиогенного отека легких в данном случае нивелируется угрозой смерти в результате недостаточности насосной функции сердца, обусловленной сниженной преднагрузкой, на фоне гиповолемии. Принимая во внимание дискутабельность данного утверждения, следует указать на то, что, несмотря на снижение онкотического давления плазмы, баланс сил обычно направлен в сторону резорбции жидкости. Поэтому в раннем послеоперационном периоде для развития интерстициального отека требуется определенное повышение капиллярного давления, которое может быть вовремя диагностировано кратным измерением ИВГОК и ИВСВЛ. Согласно данным Н. Roland (2001), Ingram Jr (2008) и Е. Braunwalder (2009), этот период времени составляет 10–16 часов. Результирующей составляющей оптимизации волюмического мониторинга при хирургическом лечении окклюзионного повреждения магистральных сосудов является коэффициент утилизации кислорода, который должен поддерживаться в физиологических границах нормы (КУО2 25–35 %) (рис. 1). Для оптимизации послеоперационной ИТ предложен следующий алгоритм лечебной тактики, основанный на показателях волюмического мониторинга.
Выводы
1. Дебютная инфузионная терапия во время хирургического лечения окклюзионного повреждения магистральных сосудов базируется на динамике величины сердечного индекса.
2. В послеоперационном периоде величина преднагрузки дополнительно формируется за счет внутригрудного объема крови.
3. Гидродинамические колебания в послеоперационном периоде, формируя изменчивость транскапиллярной проницаемости, требуют определения внесосудистой воды легких.
1. Гельфанд Б.Р. Острый респираторный дистресс-синдром. Практическое руководство / Б.Р. Гельфанд, В.Л. Кассиль. — М., 2007. — C. 86-97.
2. Горобец B.C. Проблема массивных кровопотерь в онкохирургии (аналитический обзор) / B.C. Горобец, С.П. Свиридова // Анест. и реан. — 2001. — № 5. — C. 44-47.
3. Киров М.Ю. Мониторинг внесосудистой воды легких у больных с тяжелым сепсисом / М.Ю. Киров, В.В. Кузьков,
В.Я. Бьртнес, Э.В. Недашковский // Анестезиология и реаниматология. — 2003. — № 4. — С. 41-53.
4. Руднов В.А. Современная практика инфузионно-трансфузионной терапии в отделениях реанимации и интенсивной терапии России (Результаты многоцентрового клинико-эпидемиологического исследования КРИСКО) / В.А. Руднов, А.С. Зубарев, А.В. Бутров // Интенсив. тер. —2007. — № 1. — С. 4-9.
5. Boldt J. Influence of different volume therapies and pentoxifylline infusion on circulating soluble adhesion molecules in critically ill patients / J. Boldt, M. Muller, M. Heensen // Crit. Care Med. — 2006. — № 24. — Р. 85-91.
6. Chanand J. Influence of hydroxyethystarch on inflam matory cytokine release following trauma and hemorrhagic shock / J. Chanand, A. Ayala, H. Chaudry // Intensive Care Med. — 2004. — № 1. — Р. 20-24.
7. Densmore T.L. Prevalence HLA sensitization in female apheresis donors / T.L. Densmore, L.T. Goodnough, Ali S et al. // Transfusion. — 2009. — P. 39-42.
8. Gajic O. Pulmonary edema after transfusion: how to differentiate transfusion-associated circulatory overload from transfusion-related acute lung injury / O. Gajic, M. Gropper, G. Hubmayr // Crit. Care Med. — 2006. — P. 109-131.
9. Guglin M. Pulmonary edema after transfusion in a patients with end-stage renal disease / M. Guglin, C. Dey, G.M. Meny et al. // Clin. Nephrol. — 2003. — P. 59-63.
10. Hebert P. Clinical outcomes following institution of the Canadian universal leucoredaction program for red blood cell transfusion / P.C. Hebert, D. Fergusson, M.A. Blajchman // JAMA. — 2003. — P. 289.
11. Kirov M.Y. Extravascular lung water in sepsis / M.Y. Kirov, V.V. Kuzlov, L.J. Bjertnaes // Yеarbооk of Intensive Care and Emergency Medicine / Ed. J.-L. Vincent. — Berlin-New York, 2005. — P. 449-461.
12. Malbrain M. Abdominal perfusion pressure / M. Malbrain, R. Ivatury, M. Cheatham, M. Sugrue // Abdominal Compartment Syndrome. — Georgetown: Landes Bioscience, 2006. — Р. 69-81.