Журнал «Внутренняя медицина» 4(4) 2007
Вернуться к номеру
Ревматические маски ВИЧ-инфекции
Авторы: О.Г. Пузанова, к.м.н., кафедра пропедевтики внутренних болезней № 1, Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Ревматология, Иммунология
Разделы: Справочник специалиста
Версия для печати
Приведены сведения о распространенности, патогенезе, клинико-лабораторных особенностях и лечении суставных и системных проявлений ВИЧ/СПИДа, а также оппортунистических инфекций (HCV, HBV, герпесвирусных, микоплазменных, грибковых). Выделена группа признаков, позволяющих предположить ассоциацию таких синдромов с ВИЧ-инфекцией. Описано влияние заражения ВИЧ на течение некоторых истинно ревматических заболеваний.
ВИЧ/СПИД, оппортунистические инфекции, ВИЧ-ассоциированные ревматические синдромы, патогенез, особенности течения, дифференциальный диагноз, лечение, прогноз.
Ревматические маски ВИЧ-инфекции — это разнообразные поражения периферических суставов и позвоночника, а также системные проявления, сопровождающие развитие этой инфекции и имитирующие истинные ревматические болезни и синдромы (синоним — ревматические синдромы при ВИЧ-инфекции). Кроме собственно ВИЧ такие синдромы известны для ряда оппортунистических инфекций (грибковых, микоплазменных, герпесвирусных и т.д.). И наконец, особый интерес представляет изменение клинического течения уже имеющихся ревматических заболеваний в случае инфицирования пациентов ВИЧ.
По современным представлениям, ВИЧ-инфекция — это заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ), которое развивается после длительной персистенции возбудителя в лимфоцитах, макрофагах и клетках нервной ткани и характеризуется медленно прогрессирующей дисфункцией иммунной системы. ВИЧ-инфицированными являются люди, в организме которых выявлен ВИЧ; к этой категории относятся и носители ВИЧ, и пациенты с клиническими проявлениями инфекции, в том числе больные СПИДом. Синдром приобретенного иммунодефицита (СПИД) — особо опасное инфекционное заболевание, терминальная стадия ВИЧ-инфекции, протекающее с поражением иммунной и нервной систем, проявляющееся развитием тяжелых вирусных, бактериальных, паразитарных поражений и/или злокачественных новообразований, которые приводят к смерти больного. Больные СПИДом — люди с разнообразными патологическими проявленими, обусловленными глубоким поражением иммунной системы ВИЧ-инфекцией.
В настоящее время речь идет о пандемии ВИЧ-инфекции. Как известно, в Европе преимущественно встречается ВИЧ-1, в Западной Африке — ВИЧ-2. В ряде стран Африки ВИЧ-позитивны более 30 % населения, и основным путем заражения остается половой. С 90-х годов прошлого века эпицентр инфекции перемещается в Южную и Юго-Восточную Азию, и наркозависимые становятся более типичной группой риска, чем гомосексуалисты. И в Азии, и в Европе возрастает значимость парентерального механизма передачи ВИЧ — при гемотрансфузиях, парентеральных манипуляциях и трансплантации органов; инъекционные наркоманы в Азии составляют до 70 % зараженных, в Европе — 44 %. Возможно и вертикальное инфицирование — внутриутробное, происходящее в родовых путях и при грудном вскармливании.
По данным Украинского центра СПИДа, первый случай ВИЧ-инфекции в нашей стране был зарегистрирован 20 лет назад — в 1987 г., и к началу 2005 г. число инфицированных возросло до 74 856 (в том числе 8478 детей). Соответственно, первый больной СПИДом зарегистрирован в 1988 г., а к 2005 г. синдром был диагностирован у 8614 взрослых и 304 детей. За этот период умерли 5217 взрослых и 150 детей. До 70 % заражений ВИЧ в Украине связано с внутривенным введением наркотических веществ. Среди ВИЧ-позитивных детей почти 90 % составляют дети раннего возраста, рожденные инфицированными матерями. По данным профессора С.А. Крамарева (2007), за последние 10 лет число ВИЧ-инфицированных возросло в 6,3 раза, а больных СПИДом — в 111,3 раза; при этом эксперты ВОЗ и ООН прогнозируют, что к 2010 г. количество ВИЧ-инфицированных в нашей стране может составить 1,4 млн. В 2005 г. в структуре инфекционной смертности удельный вес умерших от ВИЧ-инфекции взрослых трудоспособного возраста составил 21 %, а детей, соответственно, 11,6 %.
Этиопатогенез. Возбудитель ВИЧ-инфекции является лентивирусом (семейство ретровирусов). В сердцевине вирион содержит двунитчатую РНК, структурные белки и ферменты (в том числе обратную транскриптазу), снаружеипокрыт двойной липидной оболочкой, в состав которой входят гликопротеиды gp41 и gp120. Вирус чрезвычайно изменчив, геном его содержит 9213 пар нуклеотидов; лишь «типичный» для Европы ВИЧ-1 состоит из 2 групп (О и М) и 10 подвидов (от А до J). Резистентность к ВИЧ связывают с мутациями гена, кодирующего рецептор CCR-5.
Известен тропизм вируса к Т-лимфоцитам-хелперам, а также к макрофагам, клеткам нейроглии ЦНС, эпителию прямой кишки, островкам Лангерганса, клеткам тимуса, лимфатических узлов и селезенки — все эти клетки содержат антиген CD4. Гликопротеины CD4+ Т-хелперов являются также рецепторами к gp120 ВИЧ-1 и к gp105 ВИЧ-2. Соединение gp120 с CD4 блокирует сигналы от антигенпрезентирующих клеток.
При заражении в чувствительные клетки внедряется именно сердцевина вируса; затем под влиянием обратной транскриптазы происходит реверсия РНК в двунитчатую ДНК, а последняя проникает в ядро, где может длительно сохраняться как провирус, обеспечивая носительство инфекции. Активация провирусов у носителей ВИЧ возможна под влиянием герпесвирусных инфекций (цитомегаловирус, вирус Эпштейна — Барр, вирус простого герпеса), метаболитов простейших или грибов, перенесенных стрессов, неполноценного питания и т.п.
После внутриклеточного размножения вируса зараженные Т-хелперы погибают, и возникает виремия. Она сопровождается основными симптомами ранней фазы ВИЧ-инфекции — лихорадкой и лимфаденопатией. Но не только гибель зараженных Т-хелперов обусловливает развитие иммунодефицита у пациентов — важно и другое: 1) тысячи T-хелперов под влиянием gp41 ВИЧ становятся синцитием, то есть функционально неполноценными; 2) ВИЧ угнетает образование клеток-предшественников Т- и В-лимфоцитов в костном мозге и вызревание Т-лимфоцитов в тимусе; 3) ВИЧ индуцирует апоптоз незараженных Т-лимфоцитов; 4) ВИЧ-инфицированные макрофаги в отличие от Т-хелперов не гибнут, сохраняются и обеспечивают гиперсекрецию таких провоспалительных цитокинов, как TNF-α и ИЛ-6, а последние активируют зараженные клетки. Таким образом, содержание клеток CD4+ постепенно, но неуклонно снижается (логично предположить, что инфицирование ВИЧ пациента с ревматическим заболеванием Th1-типа должно сопровождаться ремиссией последнего, что и отмечают на этой стадии).
В норме соотношение CD4+/CD8+ составляет 1,5–1,7. Нарушение этого баланса и дисфункция CD4-звена обусловливает последующий дефицит клеток CD8+ — то есть дефицит цитотоксических Т-лимфоцитов, или Т-супрессоров. Соотношение CD4+/CD8+ менее 0,5–1 свидетельствует о развитии иммунодефицита (CD8+ клеточные механизмы связаны с развитием многих ревматических проявлений ВИЧ-инфекции, о чем будет сказано позже).
Рано вовлекаются и В-лимфоциты (клетки CD19+): прежде всего при выработке вируснейтрализующих антител происходит селекция вирусов, из-за чего их новая популяция становится более стойкой. Латентная внутриклеточная ВИЧ-инфекция (провирусы) недостижима для антител, что способствует ее персистенции (вовлечение В-клеточного звена объясняет причину многих волчаночно- и васкулитоподобных проявлений ВИЧ-инфекции, а также обострение предсуществующих ревматических заболеваний такого типа).
Значительная гипергаммаглобулинемия в разгаре ВИЧ-инфекции (а чаще на стадии СПИДа) свидетельствует о поликлональной В-клеточной активации — предшественнице В-клеточной лимфомы. Содержание В-лимфоцитов постепенно снижается (соответствующие ревматические синдромы угасают), а в дальнейшем наступает полный блок иммунной системы с активацией множества патогенных факторов, в зависимости от которых в терминальной стадии ВИЧ-инфекции различают инфекто-СПИД, онко-СПИД и нейро-СПИД. Смертность при ВИЧ-инфекции составляет 100 %; смерть наступает на фоне болезней, определивших клиническую картину СПИДа.
Показатели частоты встречаемости и интерпретация ревматических симптомов и синдромов при ВИЧ-инфекции в литературе очень разнятся, нередко оттого, что не принимаются во внимание стадии этой болезни, наличие предшествующих «самостоятельных» ревматических заболеваний и влияние оппортунистических инфекций.
Классификации ВИЧ-инфекции. В мире существует несколько классификаций ВИЧ-инфекции, но ни одна из них не отвечает потребностям клиницистов в полной мере. В нашей стране принята классификация клинических стадий ВИЧ/СПИДа (стадии I–IV), предложенная ВОЗ в 2002 г. («Scaling up Antiretroviral therapy in resource limited setting. Guidelines for a public health approach», WHO June 2002) (табл. 1).
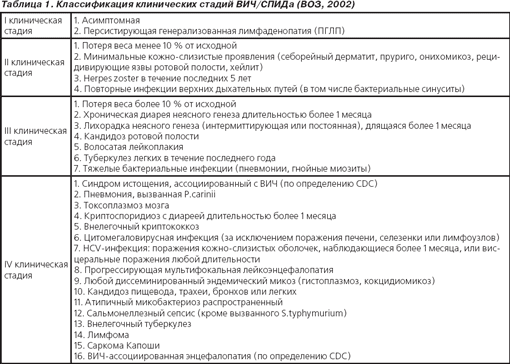
Как видно из табл. 1, ревматические синдромы вообще не указываются как определяющие клиническую стадию ВИЧ-инфекции. На I–III стадиях болезни исключения системной ревматической патологии требуют персистирующая генерализованная лимфаденопатия, похудение, рецидивирующие язвы ротовой полости, хейлит, лихорадка неясного генеза. В ІV клинической стадии внелегочные микозы и микоплазменные инфекции нередко протекают именно с поражением опорно-двигательного аппарата (грибковых и микоаллергических моно, олигоартритов и остеомиелитов, туберкулезного спондилита, коксита или гонита), а оппортунистические герпесвирусные инфекции и лимфомы обусловливают яркие системные проявления, трудноотличимые от истинно ревматических.
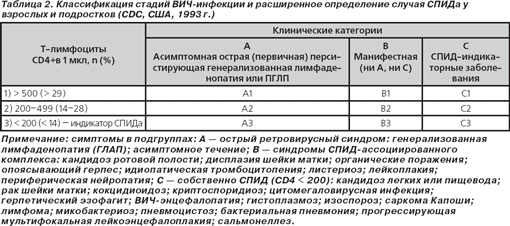
В классификации, разработанной Центром контроля за болезнями (CDC, США, 1993), учтены как клинические проявления (А — острый ретровирусный синдром, В — синдромы СПИД-ассоциированного комплекса, С — собственно СПИД), так и степень угнетения иммунной системы по содержанию Т-клеток CD4+ в 1 мкл крови (3 группы — более 500 (> 29 %), 200–499 (14–28 %) и менее 200 (< 14 %); последний показатель считается индикатором СПИДа) (табл. 2). Категории А3, В3, С1, С2 и С3 являются определяющими для случая СПИДа, а больные, относящиеся к этим категориям, подлежат в США учету как больные СПИДом.
Суставные синдромы возникают не менее чем у 60 % ВИЧ-инфицированных (табл. 3).
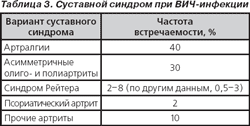
Что касается артралгий, то они чаще возникают внезапно в коленных, плечевых и локтевых суставах, длятся от 2 до 24 часов и объясняются транзиторной ишемией подлежащих костей.
Типичными считают следующие ВИЧ-ассоциированные (собственно вирусные) артриты. Первый вариант: подострый асимметричный олигоартрит с поражением коленных и/или голеностопных суставов, сопровождающийся очень сильными болями в костях и значительным ограничением движений. Длительность таких артритов от 1 недели до 1,5 месяца. Следует помнить, что стойкий болевой синдром может быть обусловлен развитием остеонекрозов. Второй вариант: остро развившийся симметричный ревматоидоподобный полиартрит — преимущественно отмечается у мужчин (постепенное развитие РА-подобных неэрозивных полиартритов, как сказано ниже, может быть обусловлено сопутствующей ВИЧ HCV-инфекцией, а развитие собственно РА у ВИЧ-инфицированых невозможно).
Практически маркером связи суставного синдрома с ВИЧ-инфекцией называют недифференцированную спондилоартропатию и перекрестные (сочетанные) формы спондилоартритов (т.е. выявление у пациента признаков 2 и более заболеваний этой группы), причем в литературе чаще встречается их определение не как вирусных, а как HLA-B27-ассоциированных артритов при ВИЧ-инфекции. Наиболее характерными являются комбинации псориатических артритов с реактивными или же с синдромом Рейтера. Как известно, течение сочетанных форм спондилоартритов более тяжелое, чем классических: типично острое начало, высокая лабораторная активность и полиморфные системные проявления — миокардит, полисерозит, полинейропатия.
Псориатический артрит. Псориаз диагностируют часто, обычно на стадии СПИДа, что является фактором неблагоприятного прогноза. Псориатический артрит (ПА) возникает более чем в трети таких случаев и характеризуется тяжелыми энтезопатиями и дактилитами. Именно у ВИЧ-инфицированных нередко развивается злокачественная форма ПА: на фоне эритродермии и генерализованого пустулезного псориаза возникает полиартрит, доминирующий в клинической картине: выраженность боли и воспаления чрезвычайно высока, общее состояние тяжелое — возможны изнуряющая лихорадка, похудение, лимфаденопатия, алопеция, атрофия мышц, признаки сердечной и почечной недостаточности, энцефало- и полинейропатии, нередко поражение глаз (ирит, иридоциклит). Нарастает анемия, гипергаммаглобулинемия, СОЭ — возможно, до 60 мм/час. На фоне ПА у ВИЧ-инфицированных существенно возрастает риск оппортунистических инфекций.
Реактивные артриты при ВИЧ-инфекции бывают связаны с хламидийной, иерсиниозной, шигеллезной или сальмонеллезной инфекцией; частота связи их с HLA-B27 точно не установлена. Синдром Рейтера обычно проявляется на фоне тяжелого иммунодефицита и протекает чрезвычайно тяжело, с развитием эрозивных и остеолитических суставных деструкций. Характерно сочетание олигоартрита и уретрита, развитие дактилитов, энтезопатий, подошвенного фасциита, изменений кожи и ногтей. Интересно, что поражения слизистых оболочек (конъюнктивит, стоматит, баланит) и осевого скелета (особенно сакроилеит) наблюдаются редко.
Как уже было сказано, с ВИЧ-инфекцией связывают тяжелое течение недифференцированной спондилоартропатии: у больных развиваются олигоартриты, спондилиты, дактилиты, энтезопатии (обращает на себя внимание редкое вовлечение ахилловых сухожилий), онихолизис, баланиты и увеиты, однако сочетание симптомов не позволяет диагностировать ни синдром Рейтера, ни псориатический артрит
Патогенетические механизмы описанных синдромов гетерогенны. Доказывают как непосредственное поражение суставов вирусом (выявляя в тканях антиген p24-ВИЧ), так и активацию триггерных инфекций (в частности, иерсиний) у носителей HLA-B27. Специфических гистологических признаков при ВИЧ-ассоциированных синовитах не находят.
Реже у ВИЧ-инфицированных возникают собственно инфекционные (т.е. гнойные, септические) артриты. Риск их существенно возрастает у инъекционных наркоманов и больных гемофилией, при этом возможна комбинация с гнойным бурситом и остеомиелитом. Инфектартриты у наркозависимых обычно обусловлены Pseudomonas aeruginosa, Serratia marcensens и S. aureus.
Кроме описанных ВИЧ-, HLA-B27-ассоциированных и бактериальных артритов следует остановиться на тех, которые обусловлены оппортунистическими инфекциями — кандидозом, туберкулезом, герпесвирусами, HCV- и HBV-инфекциями.
Грибком Candida albicans заражено до 90 % ВИЧ-инфицированных, и на фоне иммунодефицита острая грибковая костно-суставная инфекция может доминировать в клинической картине заболевания. Риск инвазивного микоза возрастает у новорожденных (особенно недоношенных), лиц с глубокой и длительной нейтропенией, пациентов, более 2 недель получавших антибиотики, имеющих туберкулез, злокачественные новообразования, гепатит или цирроз печени, женщин с хроническими воспалительными заболеваниями половых органов, получавших глюкокортикоиды (ГК) и т.д. Развитие кандидозного остеомиелита может быть следствием кандидемии при ВИЧ-инфекции или результатом занесения грибка при инъекциях контаминированных наркотических средств, хирургическом вмешательстве, травме. Обычно поражаются смежные позвонки или трубчатая кость — возникает локальная боль. Для верификации остеомиелита проводят рентгенографию, грибковый генез подтверждает выделение культуры кандиды из кости (используется открытая или игольчатая биопсия). Реже кандиды вызывают моноартриты коленных суставов — как проявление многоочагового микоза, что сопровождается конституциональными признаками и часто — остеомиелитом. Во всех случаях из синовиальной жидкости может быть выделена культура кандиды; гистологическое исследование биоптатов синовиальной оболочки выявляет неспецифическое, реже — гранулематозное воспаление.
Возбудители кокцидиомикоза (Coccidioides immitis) первично поражают дыхательные пути, а костно-суставные очаги являются результатом гематогенной диссеминации, особенно на стадии СПИДа. Типично постепенное развитие гонита — боль и незначительная припухлость коленного сустава, ранние рентгенологические изменения, хронизация в 70 % случаев. Инвазия синовиальных оболочек другой локализации чаще происходит при распространении грибка из очагов остеомиелита (в позвонках, костях запястья, таза, кистях, ступнях, длинных трубчатых костях). У большинства больных отмечается позитивный кокцидиоидиновый кожный тест. В биоптатах синовиальной оболочки определяют гранулематозное воспаление и типичные сферулы. В части случаев удается выделить культуру грибов, но из синовиальной жидкости — лишь в 5 %. Преходящий полиартрит обычно отражает микоаллергию при кокцидиозном поражении легких и сочетается с лихорадкой, узловатой или мультиформной эритемой, эозинофилией и лимфаденопатией.
Именно грибковые пневмонии при ВИЧ-инфекции IV клинической стадии нередко сопровождаются преходящими полиартикулярными артралгиями или синовитами, а также полиморфной кожной сыпью, синдромом бронхиальной обструкции — проявлениями микогенной аллергии (как, например, при кокцидиозе, гистоплазмозе).
Возбудители криптококкоза — Cryptococcus neoformans — становятся патогенными для человека при дефиците клеточного иммунитета, в том числе при ВИЧ-инфекции: со СПИДом связано 80–90 % случаев криптококковых заболеваний. Первичным очагом являются легкие, при гематогенной диссеминации в 5–10 % поражаются кости — развивается остеолиз, рентгенологически напоминающий картину при метастазах. Суставной синдром встречается очень редко — моноартикулярный, слабо выраженный, обычно с вовлечением коленного сустава, в сочетании с остеомиелитом подлежащей кости. При гистологическом исследовании синовиальной оболочки находят острый или хронический синовит, многоядерные гигантские клетки и гранулемы, множество почкующихся криптококков.
Споротрихоз преимущественно поражает кожу и лимфатические пути, но возможна и диссеминация Sporotrichum schenckii в легкие, ЦНС, глаза, кости и суставы; при иммунодефиците очаги этого микоза обычно множественные. Суставной споротрихоз встречается нечасто, у ослабленных больных: артралгии слабые или не выражены; возможны как моно-, так и полиартикулярные поражения; вовлекаются коленные, локтевые и плечевые суставы. Именно воспаление мелких суставов рук отличает споротрихоз от других грибковых артритов. Отмечается склонность к распространению инфекции на окружающие мягкие ткани, при этом формируются свищи. Конституциональные симптомы споротрихозу не присущи, однако это заболевание может оказаться смертельным у ВИЧ-инфицированных при сочетании деструктивних артритов с субфебрилитетом, похудением, экзантемой, анемией, поражением глаз и ЦНС.
Рентгенологические данные вариабельны — от субхондральной остеопении до характерных «пробойников» кости. При исследовании биоптатов синовии отмечают инвазивный рост паннуса, при микроскопии — гранулемы, реже — неспецифическое воспаление. Диагностика часто основана на выявлении культуры возбудителя из синовиальной жидкости.
Терминальной стадии ВИЧ-инфекции присущи проявления внелегочного туберкулеза, в том числе костно-суставного — либо в связи с активацией инфекции в первичном комплексе, либо с ее распространением из лимфоузлов. Большинство случаев представлены специфическим моноартритом тазобедренных, коленных или плечевых суставов. Даже стойкий полиартрит кистей обычно является аллергическим и не приводит к деструкциям и деформациям. Коксит поначалу имеет реактивный, транзиторный характер, возникает стойкая боль в паху, иррадиирующая в бедро, ограничение всех движений в суставе. В ряде случаев отмечают холодный абсцесс на передневнешней поверхности бедра. Прогрессируют слабость, потливость, похудение. С помощью рентгенографии, КТ или МРТ выявляют очаги деструкции в вертлужной впадине, головке и шейке бедренной кости (симптом тающего сахара). Гонит начинается с болей. Припухлость возникает либо внезапно (при «прорыве» костного очага в полость сустава), либо постепенно (при прорастании специфических гранулем), обычно стойкая. На рентгенограмме выявляют эпифизарный остеопороз и эрозии большеберцовой кости. При воспалении плечевого сустава движения в нем невозможны, плечо приведено, атрофия мышц резко выражена, припухлости нет (caries sicca). На рентгенограмме определяются дефекты головки плеча, секвестрация не характерна.
При туберкулезном спондилите возникает стойкая боль в грудном или поясничном отделе, при пальпации обычно болезненны 2 смежных позвонка (Th-IX-X). Для ранней диагностики остеонекрозов информативна КТ, изменения на рентгенограммах отмечают позднее: снижение высоты межпозвоночных дисков, узурация суставных поверхностей тел позвонков, казеозный остит и, наконец, клиновидная деформация позвонков.
Поражение суставов вследствие герпесвирусных инфекций отмечается крайне редко: 1) при опоясывающем лишае (возбудитель — Varicella zoster) через 1–5 дней после появления кожной сыпи возможно вовлечение коленных суставов — боли или воспаление, длящиеся не больше недели; часто выражена локальная гиперемия, что требует исключения инфекционного артрита; 2) острый моноартрит на фоне герпетиформной кожной сыпи (возбудитель — Herpes simplex 1-го типа) склонен к ремиссии через 2–16 недель; 3) вирус Эпштейна — Барр может обусловить моно- или олигоартрит крупных суставов, а также развитие симметричного полиартрита; симптомы могут сохраняться от 8 дней до 14 месяцев.
Частота HCV-инфекции у ВИЧ-инфицированных чрезвычайно высока, у наркозависимых превышает 70 %. Обусловленный ею суставной синдром может проявиться острым полиартритом межфаланговых суставов, суставов запястья, плечевых, коленных и тазобедренных суставов и даже соответствовать критериям РА; часто сочетается с карпальным туннельным синдромом и ладонными теносиновитами. Даже при затяжном и хроническом течении артритов они не бывают деструктивными, и прогностически более важны прочие ревматические синдромы, ассоциированные с HCV. Как известно, в общей популяции они представлены проявлениями криоглобулинемии (эссенциальный криоглобулинемический и изолированный кожный васкулиты, синдром Рейно, полинейропатия, мембранозно-пролиферативный гломерулонефрит), а также синдромом Шегрена, фибромиалгией, полимиозитом, идиопатическим легочным фиброзом и тромбоэмболиями. Связь этих синдромов с HCV на фоне ВИЧ-инфекции не изучена. Однако установлено, что фибромиалгия возникает более чем у 30 % ВИЧ-инфицированных, синдром Шегрена имеет значительные клинико-иммунологические отличия от первичного. Возможно, дальнейшие исследования покажут влияние HCV-инфекции на так называемые ревматические маски ВИЧ.
Прочие ВИЧ-ассоциированные ревматические синдромы. Развитие множества ревматических симптомов и синдромов при ВИЧ-инфекции (особенно внесуставных) связывают с CD8-клеточными механизмами, учитывая высокую частоту обнаружения разнообразных антител, прежде всего — антинуклеарных, антифосфолипидных (особенно к кардиолипину), ревматоидного фактора и циркулирующих иммунных комплексов. Также выявляются антитела к нервным клеткам, клеткам крови, к париетальным клеткам желудка.
С другой стороны, развитие синдрома Шегрена у ВИЧ-инфицированных не сопровождается появлением РФ, SSA- и SSB-антител. Ксерофтальмия, ксеростомия и увеличение околоушных слюнных желез сочетаются с лимфоцитарной инфильтрацией (CD8-клетками) внутренних органов. Отсюда и название — синдром диффузного инфильтративного лимфоцитоза. Особенно важны поражения легких (пневмонит), нервной системы (асептический менингит, парезы черепно-мозговых нервов, симметричная двигательная полинейропатия), печени (гепатомегалия, гиперферментемия) и почек (интерстициальный нефрит с развитием почечной недостаточности, канальцевый ацидоз IV типа). Как известно, при болезни Шегрена внутренние органы вовлекаются реже, и типичны ее ассоциации с антигенами B8, DR3, DW3 и DW4. Синдром Шегрена у ВИЧ-инфицированных европеоидов cвязывают с носительством DR6 и DR7, у негроидов — с DR5.
Сообщается о случаях возникновения признаков полимиозита на фоне ВИЧ-инфекции, но особенности его не описаны: отмечают проксимальную мышечную слабость, повышение содержания креатинфосфокиназы в крови, изменения на электромиограммах и при исследовании биопсийного материала. Клинически неотличима зидовудининдуцированная миопатия (синоним — AZT-индуцированная миопатия), возникающая не раньше чем через полгода от начала терапии. При исследовании биоптатов выявляют характерные паракристаллические митохондриальные включения («рваные» красные волокна). Мышечная атрофия может быть чрезвычайно выраженной у больных со злокачественным ПсА и другими тяжелыми ВИЧ-ассоциированными спондилоартритами. Наконец, встречаются гнойные миозиты, обычно вызванные золотистым стафилококком: чаще поражается четырехглавая мышца бедра, 75 % случаев представлены одиночным абсцессом (очевидно, вследствие инъекций наркотических веществ нестерильными шприцами). У пациентов с нейтропенией возможны кандидозные миозиты — от диффузных до локализованных (абсцессов).
Что касается васкулитов и васкулопатий, то на фоне ВИЧ-инфекции возможно развитие признаков узелкового полиартериита, синдрома Чарджа — Стросса, геморрагического и гиперсенситивного васкулитов, а также изолированного васкулита ЦНС. Частота, клинико-морфологические особенности и прогностическая ценность их мало изучены. Как отмечалось, ряд васкулитов и васкулопатий у ВИЧ-инфицированных обусловлен оппортунистическими инфекциями (в том числе HCV и HВV).
Синтез антифосфолипидных антител, особенно к кардиолипину, возрастает как на фоне собственно ВИЧ, так и в связи с сопутствующими вирусными, бактериальными инфекциями и паразитарными инвазиями. Несмотря на высокую частоту обнаружения (у 60–80 % пациентов, у большинства — транзиторно), гиперкоагуляцию они не усиливают и клиническими проявлениями (тромбозами) не сопровождаются.
Описывают также развитие ВИЧ-ассоциированых мягкотканных поражений — тендинитов, бурситов, адгезивного капсулита, карпального туннельного синдрома, контрактуры Дюпюитрена.
Как уже было замечено, развитие истинных РА и системной красной волчанки (СКВ) на фоне ВИЧ-инфекции невозможно. При заражении ВИЧ течение предсуществующего РА изменяется — возникает стойкая ремиссия, очевидно, обусловленная снижением содержания клеток CD4+; но в отдельных случаях активность болезни может возрасти. Что касается случаев заражения ВИЧ больных СКВ, то проблема мало изучена; описывают как ремиссии, так и обострения заболевания. Более типична все же проблема дифференциальной диагностики волчаночноподобных проявлений — СКВ или ВИЧ (в том числе и разнообразные ассоциированные лимфомы).
Итак, предполагать обусловленность суставных и прочих ревматических синдромов ВИЧ-инфекцией следует прежде всего у пациентов из групп риска. Во-вторых, следует учитывать клинико-анамнестические и иногда лабораторные особенности, присущие ВИЧ-ассоциированным ревматическим синдромам и отличающие их от истинных:
— тяжелый резистентный псориаз / псориатический артрит,
— недифференцированная и перекрестные спондилоартропатии;
— очевидно, все случаи синдрома Рейтера, реактивных артритов, СКВ и ПМ;
— синдром Шегрена с вовлечением внутренних органов и описанными серологическими особенностями;
— острый дебют РА-подобного полиартрита у мужчин;
— внезапные ремиссии РА;
— отсутствие эффекта или ухудшение суставных симптомов при применении метотрексата, системной ГК-терапии;
— фибромиалгия;
— упорные артралгии;
— некоторые васкулиты (узелковый полиартериит, синдром Чарджа — Стросса, геморрагический, гиперсенситивный васкулиты, изолированный васкулит ЦНС).
Рутинные лабораторные исследования мало помогают при интерпретации ревматических синдромов: неспецифично увеличение СОЭ и С-реактивного белка, часто выявляются HLA-B27, разнообразные антитела (как уже отмечалось, особенно антинуклеарные, антикардиолипиновые, ревматоидный фактор) и циркулирующие иммунные комплексы. Кроме того, изменения общеклинических и биохимических показателей зависят также от стадии ВИЧ-инфекции, наличия и характера осложнений и сопутствующих заболеваний: например, вначале возможен лейкоцитоз крови со сдвигом формулы влево, а на стадии СПИДа возникает панцитопения. Наиболее важна серологическая диагностика ВИЧ-инфекции — выявление ее специфических маркеров.
Как известно, существует перечень клинических показаний, при которых пациенты подлежат рекомендованному медицинскому освидетельствованию на выявление заражения ВИЧ; обследование проводится с согласия пациента или его законного представителя (для несовершеннолетних, нетрудоспособных). В этот перечень вошли лихорадка неясного генеза, генерализованная лимфаденопатия, случаи выраженного похудения, длительных и рецидивирующих бактериальных инфекций и паразитарных инвазий, хронических воспалительных заболеваний женской половой сферы, случаи установленного туберкулеза, гепатитов В и С, ряда герпесвирусных, грибковых и паразитарных заболеваний, болезней крови и ряда лимфопролиферативных заболеваний, частых гемотрансфузий, случаи заболеваний, передающихся половым путем, а также наркомания, токсикомания, гомо- и бисексуальная активность и занятия проституцией. Ревматические заболевания и синдромы в этом перечне не значатся, и тем не менее, знание описанных выше клинических особенностей поможет врачу предположить именно ВИЧ-инфекцию в качестве их истинной причины.
Вирусологическая диагностика ВИЧ-инфекции на практике не применяется. Чаще всего проводят иммуноферментный анализ (ИФА) для выявления антител к ВИЧ-1, ВИЧ-2 и их фрагментам. Ложноположительные результаты нередки при обследовании беременных, наркозависимых и больных алкоголизмом, а также возможны при наличии в крови антигенов, подобных ВИЧ, поэтому все положительные результаты перепроверяют, используя другую тест-систему, а затем метод иммуноблотинга (вестернблотинга). При сомнительном результате исследование повторяют, используя диагностический набор другой серии. Определение антител к ВИЧ возможно также с помощью реакций агглютинации, иммунопреципитации, непрямой иммунофлюоресценции. Выявление РНК ВИЧ (для оценки вирусной нагрузки) и ДНК провируса ВИЧ (для диагностики ВИЧ-инфекции) возможно с помощью ПЦР — полимеразной цепной реакции. ИФА и ПЦР являются взаимодополняющими методами диагностики ВИЧ-инфекции: сначала выполняют ИФА, затем ПЦР. Исследования проводятся в специальных лабораториях. Материалом для выявления антител являются сыворотка или плазма крови. Образцы сыворотки на пункте забора крови регистрируют и с двумя направлениями передают на анализ не позднее 3 дней от взятия крови (не позднее 7 дней для замороженных образцов, которые доставляют в специальном контейнере с холодоагентом). Не подлежат исследованию хилезные, гемолизированные сыворотки, сыворотки на сгустке крови и образцы с бактериальным проростом. В ряде случаев допускается забор 3–4 капель крови из пальца на специально предназначенную фильтровальную бумагу — лишь для первичного скрининга на антитела.
Лечение
Основой являются рекомендации экспертов ВОЗ. Специфическим лечением ВИЧ-инфекции является антиретровирусная терапия, направленная на максимальное угнетение репликации ВИЧ в организме, при котором восстанавливаются клетки иммунной системы, улучшается состояние и качество жизни пациента, увеличивается продолжительность жизни. Антиретровирусную терапию рассматривают как этиотропное лечение ВИЧ-инфекции. Назначение ее регламентируется приказами МЗ Украины в соответствии с клинико-лабораторными показателями и стадиями болезни.
Применяют 2 категории антиретровирусных лекарственных средств — ингибиторы обратной транскриптазы (нуклеозидные и ненуклеозидные) и ингибиторы протеаз. Нуклеозидные ингибиторы обратной транскриптазы — это зидовудин, ламивудин, видекс, ставудин; ненуклеозидные — невирапин, нельфинавир, ифавиренц; к ингибиторам протеаз относится индинавира сульфат. Антиретровирусная терапия состоит в комбинированном применении препаратов, обеспечивающем терапевтический эффект и упреждающем развитие резистентных форм ВИЧ-инфекции. Для контроля ответа на лечение в динамике определяют вирусную нагрузку (содержание копий РНК ВИЧ) и оценивают клинико-иммунологический статус пациента (по содержанию клеток CD4+).
При выявлении туберкулеза рекомендуется сначала провести его специфическое лечение в течение по меньшей мере 2 месяцев), после чего перейти к антиретровирусной терапии.
Антиретровирусная терапия снижает риск оппортунистических инфекций, но при их возникновении показано специфическое лечение. Лечение острой оппортунистической инфекции предшествует назначению антиретровирусной терапии первой линии.
ВИЧ-ассоциированные артриты обычно хорошо поддаются лечению нестероидными противовоспалительными средствами (НПВС). При развитии реактивного артрита, синдрома Рейтера или ПА показаны НПВС и физиотерапия (криотерапия, фонофорез) в сочетании с лечебной физкультурой. Иногда возникает необходимость применения глюкокортикоидов — локально (в том числе внутрисуставно) или системно (в низких или средних дозах, с осторожностью, учитывая усиление иммуносупрессии).
При синдроме Рейтера, тяжелых энтезопатиях низкие дозы ГК обычно неэффективны, так же как и применение зидовудина, и в этих случаях обычно увеличивают дозу НПВС и назначают сульфасалазин. В мире есть опыт эффективного лечения таких пациентов производными аминохинолина, этретинатом и циклоспорином А и негативного влияния метотрексата. В отдельных случаях целесообразна профилактическая антибиотикотерапия. Метотрексат и прочие цитостатики могут спровоцировать молниеносное развитие СПИДа, саркомы Капоши и присоединение оппортунистических инфекций.
Развитие у ВИЧ-инфицированного псориаза и ПА свидетельствует о возросшем риске оппортунистических инфекций, поэтому системная ГК-терапия и цитостатические иммунодепрессанты особенно небезопасны. Метотрексат и ультрафиолетовое облучение допускаются лишь при очень тяжелом течении этих заболеваний. Сульфасалазин и производные аминохинолина не применяют; сообщается о высокой эффективности зидовудина, а также препаратов золота (ауранофина). Предполагая злокачественную форму ПА, важно исключить сепсис.
В случаях ВИЧ-ассоциированного полимиозита показано применение ГК по 30–60 мг/сут. по схеме преднизолона в течение 8–12 недель (возможна комбинация с зидовудином), с последующим постепенным снижением дозы; допускается осторожное применение метотрексата. Улучшение состояния при зидовудининдуцированной миопатии отмечается после уменьшения дозы или полного прекращения приема препарата.
При гнойных артритах, бурситах, миозитах, остеомиелитах применяют общепринятые схемы лечения.
Первичная профилактика кандидоза при антибиотикотерапии у ВИЧ-инфицированных проводится по таким схемам: № 1 — нистатин 2,0 г/сут. ежедневно; № 2 — нистатин 4,0 г/сут. ежедневно (не более 10 дней); № 3 — кетоконазол 0,2 г ежедневно; № 4 — флюконазол 0,15 г 1 раз в неделю; № 5 — флюконазол 0,05 г ежедневно. Профилактику начинают со схемы меньшего номера, а при отсутствии или снижении эффекта переходят к следующей.
Для лечения кандидемии применяют флюконазол или амфотерицин В внутривенно в течение 2–3 недель. Разовая доза флюконазола — 600 мг, а при нормальной температуре — 400 мг, вводят 1 раз в сутки; доза амфотерицина В — 0,6–0,8 мг/кг, также 1 раз в сутки. Препараты отменяют через 2 недели с момента негативного посева крови. При выделении Сandida glоbrata или Сandida globrata доза флюконазола составляет 800 мг. При кандидозном артрите и остеомиелите применяют либо амфотерицин В (в/в по 0,5–1 мг/кг 1 раз в сутки в течение 6–10 месяцев), либо флюконазол (в/в или per os по 600 мг 1 раз в сутки в течение 6–12 месяцев). При инфекции, вызванной Сandida glоbrata или Сandida krusei, доза флюконазола — 800 мг в сутки. Для поддерживающего лечения можно применять итраконазол. Вопрос об оперативном лечении решают индивидуально. При отсутствии неврологических осложнений кандидозного остеомиелита позвонков достаточно монотерапии противогрибковым средством.
Лечение кокцидиомикоза комбинированное: терапию флюконазолом, итраконазолом или амфотерицином В сочетают с оперативным вмешательством при хроническом артрите с формированием паннуса и резистентностью к проводимому медикаментозному лечению; при внесуставной диссеминации, в том числе с поражением костей; при титре комплемента выше 1:128. При костно-суставном споротрихозе оптимальна комбинация дебриджмента пораженных суставов с внутривенным введеним высоких доз амфотерицина В. Менее эффективна монотерапия этим препаратом; сообщается об эффективности итраконазола.
Прогноз
В настоящее время из-за отсутствия специфических методов профилактики и эффективных методов лечения ВИЧ-инфекции больные СПИДом неизбежно погибают. Прогноз для ревматических проявлений существенно зависит от стадии ВИЧ-инфекции и клинической формы поражений опорно-двигательного аппарата: от полного исчезновения симптомов до тяжелых деструктивных артритов, особенно в случаях гнойных воспалений и грибковых инвазий.
1. Агабабова Э.Р. Спондилоартриты как объект перспективных научных исследований в ревматологии / Избранные лекции по клинической ревматологии / Под ред. В.А. Насоновой, Н.В. Бунчука. — М.: Медицина, 2001. — С. 74-82.
2. Вест С.Дж. Секреты ревматологии: Пер. с англ. — М.: Бином; СПб.: Невский диалект, 1999. — 768 с.
3. Збiрник нормативної документації по ВІЛ/СНІДу. — Київ, 2002. — 198 с.
3. Клинические рекомендации. Ревматология / Под ред. Е.Л. Насонова. — М.: ГЭОТАР-Медиа, 2005. — 288 с.
4. Крамарев С.О. Проблемні питання інфекційних хвороб в Україні // Здоров'я України. — 2007. — № 2/1. — C. 7-8.
5. Насонов Е.Л. Антифосфолипидный синдром. — М.: Литтерра, 2004. — 440 с.
6. Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. — Ярославль: Верхняя Волга, 1999. — 616 с.
7. Ревматичні хвороби та синдроми / А.С. Свінціцький, О.Б. Яременко, О.Г. Пузанова, Н.І. Хомченкова. — К.: Книга-плюс, 2006. — 680 с.
8. Фещенко Ю.І., Ільницький І.Г., Мельник В.М. та ін. Туберкульоз позалегеневої локалізації. — К.: Логос, 1998. — 376 с.
9. Furst D.E., Breedveld F.C., Kalden J.R. et al. Updated consensus statement on biological agents, specifically tumor necrosis factor α(TNF-α) blocking agents and interleukin-1 receptor antagonist (IL-1 ra), for the treatment of rheumatic diseases, 2004 / Ann. Rheum. Dis. — 2004. — Vol. 63 (Suppl. II). — ii2-ii12.
10. Manger B. Checkliste XXL Rheumatologie. — 3 Auflage. — Stuttgart; New York: Georg Thieme Verlag, 2005. — 586S.
11. Pschyrembel Klinisches Woerterbuch. — 259 Auflage. — Berlin; New York: Walter de Gruyter, 2002. — 1842S.
12. Spondyloarthropathies // Textbook of Rheumatology. — 5th ed. / W.N. Kelley, E.D. Harris, S. Ruddy, C.B. Sledge. — Philadelphia; London; Toronto; Montreal; Sydney; Tokyo: W.B. Saunders Co. — P. 969-1014.
