Журнал «Внутренняя медицина» 4(4) 2007
Вернуться к номеру
Тромбоэмболия легочной артерии
Авторы: Hans-Peter Kohler, MD, Professor of Medicine University Hospital of Bern, Switzerland
Рубрики: Медицина неотложных состояний, Хирургия
Разделы: Справочник специалиста
Версия для печати
Тромбоэмболия легочной артерии (ТЭЛА) — это окклюзия просвета основного ствола или ветвей легочной артерии частичками тромба, сформировавшегося в венах большого круга кровообращения или полостях правого сердца, переносимыми в малый круг кровообращения с током крови. Механическая закупорка ствола или ветвей легочной артерии тромбоэмболом сопровождается генерализованным спазмом легочных артериол, что приводит к резкому ограничению кровотока в легких.
Практическая значимость ТЭЛА в настоящее время определяется явным увеличением ее частоты при разнообразных заболеваниях, в том числе после операционных вмешательств, проградиентным ростом летальных исходов и трудностями диагностики этого осложнения из-за полиморфизма развивающихся клинических синдромов.
В настоящее время в Европе частота тромбоэмболии составляет 11–25 %. В частности, во Франции ежегодно регистрируется до 100 000 случаев ТЭЛА, в Англии и Шотландии по причине тромбоэмболии легочной артерии ежегодно госпитализируется 65 000 пациентов, а в Италии — 60 000. По данным крупнейших клиник США, ТЭЛА наблюдается у 3 % населения страны. По данным Фремингемского исследования, ТЭЛА составляет 15,6 % от всей внутригоспитальной летальности, причем на хирургических больных приходилось 18 %, а 82 % составили больные с терапевтической патологией. По данным многочисленных патологоанатомических исследований [13], в 50–80 % случаев тромбоэмболия легочной артерии не диагностируется вообще, а во многих случаях ставится лишь предположительный диагноз. ТЭЛА занимает одно из ведущих мест в акушерской практике: смертность от этого осложнения колеблется от 1,5 до 2,7 % на 10 000 родов, а в структуре материнской смертности составляет 2,8–9,2 % [3]. Не получая адекватного лечения, многие больные умирают в первые часы от начала заболевания.
Этиология
Непосредственной причиной возникновения ТЭЛА является тромб, который мигрировал в легочную артерию из того места в организме, где он образовался. Такие тромбы называют эмболами. В большинстве случаев причиной развития заболевания является тромбоз глубоких вен ног. Ежегодная частота возникновения тромбоза глубоких вен голени составляет 100 случаев на 100 000 населения [11]. Риск возникновения ТЭЛА значительно увеличивается при развитии тромбофлебита. Наиболее частой причиной ТЭЛА является отрыв венозного тромба и закупорка им части или всего русла легочной артерии. По данным патологоанатомического исследования 749 умерших с ТЭЛА, основным источником эмболии был тромбоз в системе нижней полой вены (83,6 %), при этом в 68,1 % случаев он локализовался в бедренной, подвздошной и нижней полой венах. Значительно реже (3,4 %) тромбоз имел место в полостях правого сердца и в системе верхней полой вены [8].
Часто отмечается тромбоз одновременно глубоких и поверхностных вен голени. Распространение тромботического процесса с поверхностных и глубоких вен голени на бедренную вену происходит через большую подкожную вену бедра. Вначале тромб имеет диаметр меньше, чем диаметр бедренной вены, увеличивается главным образом в длину и не перекрывает просвета вены (флотирующий тромб). Длина таких тромбов достигает иногда 15–20 см. При тромбах, окклюзирующих просвет сосуда, ТЭЛА не развивается. Кровоток в венах в этом периоде сохранен, но вероятность отрыва фрагмента тромба и развития ТЭЛА очень велика.
Очень опасным является момент перехода тромботического процесса с глубоких вен голеней на подколенную вену, так как диаметр тромба меньше подколенной вены и фрагмент его легко может проникать в систему нижней полой вены и далее в легочную артерию.
К числу наиболее распространенных факторов, способствующих тромбообразованию в магистральных венах, относятся: сердечно-сосудистые заболевания (ревматизм, особенно в активной фазе, с наличием митрального стеноза и мерцательной аритмии, инфекционный эндокардит, гипертоническая болезнь, ишемическая болезнь сердца, хроническая сердечная недостаточность, кардиомиопатии, тяжело протекающие формы неревматических миокардитов); злокачественные новообразования; гиподинамия, в том числе необходимость соблюдения постельного режима более 3 дней (особенно у больных с заболеваниями легких, инфарктом миокарда, с повреждениями спинного мозга), изредка и у здоровых людей, которые долго находятся в вынужденном положении; переломы костей или травмы ног, в том числе иммобилизация ноги в течение последних 12 недель или ее паралич; хирургические вмешательства, в первую очередь на органах брюшной полости и нижних конечностях; постоянный катетер в центральной вене; пожилой и старческий возраст; ожирение; сахарный диабет; прием пероральных контрацептивов; хроническая венозная недостаточность нижних конечностей; беременность, ранний послеродовой период и оперативное родоразрешение; эритремия; системная красная волчанка; первичные гиперкоагуляционные состояния; наследственные факторы (дефицит антитромбина III, протеинов С и S, резистентность к активированному протеину С (фактор V Лейдена), высокий уровень ингибитора плазмина, гипергомоцистеинемия, высокая концентрация фактора VIII, мутация протромбина G20210A, дисфибриногенемия и др.). Среди наследственных факторов одним из наиболее распространенных является генетическая мутация фактора V свертывания крови (фактор V Лейдена), встречающийся у 3 % населения и увеличивающий риск тромбоза в несколько раз. Предрасполагающие факторы выявляют у 80–90 % больных [5].
Патогенез
Патогенез гемодинамических и вентиляционных расстройств при ТЭЛА чрезвычайно сложен. Ведущим фактором в генезе гемодинамических расстройств при ТЭЛА является механическая обструкция легочноартериального русла. Причем тромб, оторвавшийся от места своего образования, например в глубоких венах нижних конечностей, и переносимый с током крови в малый круг кровообращения, частично разрушается. Поэтому в большинстве случаев имеет место множественная окклюзия нескольких ветвей легочной артерии разного калибра, часто двусторонняя (немассивная ТЭЛА). В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола легочной артерии, которая, как правило, сопровождается острым (без предвестников) развитием тяжелейшей клинической картины тромбоэмболии, в том числе быстро наступающей внезапной сердечной смертью. При обтурации на 25–30 % просвета сосуда давление в легочной артерии повышается до 30 мм рт.ст., но общий кровоток остается в норме. При закупорке легочной артерии на 50 % и более отмечается уменьшение как легочного кровотока, так и сердечного выброса. При окклюзии 85 % легочной артерии практически выключается легочный кровоток и наступает смерть. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви легочной артерии. Наряду с механической частичной или полной закупоркой легочноартериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга, во многом обусловленный высвобождением из тромбоцитов, оседающих на поверхности тромбоэмбола, вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и др.). В результате легочное сосудистое сопротивление возрастает в еще большей степени. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Следует также помнить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола в проксимальном направлении, то есть против тока крови. Нередко это приводит к трансформации немассивной ТЭЛА в массивную.
Полное или частичное прекращение легочного кровотока в результате тромбоэмболии легочной артерии чревато двумя основными следствиями, определяющими клиническую картину заболевания и судьбу больного:
1. Выраженным нарушением вентиляционно-перфузионных отношений, что приводит к возникновению дыхательной недостаточности и артериальной гипоксемии.
2. Формированием легочной артериальной гипертензии, которая, в свою очередь, является причиной резкого падения минутного объема и системного АД, а также развитием острой правожелудочковой недостаточности (острого легочного сердца).
Дыхательная недостаточность и артериальная гипоксемия возникают прежде всего в результате прекращения кровотока в хорошо вентилируемых альвеолах, что приводит к увеличению внутрилегочного «мертвого пространства» и ухудшению газообмена. Нарушение вентиляционно-перфузионных отношений усугубляется выраженным бронхоспазмом, связанным с действием на гладкую мускулатуру мелких бронхов биологически активных веществ, выделяющихся из тромбоцитов (тромбоксан А2, серотонин и др.). Участие гуморальных механизмов объясняет нередко наблюдаемое несоответствие между тяжестью сердечно-сосудистых расстройств и объемом окклюзии легочных артерий. Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и выработка сурфактанта, что уже спустя 1–2 суток после тромбоэмболии может привести к развитию ателектазов. Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции хорошо перфузируемых альвеол еще больше нарушает газообмен в легких и приводит к усугублению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее области окклюзии открываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также усугубляет артериальную гипоксемию.
Вторым следствием окклюзии ветвей легочной артерии является легочная АГ. Она обусловлена как самой механической окклюзией сосудистого русла тромбоэмболом, так и генерализованным спазмом легочных артериол. В результате повышается легочное сосудистое сопротивление на фоне значительного уменьшения емкости артериального русла. Это приводит к значительному ограничению венозного притока крови в левые отделы сердца и развитию синдрома малого сердечного выброса: уменьшаются минутный объем, сердечный индекс, уровень АД, нарушается кровоснабжение жизненно важных органов (головного мозга, сердца, почек). В тяжелых случаях могут развиться признаки так называемого обструктивного шока, включая потерю сознания (синкопе), значительное снижение АД, уменьшение диуреза, стенокардию и т.д.
Кроме того, значительные цифры давления в легочной артерии и увеличение постнагрузки на правый желудочек может приводить к быстрому развитию острого легочного сердца. Повышается систолическое и конечно-диастолическое давление в правом желудочке, правом предсердии, желудочек и предсердие дилатируются и возникает застой крови в венозном русле большого круга кровообращения. В 1/3 случаев течение тромбоэмболии легочной артерии осложняется развитием инфаркта легкого. В связи с тем что легочная ткань обеспечивается кислородом через систему легочных, бронхиальных артерий и воздухоносные пути, наряду с эмболической окклюзией ветвей легочной артерии для развития инфаркта легкого необходимыми условиями являются снижение кровотока в бронхиальных артериях, а также нарушение бронхиальной проходимости. Поэтому наиболее часто инфаркт легкого осложняет течение ТЭЛА у больных с хронической сердечной недостаточностью, хронической обструктивной болезнью легких и митральным стенозом.
Для острой ТЭЛА характерны два нарушения гемодинамики и альвеолярной вентиляции:
1. Дыхательная недостаточность и артериальная гипоксемия, причинами которых являются:
— прекращение кровотока по вентилируемым альвеолам, что приводит к увеличению внутрилегочного «мертвого пространства»;
— бронхоспазм;
— развитие ателектазов;
— ишемия легкого и снижение вентиляции;
— артериоло-венозное шунтирование крови.
2. Легочная АГ, возникающая в результате механической окклюзии сосудистого русла и генерализованного спазма артериол. Следствием повышенного давления в легочной артерии являются:
— синдром малого сердечного выброса, сопровождающийся снижением минутного объема, АД и нарушением кровоснабжения жизненно важных органов (головного мозга, сердца, почек);
— острая правожелудочковая недостаточность с подъемом конечно-диастолического давления правого желудочка, центрального венозного давления и (в тяжелых случаях) застоем крови в венах большого круга кровообращения.
Большинство тромбоэмболов в сосудистом русле легких подвергаются лизису и организации. Лизис эмболов начинается с первых дней болезни и продолжается в течение 10–14 суток. С восстановлением капиллярного кровотока происходит увеличение продукции сурфактанта, ателектазы легочной ткани претерпевают обратное развитие. Клинико-морфологические данные позволяют сделать заключение, что мелкие эмболы быстро лизируются. В возрасте до 40 лет происходит почти полное или полное рассасывание эмболов в течение 3 месяцев, а у лиц старше 60 лет рассасывание не наступает.
Классификация ТЭЛА [14]
В зависимости от объема поражения сосудов легких ТЭЛА может быть:
— сверхмассивная — более 70 % (внезапная потеря сознания, диффузный цианоз верхней половины тела, остановка кровообращения, судороги, остановка дыхания);
— массивная — более 50 % сосудов легких (потеря сознания, шок, падение артериального давления, недостаточность функции правого желудочка);
— субмассивная — от 30 до 50 % сосудов легких (одышка, нормальное артериальное давление, функция правого желудочка нарушается в меньшей степени);
— немассивная — менее 30 % (одышка, функция правого желудочка не страдает).
По течению ТЭЛА выделяют:
— острую форму с внезапным началом с болью за грудиной, одышкой, падением АД, признаками острого легочного сердца;
— подострую форму с прогрессирующей дыхательной и правожелудочковой недостаточностью, признаками инфаркта легкого, кровохарканьем;
— рецидивирующую форму с повторными эпизодами одышки, обмороками, признаками инфаркта легкого.
Клиническая картина
Клиническая картина и течение ТЭЛА в значительной степени определяются калибром и количеством окклюзированных легочных артерий, темпами развития эмболического процесса, степенью возникающих при этом гемодинамических расстройств, а также исходным состоянием сердечно-сосудистой и дыхательной систем.
Внезапно возникающая, нередко необъяснимая одышка — наиболее характерный симптом тромбоэмболии. Она является отражением острой дыхательной недостаточности и носит инспираторный характер, ортопноэ не наблюдается. Одышка бывает различной степени выраженности: от ощущения нехватки воздуха до очень выраженной. Столь же постоянно, как и одышка, наблюдается тахикардия с частотой сердечных сокращений более 100 в минуту.
Болевой синдром встречается в нескольких вариантах. У 42–87 % больных наблюдается острая кинжальная боль за грудиной. В целом продолжительность болевого синдрома может варьировать от нескольких минут до нескольких часов. При эмболии основного ствола легочной артерии нередко возникают раздирающие загрудинные боли, которые обусловлены тем, что происходит раздражение рецепторов в стенке легочной артерии. В некоторых случаях массивной тромбоэмболии резкая боль с широкой иррадиацией напоминает болевой синдром при расслаивающей аневризме аорты. Иногда боли могут носить ангинозный характер, что связывают с резким снижением коронарного кровотока вследствие снижения ударного и минутного объемов сердца. Определенное значение имеет и повышение артериального давления в полостях правого сердца, что нарушает отток крови по тебезиевым и коронарным венам. При развитии массивных инфарктов правого легкого могут наблюдаться резкие боли в правом подреберье, связанные с острой правожелудочковой недостаточностью и острым застойным набуханием печени, сочетающиеся с парезом кишечника, симптомами раздражения брюшины. При инфаркте легкого отмечаются острые боли в грудной клетке, усиливающиеся при дыхании и кашле. При эмболии мелких ветвей легочной артерии боли могут отсутствовать или быть завуалированы другими клиническими проявлениями.
Можно выделить несколько клинических синдромов:
1. Синдром острой дыхательной недостаточности объективно проявляется одышкой. Частота дыхания превышает 30–40 в минуту, отмечается цианоз в сочетании с бледностью кожных покровов.
2. Синдром острой недостаточности кровообращения проявляется артериальной гипотонией. Шоковое состояние, сопровождающее окклюзию ствола легочной артерии, развивается у 20–58 % больных. Артериальная гипотония обусловлена резким снижением сердечного выброса, которое развивается вследствие острой перегрузки правого сердца и резкого снижения притока крови к левому сердцу.
3. Синдром острого легочного сердца возникает при массивной и субмассивной тромбоэмболии. При этом появляются набухание шейных вен, патологическая пульсация в эпигастральной области и во II межреберье слева от грудины, тахикардия, расширение правой границы сердца, акцент и раздвоение II тона над легочной артерией, повышение центрального венозного давления, болезненное набухание печени и положительный симптом Плеша (надавливание на болезненную печень вызывает набухание шейных вен, характерные электрокардиографические изменения).
4. При массивной тромбоэмболии могут наблюдаться церебральные нарушения, развивающиеся вследствие гипоксии головного мозга. Церебральный синдром может проявляться в двух вариантах: синкопальном (по типу глубокого обморока) с рвотой, непроизвольным мочеиспусканием или дефекацией, судорогами в конечностях, брадикардией и коматозном. Кроме того, может наблюдаться психомоторное возбуждение.
Характерным симптомом ТЭЛА является повышение температуры, которое возникает, как правило, с первых часов заболевания. У большинства больных отмечается субфебрильная температура, у меньшей части больных — фебрильная. Повышение температуры связано с выбросом в кровь большого количества биологически активных веществ. Общая длительность лихорадочного периода составляет от 2 дней до 2 недель.
Тромбоэмболия мелких ветвей легочной артерии в большинстве случаев протекает с менее выраженными симптомами или бессимптомно и нередко остается нераспознанной. Часто немассивная ТЭЛА протекает под маской других заболеваний и синдромов [8]: повторных «пневмоний» неясной этиологии, часть которых протекает как плевропневмония; быстропроходящих (в течение 2–3 суток) сухих плевритов; экссудативных плевритов, в том числе геморрагических; повторных «необъяснимых» обмороков, коллапсов, нередко сопровождающихся ощущением нехватки воздуха и тахикардией; внезапно возникающего чувства сдавления в груди, затруднения дыхания и последующего повышения температуры тела; «беспричинной» лихорадки, не поддающейся антибактериальной терапии; появлением и/или прогрессированием сердечной недостаточности, резистентной к лечению; появлением и/или прогрессированием симптомов подострого или хронического легочного сердца при отсутствии указаний на хронические заболевания бронхолегочного аппарата.
У пациента с подозрением на ТЭЛА необходимо обратить внимание на анамнез, возможные признаки тромбоэмболий в предыдущие годы. Собирать анамнез у такого больного следует особо тщательно, обращая внимание на, казалось бы, малозначимые эпизоды пароксизмальной одышки, кратковременных потерь сознания (или головокружений), преходящих аритмий и пр. Важно выяснить наличие заболеваний органов малого таза, оперативных вмешательств (особенно в области правого подреберья), травм, орофарингеальной инфекции, которая у молодых людей может привести к воспалению и тромбозу внутренней яремной вены.
ТЭЛА может скрываться под масками обострения ишемической болезни сердца, пневмонии, септического состояния (в 40 % случаев при тромбоэмболии наблюдается температурная реакция, хотя в большинстве случаев это субфебрильная температура) и др. Требуется дифференциальная диагностика с острым инфарктом миокарда, пневмонией, застойной сердечной недостаточностью, первичной легочной гипертензией, перикардитом, бронхиальной астмой, пневмотораксом, злокачественным новообразованием в грудной полости, переломом ребер, сепсисом и просто беспокойством.
Диагностика
У такого больного необходимо исследовать ряд биомаркеров риска тромбоэмболии, в первую очередь D-димер — один из продуктов распада фибриногена и фибрина вследствие активации эндогенного фибринолиза. В последние годы в целом ряде исследований проведена оценка значения определения D-димера плазмы крови с точки зрения диагностики тромбоза глубоких вен и ТЭЛА.
У большинства больных венозным тромбозом наблюдается спонтанный фибринолиз. Он совершенно недостаточен для предупреждения дальнейшего роста тромба, но вызывает расщепление отдельных сгустков фибрина с образованием D-димеров. Чувствительность повышения уровня D-димера в диагностике венозного тромбоза или ТЭЛА превышает 90 %. Нормальный уровень D-димера в плазме крови позволяет с точностью более 90 % предсказать отсутствие венозного тромбоза или тромбоэмболии (при отсутствии инфаркта миокарда, сепсиса или каких-либо системных заболеваний). Специфичность этого метода у больных ТЭЛА составляет только 50 %.
Уровень D-димера может определяться различными факторами. К непатологическим факторам, способствующим повышению уровня D-димера, относятся, например, курение, пожилой возраст, послеоперационные состояния и инвазивные манипуляции, такие как постановка периферического интравенозного катетера.
К патологическим факторам, определяющим концентрацию D-димера в крови, относятся: травматические повреждения, преэклампсия, злокачественные новообразования, инфекционные процессы, синдром диссеминированного внутрисосудистого свертывания, артериальные и венозные тромбоэмболии, фибрилляция предсердий, острый коронарный синдром, острые желудочно-кишечные кровотечения.
Результаты теста определения D-димера у госпитализированных пациентов зачастую оказываются ложноположительными из-за его повышения вследствие коморбидных состояний и тромбозов, не связанных с ТЭЛА. У пожилых пациентов специфичность определения уровня D-димера как диагностического теста снижается до критических значений.
Существенным ограничением к применению определения уровня D-димера в плазме крови в клинической практике является тот факт, что у пациентов с наличием в анамнезе явлений процессов тромбообразования в бассейне глубоких вен нижних конечностей содержание D-димера в плазме крови повышено относительно общей популяции, даже при отсутствии острых процессов тромбообразования, в то время как у пациентов, получавших ранее лечение по поводу тех или иных тромбозов, уровень D-димера может оставаться в пределах нормы даже при развитии массивных острых тромботических процессов по причине исходно сниженной его концентрации. Тем не менее значение определения повышенного уровня D-димера для оценки вероятности венозных тромбозов достаточно велико, особенно в сочетании с ультразвуковыми методами исследования.
Поэтому изолированное повышение уровня D-димера, согласно современным представлениям, не может служить однозначным критерием для постановки диагноза ТЭЛА. Несмотря на то что чувствительность теста определения D-димера плазмы крови по отношению к диагностике ТЭЛА высока, особенно при тромбоэмболии крупных ветвей или легочного ствола (до 90 %), его специфичность невысока, поэтому, по современным рекомендациям, определение уровня D-димера может использоваться для исключения с высокой степенью достоверности диагноза ТЭЛА (при его величине менее 500 мкг/л).
Таким образом, хотя уровень D-димера является важным диагностическим критерием для исключения возможного диагноза ТЭЛА, для подтверждения данного диагноза использования только одного теста на D-димер недостаточно для адекватной оценки клинического состояния больного, так как нормальный уровень D-димера не позволяет полностью исключить возможность наличия ТЭЛА вследствие того, что чувствительность уровня D-димера к образованию тромба малого размера недостаточно высока, поэтому в случае, если клиническая симптоматика позволяет врачу предполагать данный диагноз, лучше склониться в пользу проведения лечебных мероприятий, показанных при ТЭЛА.
Для оперативного определения тактики ведения пациента с подозрением на ТЭЛА можно использовать, например, клинический алгоритм (табл. 1), основанный на сочетании ряда клинико-анамнестических признаков, в результате оценки которого можно сделать заключение о низкой, умеренной или высокой вероятности наличия ТЭЛА у данного пациента. При проверке этого алгоритма в клинической практике была показана его достаточно высокая диагностическая точность и воспроизводимость при использовании разными врачами.
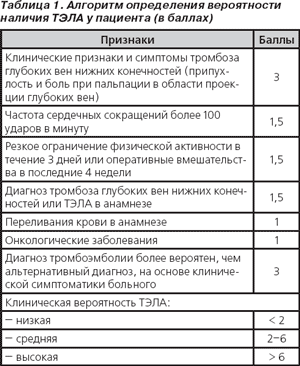
Так как для подтверждения или исключения данного диагноза в большинстве случаев необходимо будет провести несколько тестов, позволяющих с высокой долей вероятности правильно диагностировать ТЭЛА (венозную компрессионную ультрасонографию, сцинтиграфию легких и ангиопульмонографию), проведение которых зачастую невозможно по целому ряду причин (отсутствие оборудования, высокая стоимость и т.д.), применение указанного выше клинического алгоритма одновременно с определением уровня D-димера плазмы крови позволяет упростить диагностическое обследование пациента при поступлении в стационар и ускорить принятие решения относительно тактики ведения больного, особенно при проведении дифференциальной диагностики ТЭЛА и инфаркта миокарда в палатах (отделении) интенсивной терапии [7].
Одно из ведущих мест в диагностике ТЭЛА занимает вентиляционно-перфузионная сцинтиграфия легких, которая представляет собой сочетание радионуклидного исследования региональных нарушений легочной вентиляции (пневмосцинтиграфия) и перфузии (пульмоносцинтиграфия). Наибольшее значение имеет методика перфузионной пульмоносцинтиграфии с внутривенным введением микросфер альбумина, меченных 99mTc. Поскольку диаметр этих частиц не превышает 10–30 мкм, они хорошо распределяются в кровотоке и скапливаются в легочных артериолах, причем незначительная часть артериол (не более 0,1 %) эмболизируется. Изображение получают с помощью гамма-камеры в шести стандартных позициях. Метод перфузионной сцинтиграфии дает возможность изучить региональную легочную гемодинамику, что может быть использовано для диагностики ТЭЛА. Он отличается высокой чувствительностью, но недостаточно специфичен, поскольку многие патологические процессы в легких сопровождаются региональным снижением перфузии (опухоли легкого, пневмонии, обструктивные заболевания легких, пневмосклероз и т.д.). Наиболее достоверный признак ТЭЛА, выявляемый при анализе перфузионных и вентиляционных сканограмм, — это наличие выраженного локального снижения перфузии участка легкого при отсутствии здесь сколько-нибудь значительных вентиляционных расстройств и изменений на обычной рентгенограмме. Признак отличается высокой диагностической точностью, достигающей 90 %. Отсутствие изменений на перфузионной и вентиляционной сканограммах практически полностью исключает диагноз ТЭЛА [1].
Ангиография сосудов легких (селективная ангиопульмонография) является эталонным методом диагностики ТЭЛА [12]. Информативность этого метода приближается к 100 %, в том числе при эмболии мелких ветвей легочной артерии. Селективная ангиопульмонография — это рентгенологический метод исследования сосудов легких и легочного кровотока, при котором контрастное вещество (уротраст, верографин, урографин и др.) вводится с помощью катетеров непосредственно в сосудистое русло. Для введения рентгеноконтрастного вещества в ствол легочной артерии, левую, правую или концевые (терминальные) ветви легочной артерии проводят чрескожную катетеризацию бедренной вены по Сельдингеру и вводят катетер через правое предсердие и правый желудочек в легочную артерию и ее ветви. Для контрастирования бронхиальных или добавочных артерий большого круга кровообращения применяют ретроградную катетеризацию бедренной артерии. Таким образом, селективная ангиопульмонография дает возможность получить максимальную информацию об анатомическом и функциональном состоянии сосудов легких. Наиболее общими показаниями для использования этого метода являются:
1. Тромбоэмболия ветвей легочной артерии, особенно в тех случаях, когда другие методы исследования (например, радионуклидные) дают сомнительные результаты, а антикоагулянтная или тромболитическая терапия чреваты повышенным риском кровотечений.
2. Рецидивирующее кровохарканье или легочное кровотечение, генез которых не удается выяснить с помощью обычных методов клинико-инструментального исследования больного.
3. Подозрение на врожденную аномалию легкого или легочных сосудов, когда от точности установления диагноза зависит выбор наиболее рационального метода лечения, включая оперативное вмешательство.
4. Уточнение риска предстоящей операции при точно установленном диагнозе.
Ангиография противопоказана при тяжелом общем состоянии больного, выраженной сердечно-легочной недостаточности с признаками легочной гипертензии, при нарушениях ритма сердца, выраженной печеночно-почечной недостаточности, тромбофлебите или флеботромбозе нижних конечностей, непереносимости препаратов йода. Исследование выполняется в специально оборудованной операционной, оснащенной рентгенотелевизионной установкой, видеомагнитофоном и скоростной кинокамерой. После катетеризации соответствующих сосудов и селективного введения рентгеноконтрастного вещества получают серию ангиограмм, отражающих динамику заполнения контрастным веществом сосудистого русла в артериальной, капиллярной и венозной фазах кровотока. Оценивают сужение, деформацию, характер ветвлений сегментарных и субсегментарных артерий, наличие артериальной обструкции, культи артерии, отсутствие контрастирования определенных зон легкого, а также скорость артериального кровотока, характер возможного перераспределения кровотока и другие признаки (рис. 1).
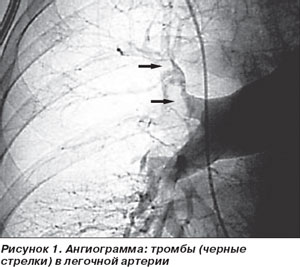
Наиболее характерными ангиографическими признаками ТЭЛА являются:
— увеличение диаметра легочной артерии;
— полное (при окклюзии главной ветви легочной артерии) или частичное (при окклюзии сегментарных артерий) отсутствие контрастирования сосудов легкого на стороне поражения;
— «размытый» или «пятнистый» характер контрастирования сосудов при множественной, но не полной обтурации долевых, а также сегментарных артерий;
— дефекты наполнения в просвете сосудов при наличии единичных пристеночных тромбов;
— деформация легочного рисунка в виде расширения и извитости сегментарных и долевых сосудов при множественном поражении мелких ветвей.
Следует помнить, что локальное отсутствие контрастирования дистальных разветвлений легочной артерии (зоны аваскуляризации) и формирование культи артерии встречается не только при ТЭЛА, но и при других патологических состояниях (рак легкого, абсцесс, крупная воздушная полость и т.п.). В этих случаях для установления правильного диагноза необходимо учитывать данные других методов исследования (рентгенологического, пульмоносцинтиграфии и т.п.) в сопоставлении с клинической картиной заболевания.
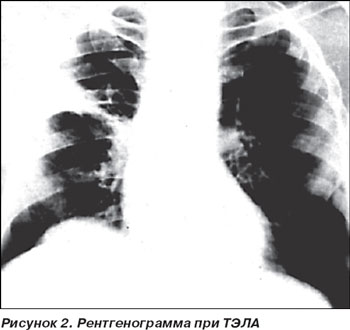
В большинстве случаев ТЭЛА сопровождается появлением на рентгенограмме малоспецифичных рентгенологических признаков (рис. 2):
— в 40 % случаев имеет место высокое и малоподвижное стояние купола диафрагмы со стороны поражения легкого вследствие уменьшения легочного объема в результате появления ателектазов и воспалительных инфильтратов;
— появление дисковидного ателектаза легкого на стороне поражения;
— симптом Вестермарка — локальное просветление легочного поля на ограниченном участке вследствие обеднения легочного рисунка;
— резкое расширение корня легкого, его обрубленность, деформация;
— расширение тени сердца вправо за счет правого предсердия, выбухание легочного конуса (вторая дуга по левому контуру сердечной тени);
— расширение тени верхней полой вены вследствие повышения давления, наполнения в правых отделах сердца (верхняя полая вена считается расширенной при увеличении расстояния между линией остистых отростков и правым контуром средостения более 3 см);
— после появления инфаркта легкого выявляется инфильтрация легочной ткани (иногда в виде треугольной тени), чаще расположенная субплеврально. Типичная картина инфаркта легкого обнаруживается не ранее второго дня и лишь у 10 % больных.
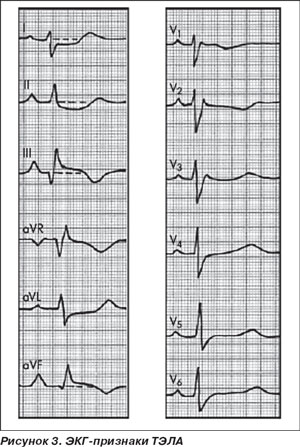
ЭКГ-признаки острого легочного сердца, получившие название синдрома McGinn — White, представлены на рис. 3. В 60–70 % случаев в острой стадии ТЭЛА (первая неделя заболевания) на ЭКГ регистрируются следующие изменения: SI, QIII, отрицательный зубец ТIII; отклонение электрической оси сердца вправо; смещение переходной зоны к V4–V6; признаки перегрузки правого предсердия — Р-pulmonale. При массивной тромбоэмболии имеет место элевация сегмента ST в правых грудных отведениях, что свидетельствует о систолической перегрузке правого желудочка. Диастолическая перегрузка правого желудочка — дилатация — проявляется блокадой правой ножки пучка Гиса. В подострой стадии (1–3 недели) зубцы T в отведениях II, III, аVF, V1-3 становятся отрицательными. В последующие 2–3 месяца происходит исчезновение отрицательного зубца Т и возвращение ЭКГ к норме. В отличие от инфаркта миокарда для ТЭЛА нехарактерны реципрокные изменения. В 20 % случаев тромбоэмболия не вызывает изменения на ЭКГ. После эффективного лечения ТЭЛА и нормализации давления в легочной артерии эти признаки быстро уменьшаются и исчезают.
При эхокардиографическом исследовании регистрируются повышение давления в легочной артерии, расширение правого желудочка, парадоксальное движение межжелудочковой перегородки, утолщение стенки правого желудочка и межжелудочковой перегородки. Кроме того, эхокардиограмма позволяет визуализировать тромбы в правых отделах сердца.
Важной задачей клинического и инструментального исследования больных ТЭЛА является установление источника тромбоэмболии. В то же время отчетливые клинические признаки тромбоза глубоких вен нижних конечностей — наиболее частой причины ТЭЛА — обнаруживают только в 30 % случаев. Следует помнить, что к числу ранних признаков флеботромбоза глубоких вен относятся:
— спонтанные боли в области стопы и голени, усиливающиеся при ходьбе;
— появление боли в икроножных мышцах при тыльном сгибании стопы (симптом Хоманса);
— локальная болезненность при пальпации по ходу вен;
— односторонний отек голени, стопы и бедра, выявляемый при осмотре в горизонтальном и вертикальном положении пациента.
Более информативным является дуплексное ультразвуковое и допплеровское исследование глубоких вен, которое в большинстве случаев позволяет выявить признаки нарушения венозного кровообращения, локализацию и протяженность тромботической окклюзии. Кроме того, используется венозноокклюзивная плетизмография. Метод основан на измерении скорости изменения объема голени после снятия внешнего давления, прерывавшего венозный отток крови. При нарушении проходимости глубоких вен уменьшение объема голени после распускания манжеты будет замедлено [9].
Осложнения
Установлено, что после первоначального повышения давление в легочной артерии начинает снижаться, при этом сначала выявляется фаза экспоненциального снижения, затем (в среднем через 38 сут. после ТЭЛА) — фаза линейного снижения или стабильная фаза. В цитируемом исследовании у большинства больных также проводилась повторная оценка функции правого желудочка, которая позволила диагностировать хроническую легочную гипертензию в 5,1 % случаев, что значительно превышает средние показатели. Если во время первой допплер-ЭхоКГ систолическое давление в легочной артерии превышало 50 мм рт.ст., отношение шансов развития стойкой легочной гипертензии и/или дисфункции правого желудочка равнялось 3,3 [4].
Лечение
Основной целью лечебных мероприятий при ТЭЛА является улучшение перфузии легких и предотвращение развития тяжелой хронической постэмболической легочной гипертензии. Общие лечебные мероприятия на догоспитальном этапе при подозрении на тромбоэмболию легочной артерии и в процессе обследования включают соблюдение строгого постельного режима с целью предупреждения рецидива ТЭЛА, катетеризацию центральной вены для проведения инфузионной терапии и контроля центрального венозного давления, ингаляцию кислорода через интраназальный катетер, а при выраженной острой дыхательной недостаточности — интубацию трахеи и проведение ИВЛ.
Восстановление проходимости легочной артерии осуществляется консервативным и хирургическим путем. Консервативное лечение предусматривает проведение тромболизиса и профилактику продолжающегося тромбоза и повторной эмболизации. Стандартом лечения при ТЭЛА является тромболитическая терапия, цель которой — максимально быстро восстановить кровоток через окклюзированные легочные артерии, уменьшить давление в легочной артерии и снизить постнагрузки на правый желудочек. Механизм действия тромболитиков единый — активация неактивного комплекса плазминогена в активный комплекс плазмин, являющийся естественным фибринолитиком. В настоящее время используются две группы тромболитических препаратов: не обладающие сродством к фибрину, создающие системный фибринолиз (стрептокиназа, урокиназа) и обладающие сродством к фибрину тромба, которые оказывают действие непосредственно на тромб за счет наличия SH-радикала, обладающего сродством к фибрину (ТАП, альтеплаза).
В последние годы для лечения больных ТЭЛА успешно используются низкомолекулярные гепарины (фраксипарин, эноксапарин, надропарин, дельтапарин и др.), которые отличаются более высокой эффективностью и вместе с тем более редким возникновением нежелательных побочных явлений, в том числе геморрагических осложнений и тромбоцитопений. Следует помнить, что низкомолекулярные гепарины относительно мало влияют на тромбин и почти не связывают II фактор коагуляции. Поэтому на фоне лечения низкомолекулярными гепаринами мало изменяется время свертывания крови, хотя и наблюдается отчетливый терапевтический эффект, в частности уменьшение адгезии и агрегации тромбоцитов. Дозируют низкомолекулярные гепарины индивидуально от 0,3 до 0,8 мг 2 раза в сутки. Считается, что при лечении низкомолекулярными гепаринами специальный лабораторный контроль не требуется, хотя целесообразно все же следить за уровнем тромбоцитов и периодически (1 раз в 3–4 дня) определять активированное частичное тромбопластиновое время, особенно если больной, помимо гепарина, принимает препараты, оказывающие влияние на свертываемость крови (например, НПВC). Продолжительность лечения больных ТЭЛА низкомолекулярными гепаринами составляет 7–10 дней [2].
Непрямые антикоагулянты. Одновременно с применением гепарина больным ТЭЛА уже на 2–3-й день заболевания назначают так называемые непрямые антикоагулянты, механизм действия которых заключается в нарушении нормального метаболизма витамина К в печени. Как известно, витамин К необходим для активации некоторых факторов свертывания крови (II, VII, IX, Х), а также протеинов С и S. Нарушение метаболизма витамина К под действием непрямых антикоагулянтов приводит к выраженному снижению участия этих факторов свертывания в процессе коагуляции. В последние годы наиболее широкое распространение в мировой клинической практике получил варфарин. У больных ТЭЛА прием варфарина или других непрямых антикоагулянтов (синкумар, фенилин, пелентан и др.) в течение 5–8 суток сочетают с применением гепарина. Адекватность дозы контролируется с помощью определения протромбинового времени, величина которого должна превышать исходный уровень в 1,5–2,0 раза. При этом МНО (международное нормализованное отношение) должно быть на уровне 2,0–2,5. Общая продолжительность лечения непрямыми антикоагулянтами должна составлять не менее 3 месяцев. В некоторых случаях, например у больных с отчетливо выраженным гиперкоагуляционным синдромом, непрямые антикоагулянты принимают в течение года и более [1].
Тромбоэмболия ствола легочной артерии является абсолютным показанием для проведения хирургического лечения — эмболэктомии. Оптимальным методом хирургического лечения является эмболэктомия в условиях искусственного кровообращения. Альтернативой хирургическому вмешательству в некоторых случаях может быть бужирование тромбоэмбола в легочной артерии с помощью катетера Фогарти. После проведения ангиопульмонографии, установления локализации и размера тромбоэмбола под контролем рентгеноскопии вводится зонд и производится механическое разрушение тромба с последующим введением тромболитиков.
Профилактика
Профилактика тромбоэмболии легочной артерии заключается в своевременном расширении постельного режима в послеоперационном периоде, диагностике и лечении тромбофлебита вен нижних конечностей. Больным с сердечной недостаточностью, тучным, со злокачественными новообразованиями, оперированным на органах малого таза и забрюшинного пространства, после протезирования тазобедренных суставов, находящимся на иммобилизации в целях профилактики флеботромбозов нижних конечностей и тромбоэмболии проводят профилактическое введение низкомолекулярных гепаринов. Также эффективно использование антиагрегантов — ацетилсалициловой кислоты в малых дозах (150 мг в сутки). В последние годы для профилактики повторных тромбозов и тромбоэмболий все чаще используют длительное применение современных антитромбоцитарных препаратов (тиклопидина и клопидогреля). Оба препарата относятся к производным тиенопиридина и эффективно блокируют АДФ-рецепторы тромбоцитов, что способствует уменьшению их агрегации [5].
При рецидивирующей тромбоэмболии легочной артерии рекомендована постановка фильтра в нижнюю полую вену. Кава-фильтры (рис. 4) подразделяются на временные (устанавливаются на период родов, операции, курса тромболитиков) и постоянные (устанавливаются при венозном тромбозе с опасностью отрыва тромбов).

Оторвавшийся тромб в этом случае не попадает в сердце, а задерживается фильтром. Зачастую процедура установки кава-фильтра является единственным способом сохранить жизнь пациентам с тромбозом глубоких вен нижних конечностей.
Показания для установки кава-фильтров [10, 14]:
— тромбоз глубоких вен нижних конечностей с наличием неокклюзивных флотирующих тромбов — устанавливается постоянный кава-фильтр;
— венозный тромбоз нижних конечностей с наличием эпизодов тромбоэмболии легочной артерии — устанавливается постоянный кава-фильтр;
— венозный тромбоз нижних конечностей у беременных и рожениц — устанавливается временный либо постоянный кава-фильтр;
— проведение операций на венах, лапароскопических вмешательств при тромбозе вен таза: на момент операции и ближайший послеоперационный период — устанавливается временный кава-фильтр.
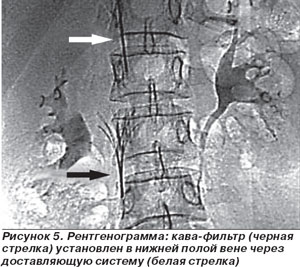
Установка кава-фильтра производится через катетер диаметром 2–3 мм, введенный через бедренную вену (укол производится в паховой складке), подключичную вену (укол производится под ключицей) или яремную вену (укол производится на шее). Это практически безболезненная процедура, не оказывающая влияния на качество жизни и не требующая последующего применения каких-либо препаратов (рис. 5). После установки фильтра могут возникнуть боли в пояснице, напоминающие радикулит, которые лечатся аналогично радикулиту и, как правило, бесследно проходят в течение недели. Приступ болей в пояснице у больных с установленным кава-фильтром может являться признаком отрыва тромба и задержания его фильтром. В этом случае необходимо провести допплеровское исследование нижней полой вены и/или контрастное исследование вен [6].
Подготовили Т.И. Мальчевская,
С.О. Сквозникова,
кафедра пропедевтики внутренних болезней № 2,
Национальный медицинский
университет имени А.А. Богомольца
1. Александер Дж.К. Тромбоэмболия легочной артерии. Руководство по медицине. Диагностика и терапия: В 2 т. / Под ред. Р. Беркоу, Э. Флетчера: Пер. с англ. — М.: Мир, 1997. — Т. 1. — 460-5.
2. Верткин А.Л., Тополянский А.В. // Лечащий врач. — 2003. — 8.
3. Макаров О.В., Озолиня Л.А. Венозные тромбозы в акушерстве и гинекологии. — М., 1998.
4. Матюшенко А.А. Хроническая постэмболическая легочная гипертензия. 50 лекций по хирургии. — М.: Медиа Медика, 2003. — 99-105.
5. Панченко Е.П. Венозные тромбозы в терапевтической клинике. Факторы риска и возможности профилактики // Сердце. — 2002. — 1 (4). — 177–9.
6. Российский Консенсус «Профилактика послеоперационных венозных тромбоэмболических осложнений». — М., 2000.
7. Фурман Н.В., Киселев А.Р., Довгалевский П.Я. // Российский кардиологический журнал. — 2006. — 4.
8. Яковлев В.Б. Тромбоэмболия легочной артерии в многопрофильном клиническом стационаре (распространенность, диагностика, лечение, организация специализированной медицинской помощи): Дис... докт. мед. наук. — М., 1995. — 47 с.
9. Янссен М.К.Х., Уоллешейм Х., Новакова Х. и др. (Janssen M.C.H., Wollershein H., Novakova I.R.O. et al.). Диагностика тромбоза глубоких вен: общий обзор // Рус. мед. журн. — 1996. — 4 (1). — 11-23
10. Buller H.R., Agnelli G., Hull R.D. et al. Antithrombotic therapy for venous thromboembolic disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy // Chest. — 2004. — 126 (3 Suppl.). — 401S-28S.
11. Dahlback B. Inherited Thrombоphilia: Resistance to Activated Protein C as a Pathogenic Factor of Venous Thromboembolism (Review) // Blood. — 1995. — 85. — 607.
12. Greenspan R.H. Pulmonary angiography and the diagnosis of pulmonary embolism // Progress in cardiovascular diseases. — 1994. — XXXVII (2). — 93-106.
13. Stevanovic G., Tucakovic G., Dotlic R., Kanjuh V. Correlation of clinical diagnoses with autopsy findings: a retrospective study of 2145 consecutive autopsies // Hum. Pathol. — 1986. — 17. — 1225-30.
14. Task Force Report. Guidelines on diagnosis and management of acute pulmonary embolism // Europ. Heart J. — 2000. — 21. — 1301-36.
