Газета «Новости медицины и фармации» Неврология (438) 2013 (тематический номер)
Вернуться к номеру
Возможности Глиатилина в лечении больных с неврологическим дефицитом различного генеза
Рубрики: Неврология, Эндокринология
Разделы: Медицинские форумы
Версия для печати
1–2 ноября 2012 года в г. Киеве состоялся научно-образовательный форум «Академия инсульта». Научная программа форума включала обсуждение утвержденных МЗ Украины унифицированных клинических протоколов по оказанию медицинской помощи пациентам с ишемическим инсультом, рассматривались вопросы тромболизиса, поражения сосудов головного мозга при сахарном диабете. Особое внимание в этом году было уделено вопросам нейрореабилитации.
С докладом о возможностях применения Глиатилина у больных с ишемическим повреждением головного мозга выступила кандидат медицинских наук, ассистент кафедры неврологии № 1 М.А. Трещинская.
Критическое состояние при повреждении головного мозга — это особое состояние больного, развитие которого обусловлено первичным или вторичным поражением структур мозга, ответственных за регуляцию системных и гуморальных механизмов жизнеобеспечения, что требует неотложного применения средств и методов интенсивной терапии или реанимации для контроля и управления временно нарушенными системными функциями и гомеостазом до полного или частичного восстановления их центральной регуляции (А.З. Маневич, 1977).
Первичное повреждение — это результат непосредственного воздействия на мозг повреждающих факторов:
— механическая энергия при травме;
— внутричерепное кровоизлияние при геморрагическом инсульте;
— очаговая ишемия мозга при ишемическом инсульте;
— тотальная ишемия при циркуляторной недостаточности, гипоксии различного генеза, в том числе при шоке, и т.д.
Таких факторов может быть несколько или они могут сочетаться, взаимно усугубляя свое первично повреждающее воздействие на мозг.
Вторичное повреждение головного мозга:
— повреждающее воздействие на мозг на фоне уже состоявшегося первичного повреждения мозга;
— в отличие от факторов первичного повреждения мозга факторы вторичного повреждения, как правило, сочетаются, взаимоотягощают свое повреждающее воздействие на мозг и могут присоединяться неоднократно на протяжении всего острого периода заболевания.
Выделяют внутричерепные и внечерепные факторы вторичного повреждения головного мозга.
Внутричерепные факторы вторичного повреждения мозга:
— вторичные внутричерепные кровоизлияния и ишемия мозга;
— синдром внутричерепной гипертензии;
— дислокационный синдром;
— церебральный вазоспазм;
— внутричерепная инфекция.
Внечерепные факторы вторичного повреждения мозга:
— нарушения газообмена, системной гемодинамики, температурной регуляции, углеводного обмена, кислотно-основного равновесия, водно-электролитного гомеостаза;
— эндогенная интоксикация и т.д.
Сознание — это биологический феномен, который обеспечивается корой больших полушарий. По определению М. Мументалер (2007), сознание — это «способность субъекта к восприятию самого себя и окружающей действительности».
Компоненты сознания:
— количество сознания — уровень бодрствования;
— качество сознания — способность к познавательной деятельности.
Основной субстрат бодрствования — ретикулярная формация (РФ), оказывающая генерализованное неспецифическое активирующее влияние на кору больших полушарий. Количественное нарушение сознания возникает в результате повреждающего фактора, что приводит к формированию патологической детерминанты и, как следствие, генерации избыточной афферентной импульсации. В ответ включается защитное торможение восходящей РФ, приводящее к недостаточному возбуждению коры головного мозга.
Кома — это двустороннее структурное повреждение или дисфункция покрышки моста, околоводопроводной зоны среднего мозга, таламуса, белого вещества или коры обоих полушарий. В основе развития комы лежит нарушение перфузионно-метаболического сопряжения и формирование острой церебральной недостаточности.
Значения нарушения сознания:
— саногенетическое — диффузное снижение активности структур с самым высоким уровнем метаболизма (РФ и кора), повышает их выживаемость в острейший период и «экономит» энергию в очаге действия патологической детерминанты;
— патологическое — размер и локализация очага повреждения мозга пропорциональны степени снижения уровня бодрствования и угнетения психических функций больного при достижении уровня его полного исчезновения.
Холинергическая система, тесно взаимодействуя с дофаминергической, глутаматергической, ГАМКергической (как по синергическим, так и по антагонистическим принципам), обеспечивает: уровень сознания, спонтанную двигательную активность, эмоциональное поведение, память, волевые акты. Значение холинергической системы в развитии нарушения сознания состоит в снижении выработки ацетилхолина и блокаде синтеза фосфатидилхолина, что может вызвать гибель клетки (потеря 10 % клеточной мембраны опасна для жизнеспособности клеток).
Ведение пациентов с нарушением сознания включает оценку степени нарушения сознания, обеспечение адекватного функционирования систем дыхания и кровообращения, контроль внутричерепного давления. Лечебные манипуляции направлены на достижение эуволемии, нормотензии (адекватное артериальное давление — АД), нормотермии, нормогликемии. Кроме того, обязательно проводится нутритивная поддержка, профилактика тромбоэмболий.
Физиологические основы фармакотерапии выхода из комы:
— острейший период — медиаторная буря (использование нейротропных препаратов не показано);
— «пауза» — медиаторное истощение (стволовой уровень). Ослабление всех медиаторных систем, в первую очередь холинергических.
Основные направления лечения острого инсульта (рекомендации ЕUSI):
1. Коррекция и поддержание параметров общего состояния, которые нуждаются в стабилизации.
2. Специфическая терапия: улучшение перфузии ткани мозга в зоне ишемической полутени (воздействие на 1-й этап каскада) и нейропротекторная терапия (воздействие на 2–8-й этапы каскада).
3. Профилактика и лечение осложнений, которые могут быть либо неврологическими (вторичная геморрагия, злокачественный отек или эпиприступы), либо терапевтическими (аспирация, инфекции, пролежни, тромбоз глубоких вен или эмболия легочной артерии).
4. Ранняя вторичная профилактика, целью которой является уменьшение частоты повторного инсульта.
5. Ранняя реабилитация.
Роль нейропротекции:
— увеличение доли транзиторных ишемических атак и малых инсультов среди острых нарушений мозгового кровообращения;
— уменьшение размеров инфаркта мозга;
— увеличение периода терапевтического окна, при расширении возможностей для тромболитической терапии;
— защита от реперфузионного повреждения.
Целью нейропротекции является улучшение исхода заболевания. Нейропротекция может быть начата относительно поздно — через 6–12 часов, но как минимум в течение первых 7 суток.
В настоящее время для восстановления сознания используется новый препарат Глиатилин (Italfarmaco). Пробуждающий эффект Глиатилина заключается в восстановлении физиологического уровня ацетилхолина, стимуляции нервно-мышечной проводимости, улучшении передачи импульсов на уровне синаптической щели, восстановлении функциональной активности нейронов. Данный эффект дозозависимый. Высвобождение эндогенного ацетилхолина из терминалей происходит уже в первые минуты в ответ на болюсное введение препарата. Эффективность Глиатилина в восстановлении сознания у пациентов с ишемическим инсультом значительно превосходит схемы без его применения.
Эффект Глиатилина на динамику регресса неврологических синдромов у пациентов с депрессией сознания различного генеза выражается в виде уменьшения дезориентированности, восстановлении плавности и беглости речи, восстановлении чтения, письма и высших корковых функций.
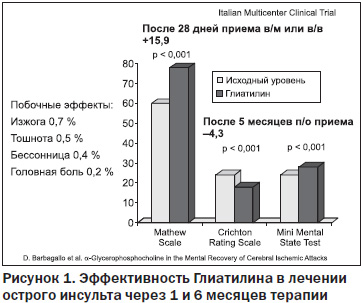
В итальянском многоцентровом исследовании, включающем 2058 пациентов с острым нарушением мозгового кровообращения (инсульт или транзиторная ишемическая атака), доказана эффективность Глиатилина по схеме 1000 мг в/м или в/в в течение 28 дней, затем 400 мг внутрь 3 раза в сутки.
Кроме пробуждающего эффекта Глиатилин уменьшает объем возможного дефекта мозговой ткани (при введении препарата в/м в дозе 1000 мг/сутки).
Таким образом, показаниями к применению Глиатилина являются: инсульт, сосудистая нейродегенеративная деменция, черепно-мозговая травма, снижение сознания вне зависимости от этиологии.
С докладом на тему «Лечение умеренных когнитивных нарушений у больных с дисциркуляторной энцефалопатией с метаболическим синдромом» выступила О.О. Копчак (Центральный госпиталь МВД Украины), которая отметила, что в мире насчитывается 24,3 миллиона людей с деменцией. По данным Всемирной организации здравоохранения, до 2020 года количество пациентов с деменцией увеличится вдвое, а до 2050 года — почти втрое и превысит 115 миллионов.
Согласно данным J. Touchon, R. Petersen (2004), к модифицированным диагностическим критериям синдрома умеренных когнитивных нарушений относятся:
— когнитивные нарушения, выявленные со слов пациента или его ближайшего окружения;
— признаки ухудшения когнитивных способностей в сравнении с индивидуальной нормой для данного индивидуума, которые произошли в последнее время;
— объективные свидетельства, которые получены при помощи нейропсихологических тестов;
— отсутствие нарушения обычных для пациента форм повседневной активности, но могут быть трудности в сложных видах деятельности;
— деменция отсутствует, если результат по ММSE (Mini Mental State Examination) составляет менее 24 баллов.
Сочетание цереброваскулярных факторов и нарушения таких когнитивных функций, как память, интеллект, праксис, гнозис, речь или внимание, представляет собой сосудистые когнитивные нарушения (СКН).
Метаболический синдром диагностируют при наличии у пациента трех или более критериев:
1) артериальная гипертензия (АГ) (АД более чем 130/85 мм рт.ст. или прием гипотензивных препаратов);
2) ожирение (окружность талии больше 94 см у мужчин и больше 80 см у женщин);
3) дислипидемия (повышение уровня триглицеридов сыворотки крови ≥ 1,7 ммоль/л или нормальный уровень триглицеридов при соответствующей терапии, снижение уровня липопротеидов высокой плотности (ЛПВП) < 1 ммоль/л у мужчин и < 1,3 ммоль/л у женщин или нормальный уровень ЛПВП при соответствующей терапии);
4) повышение уровня глюкозы плазмы крови натощак ≥ 5,6 ммоль/л или гипогликемическая терапия.
Основными задачами эффективной терапии преходящих СКН являются:
— замедление нарастания когнитивных нарушений;
— уменьшение степени тяжести имеющихся когнитивных нарушений;
— вторичная профилактика когнитивных нарушений.
В соответствии с выделенными задачами в лечении СКН выделяют следующие направления:
— влияние на основной патологический процесс: лечение цереброваскулярных заболеваний;
— выявление и коррекция сосудистых факторов риска: АГ, гипер- и дислипидемии, ожирения, гипергомоцистеинемии, предупреждение ишемических эпизодов путем применения антиагрегантов или антикоагулянтов;
— лечение сопутствующей соматической патологии (кардиоваскулярные заболевания, сердечная недостаточность), депрессии;
— применение препаратов для улучшения когнитивных функций.
Одним из механизмов развития когнитивных нарушений является развитие холинергической недостаточности, в основе которой лежат недостаточность продукции ацетилхолина, нарушение баланса холинергических энзимов, утрата холинергических нейронов. Для коррекции этих нарушений показано применение препаратов, действие которых направлено на преодоление холинергической недостаточности:
— препараты, которые непосредственно пополняют дефицит ацетилхолина (Глиатилин);
— ингибиторы ацетилхолинэстеразы (донепезил, ривастигмин, галантамин).
Действующее вещество препарата Глиатилин — это холина альфосцерат, который является предшественником ацетилхолина и фосфатидилхолина. При попадании в организм он расщепляется под действием ферментов на холин и глицерофосфат. Холин принимает участие в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения, который играет ключевую роль в формировании интегративных когнитивных функций. Глицерофосфат — это предшественник фосфатидилхолина мембран нейронов, который оказывает нейропротекторное и мембраностабилизирующее действие. Таким образом, Глиатилин позитивно влияет на функциональное состояние микроструктур клеток, нормализует передачу нервных импульсов, потенцирует анаболические процессы в нейронах.
В опубликованном анализе 13 рандомизированных клинических исследований при участии 4054 пациентов доказана эффективность Глиатилина в лечении дегенеративной и сосудистой деменции, острой цереброваскулярной патологии (транзиторная ишемическая атака, инсульт). На фоне терапии Глиатилином отмечено достоверно лучшее (по сравнению со стандартной терапией и плацебо) восстановление когнитивных функций (памяти, внимания), эмоционального фона. Также наблюдали положительную реакцию со стороны поведенческих расстройств у больных и уменьшение функционального ограничения повседневной деятельности. Согласно данным метаанализа, эффективность Глиатилина в лечении легкой и умеренной сосудистой и дегенеративной деменции (болезнь Альцгеймера) была аналогичной в сравнении с ингибиторами холинэстеразы. При этом авторы не наблюдали побочных эффектов, характерных для ингибиторов холинэстеразы (синкопе, нарушения сердечного ритма).
Нами было проведено собственное исследование с участием 80 больных среднего и преклонного возраста (62,3 ± 4,7 года) с хронической недостаточностью мозгового кровообращения и метаболическим синдромом. Клинический диагноз во всех случаях формулировался как дисциркуляторная энцефалопатия атеросклеротической, гипертонической, дисметаболической (смешанной) этиологии. В зависимости от назначенной терапии все пациенты были разделены на 2 группы: основную (n = 40) и контрольную (n = 40), которые были равнозначны по возрасту, полу, уровню образования, степени когнитивных нарушений и неврологического дефицита. Когнитивный статус у всех больных соответствовал СКН по данным MMSE: основная группа — 25,1 ± 0,76, контрольная группа — 24,7 ± 0,73 балла.
Пациенты основной группы получали Глиатилин по 4 мл внутривенно струйно на протяжении 9 дней, с последующим переходом на пероральный прием по 400 мг 2 раза в сутки в течение 1 месяца. Кроме того, пациенты как основной, так и контрольной группы получали базисную терапию, включающую гипотензивные и сахароснижающие препараты, статины, антиагреганты, вазоактивные средства, витамины группы В. Курс лечения больных составлял 6 недель.
Методы обследования больных включали: клинико-неврологическое обследование, лабораторные тесты (общий анализ крови, общий анализ мочи, биохимический анализ крови, липидограмма, гормоны щитовидной железы); инструментальные (ЭКГ, ЭЭГ, КТ и/или МРТ головного мозга); для оценки степени когнитивных нарушений использовали краткую шкалу оценки психического статуса MMSE; экспериментально-психологическое тестирование (методика заучивания слов, таблицы Шульте, тест заучивания парных взаимосвязанных слов, тест цвето-словесного взаимодействия).
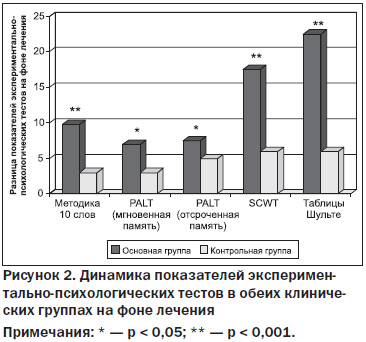
При проведении анализа полученных результатов было установлено, что лечение с использованием Глиатилина на фоне базисной терапии позитивно влияло на общее состояние пациентов. В основной группе отмечено значительное улучшение показателей экспериментально-психологических тестов по сравнению с контрольной группой (p < 0,05; p < 0,001): уменьшилась выраженность когнитивного дефицита по данным MMSE, улучшились процессы запоминания, скорость обработки и воспроизведения информации, немедленная и отсроченная распознавательная память, уровень умственной работоспособности и внимания, темп сенсомоторных реакций. Отмечена хорошая переносимость Глиатилина. Побочных эффектов не выявлено.
Подготовила Татьяна Тлустова