Газета «Новости медицины и фармации» 10 (461) 2013
Вернуться к номеру
Актуальные вопросы эндокринной патологии: по материалам 57-й Украинской школы эндокринологии
Рубрики: Семейная медицина/Терапия, Эндокринология
Разделы: Медицинские форумы
Версия для печати
6–7 июня в Харькове в 57-й раз прошла ежегодная научно-практическая конференция «Украинская школа эндокринологии», традиционно организуемая Институтом проблем эндокринной патологии им. В.Я. Данилевского Национальной академии медицинских наук Украины (ИПЭП им. В.Я. Данилевского). Нынешняя школа собрала более 200 практических врачей-эндокринологов из 95 городов различных регионов Украины. Среди лекторов — видные профессора, лидеры мнения, специалисты в области эндокринной патологии из Харькова, Киева, Самары и Краснодара. В рамках конференции состоялись тематическая выставка фармацевтических компаний и научные симпозиумы при поддержке компаний Eli Lilly и «Берлин Хеми АГ».
 Сердце, сосуды и сахарный диабет
Сердце, сосуды и сахарный диабет
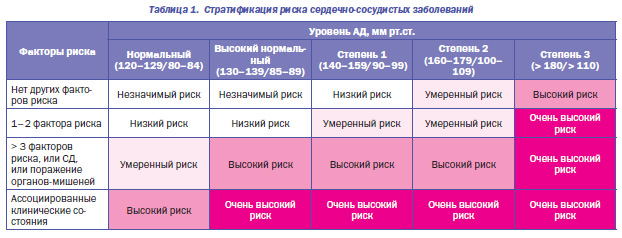
Целый блок лекций нынешней школы эндокринологии был посвящен проблеме патогенеза и фармакотерапии кардиоваскулярных осложнений сахарного диабета (СД), которая является стратегическим направлением терапии СД. В частности, Нонна Кравчун, проф., д.м.н., зам. директора по научной работе, руководитель отдела фармакотерапии эндокринных заболеваний ИПЭП им. В.Я. Данилевского, изложила современный взгляд на лечение кардиоваскулярных осложнений СД 2го типа. Она отметила, что одно из стратегических направлений фармакотерапии СД — это предупреждение кардиоваскулярных осложнений. Большинство состояний, сопровождающих СД 2го типа (гипертензия, дислипидемия), являются факторами риска сердечнососудистых заболеваний (ССЗ). СД — независимый фактор риска ССЗ. Одной из распространенных проблем является сочетание артериальной гипертензии (АГ) и СД. Так, например, согласно эпидемиологическим данным около 1/3 лиц с АГ имеют СД и 80 % больных СД страдают АГ. При этом у пациентов с СД частота АГ в 2 раза превышает общепопуляционную: 10–30 % — у больных СД 1го типа; 60–80 % — при СД 2го типа. Сочетание АГ и СД в 2–7 раз повышает риск и ускоряет развитие ишемической болезни сердца, инфаркта миокарда (ИМ), острых нарушений мозгового кровообращения, нефропатии, ретинопатии, в 3 раза увеличивает риск сердечнососудистой смертности по сравнению с больными с АГ без СД. Проф. Н.А. Кравчун также представила стратификацию риска сердечнососудистых заболеваний (табл. 1).
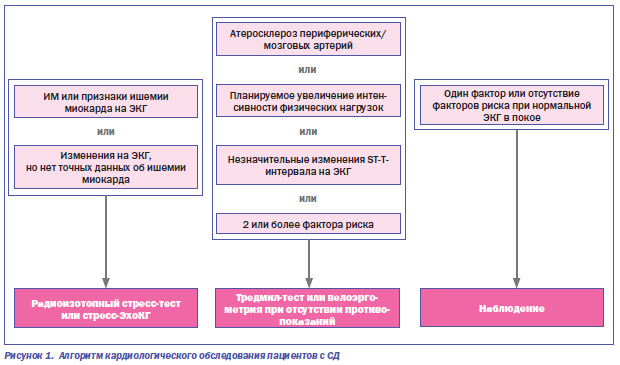
Представляя алгоритм кардиологического обследования пациента с СД при ведении сочетанной патологии (рис. 1), проф. Н.А. Кравчун заметила, что эндокринологам нужно обязательно советоваться с другими специалистами, в данном случае с кардиологами.
Говоря об антигипертензивной терапии, проф. Н.А. Кравчун подчеркнула, что гипотензивные препараты, применяемые у данной категории пациентов, должны обладать следующими важными свойствами:
- высокой антигипертензивной активностью при минимальном количестве побочных эффектов;
- не нарушать углеводный и липидный обмен;
- органопротекторными свойствами (кардио и нефропротекция).
Таким требованиям удовлетворяют гипотензивные лекарственные средства из группы препаратов центрального действия. Однако эта группа неоднородна, и препараты первого поколения (клонидин, метилдопа и др.) не рекомендуется применять при СД в связи с высокой частотой развития нежелательных явлений и отсутствием данных по влиянию на осложнения и смертность. Препараты центрального действия из группы агонистов I1имидазолиновых рецепторов1 (моксонидин, рилменидин) не оказывают побочного действия, характерного для препаратов первого поколения, и обладают благоприятным метаболическим профилем: снижают инсулинорезистентность, гипергликемию, нейтральны по отношению к липидному обмену, т.е. обладают положительным метаболическим действием. Возбуждение I1имидазолиновых рецепторов в вентролатеральном отделе продолговатого мозга приводит к подавлению активности симпатических преганглионарных нейронов промежуточной зоны спинного мозга, что сопровождается угнетением активности симпатической нервной системы с уменьшением высвобождения катехоламинов из окончаний симпатических нейронов, уменьшением симпатической импульсации к сосудам и сердцу. Проявляется это снижением тонуса резистивных сосудов, снижением артериального давления (АД) и общего периферического сопротивления сосудов, умеренным уменьшением частоты сердечных сокращений, уменьшением выделения адреналина из мозгового вещества надпочечников, улучшением электрической стабильности миокарда, уменьшением агрегации тромбоцитов. Отчасти антигипертензивное действие моксонидина и рилменидина связано также со стимуляцией a2адренергических рецепторов на мембранах нейронов в ядрах солитарного тракта.
Монотерапия агонистами I1имидазолиновых рецепторов эффективна у 40–50 % больных, в связи с чем эти препараты рекомендуется применять в составе комбинированной терапии с другими антигипертензивными средствами. Органопротекторные свойства препаратов нуждаются в дополнительном изучении в рандомизированных клинических исследованиях. Поэтому Н.А. Кравчун представила результаты собственных исследований эффективности препарата моксонидин в дозе 0,4 мг/сут, выполненных в клинике ИПЭП им. В.Я. Данилевского у 96 пациентов (47 мужчин и 49 женщин) в возрасте от 38 до 56 лет с мягкой и умеренной АГ II ст. (по классификации ВОЗ, 1999). В результате исследования было установлено не только снижение АД (у 63 % больных, причем при дозе 0,4 мг — у 58 %), но и улучшение состояния углеводного обмена после 12 недель приема моксонидина: зафиксировано снижение уровня глюкозы крови на 14,7 % (Р < 0,05), индекса инсулинорезистентности — на 19,4 % (Р < 0,05); наблюдалась нормализация состояния липидного обмена (достоверное повышение уровня холестерина липопротеидов высокой плотности) у обследованных пациентов.

Продолжая блок лекций, посвященных фармакотерапии кардиоваскулярных осложнений СД, Любовь Соколова, к.м.н., доцент кафедры диабетологии НМАПО им. П.Л. Шупика (Киев), представила сахароснижающую и антигипертензивную стратегию в комплексном подходе к нефропротекции. Она напомнила, что риск смертности от почечных осложнений, прежде всего от осложнений диабетической нефропатии, вызванной СД, превышает риск смерти от других причин, а СД — основная причина терминальной стадии хронической почечной недостаточности (ХПН). Такие неутешительные результаты были представлены мировой общественности в известном исследовании UKPDS. Поэтому поражения почек и сердечнососудистые события и были объединены в единый сердечнососудистый континуум.
Диабет и диабетическая нефропатия: факты
- 20 % пациентов с диабетом умирают от почечных осложнений;
- 50 % пациентов, которые получают диализ, имеют диабет;
- снижение скорости клубочковой фильтрации: 3–4 мл/мин независимо от терапии.
Доцент Соколова отметила, что так как АГ, протеинурия, гликемия (в том числе уровень HbA1c), уровень липидов в плазме крови относятся к одним из главных модифицируемых факторов прогрессирования диабетической нефропатии, то на них и должна быть сосредоточена основная стратегия борьбы, чтобы не допустить быстрого прогрессирования терминальной стадии ХПН. Она также акцентировала внимание коллег на том, что только в одном исследовании ADVANCE было показано, что интенсивный гликемический контроль, основой которого было применение диабетона MR 60 мг, приводил к контролю гликемии и снижению на 10 % риска макро и микрососудистых осложнений, а также риска почечных осложнений (–65 %) и тяжелых гипогликемий (в 7 раз) у пациентов с СД 2го типа. Но, к сожалению, как заметила доцент Соколова, в Украине иные реалии, так как до 71 % пациентов с СД находятся на стадии макроальбуминурии, и поэтому им нужна не столько профилактика поражений почек, сколько восстановление функций последних. Поэтому антигипертензивную терапию пациентов с СД лучше всего начинать с комбинированных препаратов, обеспечивающих 24часовой контроль АД. Таким препаратом согласно приказу МЗУ № 384 от 24.05.2012 г. (глава 15) является фиксированная комбинация 10 мг периндоприла и 2,5 мг индапамида. Эта рекомендация опирается на данные, полученные в исследовании ADVANCE, согласно которым назначение комбинации периндоприл/индапамид у пациентов с СД 2го типа привело к снижению общей смертности на 14 %, сердечнососудистой — на 18 %, основных сосудистых событий — на 9 %, коронарных — на 14 %, почечных событий — на 21 %.

Взгляд на проблемы медикаментозной терапии другого грозного осложнения СД 1го типа — диабетической ретинопатии (ДР) — представил Михаил Кирилюк, д.м.н., профессор, зав. отделом клинической эндокринологии Украинского НПЦ эндокринной хирургии МЗ Украины (Киев). «Уметь диагностировать ДР должен не только семейный врач, но и каждый эндокринолог», — заявил проф. Кирилюк. При СД 1го типа признаки ретинопатии появляются через 5 лет после начала заболевания у 20 % больных, через 10 лет частота ретинопатии составляет 60 %, через 30 лет отмечается практически у всех пациентов, а при СД 2го типа ретинопатия может быть диагностирована уже при первоначальном выявлении СД у 20–30 % обследованных, через 30 лет — у 90 % пациентов. Каждому пациенту при постановке диагноза ДР необходимо сделать фотоснимок глазного дна для наблюдения за процессом в динамике, что является стандартом в странах ЕС.
Nota Bene!
Даже при 100% зрении у пациентов с ДР на фоне СД есть вероятность тяжелого поражения сетчатки, так как очаги поражения могут располагаться на периферии от макулы, отметил проф. Кирилюк.
Лечение ДР должно быть интенсивным, включать эффективный контроль основного заболевания СД, снижение системного АД (снятие так называемого «давления сдвига», гиперперфузии), блок внутриретинальной РАС (ангиотензин II, локально продуцируемый эндотелиальными клетками сосудов сетчатки, является медиатором ангиогенеза, повышает проницаемость сосудов, ассоциирован с пролиферативной ДР и отеком макулы, обладает прооксидантной и протромбогенной активностью, EUCLID, 1999, DIRECT1, 2007), блок неоангиогенеза (интравитреального введения триамцинолона ацетата и так называемых ингибиторов VEGF (пегаптаниб, ранибизумаб, бевацизумаб). Этот фактор стимулирует деградацию внеклеточного матрикса, миграцию клеток и образование сосудистых структур, регулирует проницаемость сосудов, участвует в процессах свертывания крови. Так как сильнейшими стимулами ангиогенеза являются гипоксия и ишемия, то считается, что VEGF является пусковым фактором развития пролиферативной ДР.

Большой интерес участников конференции вызвал доклад Виктории Полторак, проф., д.м.н., зав. отделом патофизиологии ИПЭП им. В.Я. Данилевского, посвященный проблеме коррекции оксидативного стресса (ОС) на фоне СД. Она назвала ОС основным фактором развития микро и макрососудистых нарушений СД. Кроме того, атеросклероз можно назвать хроническим воспалением сосудов низкой интенсивности. «Эффективная терапия СД 2го типа требует множества лекарств, используемых в комбинации для коррекции множественных патофизиологических дефектов. Лечение следовало бы основывать на известных патогенетических нарушениях, а не на простом уменьшении HbA1C. Терапия должна начинаться на ранних этапах естественного течения СД 2го типа для предупреждения прогрессирующей недостаточности bклеток», — заявила профессор Полторак.
ОС — тяжелый дисбаланс между образованием реактивных видов (активных форм азота, кислорода) и антиоксидантной защитой, ведущий к потенциальному повреждению тканей. Гипергликемия и гиперлипидемия (как компонент инсулинорезистентности), находясь в основе процессов, приводящих к повреждению тканей, в первую очередь эндотелия сосудов, инициируют развитие ОС посредством ряда механизмов, главным образом митохондриальной дисфункции — гиперпродукции митохондриями активных форм кислорода в условиях избыточного поступления субстрата. Такими субстратами являются свободные жирные кислоты (СЖК). Циркулирующие уровни СЖК — независимые предикторы общей смертности и кардиоваскулярной смертности у лиц с ангиографически подтвержденной ишемической болезнью сердца. Следствие оксидативного стресса — ускорение перекисного окисления липидов (ПОЛ). Клиническое исследование KUNGSHOLMEN (Стокгольм)2 показало, что инсулинорезистентность у пациентов с СД нормализуется при нормализации ПОЛ. Выбор специфических антидиабетических препаратов определяется их глюкозопонижающей эффективностью, экстрагликемическими эффектами3, которые могут уменьшить долгосрочные осложнения, безопасным профилем, переносимостью, легкостью использования и ценой. Препаратом с доказанным влиянием на ОС и многогранными свойствами, которые продолжают интенсивно изучаться, является aлипоевая кислота (aЛК). Так, например, проф. Полторак привела данные, что у тучных пациентов со сниженной толерантностью к глюкозе aЛК (600 мг внутривенно, ежедневно, 2 недели) повышает чувствительность к инсулину и улучшает липидный профиль посредством уменьшения ОС, хронического воспаления и увеличения уровня адипонектина4.
Nota Bene!
aлипоевая кислота проникает через гематоэнцефалический барьер и улучшает когнитивную функцию.

Собственный уникальный клинический опыт оптимизации лечения 215 больных СД 2го типа и острым коронарным синдромом представила Людмила Иванова, д.м.н., профессор, зав. каф. эндокринологии ГБОУ ВПО «Кубанский государственный медицинский университет» МЗ РФ (Краснодар). Она отметила, что у таких пациентов ранее назначенный метформин отменяли при поступлении и уже никогда более не назначали. Проф. Иванова выступает против назначения метформина пациентам с острым коронарным синдромом. Далее при гликемии 4,4–7,8 ммоль/л лечение СД не изменяли, а при гликемии > 7,8 ммоль/л, которая держалась в течение 6 часов от момента госпитализации, начинала проводиться в/в инфузия инсулина короткого действия перфузором в течение 24 часов, начиная с дозы 0,5 ЕД/ч, с последующей ежечасной коррекцией дозы для поддержания гликемии от 4,4 ммоль/л натощак до 7,8 ммоль/л, преимущественно в диапазоне 7–8 ммоль/л. Если больной не мог принимать пищу, для поддержания целевых уровней гликемии вводилась в/в глюкоза. На вторые сутки больных переводили на п/к введение инсулина короткого действия перед основными приемами пищи. Все пациенты, принимавшие препараты сульфонилмочевины, обязательно получали второй завтрак через 2–3 часа после приема препарата. При стабильной гемодинамике и гликемии в пределах целевых значений начиная с 3–4х суток острого периода переходили на лечение, которое пациент получал до госпитализации. В этот период допускался уровень гликемии 10–11 ммоль/л. Больные СД 2го типа, получавшие инсулин до поступления в стационар или перенесшие кетоацидоз, оставались на инсулинотерапии после выписки из стационара. Выбор жидкости для инфузии в остром периоде ИМ зависел от уровня гликемии (табл. 2) и преследовал своей целью поддержание гликемии > 4,4 ммоль/л натощак и 7,8–8,0 ммоль/л после еды.

Игорь Макаров, д.м.н., зав. кафедрой, профессор кафедры хирургических болезней № 1 ГБОУ ВПО «Самарский государственный медицинский университет» (Россия), представил практический опыт гравитационной терапии в комплексном лечении больных СД с синдромом диабетической стопы. Созданный стенд для моделирования повышенной гравитации стал первой установкой в России и в мире, применяемой в клинической практике. Лечебный эффект у больных с облитерирующими заболеваниями периферических артерий связан с принудительным током крови к нижним конечностям, вызванным действием центробежных сил и последующим развитием и стимуляцией коллатерального кровообращения. При этом повышенная гравитация сочеталась с дозированной мышечной работой ног на ножном тренажере, что способствует хорошему венозному оттоку.

К индивидуальному и вдумчивому подходу к каждому пациенту с СД призвал практических врачейэндокринологов профессор Владимир Панькив, заслуженный врач Украины, руководитель отдела Украинского НПЦ эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины (Киев). Он отметил, что при разработке программ терапии СД, конечно же, следует ориентироваться на международные протоколы и ряд нормативных документов, прежде всего на Приказ МЗ Украины от 21.12.2012 г. № 1118 «Уніфікований клінічний протокол первинної і вторинної (спеціалізованої) медичної допомоги «Цукровий діабет 2го типу», начиная с модификации образа жизни пациента и при необходимости назначая метформин. Профессор Панькив призвал практических врачей учитывать инсулинорезистентность каждого пациента по уровню Спептида как определяющего маркера секреции инсулина и показателя остаточной эндокринной функции бетаклеток, который не зависит от наличия антител к инсулину при инсулинотерапии. Его определение позволяет контролировать терапевтическую эффективность лечения СД 2го типа5.
«Патология щитовидной железы — неисчерпаемая тема для дискуссии»

Так образно сказал о патологии щитовидной железы (ЩЖ) в самом начале своей лекции, посященной направлениям диагностики узловой патологии ЩЖ, Ю.И. Караченцев, проф., д.м.н., директор ИПЭП им. В.Я. Данилевского. Узловой зоб является весьма распространенным заболеванием ЩЖ. Вероятность развития данной патологии в течение жизни в среднем составляет 5–10 %, а заболеваемость — 30–40 на 100 тыс. населения. Узловой зоб — собирательное клиническое понятие, объединяющее различные по морфологии объемные образования ЩЖ, включающее такие заболевания, как узловой коллоидный зоб, аденома, хронический тиреоидит, киста, рак, дермоид, туберкулез, метастазы рака другой локализации. В диагностике узловой патологии ЩЖ он выделил шесть направлений:
1) физикальное обследование;
2) комплекс клиниколабораторных исследований;
3) ультразвуковое исследование;
4) тонкоигольная аспирационная пункционная биопсия;
5) маркеры малигнизации: иммуногистохимические, иммуноцитохимические, молекулярные;
6) интраоперационная морфологическая диагностика.
При этом проф. Ю.И. Караченцев, опираясь в том числе и на многолетний опыт клиники ИПЭП им. В.Я. Данилевского, подчеркнул, что не существует значимых различий в вероятности обнаружения злокачественного процесса в узлах большого и малого размера, единичных и множественных, а также какойлибо зависимости от их функциональной активности. Согласно существующим данным распространенность пальпируемых узловых образований в Северной Америке составляет от 3 до 7 %, а по данным УЗИ и аутопсийных исследований и этот показатель превышает 50 %.
Методом первичной диагностики узлового зоба является пальпация ЩЖ (диагностическая точность — 38–63 %). Выявляемость узлов ЩЖ при ультразвуковом исследовании среди всего населения у женщин и лиц пожилого возраста составляет 19–67 %, при этом среди всех клинически значимых образований тиреоидный рак может быть обнаружен в 5–10 % наблюдений. Следует помнить, что большинство узлов ЩЖ являются бессимптомными, но отсутствие симптомов не исключает наличия рака щитовидной железы. Наиболее характерными жалобами при узловой патологии ЩЖ являются:
— выпячивания на передней поверхности шеи;
— дискомфорт, тяжесть при глотании;
— периодическое покашливание;
— ощущение сдавливания шеи.
Nota Bene!
Риск наличия рака ЩЖ увеличивается при плотной консистенции узла, его неподвижности, быстром росте, наличии шейной лимфаденопатии, дисфонии, дисфагии, одышки.
Проф. Ю.И. Караченцев определил диагностическую ценность гормональных и дорогостоящих биохимических методов исследования как минимальную. К тому же излишнее количество малоинформативных исследований, нередко назначаемых без достаточных оснований, обусловливает сложность и высокую стоимость обследования больного.
Использование современных методов визуализации, таких как УЗИ, значительно повысило количество выявляемых очаговых органических изменений ЩЖ (чувствительность УЗИ — 53–91 %). Почти у 1/3 женщин в возрасте старше 30 лет могут отмечаться те или иные очаговые изменения тиреоидной ткани на УЗИ (специфичность — 21–80 %). Частота выявления узлового зоба у женщин в возрасте старше 50 лет по данным пальпации составляет 21 %, УЗИ — 67 %, аутопсии — 50 %, т.е. точность УЗИ — 64–81 %.
Nota Bene!
Риск диагностики рака ЩЖ по данным УЗИ возникает, если обнаружены:
- гипоэхогенность узла;
- нечеткие контуры;
- неправильная форма;
- наличие микрокальцинатов;
- повышение васкуляризации;
- извилистые васкулярные структуры;
- увеличение регионарных лимфоузлов.
Как практический хирургэндокринолог, проф. Ю.И. Караченцев отметил, что стандартная тонкоигольная аспирационная биопсия (ТАБ), к сожалению, не может в 15–30 % случаев дифференцировать доброкачественные и злокачественные опухоли ЩЖ. Кроме того, цитологическое исследование материала, полученного при ТАБ, должно осуществляться специально обученным цитологом. Ложноотрицательные результаты обычно связаны с получением при ТАБ недостаточного количества материала, а ложноположительные — с получением «подозрительных» данных. При многоузловом зобе не всегда представляется возможным пунктировать все существующие узлы, не во всех случаях удается получить достаточное количество клеток.
Профессор Ю.И. Караченцев назвал один из актуальных путей повышения диагностической эффективности ТАБ — иммуноцитохимическое определение тиреоидной пероксидазы47, дипептидиламинопептидазы IV и других в материале биопсии. Согласно рекомендациям Американской тиреоидной ассоциации, маркеры злокачественности не могут быть использованы при неопределенном потенциале тиреоидного новообразования6. Совокупная точность клинических, инструментальных и лабораторных методов диагностики узлового зоба по установлению морфологического происхождения очага пролиферации в ЩЖ даже по самым смелым подсчетам не превышает 80 %.
Nota Bene!
«До 70 % рака ЩЖ в обиходе хирурговэндокринологов определяется термином «маленький рак», так как находится в узлах до 1 см», — отметил проф. Ю.И. Караченцев.
В то же время, по мнению проф. Ю.И. Караченцева, интраоперационная диагностика узловой патологии ЩЖ является очень эффективной, так как обладает самой высокой чувствительностью (78–92 %), наибольшей специфичностью (90–100 %) и диагностической точностью (97–90 %).
Дискуссию о лечении патологии ЩЖ поддержал профессор Владимир Панькив, который подробно остановился на фармакотерапии тиреотоксикоза (ТТ). ТТ — клинический синдром, обусловленный действием на организм избытка тиреоидных гормонов (ТГ). Современные лабораторные методы позволяют диагностировать два варианта ТТ, которые часто являются стадиями одного процесса. У пациентов в возрасте старше 60 лет ТТ может вызывать опасные тахиаритмии. «Каждый человек после 60 лет должен знать не только уровень собственного АД, сахара, липидов, но и уровень ТГ», — заявил профессор Панькив. Различают следующие варианты ТТ: 1) субклинический тиреотоксикоз характеризуется снижением уровня тиреотропного гормона (ТТГ) в сочетании с нормальными уровнями свободного тироксина (fT4) и трийодтиронина (fT3); 2) манифестный (явный) тиреотоксикоз характеризуется снижением уровня ТТГ и повышением уровня fT4 и/или fT3. Основной причиной тиреотоксикоза в районах с достаточным йодным обеспечением является болезнь Грейвса (диффузный токсический зоб). В регионах с йодным дефицитом частая причина тиреотоксикоза — многоузловой или узловой токсический зоб. Тиреотоксикоз может быть ятрогенным, развиваясь при передозировке препаратов гормонов щитовидной железы. При различных видах тиреоидитов развивается так называемый деструктивный вариант тиреотоксикоза, обусловленный разрушением фолликулов щитовидной железы и попаданием в кровь избытка ТГ. Хорошие результаты по ремиссии пациентов с ТТ в клинических исследованиях профессора Панькива показал новый антитиреоидный препарат — карбимазол (эспакарб®) в таблетках 5, 10 мг, курсом до 18 месяцев.

Опыт терапевтаэндокринолога в лечении патологии ЩЖ (диффузный нетоксический зоб, гипертиреоз) у 55 пациентов с использованием диетической добавки на основе экстракта лапчатки белой (300 мг 2 раза в сутки) представил Алексей Каминский, к.м.н., ГУ «Национальный научный центр радиационной медицины НАМН Украины» (Киев). В результате было установлено, что при длительном режиме применения (2 табл/сут) у большей части больных с тиреоидной патологией (диффузный нетоксический зоб, гипертиреоз) констатировали быстрое уменьшение объема ЩЖ, нормализацию ее функционального состояния. Дополнительно было отмечено сокращение сроков достижения целевых уровней ТТГ примерно на 20 %, а также в целом и продолжительности лечения гипертиреозов.
Гормоны и мужское здоровье

Владимир Бондаренко, д.м.н., руководитель клинического отдела патологии половых желез, директор ИПЭП им. В.Я. Данилевского, рассказал об особенностях течения, диагностики и терапии гиперпролактинемического гипогонадизма (ГГ) у мужчин. ГГ — клинический синдром, обусловленный избытком пролактина — гиперпролактинемией (ГП), включающий той или иной степени гипогонадизм и патологическое отделяемое из молочных желез (необязательный признак). Патологическая ГП может являться следствием аденомы лактотрофов гипофиза, опухолей гипофиза или гипоталамуса, в результате которых возникает недостаточное ингибирование секреции пролактина дофамином. Понятия ГП и ГГ не являются синонимами. ГП (повышение сывороточного уровня пролактина) подразделяется на физиологическую (при беременности, лактации, у новорожденных), бессимптомную (биохимическую) и патологическую. В. Бондаренко отметил, что уровень сывороточного пролактина у мужчин не должен превышать 20 нг/мл. Уровень пролактина выше 200 нг/мл характерен для макропролактиномы. Нарушение полей зрения, как правило, свидетельствует о наличии макропролактиномы. В то же время при уровне пролактина менее 200 нг/мл наиболее вероятны микропролактинома или идиопатическая гиперпролактинемия, а умеренное повышение пролактина (до 40–85 нг/мл) характерно для краниофарингиомы, гипотиреоза, а также лекарственной гиперпролактинемии, которую могут вызывать нейролептики, циметидин и др. Патологическая ГП может также возникать при гипотиреозе (при первичном гипотериозе до 40 %), применении антагонистов D2рецепторов дофамина.
По данным разных авторов, гиперпролактинемия у мужчин обнаруживается в 0,4–11 % случаев и в 50–85 % является ведущим симптомом эректильной дисфункции. При этом наиболее частый показатель нарушения фертильности спермы — олигозооспермия, встречающаяся в 3–15 %. У таких пациентов выявляются нормальный или низкий уровень гонадотропинов и андрогенная недостаточность. Известны случаи, когда гиперпролактинемия обусловливает нарушения потенции независимо от подавляющего действия пролактина на тестостерон.
В. Бондаренко поделился положительным опытом назначения пациентам мужчинам с ГП агониста D2рецепторов — препарата каберголин (достинекс®)7 в дозе 0,5–1 мг 2 раза в неделю на протяжении 6 месяцев, что приводило к снижению уровней пролактина и восстановлению эректильной функции.
Подготовил Р. Редькин, к.фарм.н., старший научный сотрудник
ГУ «Институт проблем эндокринной
патологии им. В.Я. Данилевского НАМН Украины», г. Харьков
______________________________________________________________________________________________________
1 Центральные I1имидазолиновые рецепторы расположены в ростральном вентролатеральном отделе продолговатого мозга, отвечающем за тонический и рефлекторный контроль над симпатической нервной системой. Эндогенным лигандом имидазолиновых рецепторов является декарбоксилированный аргинин — агмантин.
2 Xu W. et al. // Diabetes. — 2010. — 59. — 29282935.
3 Снижение факторов риска кардиоваскулярной болезни, таких как гипертония или дислипидемия, благоприятные изменения массы тела, инсулинорезистентности и инсулинсекреторной активности (A consensus statement from the ADA and EASD / Nathan D.M. еt al. // Diabetes Care. — 2008, Dec. — 31. — 111).
4 Zhang J. // Obesity. — 2011. — 19. — 16471653.
5 J. Roth et al. // Diabetologia. — 2012. — № 4.
6 American association of clinical endocrinologists medical guidelines for clinical practice for the diagnosis and management of thyroid nodules // AACE/AME Task Force on Thyroid Nodules — Endocr. Pract. — 2006. — Vol. 12. — P. 63102.
7 Является агонистом дофаминовых рецепторов пролонгированного действия. Обладает высокой аффинностью к D2дофаминовым рецепторам, низкой — к D1дофаминовым, альфа1 и альфа2адренергическим, 5HT1 и 5HT2серотониновым рецепторам.