Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Состояние системы гемостаза, спектр генов тромбофилии и морфология последов у рожениц юго-восточного региона Украины с преэклампсией средней и тяжелой степени
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Цель: изучение состояния системы гемостаза, результатов генетического тестирования наследственных тромбофилий и морфологии последов у рожениц юго-восточного региона Украины с преэклампсией (ПЭ) средней и тяжелой степени.
Материал и методы. Группу П составили 38 рожениц с ПЭ средней и тяжелой степени. Группу К составили 46 рожениц без проявлений ПЭ и артериальной гипертензии. В исследовании использованы методы и тесты, характеризующие основные звенья системы гемостаза, молекулярно-генетические, морфологические, статистические методы.
Результаты. Гемостаз у рожениц с тяжелой и средней ПЭ характеризовался: нарушениями сосудисто-тромбоцитарного звена, активацией коагуляционного звена, истощением резервов антикоагуляционного звена гемостаза, угнетением фибринолиза. Установлено, что в развитии ПЭ средней и тяжелой степени играют роль генетически наследуемые формы тромбофилий, которые у таких пациенток встречаются в 1,18 раза чаще, чем в группе беременных без ПЭ и артериальной гипертензии (ОШ 7,70; ДИ 95% 0,93–65,69). Основными перинатальными последствиями родоразрешения женщин с ПЭ средней и тяжелой степени являются перинатальное гипоксическое поражение центральной нервной системы —
у 32 (84,21 %, р < 0,0001) новорожденных, врожденные рассеянные ателектазы легких — у 28 (73,68 %, р < 0,0001), дыхательная недостаточность — у 27 (71,05 %, р < 0,0001), задержка роста плода —
у 10 (26,32 %, р < 0,0002), конъюгационная желтуха — у 9 (23,68 %, р < 0,0005). В последах от женщин с ПЭ средней и тяжелой степени преобладают выраженные инволютивно-дистрофические и циркуляторные нарушения, множественные инфаркты и тромбозы. Морфофункциональные изменения затрудняют плацентарно-плодовый обмен и приводят к нарушениям и задержке роста плода, а в некоторых случаях — к гибели.
Выводы. Беременность и роды у женщин с преэклампсией средней и тяжелой степени протекают на фоне нарушений системы гемостаза, частого наличия генетически наследуемых форм тромбофилий, выраженных инволютивно-дистрофических и циркуляторных нарушений, множественных инфарктов и тромбозов в последах, что приводит к невынашиванию беременности и перинатальным последствиям и требует проведения ранних профилактических мероприятий у беременных группы риска по развитию преэклампсии средней и тяжелой степени.
Мета: вивчення стану системи гемостазу, результатів генетичного тестування спадкових тромбофілій та морфології послідів у породіль південно-східного регіону України з прееклампсією (ПЕ) середнього та тяжкого ступеня.
Матеріал і методи. Групу П становили 38 породіль із ПЕ середнього та тяжкого ступеня. Групу К становили 46 породіль без проявів прееклампсії та артеріальної гіпертензії. У дослідженні використані методи і тести, що характеризують основні ланки системи гемостазу, молекулярно-генетичні, морфологічні, статистичні методи.
Результати. Гемостаз у породіль із тяжкою та середньою ПЕ характеризувався: порушеннями судинно-тромбоцитарної ланки, активацією коагуляційної ланки, виснаженням резервів антикоагуляційної ланки гемостазу, пригніченням фібринолізу. Встановлено, що в розвитку ПЕ середнього та важкого ступеня відіграють роль генетично успадковані форми тромбофілії, що в таких пацієнток зустрічаються в 1,18 раза частіше, ніж у групі вагітних без ПЕ й артеріальної гіпертензії (ВШ 7,70; ДІ 95% 0,93–65,69). Основними перинатальними наслідками розродження жінок із ПЕ середнього та тяжкого ступеня є перинатальне гіпоксичне ураження центральної нервової системи — у 32 (84,21 %, р < 0,0001) новонароджених, вроджені розсіяні ателектази легенів — у 28 (73,68 %, р < 0,0001), дихальна недостатність — у 27 (71,05 %, р < 0,0001), затримка росту плода — у 10 (26,32 %, р < 0,0002), кон’югаційна жовтяниця — у 9 (23,68 %, р < 0,0005). У послідах від жінок із ПЕ середнього та тяжкого ступеня переважають виражені інволютивно-дистрофічні та циркуляторні порушення, множинні інфаркти та тромбози. Морфофункціональні зміни ускладнюють плацентарно-плодовий обмін і призводять до порушень і затримки росту плода, а в деяких випадках — до загибелі.
Висновки. Вагітність і пологи в жінок із прееклампсією середнього та тяжкого ступеня перебігають на тлі порушень системи гемостазу, частої наявності генетично успадкованих форм тромбофілій, виражених інволютивно-дистрофічних і циркуляторних порушень, множинних інфарктів і тромбозів у послідах, що призводить до невиношування вагітності та перинатальних наслідків і вимагає проведення ранніх профілактичних заходів у вагітних групи ризику з розвитку прееклампсії середнього та тяжкого ступеня.
Objective: to study the state of hemostatic system, the results of genetic testing of hereditary thrombophilia and morphology of afterbirth from parturients of south eastern region of Ukraine with moderate and severe preeclampsia (PE).
Material and Methods. Group P consisted of 38 pregnant women with moderate and severe PE. Group K comprised 46 pregnant women without PE manifestations and hypertension. The study used the methods and tests that characterize the main links of hemostatic system, molecular-genetic, morphological, statistical methods.
Results. Hemostasis in obstetric patients with severe and moderate PE is characterized: by impaired vascular-platelet component, activation of coagulation link, depletion of reserves of anticoagulation hemostasis, inhibition of fibrinolysis. It is found that in the development of moderate and severe PE play a role genetically inherited thrombophilia which in these patients are found 1.18 times more frequently than in the group of pregnant women without PE and hypertension (OR 7.70; CI 95% 0.93–65.69). The main perinatal effects of delivery in women with moderate and severe PE are perinatal hypoxic lesion of the central nervous system — in 32 (84.21 %, p < 0.0001) infants, congenital pulmonary scattered atelectasis — in 28 (73.68 %, p < 0.0001), respiratory failure — in 27 (71.05 %, p < 0.0001), fetal growth retardation — in 10 (26.32 %, p < 0.0002), conjugated jaundice — in 9 (23.68 %, p < 0.0005). In afterbirth from women with moderate and severe PE dominated expressed involutional dystrophic and circulatory disorders, multiple infarctions and thromboses. Morphological changes complicate placental fetal exchange and lead to violations and fetal growth retardation, and in some cases — to the death.
Conclusions. Pregnancy and childbirth in women with moderate and severe preeclampsia occur against a background of hemostatic disorders, frequent presence of genetically inherited thrombophilia forms, expressed involutional dystrophic and circulatory disorders, multiple infarctions and thrombosis in afterbirth, that leads to miscarriage and perinatal consequences and requires early preventive measures in pregnant women at risk of moderate and severe preeclampsia.
преэклампсия, гемостаз, гены тромбофилии, исходы родов, морфология последов.
прееклампсія, гемостаз, гени тромбофілії, наслідки пологів, морфологія послідів.
preeclampsia, hemostasis, thrombophilia genes, birth outcomes, afterbirth morphology.
Статья опубликована на с. 6-13
Преэклампсия (ПЭ) относится к одной из важнейших проблем современного акушерства и на сегодняшний день является одной из основных причин материнской и перинатальной заболеваемости и смертности [1, 2].
Существует более 30 аргументированных этиопатогенетических суждений о возникновении ПЭ, однако, к сожалению, ни одно из них не объясняет однозначно и в полной мере многообразие происходящих при данном осложнении беременности морфофункциональных изменений и клинических манифестаций [3, 4]. Одним из этиопатогенетических аспектов ПЭ являются различные нарушения в системе гемостаза крови с развитием тромбофилических состояний. Наличие генетических и/или приобретенных форм тромбофилии может быть также сопряжено с высоким риском развития целого ряда акушерских осложнений, таких как привычное невынашивание, ПЭ, антенатальная гибель плода, задержка роста плода, преждевременная отслойка плаценты и другие [5–7].
Целью работы стало изучение состояния системы гемостаза, результатов генетического тестирования наследственных тромбофилий и морфологии последов у рожениц юго-восточного региона Украины с преэклампсией средней и тяжелой степени.
Материал и методы
Группу П составили 38 рожениц с ПЭ средней и тяжелой степени, группу К — 46 рожениц без проявлений ПЭ и артериальной гипертензии.
Для оценки состояния системы гемостаза применяли методы и тесты, характеризующие основные звенья системы гемостаза:
— сосудисто-тромбоцитарное: свертываемость крови по Сухареву, общее количество тромбоцитов — на автоматическом анализаторе, спонтанная агрегация тромбоцитов и индекс адгезивности тромбоцитов — с помощью набора «Агрескрин-тест», активированное частичное тромбопластиновое время, регистрация времени свертывания плазмы при наличии цефалина и поверхностного активатора;
— коагуляционное: международное нормализованное отношение, протромбиновое время, фибриноген по Рутбергу, активированное частичное тромбопластиновое время, тромбомодулин и фактор Виллебранда — иммуноферментным методом ELISA фирмы Asserachrom®VWF:Ag, STAGO (Франция), фибронектин — методом нефелометрии при помощи реактивов Dade Behring, Marburg (Германия);
— активации свертывания крови: концентрация растворимых фибрин-мономерных комплексов, D-димер — иммуноферментным методом ELISA фирмы Technozym (Австрия);
— антикоагуляционное и фибринолитическое: активность антитромбина III, протеин С, протеин S — на автоматическом коагулометре ACL-200 (США) с использованием реагентов фирмы Instrumentation Laboratory (ACL-200 Operator’s Manual), продукты деградации фибриногена/фибрина — иммуноферментным методом ELISA фирмы Technozym (Австрия), время Хагеман-зависимого фибринолиза — по А.Г. Архипову и Г.Ф. Еремину (1985).
Количественный анализ гомоцистеина проводили в образцах плазмы (с этилендиаминтетрауксусной кислотой) методом высокоэффективной жидкостной хроматографии с флюорометрическим детектированием (Shimadzu RF-535). Хроматографическое разделение гомоцистеина осуществляли на колонке Reprosil 80 ODS-2 (100 x 4 мм, 3 мкм, Dr Maisсh GmbH, Германия). Детектирование проводили при 385 нм (возбуждение) и 515 нм (испускание).
Концентрации кальция, магния и калия в сыворотке крови определяли комплексометрическим методом на биохимическом анализаторе электролитов фирмы Screen Master Plus (Швейцария) с использованием стандартного набора реактивов Вiola-test фирмы LACHEMA (Чешская Республика).
Генетическое исследование образцов ДНК включало в себя следующие этапы: выделение ДНК из лимфоцитов периферической крови фенольным методом, проведение двух раундов мультиплексной полимеразной цепной реакции, гибридизацию меченого продукта на микрочипе и интерпретацию результатов гибридизации. Флуоресцентный сигнал от ячеек микрочипа регистрировали с помощью широкопольного люминесцентного микроскопа, снабженного камерой ПЗС и программным обеспечением Imageware («Биочип-ИМБ», Россия).
Полученные последы взвешивали, измеряли толщину плаценты. Образцы последов помещали в нейтральный забуференный 10% раствор формалина (pH 7,4) и фиксировали в течение 24 часов. После дегидратации кусочки заливали в парафин по стандартной методике. На ротационном микротоме Microm HM325 с системой переноса срезов STS (Carl Zeiss, Германия) изготавливали серийные гистологические срезы толщиной 4 мкм, которые затем окрашивали гематоксилином и эозином по стандартной методике. Микроскопию препаратов проводили на микроскопе Olympus AX70 Provis (Olympus, Япония) с помощью программы анализа изображения Analysis 3.2 Pro (Soft Imaging, Германия) согласно рекомендациям производителя программного обеспечения.
Полученные данные обработаны с помощью IBM PC с использованием электронной таблицы Excel и методов аналитической и вариационной статистики.
Результаты и их обсуждение
Исследование сосудисто-тромбоцитарного звена гемостаза помимо, как отмечалось ранее, снижения количества тромбоцитов в 1,23 раза (p < 0,0001) выявило укорочение начала времени свертывания крови в 1,67 раза (115,67 ± 1,18 против 193,59 ± 1,84 с, p < 0,0001) и его конца в 1,09 раза (208,42 ± 1,52 против 227,96 ± 2,33 с, p < 0,0001), повышение спонтанной агрегации тромбоцитов в 1,24 раза (18,73 ± 0,19 против 15,13 ± 0,08 %, p < 0,0001), индекса адгезивности тромбоцитов в 1,24 раза (37,47 ± 0,38 против 30,27 ± 0,16 %, p < 0,0001).
При изучении состояния коагуляционного звена гемостаза (табл. 1) у рожениц с ПЭ средней и тяжелой степени по сравнению с контрольной группой выявлено снижение международного нормализованного отношения в 1,20 раза (p < 0,0001) и увеличение показателей всех изучаемых звеньев коагуляционного гемостаза: протромбинового индекса в 1,10 раза (p < 0,0001), протромбинового времени в 1,20 раза (p < 0,0001), фибриногена А в 1,25 раза (p < 0,002), уровня растворимых фибрин-мономерных комплексов в 1,30 раза (p < 0,0001), активированного частичного тромбопластинового времени в 1,71 раза (p < 0,0001), фактора Виллебранда в 1,84 раза (p < 0,0001), фибронектина в 1,77 раза (p < 0,0001), а также появление у 30 (83,33 %) рожениц с ПЭ фибриногена В (p < 0,0001).
При анализе показателей антикоагуляционного звена гемостаза (табл. 2) выявлено снижение первичных физиологических антикоагулянтов, в том числе активности антитромбина III в 1,24 раза (p < 0,0001), протеина С — в 1,32 раза (p < 0,0001), протеина S — в 1,69 раза (p < 0,0001), и увеличение концентрации тромбомодулина в 1,16 раза (p < 0,008), а также вторичных физиологических антикоагулянтов, таких как продукты деградации фибриногена/фибрина, в 1,44 раза (p < 0,0001).
Оценка фибринолитического звена гемостаза крови выявила увеличение времени лизиса эуглобулиновых сгустков/Хагеман-зависимого фибринолиза у рожениц с ПЭ в 1,14 раза (15,73 ± 0,19 против 13,80 ± 0,18 мин, p < 0,0001).
Об активации свертывания крови у рожениц с ПЭ средней и тяжелой степени по сравнению с контрольной группой свидетельствовало увеличение концентрации растворимых фибрин–мономерных комплексов в 1,30 раза (4,98 ± 0,10 против 3,83 ± 0,09 мг/л, p < 0,0001), а также концентрации D-димера в 1,20 раза (1,49 ± 0,06 против 1,24 ± 0,05, p < 0,0001).
Результаты генетического тестирования на наследственные тромбофилии у рожениц юго-восточного региона Украины с ПЭ средней и тяжелой степени
Проведение тестирования на наследственные тромбофилии у 38 рожениц юго-восточного региона Украины с ПЭ средней и тяжелой степени и 46 рожениц без повышения давления и ПЭ во время беременности и родов выявило, что изменения генов тромбофилии у пациенток с ПЭ средней и тяжелой степени встречались в 1,18 раза чаще, чем в группе беременных без ПЭ, — 37 (97,37 ± 1,61%) против 38 (82,61 ± 1,35 %), p < 0,03 (ОШ 7,70; ДИ 95 % 0,93–65,69).
Изучение распределения аллелей генов тромбофилии у обследованных рожениц (табл. 3) показало, что у женщин группы П достоверно реже встречались нормальные гомозиготные аллели гена эндотелиального ингибитора активатора плазминогена-1 PAI1 — в 2,89 раза (р < 0,004), гена гликопротеина тромбоцитарных рецепторов ITGB3 — в 1,50 раза (р < 0,003), гена метилентетрагидрофолатредуктазы MTHFR — в 1,55 раза (р < 0,04), но чаще гетерозиготные аллели гена ITGB3 — в 2,42 раза (р < 0,04).
Мутации генов наследственных тромбофилий регистрировались у женщин с ПЭ в 16 случаях (42,11 ± 1,06 %, р < 0,05), причем встречались мутации почти всех изучаемых генов, за исключением мутаций гена коагуляционного фактора 2 или протромбина (F2), а именно фактора 5 (F5) Лейдена — у 1 роженицы (2,63 %, р > 0,05); гена FGB, кодирующего β-субъединицу коагуляционного фактора 1 фибриногена, — у 4 (10,53 %, р > 0,05); PAI1 — у 13 (34,21 %, р < 0,02); ITGB3 — у 4 (10,53 %, р < 0,03); MTHFR — у 5 (13,16 %, р < 0,02).
Мутации генов наследственных тромбофилий регистрировались у женщин контроля в 10 случаях (21,74 ± 0,69 %, р < 0,03): мутации гена FGB, кодирующего β-субъединицу коагуляционного фактора 1 фибриногена, — у 5 женщин (10,87 %, р > 0,05) и гена ингибитора активатора плазминогена-1 PAI1 — у 6 (13,04 %, р < 0,02).
Гетерозиготные аллели изучаемых генов наследственной тромбофилии встречались как в группе П, так и в группе К. Достоверные отличия наблюдались по количеству гетерозиготных аллелей гена гликопротеина тромбоцитарных рецепторов 3 ITGB3 — у женщин с ПЭ средней и тяжелой степени количество случаев гетерозигот ITGB3 было достоверно (в 2,34 раза) выше (р < 0,05).
Срок беременности во время родов у женщин с ПЭ средней и тяжелой степени был меньше такового в группе К в 1,18 раза — 33,00 ± 0,55 против 38,98 ± 0,20 недели, р < 0,0001, соответственно, количество преждевременных родов в группе П превышало таковое в группе К в 42,37 раза — 35 (92,11 %) против 1 (2,17 %), р < 0,0001, а срочных было в 12,39 раза меньше — 3 (7,89 %) против 45 (97,83 %), р < 0,0001 (табл. 4). У родильниц группы П все роды в 100 % случаев были осложненными, тогда как в контроле осложненные роды были в 3,54 раза реже и состоялись у 13 (28,26 %, р < 0,0001) женщин. Нормальных родов в группе П не было, тогда как нормальные роды в контроле зарегистрированы в 33 случаях (71,74 %, р < 0,0001).
Роды через естественные родовые пути у родильниц группы П были отмечены в 4,48 раза реже, чем в группе К, — 7 (18,42 %) против 38 (82,61 %), р < 0,0001, а путем операции кесарева сечения — в 4,69 раза чаще — 31 (81,58 %) против 8 (17,39 %), р < 0,0001.
Достоверных различий в распределении факторов, осложнивших роды у женщин обследованных групп, кроме ПЭ, не выявлено (табл. 5).
Средняя масса новорожденных в группе П была в 1,95 раза меньше, чем в группе К (1744,17 ± 113,72 против 3405,43 ± 97,24 г, р < 0,0001), рост — в 1,22 (42,89 ± 0,84 против 52,43 ± 0,43 см, р < 0,0001), оценка по шкале Апгар на 1-й минуте — в 1,20 (5,89 ± 0,09 против 7,07 ± 0,08 балла), на 5–й минуте — в 1,03 (7,75 ± 1,18 против 7,98 ± 0,10 балла) (табл. 6).
Основными перинатальными последствиями родоразрешения женщин с ПЭ средней и тяжелой степени было перинатальное гипоксическое поражение центральной нервной системы — у 32 (84,21 %, р < 0,0001) новорожденных, врожденные рассеянные ателектазы легких — у 28 (73,68 %, р < 0,0001), дыхательная недостаточность — у 27 (71,05 %, р < 0,0001), задержка роста плода — у 10 (26,32 % р < 0,0002), конъюгационная желтуха — у 9 (23,68 %, р < 0,0005).
33 (91,67 %) ребенка родились недоношенными (табл. 7), среди них наиболее часто регистрировалась недоношенность II (15 — 39,47 %, р < 0,0001) и III (12 — 31,58 %, р < 0,0001) степени.
/10/10_2.jpg)
Изучено состояние последов от родильниц с ПЭ средней и тяжелой степени и родильниц без явлений ПЭ и артериальной гипертензии (табл. 8).
Средняя масса последа при ПЭ составила в среднем 400,97 ± 6,87 г и была меньше таковой в контроле в 1,21 раза (485,87 ± 9,90 г, р < 0,0001). Число родильниц с массой последа менее 400 г в группе П превышало таковое в контроле в 2,18 раза (р < 0,02), а с массой более 450 г было меньше в 13,22 раза (р < 0,0001).
Форма плацент в обеих группах была преимущественно овальная, встречались отдельные плаценты листовидной, треугольной, неправильной овальной формы, с добавочными дольками. До 1/10 площади плацент в группе ПЭ было представлено инфарктами, гематомами, кавернами, в контроле не превышало 1/100 части.
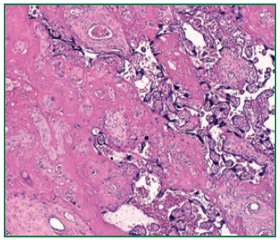
Инфаркты материнской поверхности плаценты встречались в группе П у 24 родильниц (63,16 %) и превышали число таких в контроле в 5,81 раза (р < 0,0001) (рис. 1). Инфаркты плодовой поверхности плаценты встречались у каждой пятой родильницы групп П и К (р > 0,05).
Красные инфаркты регистрировались только в группе П у 7 (18,42 %) женщин и не наблюдались в контроле (р < 0,003), аналогично желеобразные (у 7 — 18,42 %, р < 0,003) и мембранные (у 5 — 13,16 %, р < 0,02) инфаркты. Белые инфаркты в группе П регистрировались в 3,43 раза (р < 0,002) чаще (17 — 44,74 %) по сравнению с контролем (6 — 13,04 %). Нередко встречались хронические инфаркты и старые тромбы в межворсинчатом пространстве (рис. 2).
У женщин с ПЭ средней и тяжелой степени в 2,12 раза чаще в плацентах встречались некрозы (у 35 — 92,11 %, р < 0,0001) и в 1,86 раза (у 23 — 60,53 %, р < 0,02) — кальцинаты (рис. 3). Наблюдались искривление и укорочение ворсинчатого дерева, 2/3 ворсин были полнокровными. В группе П в 18 (47,37 %) случаях отмечали отложения периворсинчатого фибриноида, тогда как в контроле в 3,11 раза реже — в 7 случаях (15,22 %, р < 0,003). Было резко увеличено количество ворсин, лишенных эпителия и замурованных в фибриноид.
Дистальная гипоплазия ворсин наблюдалась в 19 (50,00 %, р < 0,0001) плацентах от женщин с ПЭ, тогда как в группе К — в 7,67 раза реже (3 плаценты — 6,52 %). За счет значительного уменьшения терминальных ворсин в группе П резко возрастала доля промежуточных. Количество синцитиальных узлов увеличивалось по сравнению с контролем в 2,22 раза — 21 (55,26 %, р < 0,07) (рис. 4). Отмечалось изменение рельефа ворсинчатого дерева с неравномерностью распределения и искривлением ворсин и изменением топографии поверхности, в отдельных участках с отеком и деструкцией. В стволовых и средних по диаметру ворсинах фиброз стромы был выражен более резко, чем в группе К. Наблюдалось утолщение стенок артериальных стволов с гипертрофией и сужением просвета.
В плацентах на фоне тяжелой ПЭ число фибриноидно-измененных ворсин достигало 3/4. Возрастало количество склерозированных и отечных ворсин, увеличивалось количество фибриноида в межворсинчатом пространстве (рис. 5).
В амнионе отмечались неравномерный отек и склероз стромы. Ядра эпителия амниона пикнотизированы и разрушены, обнаруживались обширные участки безъядерного эпителия с зернистой или пенистой цитоплазмой (рис. 6).
Выявлены существенные изменения во внеплацентарных плодных оболочках в зависимости от тяжести ПЭ: увеличение гидрофильности, набухание волокон, разрыхление соединительной ткани, заметное уменьшение количества фибробластов. В сосудах хориальной пластины и ворсин наблюдались неравномерный склероз, отек, пролиферация эндотелия, особенно в артериолах. Отмечалось плазматическое пропитывание стенок мелких сосудов децидуальной оболочки и ветвистого хориона.
Выводы
Беременность и роды у женщин с преэклампсией средней и тяжелой степени протекают на фоне нарушений системы гемостаза, частого наличия генетически наследуемых форм тромбофилий, выраженных инволютивно-дистрофических и циркуляторных нарушений, множественных инфарктов и тромбозов в последах, что приводит к невынашиванию беременности и перинатальным последствиям и требует проведения ранних профилактических мероприятий у беременных группы риска по развитию преэклампсии средней и тяжелой степени.
1. Преэклампсия беременных: особенности патогенеза, тактики ведения / И.И. Иванов, М.В. Черипко, Н.В. Косолапова, Е.Н. Прочан // Таврический медико-биологический вестник. — 2012. — Т. 15, № 2, ч. 2 (58). — С. 273–286.
2. Сімрок В.В. L-аргінін в комплексній терапії плацентарної дисфункції у вагітних з прееклампсією на тлі гепатобіліарної патології / В.В. Сімрок, Т.Ф. Коряєва // Таврический медико-биологический вестник. — 2012. — Т. 15, № 2, ч. 2 (58). — С. 276–279.
3. Запорожан В.Н. Приобретенные и генетические формы тромбофилий в патогенезе акушерской патологии / В.Н. Запорожан, В.И. Линников // Интегративная антропология. — 2006. — Т. 8, № 2. — С. 3–7.
4. The role of angiogenic, anti-angiogenic and vasoactive factors in pre–eclamptic African women: early-versus late-onset pre-eclampsia / [Govender L., Mackraj I., Gathiram P., Moodley J.] // Cardiovasc. J. Afr. — 2012. — Vol. 23, № 3. — P. 153–159.
5. Лоскутова Т.О. Генний поліморфізм залежно від ступеня тяжкості преклампсії / Т.О. Лоскутова, К.В. Воронін // Медичні перспективи. — 2011. — Т. XVI, № 4. — С. 1–5.
6. Баймурадова С.М. Патогенез, принципы диагностики, профилактики и терапии синдрома потери плода, обусловленного приобретенными и генетическими дефектами гемостаза: Автореф. дис… д-ра мед. наук: 14.01.01 / Седа Майрабековна Баймурадова. — М., 2007. — 48 с.
7. Беспалова О.Н. Генетика невынашивания беременности / О.Н. Беспалова // Журнал акушерства и женских болезней. — 2007. — Т. LVI, вып. 1. — С. 81–96.
8. Репина М.А. Преэклампсия и материнская смертность / М.А. Репина. — СПб.: Издательский дом СПбМАПО, 2005. — 208 с.
9. Khan S. Hereditary thrombophilia / S. Khan, J.D. Dickerman [электронный ресурс] // Thrombosis Journal. — 2006. — Vol. 4, № 15. — Режим доступа: http://www.thrombosisjournal.com/content/4/1/15
10. Пикаускайте Д.О. Популяционный и клинико–генетический анализ преэклампсии / Пикаускайте Д.О., Прытков А.Н., Козлова С.И. // Медицинская генетика. — 2006. — № 11. — С. 28–31.
11. Preeclampsia: multiple approaches for a multifactorial disease / [Pennington K.A., Schlitt J.M., Jackson D.L. et al.] // Dis. Model. Mech. — 2012. — Vol. 5, № 1. — P. 9–18.

/8/8.jpg)
/9/9.jpg)
/10/10.jpg)
/10/10_3.jpg)
/11/11.jpg)
/11/11_2.jpg)
/12/12.jpg)