Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Рівень інтерлейкіну-6 у сироватці периферичної крові та фолікулярній рідині в жінок у день забору яйцеклітин при проведенні допоміжних репродуктивних технологій
Авторы: Айзятулова Е.М., Чайка А.В. - Донецький національний медичний університет ім. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Мета дослідження — визначення вмісту інтерлейкіну-6 (IL-6) у фолікулярній рідині та сироватці периферичної крові пацієнток у день забору яйцеклітин із метою прогнозування ризику синдрому гіперстимуляції яєчників (СГСЯ) і оптимізації програм допоміжних репродуктивних технологій (ДРТ) у жінок з високим ризиком розвитку СГСЯ.
Матеріал та методи. Під наглядом перебувало 480 жінок із безпліддям, які проходили лікування методом ДРТ. Група І (n = 120) — пацієнтки групи ризику щодо СГСЯ з довгим протоколом контрольованої стимуляції овуляції. Група ІІ (n = 120) — пацієнтки групи ризику щодо СГСЯ із стандартним коротким протоколом контрольованої стимуляції овуляції з антагоністами гонадотропін-рилізинг-гормонів (ГнРГ). Група ІІІ (n = 120) — пацієнтки групи ризику щодо СГСЯ з протоколом контрольованої стимуляції овуляції із застосуванням антагоністів ГнРГ, з урахуванням рівня прогестерону і розробленими методами профілактики СГСЯ (у день забору яйцеклітин введення терліпресину). Група IV (n = 120) — пацієнтки без факторів ризику СГСЯ з використанням довгого протоколу контрольованої стимуляції овуляції. Концентрацію естрадіолу та IL-6 у сироватці крові та фолікулярній рідині в день пункції яєчників вимірювали на імуноферментному автоматичному аналізаторі.
Результати. Уміст IL-6 і естрадіолу в фолікулярній рідині та сироватці крові безплідних пацієнток групи ризику щодо СГСЯ, які знаходилися в довгому протоколі контрольованої стимуляції овуляції з агоністами ГнРГ, у день забору яйцеклітин вірогідно був вищим, ніж при стимуляції овуляції антагоністами ГнРГ і за розробленою методикою антагоністами ГнРГ з урахуванням рівня прогестерону. Виявлено пряму кореляційну залежність між рівнями IL-6 і естрадіолу в фолікулярній рідині (r = 0,51, p < 0,05); розвитком СГСЯ тяжкого ступеня та рівнями IL-6 (r = 0,39, p < 0,05) та естрадіолу в фолікулярній рідині (r = 0,47, p < 0,05).
Висновки. Більш високий рівень IL-6 у фолікулярній рідині порівняно з сироваткою крові підтверджує, що яєчник є основним джерелом підвищених рівнів IL-6 при контрольованій стимуляції овуляції в циклах ДРТ. Методом профілактики СГСЯ у безплідних жінок із високим ризиком його розвитку є використання протоколу контрольованої стимуляції овуляції з антагоністами ГнРГ з урахуванням рівня прогестерону на етапі стимуляції овуляції і введенням терліпресину на етапі забору яйцеклітин. Доцільно дослідження сироваткових і фолікулярних рівнів IL-6 у день забору яйцеклітин для прогнозу ймовірності розвитку і ступеня тяжкості СГСЯ.
Цель исследования — определение содержания интерлейкина-6 (IL-6) в фолликулярной жидкости и сыворотке периферической крови пациенток в день забора яйцеклеток с целью прогнозирования риска синдрома гиперстимуляции яичников (СГСЯ) и оптимизации программ вспомогательных репродуктивных технологий (ВРТ) у женщин с высоким риском развития СГСЯ.
Материал и методы. Под наблюдением находилось 480 женщин, которые проходили лечение методом ВРТ. Группа I (n = 120) — пациентки группы риска по СГСЯ с длинным протоколом контролируемой стимуляции овуляции.
Группа ІІ (n = 120) — пациентки группы риска по СГСЯ со стандартным коротким протоколом контролируемой стимуляции овуляции с антагонистами гонадотропин-рилизинг-гормона (ГнРГ). Группа III (n = 120) — пациентки группы риска по СГСЯ с протоколом контролируемой стимуляции овуляции с применением антагонистов ГнРГ, с учетом уровня прогестерона и разработанными методами профилактики СГСЯ (в день забора яйцеклеток введения терлипрессина). Группа IV (n = 120) — пациентки без факторов риска СГСЯ с использованием длинного протокола контролируемой стимуляции овуляции. Концентрацию эстрадиола и IL-6 в сыворотке крови и фолликулярной жидкости в день пункции яичников измеряли на иммуноферментном автоматическом анализаторе.
Результаты. Содержание IL-6 и эстрадиола в фолликулярной жидкости и сыворотке крови бесплодных пациенток группы риска по СГСЯ, находившихсяся в длинном протоколе контролируемой стимуляции овуляции с агонистами ГнРГ, в день забора яйцеклеток достоверно было выше, чем при стимуляции овуляции антагонистами ГнРГ и по разработанной методике антагонистами ГнРГ с учетом уровня прогестерона. Выявлена прямая корреляционная зависимость между уровнями IL-6 и эстрадиола в фолликулярной жидкости (r = 0,51, p < 0,05); развитием СГСЯ тяжелой степени и уровнями IL-6 (r = 0,39, p < 0,05) и эстрадиола в фолликулярной жидкости (r = 0,47, p < 0,05).
Выводы. Более высокий уровень IL-6 в фолликулярной жидкости по сравнению с сывороткой крови подтверждает, что яичник является основным источником повышенных уровней IL-6 при контролируемой стимуляции овуляции в циклах ВРТ. Методом профилактики СГСЯ у бесплодных женщин с высоким риском его развития является использование протокола контролируемой стимуляции овуляции с антагонистами ГнРГ с учетом уровня прогестерона на этапе стимуляции овуляции и введением терлипрессина на этапе забора яйцеклеток. Целесообразно исследование сывороточных и фолликулярных уровней IL-6 в день забора яйцеклеток для прогноза вероятности развития и степени тяжести СГСЯ.
Objective of the study — to determine level of interleukin-6 (IL-6) in follicular fluid and peripheral blood serum of patients on the day of egg collection to predict the risk of ovarian hyperstimulation syndrome (OHSS) and to optimize assisted reproductive technologies (ART) programs in women with high risk of OHSS.
Material and Methods. 480 women who were treated for infertility by ART, was under surveillance. Group I (n = 120) — patients with risk for OHSS with a long protocol of controlled ovarian stimulation. Group II (n = 120) — patients with risk for OHSS with a standard short protocol of controlled ovarian stimulation with gonadotropin-releasing hormone (GnRH) antantagonists. Group III (n = 120) — patients with risk for OHSS with protocol of controlled ovarian stimulation using GnRH antantagonist, given the level of progesterone and developed methods for OHSS (administration of terlipressin in the day of egg collection). Group IV (n = 120) — patients without risk factors for OHSS using a long protocol of controlled ovarian stimulation. Estradiol and IL-6 concentration in blood serum and follicular fluid at the day of ovarian puncture measured on ELISA automatic analyzer.
Results. Concentration of IL-6 and estradiol in follicular fluid and blood serum of infertile patients at risk for OHSS, who were in a long protocol of controlled ovarian stimulation with GnRH antantagonist, in the day of egg collection was significantly higher than in stimulation of ovulation with GnRH antantagonists by developed technique, given the level of progesterone. A direct correlation between the levels of IL-6 and estradiol in the follicular fluid (r = 0.51, p < 0.05); development of severe OHSS and levels of IL-6 (r = 0.39, p < 0.05) and estradiol in the follicular fluid (r = 0.47, p < 0.05).
Conclusions. Higher level of IL-6 in follicular fluid compared with blood serum confirms that the ovary is the main source of elevated IL-6 levels at a controlled ovarian stimulation in ART cycles. Method for preventing OHSS in infertile women with a high risk of its development is the use of controlled ovarian stimulation protocol with GnRH antantagonists based on the level of progesterone on ovulation induction stage and introduction of terlipressin at the stage of egg collection. It is advisable to study serum and follicular levels of IL-6 on the day of egg collection to predict the likelihood and severity of OHSS.
безпліддя, допоміжні репродуктивні технології, синдром гіперстимуляції яєчників, інтерлейкін-6, естрадіол.
бесплодие, вспомогательные репродуктивные технологии, синдром гиперстимуляции яичников, интерлейкин-6, эстрадиол.
infertility, assisted reproductive technologies, ovarian hyperstimulation syndrome, interleukin-6, estradiol.
Статья опубликована на с. 47-52
З 1978 року близько 10 мільйонів дітей у всьому світі народилися після застосування допоміжних репродуктивних технологій (ДРТ). Таким чином, 1–3 % усіх дітей народжені в розвинених країнах у результаті використання ДРТ. Окрім оптимізації техніки ДРТ, важливо також розглянути ризики самої контрольованої стимуляції овуляції. Хоча процедура ДРТ постійно вдосконалюється шляхом упровадження інноваційних технологій і нових наукових результатів, нинішні методи не можуть повністю імітувати природні умови. Тому знання про фактори, що регулюють передімплантаційний розвиток, становить великий інтерес [1].
Синдром гіперстимуляції яєчників (СГСЯ) є відносно поширеним ускладненням стимуляції яєчників і може бути небезпечним для життя. Одним з основних механізмів, відповідальних за клінічні прояви СГСЯ, є збільшення проникності капілярів мезотеліальної поверхні з гострим перекачанням рідини з внутрішньосудинного простору. Деякі останні повідомлення свідчать про патофізіологічне збільшення в фолікулярній рідині, асцитичній рідині і навіть у периферичній крові концентрації вазоактивних імунних медіаторів інтерлейкіну (IL)-6, IL-8, фактора некрозу пухлини α (TNF-α), фактора росту ендотелію судин (VEGF) та ін.) [2–8].
Цитокіни складаються в основному з невеликих водорозчинних білків і глікопротеїнів, які залежно від їх функцій, клітинного походження і мішеній класифікуються як лімфокіни, інтерлейкіни, хемокіни [9]. У контексті репродуктивної фізіології цитокіни, як відомо, модулюють функцію яєчників, гонадну секрецію стероїдів, функцію жовтого тіла, розвиток ембріона та імплантацію [9–14].
IL-6 був уперше ідентифікований як продукований Т-клітинами цитокін, що сприяє диференціюванню B-клітин і продукції антитіл [15–17]. Багато досліджень показали, що IL-6 є плейотропним цитокіном із кількома клітинними ефектами, починаючи від прискорення зростання, інгібування росту та диференціювання клітин до запалення, кровотворення, функції нейронів і остеокластогенезу. Патогенний вплив IL-6 описаний при декількох захворюваннях, починаючи від аутоімунних порушень у злоякісних пухлинах [16, 17]. Вплив IL-6 опосередкований через унікальну систему рецепторів, що складається з двох функціональних білків — ІЛ-6-рецептора (IL-6R) і gp130 [18–20]. Розчинна форма IL-6-рецептора (IL-6 sR) була виявлена в сироватці крові людини [18] і в сечі [20]; комплекси IL-6 і IL-6 sR проявляють агоністичний ефект на клітинах, що експресують IL-6 сигнальний трандюсер gp130 на їх поверхні [10, 21].
Експресія ІЛ-6 описується в людських гранульозних клітинах граафова фолікула [22–25], у людському жовтому тілі і тека-клітинах яєчників [26–27], в ендометрії [11, 28], у передімплантаційному ембріоні [29]. Роль ІЛ-6 при фізіологічній оваріальній функції була підтверджена дослідженням, яке виявило, що ІЛ-6 мРНК продукується протягом неоваскуляризації і ангіогенезу, які відбуваються в фолікулі, що розвивається. Вимірювання рівнів IL-6 у сироватці і фолікулярній рідині в жінок, які перенесли штучне запліднення, показало зв’язок з етіологією безпліддя, протоколами стимуляції, кількістю випадків фертилізації і результатів вагітності [15, 30–33]. Підвищені рівні IL-6 у фолікулярній рідині описані в контексті СГСЯ [34]. Тому визначення IL-6 може потенційно бути цінним засобом прогнозування.
Точне передбачення ймовірності розвитку СГСЯ в індивідуальному циклі ДРТ залишається тяжким завданням. Вважається, що сироваткові рівні естрадіолу ≥ 4500 пг / мл у день введення тригера овуляції і загальна кількість овоцитів ≥ 15 можуть бути корисними показниками для виявлення пацієнтів із високим ризиком від помірної до тяжкої форми СГСЯ [1]. Але все більше визнається, що вищевказані традиційні детермінанти не повною мірою визначають ризики для цього синдрому і не точно передбачають його появу. Потенційна цінність вимірювань цитокінів (місцевих і системних) як доповнення до гормональних тестів у прогнозуванні СГСЯ не була повністю досліджена. В ідеалі це прогнозування найкраще робити перед призначенням тригера овуляції, що дає можливість скасувати цикли ДРТ високого ризику [35–42].
Попередні роботи показали, що передовуляторні концентрації IL-6, TNF-α і VEGF не можуть передбачити появу СГСЯ. Оскільки початок ранньої форми СГСЯ (помірної або тяжкої) завжди являє декілька днів після введення тригера овуляції, то зміни цих медіаторів між днями введення тригера овуляції і перенесення ембріонів можуть бути використані для більш конкретного прогнозування [37].
Мета дослідження — визначення вмісту ІЛ-6 у фолікулярній рідині та сироватці периферичної крові пацієнток у день забору яйцеклітин із метою прогнозування ризику СГСЯ і оптимізації програм ДРТ у жінок із високим ризиком розвитку СГСЯ.
Матеріали і методи
Під спостереженням перебувало 480 жінок із безпліддям, які проходили лікування методом ДРТ. Рандомізація пацієнток на групи проводилася з урахуванням протоколу стимуляції у циклі ДРТ.
Група І (n = 120) — пацієнтки групи ризику щодо СГСЯ з використанням при ДРТ довгого протоколу контрольованої стимуляції овуляції. З 21-го дня попереднього менструального циклу у вигляді дейлі- або депо-форм вводили агоністи гонадотропін-рилізинг гормонів (ГнРГ). Після закінчення 14–18 днів введення агоністів ГнРГ й урахування даних ультразвукового дослідження (УЗД) товщини ендометрію і стану яєчників (на предмет фолікулярних кіст або кіст жовтого тіла), визначення рівня естрадіолу (< 50 пг/мл) починали введення менопаузальних або рекомбінантних гонадотропінів людини в середній стартовій дозі 150–250 МО. У момент досягнення розмірів понад 17 мм не менше ніж 3 фолікулами призначали тригер овуляції, через 34–36 годин здійснювали забір яйцеклітин.
Група ІІ (n = 120) — пацієнтки групи ризику щодо СГСЯ з використанням при ДРТ стандартного короткого протоколу контрольованої стимуляції овуляції з антагоністами ГнРГ. З 2-го дня менструального циклу починали щоденне введення гонадотропінів у середній стартовій дозі ФСГ 150–250 МО. На 7-й день проводили УЗД, при виявленні фолікула розміром не менше 14 мм призначали антагоніст ГнРГ (ганірелікс) у дозі 0,25 мг/день протягом 4–5 днів і продовжували стимуляцію гонадотропінами до досягнення не менше ніж 3 фолікулами розмірів 17 мм. Потім призначали тригер овуляції, через 34–36 годин здійснювали забір яйцеклітин.
Група ІІІ (n = 120) — пацієнтки групи ризику щодо СГСЯ з використанням при ДРТ протоколу контрольованої стимуляції овуляції із застосуванням антагоністів ГнРГ, з урахуванням рівня прогестерону і розробленими методами профілактики СГСЯ (у день забору яйцеклітин введення терліпресину). На 2-й день менструального циклу, крім визначення рівнів естрадіолу, ЛГ, ФСГ, досліджували рівень прогестерону. Якщо рівень прогестерону на 2-й день менструального циклу був < 1,5 нг/мл, то відразу з 2-го дня менструального циклу починали введення гонадотропінів у середній щоденній фіксованій дозі 150–250 МО. На 6–7-й день від початку введення гонадотропінів проводили УЗД. Якщо виявляли фолікул розмірами не менше за 14 мм, призначали антагоніст ГнРГ (ганірелікс) у дозі 0,25 мг/день протягом 4–5 днів до досягнення розмірів 17 мм не менше ніж трьома фолікулами. Потім призначали тригер овуляції — ХГЧ 10 тис. ОД. Через 34–36 годин після введення тригера овуляції здійснювали трансвагінальну пункцію фолікулів і забір яйцеклітин. Під час забору яйцеклітин вводили терліпресин 2 мл в/в одноразово. Терліпресин (N-тригліцил-8-лізин-вазопресин) (реместип, «Феррінг», Німеччина) являє собою синтетичний аналог гормону задньої частки гіпофіза вазопресину. У період забору яйцеклітин реместип, маючи вазоконстрикторну дію, перешкоджає крововиливу в жовті тіла, відповідно розміри яєчників значно не збільшуються й імовірність розриву яєчника дуже мала. Спазм судин жовтого тіла перешкоджає активному неоангіогенезу та знижує судинну проникність за рахунок зменшення кількості судинної мережі яєчників. За рахунок цього ефекту знижується ймовірність розвитку СГСЯ тяжкого ступеня.
Група IV (n = 120) — пацієнтки без факторів ризику СГСЯ з використанням при ДРТ довгого протоколу контрольованої стимуляції овуляції.
Дослідження сироватки крові та фолікулярної рідини були проведені в день пункції яєчників із метою забору яйцеклітин у програмі ДРТ. Фолікулярну рідину отримували з домінантного фолікула.
Концентрацію естрадіолу й IL-6 у сироватці крові та фолікулярній рідині вимірювали на автоматичному аналізаторі Cobas-e411 (Roche Diagnostic, Швейцарія) за допомогою наборів «Вектор-Бест» (Росія). Оптичну щільність досліджуваних зразків визначали при довжині хвилі 450 нм на напівавтоматичному імуноферментному мікропланшетному аналізаторі ImmunoChem-2100 (США). Кількість умісту естрадіолу й IL-6 вимірювали в пг/мл.
Статистичний аналіз отриманих результатів дослідження проводили за допомогою програми Excel.
Результати і обговорення
Усі досліджувані групи були однорідні за віком, гінекологічним, акушерським, соматичним, інфекційним анамнезом, тривалістю безпліддя, характером спермограм чоловіка. Групи І, ІІ, ІІІ були однорідні за урогенітальним мікробіоценозом, гормональним профілем, ехоскопічними даними внутрішніх геніталій, наявністю маткових труб. При довгому протоколі контрольованої стимуляції овуляції агоністами ГнРГ СГСЯ середнього ступеня розвинувся у 26,7 % осіб і тяжкої — у 8,3 %. При застосуванні стандартної схеми контрольованої стимуляції овуляції з антагоністами ГнРГ СГСЯ тяжкого ступеня спостерігали у 2,5 % жінок і середнього ступеня — у 15,0 %. При контрольованій стимуляції овуляції за розробленою схемою з антагоністами ГнРГ з урахуванням рівня прогестерону і застосуванням терліпресину в жодної жінки не спостерігали СГСЯ тяжкого ступеня, а СГСЯ середнього ступеня зареєстрували у 2,5 % осіб.
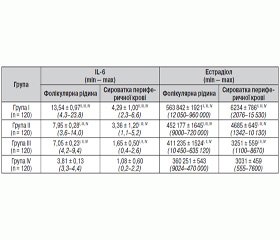
Рівні IL-6 та естрадіолу в фолікулярній рідині і сироватці периферичної крові у пацієнток із застосуванням ДРТ у день забору яйцеклітин у групах дослідження наведені в табл 1. Як видно з табл. 1, уміст IL-6 та естрадіолу в фолікулярній рідині та сироватці крові безплідних пацієнток групи ризику щодо СГСЯ, які знаходилися в довгому протоколі контрольованої стимуляції овуляції з агоністами ГнРГ, у день забору яйцеклітин вірогідно був вищим, ніж при стимуляції овуляції антагоністами ГнРГ і за розробленою методикою антагоністами ГнРГ з урахуванням рівня прогестерону.
СГСЯ тяжкого ступеня розвинувся в пацієнток, у яких рівень естрадіолу в фолікулярній рідині входив у діапазон концентрацій від 720 000 до 960 000 пг/мл і IL-6 > 8 пг/мл. Виявлено пряму кореляційну залежність між рівнями IL-6 та естрадіолу в фолікулярній рідині (r = 0,51, p < 0,05); розвитком СГСЯ тяжкого ступеня та рівнями IL-6 (r = 0,39, p < 0,05) та естрадіолу в фолікулярній рідині (r = 0,47, p < 0,05).
При порівнянні даних груп ІІ і ІІІ з контрольованою стимуляцією овуляції з антагоністами ГнРГ встановлено, що в жінок із проведенням ДРТ за розробленим протоколом завдяки застосуванню терліпресину в день забору яйцеклітин СГСЯ тяжкого ступеня не розвинувся, незважаючи на критичні рівні естрадіолу й IL-6 у деяких випадках.
У контрольній групі спостерігалися концентрації IL-6, що не перевищують 4,4 пг/мл у фолікулярній рідині і 2,2 пг/мл — у сироватці крові.
Результати цього дослідження дозволили виділити прогностичні рівні IL-6 щодо ризику розвитку СГСЯ:
— при високих концентраціях IL-6 (> 8 пг/мл у фолікулярній рідині і > 4,5 пг/мл у сироватці крові) існує висока ймовірність розвитку тяжкої форми СГСЯ;
— у діапазоні концентрацій IL-6 7–8 пг/мл у фолікулярній рідині і 1,5–4,5 пг/мл у сироватці крові) спостерігається висока ймовірність розвитку СГСЯ середнього ступеня тяжкості;
— при концентрації IL-6 < 4 пг/мл у фолікулярній рідині і 1 пг/мл у сироватці крові СГСЯ не розвивається.
Висновки
1. Уміст IL-6 та естрадіолу в фолікулярній рідині та сироватці крові безплідних пацієнток групи ризику щодо СГСЯ, які знаходяться на довгому протоколі контрольованої стимуляції овуляції з агоністами ГнРГ, у день забору яйцеклітин вірогідно вищий, ніж при стимуляції овуляції антагоністами ГнРГ і за розробленою методикою антагоністами ГнРГ з урахуванням рівня прогестерону.
2. Більш високий рівень IL-6 у фолікулярній рідині порівняно з сироваткою крові підтверджує, що яєчник є основним джерелом підвищених рівнів IL-6 при контрольованій стимуляції овуляції у циклах ДРТ.
3. Методом профілактики СГСЯ у безплідних жінок із високим ризиком його розвитку є використання протоколу контрольованої стимуляції овуляції з антагоністами ГнРГ з урахуванням рівня прогестерону на етапі стимуляції овуляції і введенням терліпресину на етапі забору яйцеклітин.
4. Доцільно дослідження сироваткових і фолікулярних рівнів IL-6 у день забору яйцеклітин для прогнозу ймовірності розвитку та ступеня тяжкості СГСЯ.
1. Risk factors for ovarian hyperstimulation syndrome in Thai patients using gonadotropins for in vitro fertilization / [Aramwit P., Pruksananonda K., Kasettratat N., Jammeechai K.] // Am. J. Health Syst. Pharm. — 2008. — Vol. 65, № 12. — P. 1148–1153. — doi: 10.2146/ajhp070566.
2. Targeting the vascular endothelial growth factor system to prevent ovarian hyperstimulation syndrome / [Soares S.R., Gómez R., Simón C. et al.] // Hum. Reprod. — Update. — 2008. — Vol. 14, № 4. — P. 321–33. — doi: 10.1093/humupd/dmn008.
3. Serum anti-mullerian hormone and estradiol levels as predictors of ovarian hyperstimulation syndrome in assisted reproduction technology cycles / [Lee T.H., Liu C.H., Huang C.C. et al.] // Hum. Reprod. — 2008. — Vol. 23, № 1. — P. 160–167.
4. Vascular endothelial growth factor production by circulating immune cells is elevated in ovarian hyperstimulation syndrome / [Kosaka K., Fujiwara H., Yoshioka S., Fujii S.] // Hum. Reprod. — 2007. — Vol. 22, № 6. — P. 1647–1651.
5. Vascular endothelial growth factor levels in serum and plasma from patients undergoing controlled ovarian hyperstimulation for IVF / [Manau D., Fábregues F., Peñarrubia J. et al.] // Hum. Reprod. — 2007. — Vol. 22, № 3. — P. 669–675.
6. Serum inhibin A, VEGF and TNF{alpha} levels after triggering oocyte maturation with GnRH agonist compared with HCG in women with polycystic ovaries undergoing IVF treatment: a prospective randomized trial / [Babayof R., Margalioth E.J., Huleihel M. et al.] // Hum. Reprod. — 2006. — Vol. 21, № 5. — P. 1260–1265.
7. Ovarian stimulation reduces IL-6 release from mouse and human pre-implantation embryos / [Yu C., Wang L., Li J. et al.] // Am. J. Reprod. Immunol. — 2012. — Vol. 68, № 3. — P. 199–204. — doi: 10.1111/j.1600-0897.2012.01142.x.
8. Low follicular fluid IL-6 levels in IVF patients are associated with increased likelihood of clinical pregnancy / [Altun T., Jindal S., Greenseid K. et al.] // J. Assist. Reprod. Genet. — 2010. — Vol. 28, № 3. — P. 245–51. — doi: 10.1007/s10815-010-9502-8.
9. Adashi E.Y. The potential relevance of cytokines to ovarian physiology: the emerging role of resident ovarian cells of the white blood cell series / E.Y. Adashi // Endocr. Rev. — 1990. — Vol. 11. — P. 454–464. — doi: 10.1210/edrv-11-3-454.
10. Kayisli U.A. Endocrine-immune interactions in human endometrium / Kayisli U.A., Guzeloglu-Kayisli O., Arici A. // Ann. N. Y. Acad. Sci. — 2004. — Vol. 1034. — P. 50–63. — doi: 10.1196/annals.1335.005.
11. Trombly D.J. Roles for transforming growth factor beta superfamily proteins in early folliculogenesis / Trombly D.J, Woodruff T.K., Mayo K.E. // Semin. Reprod. Med. — 2009. — Vol. 27. — P. 14–23. — doi: 10.1055/s-0028-1108006.
12. Luster A.D. Chemokines-chemotactic cytokines that mediate inflammation / Luster A.D. // N. Engl. J. Med. — 1998. — Vol. 338. — P. 436–445. — doi: 10.1056/NEJM199802123380706.
13. Potential involvement of the immune system in the development of endometriosis / [Kyama C.M., Debrock S., Mwenda J.M., D’Hooghe T.M.] // Reprod. Biol. Endocrinol. — 2003. — Vol. 1. — P. 123. — doi: 10.1186/1477-7827-1-123.
14. Role of the cytokines in the hypothalamic-pituitary-adrenal and gonadal axes / [Spangelo B.L., Judd A.M., Call G.B. et al.] // Neuroimmunomodulation. — 1995. — Vol. 2. — P. 299–312. — doi: 10.1159/000097209.
15. Immunoglobulins and cytokines level in follicular fluid in relation to etiology of infertility and their relevance to IVF outcome / [Hammadeh M.E., Ertan A.K., Zeppezauer M. et al.] // Am. J. Reprod. Immunol. — 2002. — Vol. 47. — P. 82–90. — doi: 10.1034/j.1600-0897.2002.1o024.x.
16. Kishimoto T. Interleukin-6 and its receptor: a paradigm for cytokines / Kishimoto T., Akira S., Taga T. // Science. — 1992. — Vol. 258. — P. 593–597. — doi: 10.1126/science.1411569.
17. Kishimoto T. Interleukin-6: from basic science to medicine 40 years in immunology / Kishimoto T. // Annu. Rev. Immunol. — 2005. — Vol. 23. — P. 1–21. — doi: 10.1146/annurev.immunol. 23.021704.115806.
18. Human soluble IL-6 receptor: its detection and enhanced release by HIV infection / [ Honda M., Yamamoto S., Cheng M., Yasukawa K., Suzuki H., Saito T., Osugi Y., Tokunaga T., Kishimoto T.] // J. Immunol. — 1992. — Vol. 148. — P. 2175–2180.
19. Interleukin-6 triggers the association of its receptor with a possible signal transducer, gp130 / [Taga T., Hibi M., Hirata Y. et al.] // Cell. — 1989. — Vol. 58. — P. 573–581. — doi: 10.1016/0092-8674(89)90438-8.
20. Soluble cytokine receptors are present in normal human urine / [Novick D., Engelmann H., Wallach D., Rubinstein M.] // J. Exp. Med. — 1989. — Vol. 170. — P. 1409–1414. — doi: 10.1084/jem.170.4.1409.
21. Complex of soluble human IL-6-receptor/IL-6 up-regulates expression of acute-phase proteins / [Mackiewicz A., Schooltink H., Heinrich P.C., Rose–John S.] // J. Immunol. — 1992. — Vol. 149. — P. 2021–2027.
22. Buyalos R.P. Detection of interleukin-6 in human follicular fluid / Buyalos R.P., Watson J.M., Martinez-Maza O. // Fertil. Steril. — 1992. — Vol. 57. — P. 1230–1234.
23. Interleukin–6 biosynthesis in human preovulatory follicles: some of its potential roles at ovulation / [Machelon V., Emilie D., Lefevre A. et al.] // J. Clin. Endocrinol. Metab. — 1994. — Vol. 79. — P. 633–642. — doi: 10.1210/jc.79.2.633.
24. Gorospe W.C. Interleukin-6 production by rat granulosa cells in vitro: effects of cytokines, follicle-stimulating hormone, and cyclic 3’, 5’-adenosine monophosphate / Gorospe W.C., Spangelo B.L. // Biol. Reprod. — 1993. — Vol. 48. — P. 538–543. — doi: 10.1095/biolreprod48.3.538.
25. Gorospe W.C. Interleukin-6: effects on and production by rat granulosa cells in vitro / Gorospe W.C., Hughes F.M. Jr, Spangelo B.L. // Endocrinology. — 1992. — Vol. 130. — P. 1750–1752. — doi: 10.1210/en.130.3.1750.
26. Rabbit ovarian production of interleukin-6 and its potential effects on gonadotropin-induced progesterone secretion in granulosa and theca cells / [Breard E., Benhaim A., Feral C., Leymarie P.] // J. Endocrinol. — 1998. — Vol. 159. — P. 479–487. — doi: 10.1677/joe.0.1590479.
27. Richards J.S. Immune-like mechanisms in ovulation / Richards J.S., Liu Z., Shimada M. // Trends Endocrinol. Metab. — 2008. — Vol. 19. — P. 191–196. — doi: 10.1016/j.tem.2008.03.001.
28. Interleukin-6 secretion in vitro is up-regulated in ectopic and eutopic endometrial stromal cells from women with endometriosis / [Tseng J.F., Ryan I.P., Milam T.D. et al.] // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81. — P. 1118–1122. — doi: 10.1210/jc.81.3.1118.
29. Progressive rise in the expression of interleukin-6 in human endometrium during menstrual cycle is initiated during the implantation window / [Tabibzadeh S., Kong Q.F., Babaknia A., May L.T.] // Hum. Reprod. — 1995. — Vol. 10. — P. 2793–2799.
30. Relationship between ovarian stimulation regimen and cytokine concentration in follicular fluid and their effect on fertilization and pregnancy outcome of patients undergoing ICSI program / [Hammadeh M.E., Braemert B., Baltes S. et al.] // Am. J. Reprod. Immunol. — 2000. — Vol. 43. — P. 12–20. — doi: 10.1111/j.8755-8920.2000.430103.x.
31. Serum levels of soluble vascular cell adhesion molecule-1, tumor necrosis factor-alpha, and interleukin-6 in in vitro fertilization cycles / [Souter I., Huang A., Martinez-Maza O. et al.] // Fertil. Steril. — 2009. — Vol. 91. — P. 2012–2019. — doi: 10.1016/j.fertnstert.2008.04.039.
32. The clinical role of interleukin-6 and interleukin-6 soluble receptor in human follicular fluids / [Kawasaki F., Kawano Y., Kosay Hasan Z., Narahara H., Miyakawa I.] // Clin. Exp. Med. — 2003. — Vol. 3. — P. 27–31. — doi: 10.1007/s102380300012.
33. Differential expression of follicular fluid cytokines: relationship to subsequent pregnancy in IVF cycles / [Bedaiwy M., Shahin A.Y., AbulHassan A.M. et al.] // Reprod. Biomed. Online. — 2007. — Vol. 15. — P. 321–325. — doi: 10.1016/S1472–6483(10)60346–X.
34. Vascular endothelial growth factor, interleukin-6 and interleukin-2 in serum and follicular fluid of patients with ovarian hyperstimulation syndrome / [Artini P.G., Monti M., Fasciani A. et al.] // Eur. J. Obstet. Gynecol. Reprod. Biol. — 2002. — Vol. 101. — P. 169–174. — doi: 10.1016/S0301–2115(01)00568–1.
35. Pattern of interleukin 6 gene expression in vivo suggests a role for this cytokine in angiogenesis / [Motro B., Itin A., Sachs L., Keshet E.] // Proceedings of the National Academy of Sciences of the United States of America. — 1990. — Vol. 87. — P. 3092–3096.
36. Selection of the in vitro culture media influences mRNA expression of Hedgehog genes, Il-6, and important genes regarding reactive oxygen species in single murine preimplantation embryos / [Pfeifer N., Baston–Büst D.M., Hirchenhain J., Friebe-Hoffmann U. et al.] // Scientific World Journal. — 2012. — 479315. — doi: 10.1100/2012/479315. 29
37. Value of serum and follicular fluid cytokine profile in the prediction of moderate to severe ovarian hyperstimulation syndrome / [Chen C.D., Chen H.F., Lu H.F. et al.] // Hum. Reprod. — 2000. — Vol. 15, № 5. — P. 1037–42.
38. The role of IL-6 trans-signaling in vascular leakage: implications for ovarian hyperstimulation syndrome in a murine model / [Wei L.H., Chou C.H., Chen M.W. et al.] // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98, № 3. — E472–84. — doi: 10.1210/jc.2012–3462.
39. Ovarian hyperstimulation syndrome is correlated with a reduction of soluble VEGF receptor protein level and a higher amount of VEGF-A / [Pietrowski D., Szabo L., Sator M. et al.] // Hum. Reprod. — 2012. — Vol. 27, № 1. — P. 196–199. — doi: 10.1093/humrep/der349.
40. Interaction between granulosa-lutein cells and monocytes regulates secretion of angiogenic factors in vitro / [Połeć A., Ráki M., Åbyholm T. et al.] // Hum. Reprod. — 2011. — Vol. 26, № 10. — P. 2819–2829. — doi: 10.1093/humrep/der216.
41. Lysophosphatidic acid up-regulates expression of interleukin-8 and -6 in granulosa-lutein cells through its receptors and nuclear factor-kappaB dependent pathways: implications for angiogenesis of corpus luteum and ovarian hyperstimulation syndrome / [Chen S.U., Chou C.H., Lee H. et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, № 3. — P. 935–43. — doi: 10.1210/jc.2007–1512.
42. Kasum M. New insights in mechanisms for development of ovarian hyperstimulation syndrome / Kasum M. // Coll. Antropol. — 2010. — Vol. 34, № 3. — P. 1139–43.
43. Interaction of interleukin-6 on human granulosa cell steroid secretion / [Salmassi A., Hedderich J., Oettinghaus C. et al.] // J. Endocrinol. — 2001. — Vol. 170. — P. 471–478. — doi: 10.1677/joe.0.1700471.

/49/49.jpg)