Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Вплив передопераційного призначення агоністів гонадотропін-рилізинг-гормонів перед видаленням ендометріом яєчників у пацієнток репродуктивного віку на морфофункціональний стан яєчників
Авторы: Носенко О.М., Чужик О.І., Постолюк І.Г. - Донецький національний медичний університет ім. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Мета: вивчення впливу передопераційного призначення агоністів гонадотропін-рилізинг-гормонів (ГнРГ) на морфофункціональний стан яєчників перед видаленням ендометріом яєчників у пацієнток репродуктивного віку.
Матеріал та методи. Під спостереженням перебували 120 жінок із прооперованими ендометріоїдними кістами яєчників: 60 жінок групи І, які отримували агоністи ГнРГ упродовж 2 місяців до та 3 місяців після операції; 60 жінок групи ІІ, які отримували агоністи ГнРГ тільки впродовж 3 місяців після операції. Контрольну групу становили 30 жінок. Оцінювали питому кількість позитивно забарвлених клітин з використанням мишачих моноклональних антитіл (МАТ) до людського судинно-ендотеліального фактора росту (VEGF) і до епідермального фактора росту (EGF), кролячих МАТ до Кi-67 і до каспази-3. Вимірювали рівень антимюллерова гормона (АМГ) в сироватці крові до та через 3 місяці після операції.
Результати. Застосування як передопераційної підготовки агоністів ГнРГ приводило до зниження ангіогенезу в стінці та навколо ендометріоїдних кіст, про що свідчить зниження експресії VEGF в 1,74 раза (p < 0,01); до зниження процесів проліферації зі зменшенням кількості імунореактивних клітин до EGF у 4,12 раза (p < 0,01) і Ki-67 в 1,38 (p < 0,01); зменшення кількості клітин у стані апоптозу в 1,89 раза (p < 0,01). У групі І сироватковий рівень АМГ знизився в 1,11 раза (p > 0,05), тоді як у групі ІІ — в 1,41 (p < 0,01). Через 3 місяці після операції рівень АМГ у пацієнток, які не отримували передопераційну підготовку агоністами ГнРГ, був нижчий за такий у тих, хто отримував її, в 1,21 раза (p < 0,01).
Висновки. Передопераційне призначення агоністів ГнРГ у пацієнток репродуктивного віку з ендометріомами яєчників сприяє зниженню кровопостачання капсули кісти, зменшує проліферативну активність ендометріозу, що приводить у сукупності до зменшення інтенсивності та тривалості коагуляційного гемостазу ранової поверхні ложа кісти і більшому збереженню оваріального резерву.
Цель: изучение влияния дооперационного назначения агонистов гонадотропин-рилизинг-гормона (ГнРГ) на морфофункциональное состояние яичников перед удалением эндометриом яичников у пациенток репродуктивного возраста.
Материал и методы. Под наблюдением находились 120 женщин с прооперированными эндометриоидными кистами яичников: 60 женщин группы I, получавших агонисты ГнРГ в течение 2 месяцев до и 3 месяцев после операции; 60 женщин группы II, получавших агонисты ГнРГ только в течение 3 месяцев после операции. Контрольную группу составили 30 женщин. Оценивали удельное количество позитивно окрашенных клеток с использованием мышиных моноклональных антител (МАТ) к человеческому сосудисто-эндотелиальному фактору роста (VEGF) и к эпидермальному фактору роста (EGF), кроличьих МАТ к Кi-67 и каспазе-3. Измеряли уровень антимюллерова гормона (АМГ) в сыворотке крови до и через 3 месяца после операции.
Результаты. Применение в качестве предоперационной подготовки агонистов ГнРГ приводило к снижению ангиогенеза в стенке и вокруг эндометриоидных кист, о чем свидетельствует снижение экспрессии VEGF в 1,74 раза (p < 0,01); к снижению процессов пролиферации с уменьшением количества иммунореактивных клеток к EGF в 4,12 раза (p < 0,01) и Ki-67 в 1,38 (p < 0,01); уменьшению количества клеток в состоянии апоптоза в 1,89 раза (p < 0,01). В группе I сывороточный уровень АМГ снизился в 1,11 раза (p > 0,05), тогда как в группе II — в 1,41 (p < 0,01). Через 3 месяца после операции уровень АМГ у пациенток, не получавших дооперационную подготовку агонистами ГнРГ, был ниже такового у получавших его в 1,21 раза (p < 0,01).
Выводы. Дооперационное назначение агонистов ГнРГ у пациенток репродуктивного возраста с эндометриомами яичников способствует снижению кровоснабжения капсулы кисты, уменьшению пролиферативной активности эндометриоза, что приводит в совокупности к уменьшению интенсивности и продолжительности коагуляционного гемостаза раневой поверхности ложа кисты и к большему сохранению овариального резерва.
Objective: to study the preoperative administration of gonadotropin-releasing hormone agonists (GnRH) on the morphofunctional state of the ovaries before ovarian endometrioma removal in patients of reproductive age.
Material and Methods. 120 women operated for ovarian endometriomas were under the supervision: 60 women of group I, treated with GnRH agonists for 2 months before and 3 months after surgery; 60 women of group II, treated with GnRH agonists only for 3 months after surgery. The control group consisted of 30 women. Specific amount of positively stained cells using mouse monoclonal antibodies (MABs) to human vascular endothelial growth factor (VEGF) and epidermal growth factor (EGF), rabbit MABs to Ki-67, and caspase-3 were studied. Anti-Mullerian hormone (AMH) levels were determined in blood serum before and 3 months after surgery.
Results. Use as a preoperative preparation of GnRH agonists lead to a decrease of angiogenesis in the wall and around the endometriotic cysts, as evidenced by a decrease in VEGF expression in 1.74 times (p < 0.01); to decrease of proliferation processes with reduction in amount of immunoreactive cells to EGF — in 4.12 times (p < 0.01) and Ki-67 — in 1.38 times (p < 0.01); reducing the number of apoptotic cells in a 1.89 times (p < 0.01). In group I AMH serum decreased in 1.11 times (p > 0.05), whereas in the group II — in 1.41 times (p < 0.01). 3 months after the operation level of AMH in patients who did not receive preoperative preparation with GnRH agonistsa was lower than that in patients treated with it in 1.21 times (p < 0.01).
Conclusions. The preoperative administration of GnRH agonists to patients of reproductive age with ovarian endometrioma reduces blood supply to the cystic sac, decrease in proliferative activity of endometriosis, which in total leads to decrease of intensity and duration of coagulative hemostasis of the wound surface of cystic bed and greater preservation of ovarian reserve.
ендометріома яєчника, операція, передопераційна підготовка, морфофункціональний стан яєчників, судинно-ендотеліальний фактор росту, епідермальний фактор росту, каспаза-3, Ki-67.
эндометриома яичника, операция, дооперационная подготовка, морфофункциональное состояние яичников, сосудисто-эндотелиальный фактор роста, эпидермальный фактор роста, каспаза-3, Ki-67.
ovarian endometrioma, surgery, preoperative preparation, morphofunctional state of the ovaries, vascular endothelial growth factor, epidermal growth factor, caspase-3, Ki-67.
Статья опубликована на с. 53-58
Ендометріоїдні кісти зазвичай лікують хірургічним шляхом, тому що медична терапія виявилися неефективною [1]. Типові методи органозберігаючої хірургії, які використовуються для лікування ендометріоїдних кіст, — цистектомія і абляція кіст [2]. Операція, проте, є потенціальним ризиком пошкодження оваріального резерву [3–5]. Цистектомія корелює з супутнім видаленням нормальної тканини яєчників, що, у свою чергу, призводить до значної втрати примордіальних фолікулів [2, 6, 7]. Сироватковий антимюллеровий гормон (АМГ) використовується як маркер оваріального резерву [8, 9] і чутливий до його змін [10, 11]. В останні роки з’явилися роботи, що вказують на пошкодження оваріального резерву при видаленні ендометріом яєчників [12–16].
Можливу шкідливу дію видалення ендометріом яєчників на оваріальний резерв було оцінено в систематичному огляді та метааналізі F. Raffi et al. (2012) [17]. Автори провели пошук даних за допомогою MEDLINE, Pub Med і Embase і визначили 8 відповідних досліджень з січня 2000 року по 30 листопада 2011 року. Діагностика ендометріоїдних кіст була проведена за допомогою УЗД у всіх включених дослідженнях. У всіх дослідженнях, крім одного, була виконана лапароскопічна операція. Дослідження включали 237 пацієнток. Зважений загальний передопераційний рівень АМГ становив 3,0 нг/мл, рівень його значно знизився (на 38 %) в післяопераційному періоді (–1,13 нг/мл при 95% ДІ від 0,37 до –1,88). Гетерогенність між досліджень була високою (I2 = 95 %). Пацієнтки з односторонніми ендометріоїдними кістами мали зниження в сироватці АМГ після операції на 30 %, з двосторонніми — на 44 %.
Причинами скорочення оваріального резерву після лапароскопічної цистектомії з приводу ендометріом яєчників на сьогодні вважаються: інтенсивна коагуляція з метою гемостазу; пошкодження кровопостачання яєчників; надмірне видалення тканини яєчника навколо кісти з розташованими там примордіальними фолікулами; використання хірургічних енергій з неконтрольованим поширенням в навколишні тканини; недосвідченість хірургів [18].
Агоністи гонадотропін-рилізинг-гормонів (ГнРГ) є таргетними препаратами при лікуванні ендометріозу внаслідок інгібіції мітогенних факторів росту, неоангіогенезу, онкогенних факторів та інгібіторів апоптозу. Але агоністи ГнРГ не впливають на розміри ендометріоїдних кіст яєчників, тому Міжнародна асоціація з ендометріозу вважала недоцільним призначення агоністів ГнРГ перед проведенням оперативного втручання. Однак на ХІ Міжнародному конгресі з ендометріозу в 2011 р. (Франція) було рекомендовано проведення рандомізованих досліджень із приводу визначення доцільності призначення агоністів ГнРГ при передопераційній підготовці пацієнток репродуктивного віку з ендометріоїдними кістами.
Ця пропозиція базується на тому, що при призначенні агоністів ГнРГ полегшується хірургія внаслідок відсутності функціональних кіст яєчників, інактивації яєчників і зниження вразливості яєчників при хірургічній травмі, зменшення об’єму ендометріоїдної тканини, запальної реакції, васкуляризації капсули кісти, скорочення тривалості оперативного втручання, полегшення адгезіолізису, зниження інтенсивності коагуляційного гемостазу, підвищення можливості збереження оваріального резерву.
Метою даного дослідження стало вивчення впливу передопераційного призначення агоністів ГнРГ перед видаленням ендометріом яєчників у пацієнток репродуктивного віку на морфофункціональний стан яєчників.
Матеріал та методи
Під спостереженням перебували 150 жінок репродуктивного віку, зацікавлених у реалізації репродуктивної функції, з яких 120 з ендометріоїдними кістами яєчників.
Група І: 60 прооперованих жінок, які отримували агоністи ГнРГ упродовж 2 місяців до та 3 місяців після операції.
Група ІІ: 60 прооперованих жінок репродуктивного віку з ендометріоїдними кістами яєчників, які отримували агоністи ГнРГ тільки впродовж 3 місяців після операції.
Контрольну групу становили 30 умовно соматично та гінекологічно здорових жінок репродуктивного віку з регулярним менструальним циклом.
Всі пацієнтки пройшли трансвагінальне ультразвукове дослідження, за необхідності — з використанням кольорового та енергетичного допплера, та обстеження на онкомаркери Са-125 та НЕ-4.
Лапароскопічні операції проводилися під загальним наркозом у ІІ групі в період ранньої або середньої фолікулярної фази менструального циклу, у І групі — через два тижні після другої ін’єкції агоніста ГнРГ. Відділення стінки кісти від нормальної тканини яєчників здійснювали після того, як яєчник був прорізаний ножицями над стінкою кісти. Потім стінку кісти відділяли від нормальної тканини яєчників за допомогою тяги і протилежної тяги двома затискачами. Гемостаз ранової поверхні ложа кісти проводили біполярним електрокоагулятором. Всі зразки ендометріом, отримані під час операцій, були подані на патологоанатомічну експертизу.
Після фіксації зразків операційних матеріалів в 10%му забуференому формаліні і гістологічної проводки тканин за стандартною методикою виготовляли парафінові зрізи товщиною 3–4 мкм, забарвлені гематоксиліном і еозином. Імуногістохімічні (ІГХ) дослідження здійснювали авідин-біотин-пероксидазним методом за стандартною методикою. Оцінювали питому кількість позитивно забарвлених клітин з використанням: моноклональних антитіл (МАТ) до людського судинно-ендотеліального фактора росту (VEGF) (Clone VG1, code No. M7273, DakoCytomation, Данія), мишачих МАТ до епідермального фактора росту (EGF) (Clone 9D7F11, Isotype: IgG1, Thermo Scientific, США), кролячих МАТ до Кi-67 (Clone SP6, code No. SP7 (RM-9106-S), Thermo Scientific, США), кролячих МАТ до каспази-3 ((Asp175) MAb (Clone 269518), catalog: MAB835, R and D Systems, Росія). Підраховували позитивно забарвлені клітини у трьох полях зору і розраховували відсоток позитивних клітин щодо всіх клітин строми або залоз. Розрахунок здійснювався не менше ніж на 1000 клітинних елементів строми або залоз.
Мікроскопію препаратів і всі морфометричні дослідження проводили на мікроскопі Оlympus AX70 Provis (Olympus, Японія) за допомогою програми аналізу зображення Analysis 3.2 Pro (Soft Imaging, Німеччина) згідно з рекомендаціями виробника програмного забезпечення.
Вимірювали рівень АМГ у сироватці крові до операції та через 3 місяці після операції в ранню фолікулінову фазу з використанням комерційного імуноферментного набору для аналізу (ELISA, Diagnostic Systems Laboratories, Webster, TX). Референсні значення знаходилися в межах 1–2,5 нг/мг.
Статистичний аналіз матеріалів проводили за допомогою комп’ютерної програми Excel.
Результати та їх обговорення
Досліджувані групи були однорідні за віком, гінекологічним, акушерським, інфектологічним, соматичним анамнезом, розмірами ендометріоїдних кіст, розподілом одно- та двосторонніх ендометріом, вираженістю злукового процесу в малому тазі, гормональним профілем периферичної крові, рівнем АМГ до операції (табл. 2).
При вилущуванні ендометріом зі здорової тканини яєчника в групі ІІ порівняно з групою І відмічали більшу кровоточивість ранової поверхні ложа кісти й необхідність більш інтенсивного і тривалого її гемостазу (в середньому на один яєчник — 5,34 ± 0,67 хв у групі ІІ проти 2,56 ± 0,55 хв у групі І (p < 0,01) (рис. 1).
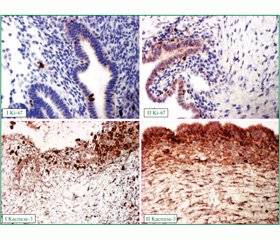
Проведення імуногістохімічного дослідження операційних матеріалів показало, що застосування як передопераційної підготовки агоністів ГнРГ призводить (табл. 1) до зниження ангіогенезу в стінці та навколо ендометріоїдних кіст, про що свідчить зниження експресії VEGF в 1,74 раза (p < 0,01) (рис. 2); до зниження процесів проліферації зі зменшенням кількості імунореактивних клітин до EGF у 4,12 раза (p < 0,01) (рис. 2) і Ki-67 в 1,38 (p < 0,01) (рис. 3); зменшення кількості клітин у стані апоптозу в 1,89 раза (p < 0,01) (рис. 3).
При оцінці оваріального резерву через 3 місяці після оперативного лікування ендометріом яєчників було встановлено, що в групі І сироватковий рівень АМГ знизився в 1,11 раза (p > 0,05), тоді як у групі ІІ — в 1,41 (p < 0,01). Через 3 місяці після операції рівень АМГ у пацієнток, які не отримували передопераційну підготовку агоністами ГнРГ, був нижчий за такий у тих, хто отримував її, в 1,21 раза (p < 0,01).
Висновки
Передопераційне призначення агоністів ГнРГ у пацієнток репродуктивного віку з ендометріомами яєчників сприяє зниженню кровопостачання капсули кісти, зменшує проліферативну активність ендометріозу, що приводить у сукупності до зменшення інтенсивності та тривалості коагуляційного гемостазу ранової поверхні ложа кісти і більшого збереження оваріального резерву.
1. Endometriotic ovarian cysts negatively affect the rate of spontaneous ovulation / [Benaglia L., Somigliana E., Vercellini P. et al.] // Hum. Reprod. — 2009. — Vol. 24, № 9. — P. 2183–2186. doi: 10.1093/humrep/dep202.
2. Coagulation or excision of ovarian endometriomas? / [Vercellini P., Chapron C., De Giorgi O. et al.] // Am. J. Obstet. Gynecol. — 2003. — Vol. 188, № 3. — P. 606–610.
3. Does laparoscopic cystectomy and cauterization of endometriomas greater than 3 cm diminish ovarian response to controlled ovarian hyperstimulation during IVF-ET? A case-control study / [Kahyaoglu S., Ertas E., Kahyaoglu I. et al.] // J. Obstet. Gynaecol. Res. — 2008. — Vol. 34, № 6. — P. 1010–1013. doi: 10.1111/j.1447-0756.2008.00825.x.
4. Effects of ovarian endometrioma on the number of oocytes retrieved for in vitro fertilization / [Almog B., Shehata F., Sheizaf B. et al.] // Fertil. Steril. — 2011. — Vol. 95, № 2. — P. 525–527. doi: 10.1016/j.fertnstert.2010.03.011.
5. Rate of severe ovarian damage following surgery for endometriomas / [Benaglia L., Somigliana E., Vighi V. et al.] // Hum. Reprod. — 2010. — Vol. 25, № 3. — P. 678–682. doi: 10.1093/humrep/dep464.
6. Laparoscopic excision of ovarian cysts: is the stripping technique a tissue-sparing procedure? / [Muzii L., Bianchi A., Crocè C. et al.] // Fertil. Steril. — 2002. — Vol. 77, № 3. — P. 609–614.
7. Hachisuga T. Histopathological analysis of laparoscopically treated ovarian endometriotic cysts with special reference to loss of follicles / Hachisuga T, Kawarabayashi T. // Hum. Reprod. — 2002. — Vol. 17, № 2. — P. 432–435.
8. Steiner A.Z. Biomarkers of ovarian reserve as predictors of reproductive potential / Steiner A.Z. // Semin. Reprod. Med. — 2013. — Vol. 31, № 6. — P. 437–442. doi: 10.1055/s-0033-1356479.
9. Dillon K.E. What is normal ovarian reserve? / Dillon K.E., Gracia C.R. // Semin. Reprod. Med. — 2013. — Vol. 31, № 6. — P. 427–436. doi: 10.1055/s-0033-1356478.
10. Evaluation of serum anti-Mullerian hormone levels to assess the ovarian reserve in women with severe endometriosis / [Pacchiarotti A., Frati P., Milazzo G.N. et al.] // Eur. J. Obstet. Gynecol. Reprod. Biol. — 2014. — Vol. 172, № 62. — P. 4. doi: 10.1016/j.ejogrb.2013.10.003.
11. Anti-Müllerian hormone: clinical insights into a promising biomarker of ovarian follicular status / [Feyereisen E., Méndez Lozano D.H., Taieb J. et al.] // Reprod. Biomed. Online. — 2006. — Vol. 12, № 6. — P. 695–703.
12. Prospective assessment of the impact of endometriomas and their removal on ovarian reserve and determinants of the rate of decline in ovarian reserve / [Uncu G., Kasapoglu I., Ozerkan K. et al.] // Hum. Reprod. — 2013. — Vol. 28, № 8. — P. 2140–2145. doi: 10.1093/humrep/det123.
13. One-year follow-up of serum antimüllerian hormone levels in patients with cystectomy: are different sequential changes due to different mechanisms causing damage to the ovarian reserve? / [Sugita A., Iwase A., Goto M. et al.] // Fertil. Steril. — 2013. — Vol. 100, № 2. — P. 516–522. e3. doi: 10.1016/j.fertnstert.2013.03.032.
14. The post-operative decline in serum anti-Mullerian hormone correlates with the bilaterality and severity of endometriosis / [Hirokawa W., Iwase A., Goto M. et al.] // Hum. Reprod. — 2011. — Vol. 26, № 4. — P. 904–910. doi:10.1093/humrep/der006.
15. Surgical excision of endometriomas and ovarian reserve: a systematic review on serum antimüllerian hormone level modifications / [Somigliana E., Berlanda N., Benaglia L. et al.] // Fertil. Steril. — 2012. — Vol. 98, № 6. — P. 1531–1538. doi: 10.1016/j.fertnstert.2012.08.009.
16. Kalampokas T. AMH after laparoscopic surgery of the ovaries: a review / Kalampokas T., Kamath M.S., Kalampokas E. // Gynecol. Endocrinol. — 2013. — Vol. 29, № 5. — P. 408–411.
17. Raffi F.The impact of excision of ovarian endometrioma on ovarian reserve: a systematic review and meta-analysis / Raffi F., Metwally M., Amer S. // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97, № 9. — P. 3146–3154. doi: 10.1210/jc.2012-1558.
18. Effect on ovarian reserve of laparoscopic bipolar electrocoagulation versus laparotomic hemostatic sutures during unilateral ovarian cystectomy / [Mohamed M.L., Nouh A.A., El-Behery M.M., Mansour S.A.[ // Int. J. Gynaecol. Obstet. — 2011. — Vol. 114, № 1. — P. 69–72.
19. Chaika А.V., Nosenko O.M., Golubyatnikov I.V., Tureev A.N. The surgical treatment of ovarian endometriomas by laparoscopic method // Acta Obstetricia et Gynecologica Scandinavica. — 1997. — Vol. 76, № 167. — P. 9.
20. Chaika A., Nosenko Y., Kornienko S., Checa N. Premature fading of ovarian function syndrome after laparoscopic ovary resection and cyst enucleation with monopolar electrocoagulation // European journal of Obstetrics & Gynecology and reproductive biology. — 2000, July. — Vol. 91, suppl. 1. — S9.
21. Чайка А.В., Носенко Е.Н., Корниенко С.В., Сусликова Л.В., Чайка К.В. Синдром преждевременного угасания функции яичников после эндохирургических операций на яичниках // Медико-социальные проблемы семьи. — 2000. — Т. 5, № 1. — С. 14–17.

/56/56.jpg)
/55/55.jpg)
/56/56_2.jpg)