Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Місцеве лікування ішемічних ранових дефектів нижніх кінцівок із використанням модифікованих біологічних середовищ
Авторы: Самойленко Д.Г. - Донецький національний медичний університет ім. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Мета: поліпшити результати комплексного лікування і скоротити кількість високих ампутацій у хворих з ішемічними дефектами кінцівок шляхом удосконалення місцево-пластичних операцій із застосуванням модифікованих покриттів.
Матеріали і методи. В умовах хірургічної клініки ІНВХ ім. В.К. Гусака НАМН України проаналізовано досвід лікування 36 хворих з ішемічними некротичними ранами. У дослідження було включено: 13 пацієнтів (основна група 1) із застосуванням аплікаційного способу закриття некректомічних ран покриттям промогран після модифікації його в культиваційному середовищі 199; 6 пацієнтів із застосуванням інвазивного методу підготовки ран із використанням ультразвукової кавітації рани з подальшою імплантацією озонованого колагенового гелю і збагаченої тромбоцитами автоплазми (основна група 2); 17 пацієнтів (контрольна група), які лікувалися в клініці з використанням традиційного лікування ран.
Результати. У пацієнтів основних груп 1 та 2 у зв’язку з прогресуванням гнійно-некротичного процесу та розвитком вологої гангрени пальців екзартикуляція з резекцією відповідних плеснових кісток виконана у 5 (26,31 %) пацієнтів та у 9 (52,94 %) із контрольної групи. Більше ніж у половини пацієнтів контрольної групи в післяопераційному періоді знадобилися етапні некректомії. Розширені некректомії з видаленням некротизованих фрагментів клітковини, власної фасції тильної поверхні стопи та розгиначів пальців, якщо вони були залучені у некротичний процес, були виконані у 4 хворих (21,05 %) з основних груп 1 та 2. У контрольній групі розширена некректомія виконана у 6 (35,29 %) пацієнтів.
Висновки. Озонований колаген є фактором гіпероксидації, місцевої імунокорекції, інгібіції протеаз та дезінфекції. Запропонований спосіб місцевого лікування із використанням модифікованих біологічних середовищ може бути ефективним у лікуванні ішемічних ранових дефектів нижніх кінцівок.
Цель — улучшить результаты комплексного лечения и сократить количество высоких ампутаций у больных с ишемическими дефектами конечностей путем усовершенствования местно-пластических операций с применением модифицированных покрытий.
Материалы и методы. В условиях хирургической клиники ИНВХ им. В.К. Гусака НАМН Украины проанализирован опыт лечения 36 больных с ишемическими некротическими ранами. В исследование были включены: 13 пациентов (основная группа 1) с применением аппликационного способа закрытия некрэктомических ран покрытием промогран после модификации его в культивационной среде 199; 6 пациентов с применением инвазивного метода подготовки ран и ультразвуковой кавитации раны с последующей имплантацией озонированного коллагенового геля и обогащенной тромбоцитами плазмы (основная группа 2); 17 пациентов (контрольная группа), лечившихся в клинике с использованием традиционного лечения ран.
Результаты. У пациентов основных групп 1 и 2 в связи с прогрессированием гнойно-некротического процесса и развитием влажной гангрены пальцев экзартикуляция и резекция соответствующих плесневых костей выполнена у 5 (26,31 %) пациентов и у 9 (52,94 %) из контрольной группы. Более чем у половины пациентов контрольной группы в послеоперационном периоде понадобились этапные некрэктомии. Расширенные некрэктомии с удалением некротизированных фрагментов клетчатки, собственной фасции тыльной поверхности стопы и разгибателей пальцев, если они были вовлечены в некротический процесс, были выполнены у 4 больных (21,05 %) из основных групп 1 и 2. В контрольной группе расширенная некрэктомия выполнена у 6 (35,29%) пациентов.
Выводы. Озонированный коллаген является фактором гипероксидации, местной иммунокоррекции, ингибирования протеаз и дезинфекции. Предложенный способ местного лечения с использованием модифицированных биологических сред может быть эффективным в лечении ишемических раневых дефектов нижних конечностей.
Objective — to improve the outcomes of combined treatment and to reduce the number of high amputations in patients with ischemic limb defects by improving local plastic surgical interventions with the use of modified surfaces.
Materials and Methods. Experience in treating 36 patients with ischemic necrotic wounds in the surgical clinic of Institute of Emergency and Reconstructive Surgery named after V.K. Gusak of NAMS of Ukraine has been analyzed. The study enrolled: 13 patients (study group 1) using application method of closing necrectomized wounds with promogran dressing after modifying it in the cultivation medium 199; 6 patients using invasive method of wounds preparation and ultrasonic wound cavitation with following implantation of ozonated collagen gel and the platelet-rich plasma (study group 2); 17 patients (control group), treated in the clinic using a conventional wound treatment.
Results. Patients of the study groups 1 and 2 due to the progression of necrotic suppurative process and the development of wet gangrene of fingers, disarticulation and resection of corresponding metatarsal bones was performed in 5 (26.31 %) patients and in 9 (52.94 %) in the control group. More than half of the patients in the control group postoperatively required stage necrectomy. Extended necrectomy removing necrotic tissue fragments, fascia on the dorsum of the foot and finger extensors, if they were involved in the necrotic process, were performed in 4 patients (21.05 %) of the study groups 1 and 2. In the control group extended necrectomy performed in 6 (35.29 %) patients.
Conclusions. Ozonated collagen is a factor of hyperoxidation, local immunomodulation, inhibition of proteases and disinfection. The proposed method of local treatment with the use of modified biological media may be effective in the treatment of ischemic wound defects of the lower limbs.
ішемічні ранові дефекти нижніх кінцівок, тромбоцитарні фактори росту, колаген, озонування.
ишемические раневые дефекты нижних конечностей, тромбоцитарные факторы роста, коллаген, озонирование.
ischemic wound defects of the lower extremities, platelet growth factors, collagen, ozonation.
Статья опубликована на с. 77-82
Висока поширеність і тяжкий перебіг судинних захворювань кінцівок при ураженнях артерій, що призводять до критичної ішемії та численних ампутацій на рівні гомілки або стегна, істотної втрати працездатності та зниження якості життя, свідчать про невирішеність питання надання лікувальної допомоги таким хворим. Способи лікування ішемічних ран нижніх кінцівок на сучасному етапі відносно обмежені і частіше за все містяться лише у визначенні рівня ампутації кінцівки [1]. Особливості перебігу деструктивного процесу, що виникає внаслідок виражених порушень мікроциркуляції і тканинного обміну, вимагають особливого, індивідуального і диференційованого підходу до вибирання засобів місцевого лікування. Традиційна терапія не завжди дозволяє отримати позитивний ефект лікування, тому актуальними і важливими є пошуки нових методів реваскуляризації кінцівки, зокрема на основі стимуляції неоангіогенезу у ішемізованих тканинах. Одним із напрямків дослідження є використання клітинних технологій, що включають уведення клітин, стимулюючих процеси ангіогенезу (це насамперед тромбоцитарні фактори росту, наприклад зі збагаченої тромбоцитами автоплазми). Сучасний розвиток уявлень про загоєння ран ґрунтується на вивченні клітинних і молекулярно-генетичних основ репарації тканин. Одним із таких перспективних напрямків є використання для лікування ран культивованих in vitro клітин — фібробластів і кератиноцитів, композицій тих покриттів, що містять ці клітини, а також чинників зростання — дермальний еквівалент [2]. Проте в такому широкому і перспективному напрямку багато аспектів, що не до кінця досліджені, у тому числі вплив дермального еквіваленту на процеси загоєння ішемічних виразок. До того ж культивування алофібробластів та кератиноцитів є достатньо складною та дорогою процедурою, що має бути виконана в умовах спеціалізованих лабораторій із усім необхідним оснащенням. Вивчення цієї проблеми та пошук нових методів лікування даної категорії хворих є предметом дослідження і визначає актуальність роботи, наукову та практичну її цінність.
Мета дослідження: покращити результати комплексного лікування і скоротити кількість високих ампутацій у хворих з ішемічними дефектами кінцівок шляхом удосконалення місцево-пластичних операцій із застосуванням модифікованих покриттів.
Матеріали і методи
В умовах хірургічної клініки ІНВХ ім. В.К. Гусака НАМН України проаналізовано досвід лікування 36 хворих з ішемічними некротичними ранами. У дослідження включені: 13 пацієнтів (основна група 1) із застосуванням аплікаційного способу закриття некректомічних ран покриттям промогран після модифікації його в культиваційному середовищі 199; 6 пацієнтів із застосуванням інвазивного методу підготовки ран із використанням ультразвукової кавітації рани з подальшою імплантацією озонованого колагенового гелю і збагаченої тромбоцитами плазми (основна група 2); 17 пацієнтів (контрольна група), які лікувалися в клініці з використанням традиційного лікування ран (10 — тільки пов’язками з антибактеріальною маззю раностоп та 7 — у яких пов’язки з вищевказаної маззю покривали харчовою поліетиленовою плівкою) для підготовки до пластичного закриття (табл. 1).
Усі пацієнти були з III–IV ступенем хронічної артеріальної недостатності нижніх кінцівок атеросклеротичної етіології. Вік хворих варіював від 41 до 75 років (66,2 ± 4,6 року). Чоловіків було 25 (69,4 %), жінок — 11 (30,6 %). Двадцять три пацієнти (63,89 %) були віком від 61 до 75 років. У 28 (77,78 %) випадках мав місце атеросклероз судин нижніх кінцівок, що призвів до облітерації судин, у 8 випадках (26,67 %) — діабетична стопа. Вологу форму некрозу кінцівки спостерігали у 22 (61,1 %) хворих, суху — у 14 (38,9 %) хворих.
Результати та обговорення
У всіх випадках хірургічна тактика залежала від локалізації гнійного вогнища, обсягу ураження тканин і мала максимально органозберігаючий характер. Так, у пацієнтів основної групи у зв’язку з прогресуванням гнійно-некротичного процесу та розвитком вологої гангрени пальців екзартикуляція з резекцією відповідних плеснових кісток виконана у 5 (26,31 %) пацієнтів основних груп 1 та 2 та у 9 (52,94 %) з контрольної групи. Більше ніж у половини пацієнтів контрольної групи в післяопераційному періоді знадобилися етапні некректомії. Розширені некректомії з видаленням некротизованих фрагментів клітковини, власної фасції тильної поверхні стопи та розгиначів пальців, якщо вони були залучені у некротичний процес, були виконані у 4 хворих (21,05 %) основних груп 1 та 2. У контрольній групі розширена некректомія виконана у 6 (35,29 %) пацієнтів.
Складніше піддавалися комплексному лікуванню гнійно-некротичні ускладнення з локалізацією в ділянці п’ят. З пацієнтів основної групи у 2 знадобилися етапні некректомії. Із 2 пацієнтів контрольної групи в одного пацієнта виконана ампутація на рівні гомілки, в іншого — на рівні стегна. За підсумками лікування високі ампутації знадобилися тільки хворим із контрольної групи.
В основі дослідження була розробка методу лікування глибоких ранових дефектів в умовах ішемії кінцівок, коли обмежено використання автопластичного повноцінного матеріалу. Після проведеної некректомії та ультразвукової санації рани ми використовували внесення збагаченої тромбоцитарними факторами росту автоплазми шляхом ін’єкційної інфільтрації прилеглих до рани ішемізованих тканин та введення озонованого колагенового гелю.
Розрахунок ефективності методу базувався на тому, що завдяки аплікації на рану гідрофільного гелю, який заповнює всю порожнину, сорбується рановий ексудат. Під його впливом і дією клітинних елементів тканин колагеновий гель поступово лізується, вивільняючи дигестазу, а продукти колагенолізису, включаючись в процеси ранового метаболізму, стимулюють репаративну регенерацію. Колаген підтримує вологе середовище в рані, стимулює синтез нового колагену, прискорює регенерацію. Крім того, ранові протеази безпосередньо не здатні здійснювати лізис колагену, а самі вільні протеази значною мірою «вимиваються» з ранової поверхні разом із рановим виділенням. Дигестаза приводить до лізису патологічно зміненого колагену і некротичних мас, руйнує оболонку бактерій. Нанесені біологічні середовища не потрібно замінювати, вони повністю розсмоктуються, спрощуючи процес перев’язки. Інфільтрація тканин озонованим колагеновим гелем та збагаченою тромбоцитарними факторами росту автоплазмою має два основних шляхи фармакологічної дії, необхідних для загоєння ран: цитопротекцію та проліферацію фібробластів з ендотеліальними клітинами, тим самим стимулюючи прогресування грануляції та створення оптимальних умов у рані до приживлення шкіряного автотрансплантату.
Поставлене завдання вирішували тим, що хворому з ішемічною раною виконували некректомію та двоетапну ультразвукову кавітацію рани спочатку з антисептиком та потім з озонованим колагеновим гелем, після чого вводили в краї висіченої рани модифіковані біологічні середовища із збагаченою тромбоцитарними факторами росту автоплазмою та озонованого колагенового гелю, проводили одночасне або відстрочене закриття ран перфорованими автодермотрансплантатами з коефіцієнтом збільшення сітки 1 × 2 або 1 × 4 під пов’язкою з гепариновою маззю в умовах «вологої камери» під поліетиленовою плівкою.
Методику застосовували таким чином, що на початку операції в 1–2 флаконах по 50 мл виконували озонування розміщеного в стерильному фізіологічному розчині NaCl колагенового гелю колост (рис. 1). Для отримання медичного озону використовували апарат «Озон УМ-80» (Україна). Концентрацію озону в озоно-кисневій суміші використовували у дозі 2,5 мг/л. Швидкість подачі озоно-кисневої суміші 0,5 л/хв. Час озонування — 10 хвилин.
У пацієнта шляхом пункції периферійної вени здійснювали забір 40 мл крові, яку направляли до лабораторії для отримання шляхом центрифугування збагаченої тромбоцитами плазми (рис. 2).
Інтраопераційно під загальним знеболюванням виконували некректомію, в тому числі, при необхідності, видалення або резекцію загиблих кісткових структур. Процедуру виконували обережно та пошарово за допомогою скальпеля, дерматому й одразу, за потреби, обережно проводили гемостаз.
Ультразвуковим дисектором (апарат Soring, Німеччина) виконували обробку ран із робочою частотою ультразвуку Г = 25 кГц при амплітуді 140/150 мкм на зонді площею 15 мм2 величиною прискорення 10 000 × g та інтенсивністю від 200 до 1000 мВ/мм2. Як робочий розчин використовували 0,02% водний хлоргексидин. Середня швидкість обробки становила 1–1,5 квадратних сантиметра на хвилину. Потужність ультразвуку добирали індивідуально, залежно від рівня забрудненості рани, больового порогу чутливості пацієнта, обсягу порожнини, що потребує санації. Після цього таким же чином виконували повторну кавітацію озонованим колагеновим гелем. Ультразвукове лікування починали з малої потужності, з поступовим її підвищенням, до появи больових відчуттів у пацієнта. Тривалість кожного з двох сеансів не перевищувала 3–5 хвилин.
Ін’єкційну інфільтрацію ішемізованих тканин по периферії та дна рани збагаченою тромбоцитарними факторами росту автоплазмою здійснювали з 4 окремих місць до 0,5 см від краю дефекту та доповнювали введенням озонованого киснево-озоновою газовою сумішшю колагенового гелю також із 4 окремих точок (усього 8 точок ін’єкційної інфільтрації). Маніпуляцію в стерильних умовах здійснювали стандартними одноразовими шприцами 10, 20 або 50 мл через голки діаметром 24–30 G. Уведення починали з пробної процедури під контролем стану пацієнта.
За візуальної життєздатності тканин виконували автодермотрансплантацію. Трансплантат та ранове покриття без додаткових зусиль (за рахунок високого ступеня адгезії колагену) фіксували на вологій рановій поверхні та покривали марлевим шаром із гепариновою маззю та поліетиленовою плівкою. Вважали, що використання озонування озоно-кисневою сумішшю колагену є фактором гіпероксидації, місцевої імунокорекції та дезінфекції, що практично виключало необхідність місцевого використання антибактеріальних мазей. Накладали пов’язки із гепариновою маззю для покращення місцевої мікроциркуляції. При неможливості одночасної автотрансплантації шкіри протягом 3–5 діб здійснювали підготовку ран до відстроченої шкіряної автотрансплантації під плівковою частиною покриття колост, яке змінювали щоденно після обробки рани та нанесення озонованого колагенового гелю.
Наводимо клінічний приклад застосування запропонованого способу лікування.
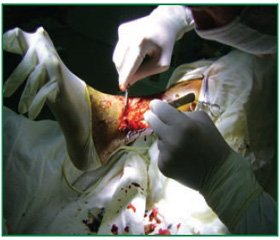
Хворий Ж., 74 років, знаходився у відділенні хірургії судин ДУ «ІНВХ ім. В.К. Гусака НАМНУ» (м. Донецьк, Україна) з діагнозом: синдром Леріша, атеросклеротичний стеноз правої клубової, оклюзія лівої клубової та обох стегнових артерій, хронічна артеріальна недостатність правої ноги IIБ ступеня, хронічна артеріальна недостатність лівої ноги IV ступеня. Супутній діагноз: ІБС: атеросклеротичний кардіосклероз, стеноз мітрального та аортального клапанів, мінімальна мітральна та аортальна недостатність, СН2А, ФКII. При огляді: ліва стопа ціанотична, холодна при пальпації, у нижній третині лівої гомілки по латеральній поверхні знаходиться ділянка сухого некрозу розміром 7 × 12 см (рис. 3); права стопа бліда, прохолодна при пальпації. Шкірна та суглобна чутливість не порушена; активні та пасивні рухи збережені у повному обсязі. Пульс на артеріях лівої ноги не визначається, на артеріях правої ноги — послаблений на стегновій артерії, дистальніше — немає, пульс на артеріях обох верхніх кінцівок — задовільний на всіх рівнях. Систолічний шум вислуховується над лівою сонною артерією, правою клубовою та правою стегновою артеріями.
У результаті ультразвукового обстеження у хворого виявлено оклюзію зовнішньої клубової артерії від устя зліва, колатерально — глибока артерія стегна від устя, поверхнева стегнова артерія — оклюзовані. Виражений кальциноз. Фрагменти підколінної артерії. Дистальніше — кровотік неможливо диференціювати. Справа: критичний стеноз устя глибокої стегнової артерії. Поверхнева стегнова артерія — оклюзія від устя. Фрагменти підколінної артерії. Дистальніше — кровотік неможливо диференціювати.
Хворому виконано клубово-глибокостегнове шунтування зліва експлантатом Bard 8 мм, другим етапом — некректомія, УЗ-кавітація рани лівої гомілки із застосуванням озонованої колагенової суміші та збагаченої факторами росту плазми за вказаною методикою, автодермотрансплантація (див. рис. 4–7).
У результаті лікування відзначено приживлення 100 % автодермотрансплантату. Ішемія лівої нижньої кінцівки регресувала (рис. 8, 9).
/80/80_2.jpg)
Наслідком запропонованої методики виконання некректомії є те, що після видалення некротизованих шарів досягається підготовка поверхні реципієнтної рани для виконання автодермопластики. Наслідком інфільтрації тканин модифікованими біологічними середовищами автоплазми із збагаченою тромбоцитарними факторами росту автоплазмою та озонованим колагеновим гелем є цитопротекція та проліферація фібробластів й ендотеліальних клітин, тобто стимуляція неоангіогенезу та прискорення грануляції, підготування і створення оптимальних умов до приживлення шкіряного автотранспланту і ліквідації ішемічних виразок нижніх кінцівок.
Висновки
1. Озонований колаген є фактором гіпероксидації, місцевої імунокорекції, інгібіції протеаз та дезінфекції.
2. Запропонований спосіб місцевого лікування із використанням модифікованих біологічних середовищ може бути ефективним у лікуванні ішемічних ранових дефектів нижніх кінцівок.
1. Treiman G.S. Management of ischemic heel ulceration and gangrene: an evaluation of factors associated with successful healing / [G.S. Treiman, G.S.C. Oderich, A. Ashrafi, P.A. Schneder] // J. Vasc. Surg. — 2000. — Vol. 31. — P. 1110–1118. doi: 10.1111/j.1365-2966.2010.18055.x
2. Смирнов С.В. Современные методы клеточной терапии при лечении ожогов / [С.В. Смирнов, И.В. Киселев, А.В. Васильев, В.В. Терских] // Хирургия. Журнал им. Н.И. Пирогова. — 2003. — № 12. — С. 252–258.
3. Оболенский В.Н. Применение тромбоцитарных факторов роста и коллагеновых биопрепаратов в лечении больных с хроническими трофическими язвами различной этиологии / В.Н. Оболенский, Д.А. Ермолова // Хирургия. Журнал им. Н.И. Пирогова. — 2012. — № 5. — С. 42–47.
4. Berlanga-Acosta J. Diabetic lower extremity wounds: the rationale for growth factors-based infiltration treatment // Int. Wound. J. — 2011. — Vol. 8, № 6. — P. 612–620. doi: 10.1111/j.1742-481X.2011.00840.x

/78/78.jpg)
/79/79.jpg)
/80/80.jpg)