Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Токсикокинетика ДНОК при применении потенциального антидота МИГУ-2
Авторы: Лукьянчук В.Д., Крылова Е.В., Бабенко М.Н. - Кафедра фармакологии ГУ «Луганский государственный медицинский университет»; Шейман Б.С. - Украинский центр детской токсикологии, интенсивной и эфферентной терапии НДСБ «Охматдет» МЗ Украины, г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье представлены результаты экспериментального исследования эффективности применения антидота МИГУ-2 при отравлении динитроортокрезолом (ДНОК), который используется в промышленности и сельском хозяйстве. На основании сравнительных параметров токсикокинетики и токсикодинамики ДНОК у экспериментальных животных в условиях использования антидота и без него сделан вывод об эффективности и детоксикационных свойствах МИГУ-2.
У статті наведені результати експериментального дослідження ефективності застосування антидоту МІГУ-2 при отруєнні динітроортокрезолом (ДНОК), що використовується у промисловості й сільському господарстві. На підставі порівнянних параметрів токсикокінетики й токсикодинаміки ДНОК в експериментальних тварин в умовах застосування антидоту й без нього зроблено висновок про ефективність і детоксикаційні властивості МІГУ-2.
The article presents the results of experimental study of the effectiveness of MIGU-2 antidote application in poisoning with dinitroorthocresol (DNOC), which is used in industry and agriculture. Based on comparative parameters of toxicokinetics and toxicodynamics of DNOC in experimental animals under conditions of antidote use and without it, we made a conclusion about the efficiency and detoxification properties of MIGU-2.
токсикокинетика, координационное соединение германия, МИГУ-2, динитроортокрезол.
токсикокінетика, координаційна сполука германію, МІГУ-2, динітроортокрезол.
toxicokinetics, germanium coordination compound, MIGU-2, dinitroorthocresol.
Статья опубликована на с. 31-35
Введение
Одной из приоритетных проблем медицины неотложных состояний является изучение механизмов формирования, лечения и предупреждения острой патологии химической этиологии. Многие химические вещества оказывают крайне неблагоприятное воздействие на процессы функционирования организма, вызывая глубокие патологические изменения. К таким веществам относятся, в частности, производные 2,4-динитрофенола (2,4-ДНФ) — динитроортокрезол (ДНОК), который используется в промышленности и сельском хозяйстве [2–5, 8].
Теоретической основой поиска и разработки новых фармакологических средств с антидотными свойствами, используемых при отравлениях ДНОК, послужили сведения о механизме его токсического действия, который заключается в разобщении процессов окислительного фосфорилирования. Кроме того, алкилпроизводные 2,4-ДНФ, являясь выраженными прогипоксантами, одновременно обладают и свойствами прооксидантов [4, 8]. В связи с этим поиск потенциальных средств детоксикации антидотного типа действия целесообразно проводить, с нашей точки зрения, среди оригинальных химических соединений, сочетающих свойства антигипоксантов и антиоксидантов.
Согласно данным литературы [9, 11–18] и результатам собственных исследований [15–17], координационные соединения германия с биолигандами различного химического строения обладают низкой токсичностью, высокой гепатопротекторной, мембранопротекторной и антигипоксантной активностью с уникальными фармакокинетическими характеристиками. Результаты проведенных нами ранее исследований показали, что высокой антидотно-лечебной активностью при ДНОК-интоксикации обладает оригинальное координационное соединение германия с никотинамидом (лабораторный шифр МИГУ-2) [14].
На современном этапе создания новых лекарственных средств необходимым требованием доклинических исследований является определение параметров фармакокинетики потенциальных препаратов, включая антидоты. Вместе с тем в токсикологической практике хемобиокинетические исследования токсического агента служат критерием оценки антидотной эффективности препарата. В этом аспекте результаты токсикокинетических исследований изучаемого токсиканта представляются крайне необходимыми и актуальными.
Вышеизложенное предопределило цель настоящей работы — сравнительное исследование токсикокинетики ДНОК в «норме» и на фоне применения потенциального антидота МИГУ-2.
Материалы и методы исследования
Эксперименты выполнены на белых нелинейных крысах массой 160–200 г обоих полов в полном соответствии с требованиями ГП «Государственный экспертный центр МЗ Украины» [10]. Экспериментальной моделью служил патологический процесс, развивающийся у животных при внутрижелудочном введении 1% водного раствора натриевой соли ДНОК в дозе, соответствующей среднесмертельной (ЛД50).
Все крысы были разделены на 2 группы: первая группа — контрольная, представлена животными, которым вводили ДНОК. Вторая группа — опытная, это животные с ДНОК-интоксикацией, получавшие МИГУ-2 в специально разработанном дозовом режиме (87,34 мг/кг за 48 мин до начала и 112,87 мг/кг через 5 мин после поступления яда в желудок) [14].
Количественное содержание ДНОК в крови определяли через 1, 6, 12 и 24 ч с момента его введения в организм [1].
Расчет токсикокинетических показателей ДНОК проводили с помощью разработанной компьютерной программы [7] в рамках двухчастевой модели с всасыванием с использованием методических приемов [19] на основе функции зависимости концентрации от времени в логарифмических координатах. Учитывая нормальность распределения экспериментальных данных и равность дисперсий, полученные результаты обрабатывали статистически с использованием t-критерия Стьюдента [6].
Рассчитывали следующие параметры: на этапе всасывания — константу скорости всасывания (K01), период полуабсорбции (t1/2,а), максимальную концентрацию препарата (яда) (Cmax) и время ее достижения (tmax); на этапе распределения — объем распределения (Vd), период полураспределения (t1/2), площадь под токсикокинетической кривой (AUC), кажущуюся начальную концентрацию (C0); на этапе элиминации — константу скорости элиминации (Кel), период полуэлиминации (t1/2,el), общий клиренс (ClT), среднее время пребывания яда в организме (MRT).
Результаты и их обсуждение
На основании результатов определения концентрации ДНОК в крови в изучаемой динамике нами была построена кинетическая кривая (рис. 1), которая положена в основу расчета токсикокинетических параметров яда при применении потенциального антидота и без него.
/32/32.jpg)
Известно, что одним из ключевых этапов токсикокинетики ксенобиотиков является процесс их абсорбции из места внесосудистого введения в системный кровоток, от которого в значительной степени зависят скорость, характер и степень развития отравлений. В связи с этим на первом этапе исследования особое внимание уделялось расчету параметров, характеризующих процесс всасывания ДНОК в изучаемых условиях эксперимента (табл. 1).
Характеризуя этап всасывания яда у животных контрольной и опытной групп, следует обратить внимание на константу скорости всасывания (К01) в сравнительном аспекте. Из данных, приведенных в табл. 1, видно, что ДНОК без применения МИГУ-2 быстро поступает в системный кровоток и величина К01 составляет 3,01 ч–1. В то же время на фоне введения МИГУ-2 исследуемый пестицид примерно в 2,5 раза медленнее всасывается в кровь.
Тесно связанный с К01 обратно пропорциональной зависимостью период полуабсорбции характеризует время, необходимое для поступления половины введенной дозы в системный кровоток. Так, если в контроле t1/2,а составляет 0,23 часа, то в опытной группе этот параметр увеличивается в 2,5 раза и составляет 0,57 часа.
Анализ величин Сmax в обеих сравниваемых группах показывает, что у крыс контрольной группы этот параметр имеет сравнительно высокую величину — 73,02 мкг/мл, которая достигается уже через 3 часа от момента поступления яда в организм, что позволяет судить о достаточно малом латентном периоде развития ДНОК-интоксикации. В опытной же группе животных концентрация ДНОК снижается в 1,7 раза в сравнении с животными контрольной группы и составляет 42,4 мкг/л.
Следовательно, выявленные изменения в кинетике ДНОК в сторону замедления процесса всасывания указывают на способность потенциального антидота отдалять и уменьшать реализацию токсикодинамических эффектов ДНОК.
Не менее важным представляется характеристика распределения ДНОК под влиянием МИГУ-2 из центральной камеры в периферические органы и ткани (табл. 2).
Как видно из табл. 2, величина Vd у контрольных животных в 1,4 раза превышает значения, идентифицированные в опытной группе, что свидетельствует о способности МИГУ-2 препятствовать депонированию ДНОК в организме.
Исходя из величины периода полураспределения, процесс поступления яда в периферическую камеру кинетической модели распределения в контроле занимает сравнительно короткий промежуток времени, что является немаловажным фактором, определяющим скорость наступления ДНОК-интоксикации и тяжесть клинических проявлений. Это также подтверждается величиной AUC, которая у животных без применения МИГУ-2 составляет 2535,4 мк·ч·мл–1.
Введение же изучаемого антидота выгодно изменяет процессы перехода токсиканта в периферические камеры, о чем свидетельствует увеличение периода полураспределения ДНОК в 1,7 раза. Кроме того, под влиянием МИГУ-2 в 2,1 раза уменьшается величина AUC и в 1,7 раза — кажущаяся начальная концентрация.
Таким образом, анализ распределения ДНОК из центрального кровотока в периферические камеры демонстрирует, что лечебно-профилактическое введение МИГУ-2 значительно модифицирует характер распределения и депонирования яда, что способствует снижению интенсивности его токсикодинамических эффектов и в конечном итоге уменьшает опасность возникновения ДНОК-интоксикации.
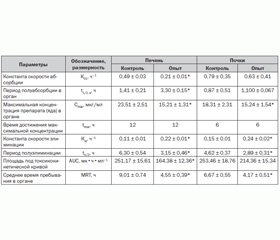
Учитывая центральную роль печени и почек в реализации токсического действия любого ксенобиотика, и ДНОК в том числе, было целесообразно изучить его кинетические процессы именно в этих органах (табл. 3).
Из полученных результатов следует, что ДНОК у животных контрольной группы достаточно интенсивно поступает в печень и почки, о чем свидетельствуют практически все изучаемые токсикокинетичесие параметры.
При применении же МИГУ-2 у крыс в условиях отравления ДНОК происходит значительная модификация всех изучаемых токсикокинетических параметров. Так, в частности, под влиянием МИГУ-2 происходит уменьшение поступления и накопления ДНОК за счет снижения величины Cmax в печени и почках крыс. Также усиливается процесс исчезновения ДНОК из анализируемых органов вследствие практически 2-кратного увеличения в них экскреторно-элиминационных процессов (в 2 и 1,6 раза соответственно). Кроме того, при применении МИГУ-2 уменьшается среднее время пребывания яда в печени и почках с одновременным снижением его депонирования, о чем свидетельствует достоверное изменение площади под токсикокинетической кривой.
Следовательно, одной из составляющих антидотно-лечебной активности МИГУ-2 является его способность уменьшать скорость и количество поступившего яда в жизненно важные органы.
Наиболее важным этапом токсикокинетики является процесс элиминации из центральной камеры кинетической модели распределения (табл. 4).
Как следует из табл. 4, ДНОК имеет период полуэлиминации 27,83 ч–1, что объясняется сравнительно длительной персистенцией яда в организме, в основном за счет липофильных депо в маловаскуляризированных органах и тканях [4]. При этом скорость исчезновения ДНОК из организма без проведения фармакокоррекции довольно низкая, о чем свидетельствуют величины Кel и ClT. Слабая интенсивность процесса элиминации обусловливает длительное (41,31 ч) пребывание ксенобиотика в организме.
В группе животных, леченных МИГУ-2, процессы экскреции и элиминации ДНОК из крови крыс протекают в 1,3 раза интенсивнее, о чем свидетельствует увеличение константы скорости элиминации и, соответственно, уменьшение периода полуэлиминации. Более того, в условиях фармакотерапии МИГУ-2 скорость очищения центрального кровотока от яда увеличивается в 1,33 раза, а среднее время его пребывания в организме сокращается на 9 ч вследствие ускорения его выведения, снижения скорости и степени всасывания в системный кровоток.
Обсуждение полученных результатов
Обобщающий анализ полученных данных показывает, что ДНОК вследствие своей высокой липофильности активно всасывается в организм, где депонируется и длительное время персистирует. Это, вероятно, и является следствием поражения энергозависимых процессов почечной экскреции вследствие разобщения процессов окислительного фосфорилирования, характерного для ДНОК [4, 8]. Применение с лечебно-профилактической целью МИГУ-2 формирует выгодные в плане детоксикации изменения токсикокинетики ДНОК, направленные на снижение его абсорбции в желудочно-кишечном тракте, скорости и степени поступления яда в паренхиматозные органы (печень и почки), а также ускоряет элиминацию яда из биосред.
Таким образом, одним из путей реализации детоксикационного действия МИГУ-2 при острой пероральной ДНОК-интоксикации является модификация всех этапов токсикокинетики яда, что значительно снижает степень его токсического воздействия на организм в целом и на жизненно важные биотрансформационные и экскреторные органы в частности.
1. Буркацкая Е.Н. Лабораторная диагностика интоксикаций пестицидами / Е.Н. Буркацкая, Г.Г. Лысина, В.Н. Карпенков. — М., 1978. — 232 с.
2. Каган Ю.С. Общая токсикология пестицидов. — К.: Здоров’я, 1981. — 176 с.
3. Мельников Н.А. Пестициды: Химия, технология, применение. — М.: Химия, 1987. — 213 с.
4. Лукьянчук В.Д. Молекулярные основы механизма токсического действия и разработка принципов детоксикации динитрофенольных соединений: Автореф. дис… д-ра мед. наук: 14.03.06. — К., 1988. — 42 с.
5. Трахтенберг И.М. Приоритетные аспекты проблем медицинской экологии в Украине (взгляд токсиколога) // Современные проблемы токсикологии. — 1998. — № 1. — С. 5-8.
6. Гланц С. Медико-биологическая статистика / Пер. с англ. — М.: Практика, 1999. — 459 с.
7. Методические рекомендации по компьютерным расчетам фармакокинетических параметров лекарственных средств (линейные частевые модели) / Н.Я. Головенко, В.Д. Лукьянчук, О.В. Жук [и др.]. — К.: Государственный научно-экспертный центр лекарственных средств, 1999. — 70 с.
8. Кравець Д.С. Токсикокінетика динітроортокрезолу в умовах профілактичного застосування силібору з ацетатом альфа-токоферолу: Автореф. дис… канд. мед. наук: 14.03.06. — К., 2001. —20 с.
9. Кресюн В.Й. Сравнительная фармакокинетика новых координационных соединений с биолигандами / В.Й. Кресюн, Е.Ф. Шемонаева, А.Г. Видавская // Вісник психіатрії та психофармакотерапії. — 2002. — № 1. — С. 56-65.
10. Доклинические исследования лекарственных средств: Метод. реком. / Под ред. чл.-корр. АМН Украины А.В. Стефанова. — К., 2002. — 567 с.
11. Шемонаєва К.Ф. Фармакокінетика координаційних сполук германію з біолігандами: Автореф. дис... канд. мед. наук: 14.03.05. — Одеса, 2003. — 20 с.
12. Відавська Г.Г. Фармакокінетика нових біологічно активних речовин на основі оксіетилідендифосфонату германію з нікотиновою кислотою, нікотинамідом і магнієм: Автореф. дис... канд. мед. наук: 14.03.05. — Одеса, 2003. — 19 с.
13. Чадова Л.В. Скринінг і порівняльна оцінка ефективності протиішемічних засобів серед координаційних сполук германію з біолігандами при гострій цереброваскулярній недостатності / Л.В. Чадова, І.Й. Сейфулліна, В.М. Ткаченко // Одеський медичний журнал. — 2005. — № 6. — С. 19-22.
14. Лукьянчук В.Д. Разработка дозового режима германийорганического соединения МИГУ-2 на модели острой пероральной ДНОК-интоксикации / В.Д. Лукьянчук, М.Н. Бабенко, Д.С. Кравец // Современные проблемы токсикологии. — 2005. — № 1. — С. 47-50.
15. Скрининг потенциальных церебропротекторов в ряду новых координационных соединений германия с комплексонами и гидроксикарбоновыми кислотами на модели тотальной ишемии головного мозга / В.Д. Лукьянчук, Е.В. Крылова, И.И. Сейфуллина [и др.] // Журнал экстремальной медицины им. Г.О. Можаева. — 2008. — Т. 9, № 4. — С. 123-126.
16. Особливості біотрансформації нового потенційного церебропротектора ВІТІН-1 у нормі та при церебральному ішемічному інсульті / О.В. Крилова, В.Д. Лук’янчук, В.Г. Ткаченко [та ін.] // Фармакологія та лікарська токсикологія. — 2009. — № 3 (10). — С. 5-20.
17. Спектр розподілення координаційної сполуки германію з пірацетамом в організмі щурів в нормі та за умов ішемії головного мозку / В.Й. Кресюн, В.Д. Лук’янчук, О.В. Крилова [та ін.] // Журнал АМН України. — 2010. — № 1. —С. 149-159.
18. Фармакокінетичний профіль МІГУ-5 в нормі та на моделі ендотоксемії / Лук’янчук В.Д., Лучишин Т.Р., Кравець Д.С. [та ін.] // Журнал АМН України. — 2012. — Т. 18, № 4. — С. 529-535.
19. Лук’янчук В.Д. Введення до загальної фармакокинетики: Навчальний посібник / В.Д. Лук’янчук, Д.С. Кравець. — Луганськ, 2013. — 115 с.

/32/32_2.jpg)
/33/33.jpg)
/34/34.jpg)