Журнал «Медицина неотложных состояний» 4 (59) 2014
Вернуться к номеру
Антидотная терапия в комплексном лечении острого отравления хлорпирифосом
Авторы: Шейман Б.С. - Национальная детская специализированная больница «ОХМАТДЕТ» МЗ Украины, г. Киев; Кривенчук В.Е., Проданчук Н.Г. - ГУ «Научный центр превентивной токсикологии, пищевой и химической безопасности имени академика Л.И. Медведя МЗ Украины»; Волошина Н.А. - Национальный медицинский университет им. А.А. Богомольца, г. Киев; Урин А.А., Сафронова И.А. - Национальная детская специализированная больница «ОХМАТДЕТ» МЗ Украины, г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье приведены результаты исследования эффективности лечения острого отравления хлорпирифосом у ребенка младшей возрастной группы. Исследована эффективность многокомпонентной интенсивной терапии с включением антидотных препаратов. Сделаны выводы относительно эффективности использования схемы антидотной терапии.
У статті наведені результати дослідження ефективності лікування гострого отруєння хлорпірифосом у дитини молодшої вікової групи. Досліджено ефективність багатокомпонентної інтенсивної терапії із включенням антидотних препаратів. Зроблено висновки щодо ефективності використання схеми антидотної терапії.
The article deals with findings of the studies on the efficiency of treatment for acute poisoning with chlorpyrifos in a young child. We studied the efficiency of multicomponent intensive therapy with antidotal drugs. Conclusions about the efficiency of antidote therapy scheme use were made.
отравление хлорпирифосом, интенсивная терапия, антидотная терапия.
отруєння хлорпірифосом, інтенсивна терапія, антидотна терапія.
chlorpyrifos poisoning, intensive care, antidote therapy.
Статья опубликована на с. 73-77
Введение
Широкое распространение в современном быту фосфорорганических соединений (ФОС) (сельскохозяйственные яды, инсектициды и др.) является причиной частых отравлений детей и подростков. ФОС способны проникать в организм пострадавших через слизистые оболочки пищеварительного тракта и неповрежденные кожные покровы. Представителем данной группы является хлорпирифос. Для ФОС характерна гематогепатоэнтеральная циркуляция. Относительный риск смерти у человека при отравлении хлорпирифосом составляет 3,5 (95% ДИ 2,2–5,4). Проспективные когортные исследования (Шри-Ланка, 2002–2004 гг.) позволили установить, что при отравлении хлорпирифосом (439 суицидентов) летальность составила 8 % (39 пациентов). При этом 3 больных из них умерли в первые 6 часов от непосредственного холинергического эффекта хлорпирифоса. Более отсроченные (после первых 5 суток) смертельные исходы отравления хлорпирифосом наступали как следствие осложнений длительной вентиляции или неврологических осложнений (14 случаев; 33,42 %) [4].
По механизму действия ФОС относятся к антихолинэстеразным веществам необратимого действия. Ацетилхолинэстераза, присутствующая в синапсе, разрушает ацетилхолин и тем самым регулирует процессы передачи нервных импульсов с холинергических нервов на другие структуры («исполнительные органы и клетки»). ФОС обладают способностью необратимо ингибировать ацетилхолинэстеразу, образуя прочные ковалентные связи. Таким образом, концентрация ацетилхолина, воздействующего на постсинаптические рецепторы, увеличивается и влияние холинергических нервов усиливается. ФОС оказывают прямое воздействие на холинергические рецепторы сосудистой стенки [2]; обладают цитотоксическими свойствами, обусловленными мембранотоксическим, прооксидантным и фосфорилирующим действиями [1].
Лабораторным маркером отравления ФОС является снижение активности псевдохолинэстеразы сыворотки крови и ацетилхолинэстеразы (АХЭ) эритроцитов более чем на 50 % [3]. Отравления ФОС легкой степени сопровождаются снижением активности холинэстеразы крови до 40–60 % от нормы (патогномоничный клинический признак — незначительное затруднение дыхания, общая слабость, головокружение); средней степени тяжести — 20–40 % (патогномоничный клинический признак — гиперсаливации, бронхорея, нарушение уровня сознания); тяжелой степени — менее 10–20 % (патогномоничным клиническим признаком является острая дыхательная недостаточность (ОДН) центрального и обструктивно-констриктивного типа, кома, возникновение судорог) [2, 3].
Несмотря на информацию об эффективности комплексной интенсивной терапии с использованием антидотов в лечении острой интоксикации ФОС, продемонстрированные авторами результаты, особенно у детей младшей возрастной группы, во многих случаях являются противоречивыми. Поэтому детальное изучение и анализ каждого случая интоксикации ФОС у детей являются актуальной проблемой, решение которой должно способствовать выбору наиболее эффективной тактики лечения.
Цель работы — провести ретроспективный анализ эффективности комплексной терапии ребенка с острым отравлением хлорпирифосом.
Задачи исследования
1. Определить уровни АХЭ на момент госпитализации пациента, а также его динамику в процессе проведения интенсивной и антидотной терапии.
2. Изучить некоторые показатели гомеостаза и их динамику в процессе лечения и провести анализ корреляционной зависимости между ними и уровнем АХЭ.
3. На основании полученных результатов сделать вывод об эффективности антидотной и детоксикационной терапии в лечении острой интоксикации хлорпирифосом.
Материалы и методы исследования
В Украинском центре детской токсикологии, интенсивной и эфферентной терапии НДСБ «Охматдет» в июне 2011 г. на лечении находился пациент Ч. в возрасте 2 лет 1 мес., у которого был установлен диагноз «острое отравление хлорпирифосом тяжелой степени». Из анамнеза заболевания было известно, что ребенок в день госпитализации раскусил ампулу с 50% раствором хлорпирифоса, после чего в короткий промежуток времени у него возникли гиперсаливация, бронхорея, потеря сознания, судороги, нарушение дыхания. При поступлении диагностирована ДН III ст., ССН III ст., кома III ст. На фоне мероприятий замещения и поддержания жизненно важных функций были назначены инфузионная детоксикационная терапия с форсированным диурезом, антидотные препараты. План-схема введения антидотов была следующая: атропин назначен с момента госпитализации в дозе насыщения по 0,8 мл в/в каждые 15 мин до появления признаков переатропинизации; поддерживающая доза — по 0,1 мл в/в каждые 6 часов. Показания к назначению поддерживающей дозы атропина сохранялись у ребенка на протяжении 5 суток от момента госпитализации. Реактиватор холинэстеразы (РХЭ) вводили линеоматом в/в со скоростью 0,4 мл 10% раствора в час. Курс лечения РХЭ составил 13 дней.
Для сбора и последующей обработки результатов исследований была построена база данных в формате Microsoft Excel 2007. Для статистической обработки базы данных было использовано программное обеспечение Statistica for Windows 6.0 (Statsoft Inc., США).
Результаты исследования
Исследование уровня АХЭ в плазме крови. Полученные результаты представлены на рис. 1, 2.
Как следует из представленных данных (рис. 1), при поступлении в стационар уровень АХЭ был снижен на 95 % (278 Ед/л) по сравнению с нормальными величинами (5300–12 900 Ед/л), что соответствовало тяжелой степени отравления хлорпирифосом. Проводимая терапия способствовала динамическому возрастанию уровня АХЭ. При этом темп роста уровня АХЭ в первые 3 суток составил в среднем 23 % от начального значения; в последующие дни — в среднем 157 % в сутки, с нормализацией АХЭ к 13-му дню лечения.
Как следует из представленных на рис. 2 результатов, установлена достоверная позитивная корреляционная зависимость между уровнями АХЭ и пространственно-временными интервалами развития событий (r = +0,98).
Некоторые показатели гомеостаза и их динамика в процессе лечения
Полученные результаты представлены на рис. 3–15.
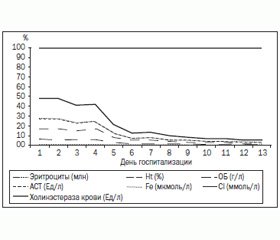
Установлено, что в течение первых 48 часов от момента госпитализации у ребенка наблюдалось снижение на 13 % общего количества эритроцитов по сравнению с их исходным значением. В последующие дни происходила быстрая нормализация с восстановлением их нормального значения на уровне 4,03–4,28 млн (рис. 3).
Установлена достоверная позитивная корреляционная зависимость между количеством эритроцитов в периферической крови и уровнями АХЭ (r = +0,59; рис. 4).
Установлено, что в течение первых 48 часов от момента госпитализации у ребенка наблюдалось снижение на 11 % уровня гематокрита по сравнению с его исходным значением. В последующие дни происходила быстрая нормализация с восстановлением нормального значения гематокрита (Ht) на уровне 31,0–32,90 % (рис. 5).
Установлена достоверная позитивная корреляционная зависимость между показателями гематокрита и уровнями АХЭ (r = +0,56; рис. 6).
Как следует из представленных данных (рис. 7), при поступлении в стационар уровень общего белка крови был несколько снижен по сравнению с нормальными величинами и составил 57 г/л. Через 72 часа от момента госпитализации на фоне проводимой терапии происходила постепенная нормализация уровня общего белка, значения которого составили 59–68 г/л.
Как следует из представленных на рис. 8 результатов, установлена достоверная позитивная корреляционная зависимость между уровнями АХЭ и общего белка (r = +0,88).
Установлено, что в течение первых 96 часов от момента госпитализации у ребенка наблюдалось относительное повышение уровня АСТ (на 22,5–31,0 % по сравнению с нормальными значениями). В последующие дни происходила быстрая нормализация с восстановлением нормального значения АСТ на уровне 23,0–31,0 Ед/л (рис. 9).
Установлена достоверная отрицательная корреляционная зависимость между показателями АСТ и уровнями АХЭ (r = –0,76; рис. 10).
Как следует из представленных данных (рис. 11), при поступлении в стационар уровень сывороточного железа в крови был снижен по сравнению с нормальными величинами (8,95–21,48 мкмоль/л) и составил 5,70 мкмоль/л. В течение 72 часов от момента госпитализации наблюдалось дальнейшее снижение этого показателя до 1,90 мкмоль/л, с последующим медленным восстановлением и его нормализацией к 13-му дню лечения.
Установлена достоверная позитивная корреляционная зависимость между показателями сывороточного железа и уровнями АХЭ (r = +0,70; рис. 12).
Установлено, что в течение первых 72 часов от момента госпитализации у ребенка наблюдалось достоверное повышение в среднем на 300 % уровней лейкоцитарного (ЛИИ; норма 1,6 ± 0,5 ед.) и гематологического (ГИИ; норма 1,6 ± 0,5 ед.) индексов по сравнению с нормальными значениями. В последующие дни происходила быстрая нормализация (рис. 13).
Установлена достоверная отрицательная корреляционная зависимость между показателями ЛИИ, ГИИ и уровнями АХЭ (r = –0,59; рис. 14).
Как следует из представленных данных (рис. 15), графическое отображение логарифмированных лабораторных параметров у ребенка позволяет установить критический период острого отравления хлорпирифосом, который длился в течение 96 часов от момента попадания яда в организм. В последующем на фоне повышения уровня АХЭ происходила нормализация исследуемых показателей, что сопоставлялось с динамикой клинических проявлений у пострадавшего.
На 5-й день было приостановлено введение атропина; на 13-й день лечения — введение РХЭ и атропина. Ребенок выписан в удовлетворительном состоянии на 16-й день от начала госпитализации.
Выводы
1. В соответствии с клинико-лабораторными проявлениями у ребенка при поступлении было диагностировано острое отравление хлорпирифосом тяжелой степени: уровень АХЭ в крови был снижен на 95 % по сравнению с нормальными значениями; в клинической картине превалировали утрата сознания (кома III ст.), судороги, ОДН III ст., ССН III ст., бронхорея, гиперсаливация.
2. Тяжесть клинической картины обусловила назначение антидотных препаратов: атропин в дозе насыщения по 0,8 мл в/в каждые 15 мин до появления признаков переатропинизации, поддерживающая доза — по 0,1 мл в/в каждые 6 часов, курс лечения составил 5 дней. Реактиватор холинэстеразы в/в со скоростью 0,4 мл 10% раствора в час, курс лечения РХЭ составил 13 дней.
3. Наличие и выраженность интоксикационного синдрома (по результатам клинических проявлений и данным ЛИИ, ГИИ) обусловило необходимость на протяжении первых 3 дней проведения метода водной нагрузки с форсированным диурезом.
4. Уровень сывороточного железа в крови достоверно коррелировал с таким АХЭ. При этом установлено его достоверное снижение в первые 48 часов госпитализации с последующей нормализацией к 13-му дню лечения. Полученные результаты требуют дальнейшего осмысления и анализа.
Проведенная терапия позволила на 2-е сутки лечения перевести ребенка с принудительного на вспомогательный режим ИВЛ и на 3-и сутки осуществить дезинтубацию и перевод на самостоятельное дыхание; на 2-е сутки лечения прекратить введение противосудорожных препаратов; на 4-е сутки прекратить водную нагрузку с форсированным диурезом; на 5-е сутки прекратить введение атропина и на 13-е сутки — введение РХ; на 13-е сутки — нормализовать уровень АХЭ.
1. Клиническая токсикология детей и подростков / Под ред. Марковой И.В., Афанасьева В.В., Цыбулькина Э.К., Неженцева М.В. — СПб.: Интермедика, 1998. — 304 с.
2. Лужников Е.А., Костомарова Л.Г. Острые отравления: Руководство для врачей. — 2-е изд., перераб. и доп. — М.: Медицина, 2000. — 434 с.
3. Михов Х. Отравления у детей: Пер. с болг. — М.: Медицина, 1985. — 224 с.
4. Eddleston M., Eyer P., Worek F., Mohamed F., Senarathna L., von Meyer L., Juszczak E., Hittarage A., Azhar S., Dissanayake W., Sheriff M.H., Szinicz L., Dawson A.H., Buckley N.A. Differences between organophosphorus insecticides in human self-poisoning: a prospective cohort study // Lancet. — 2005 Oct 22–28. — 366(9495). — 1452-9.

/74/74.jpg)
/75/75.jpg)
/76/76.jpg)
/77/77.jpg)