Журнал «Медицина неотложных состояний» 5 (60) 2014
Вернуться к номеру
Интраоперационная защита легких при хирургическом лечении больных инфекционным эндокардитом, осложненным развитием дыхательной недостаточности
Авторы: Колтунова А.Б. - ГУ «Национальный институт сердечно-сосудистой хирургии им. Н.М. Амосова НАМН Украины», г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Сохранение функции малого круга кровообращения на период искусственного кровообращения является спорным моментом в протоколах анестезиологического обеспечения кардиохирургических вмешательств. Желательное сохранение кровотока в системе легочной артерии основано на следующих фактах: исходное поражение легких у всех больных инфекционным эндокардитом; питание компонентов микроциркуляторного русла паренхимы легких за счет О2 альвеолярного воздуха; поиск путей удаления активированных нейтрофилов во время искусственного кровообращения для снижения степени повреждения легких. Цель. Оценка эффективности методов интраоперационной защиты легких в условиях различных протоколов анестезиологического ведения при хирургическом лечении больных инфекционным эндокардитом, осложненным развитием дыхательной недостаточности. Материалы. Анализ эффективности методов защиты легких был проведен 151 больному — стандартный (n = 80) и новый (n = 71) протоколы. Модифицированный протокол интраоперационного ведения больных инфекционным эндокардитом отличался от стандартного сохранением вентиляции легких (дыхательный объем 4 мл/кг,
FiO2 0,3, частота дыханий — 4 в 1 мин) и перфузии a.pulmonalis артериальной кровью через боковое ответвление артериальной магистрали без использования дополнительного нагнетающего устройства на период кардиоплегической остановки сердца. Результаты. Продолжительность искусственной вентиляции легких сократилась с 18,4 ± 1,9 ч до 13,5 ± 1,3 ч (р = 0,028). Частота регистрации послеоперационной дыхательной недостаточности снизилась с 6,3 % (2010 г.) до 2,8 % (2012 г.). Выводы. Внедрение методов защиты легких позволило снизить частоту послеоперационной дыхательной недостаточности.
Збереження функції малого кола кровообігу на період штучного кровообігу є суперечливим моментом у протоколах анестезіологічного забезпечення кардіохірургічних втручань. Бажане збереження кровотоку в системі легеневої артерії ґрунтується на таких фактах: вихідне ураження легень у всіх хворих на інфекційний ендокардит; живлення компонентів мікроциркуляторного русла паренхіми легень за рахунок О2 альвеолярного повітря; пошук шляхів видалення активованих нейтрофілів під час штучного кровообігу для зниження ступеня пошкодження легень. Мета. Оцінка ефективності методів інтраопераційного захисту легень в умовах різних протоколів анестезіологічного ведення при хірургічному лікуванні хворих на інфекційний ендокардит, ускладнений розвитком дихальної недостатності. Матеріали. Аналіз ефективності методів захисту легень було проведено в 151 хворого — стандартний (n = 80) та новий (n = 71) протоколи. Модифікований протокол інтраопераційного ведення хворих на інфекційний ендокардит відрізнявся від стандартного збереженням вентиляції легень (дихальний об’єм 4 мл/кг,
FiO2 0,3, частота подихів 4 на 1 хв) і перфузії a.pulmonalis артеріальною кров’ю через бічне відгалуження артеріальної магістралі без використання додаткового нагнітаючого пристрою на період кардіоплегічної зупинки серця. Результати. Тривалість штучної вентиляції легень скоротилася з 18,4 ± 1,9 год до 13,5 ± 1,3 год (р = 0,028).Частота реєстрації післяопераційної дихальної недостатності знизилась із 6,3 % (2010 р.) до 2,8 % (2012 р.). Висновки. Впровадження методів захисту легень дозволило знизити частоту післяопераційної дихальної недостатності.
Saving function of the pulmonary circulation for a period of cardiopulmonary bypass is controversial moment in protocols for anesthetic management of cardiac surgeries. The desirability of maintaining blood flow in the pulmonary artery is based on the following facts: the initial lung lesion in all patients with infective endocarditis; feeding components of microvasculature of the lung parenchyma by O2 alveolar air; finding ways to remove activated neutrophils during cardiopulmonary bypass to reduce the severity of lung injury. Objective. Evaluating the effectiveness of methods for intraoperative lung protection under different protocols of anesthetic management in the surgical treatment of patients with infective endocarditis complicated by respiratory failure. Materials. Analysis of the effectiveness of methods to protect the lungs was performed in 151 patients — standard (n = 80) and new (n = 71) protocols. Modified protocol of intraoperative management of patients with infective endocarditis differed from standard one by preservation of lung ventilation (tidal volume of 4 ml/kg, FiO2 0.3, respiratory rate — 4 per 1 min) and a.pulmonalis perfusion by arterial blood through the arterial side branch line without additional pumping device for the period of cardioplegic cardiac arrest. Results. Duration of mechanical ventilation decreased from 18.4 ± 1.9 h to 13.5 ± 1.3 h (p = 0.028). Recording frequency of postoperative respiratory failure decreased from 6.3 % (2010) to 2.8 % (2012). Conclusions. Introduction of lung protection methods has reduced the frequency of postoperative respiratory failure.
инфекционный эндокардит, дыхательная недостаточно
інфекційний ендокардит, дихальна недостатність, захист легень.
infective endocarditis, respiratory failure, lung protection.
Статья опубликована на с. 96-99
Проблема защиты легких актуальна для больных инфекционным эндокардитом (ИЭ), которые исходно имеют все патогенетические компоненты сепсиса, такие как бактериемия, синдром системного воспалительного ответа (СВО), очаг инфекционной деструкции клапанного или париетального эндокарда. К неблагоприятным факторам, способствующим развитию послеоперационной дыхательной недостаточности, можно отнести: исходное поражение легких при ИЭ, наркоз, торакотомию, проведение искусственной вентиляции легких (ИВЛ), искусственное кровообращение (ИК), реперфузионное повреждение тканей, отсутствие вентиляции и перфузии в системе малого круга кровообращения на период ИК, массивные гемотрансфузии [1–3].
Сохранение функции малого круга на период искусственного кровообращения является спорным моментом в протоколах анестезиологического кардиохирургических вмешательств. Аргументами против сохранения кровотока в системе легочной артерии являются усиление системного воспалительного ответа, неудобство хирургических манипуляций. Желательное сохранение кровотока в системе легочной артерии основывается на следующих фактах: исходное поражение легких у всех больных ИЭ; питание компонентов микроциркуляторного русла паренхимы легких за счет О2 альвеолярного воздуха; поиск путей удаления активированных нейтрофилов во время ИК для снижения степени повреждения легких (использование высокопоточных лейкоцитарных фильтров в контурах АИК). Особую актуальность интраоперационная защита легких (ИЗЛ) приобретает у больных, имеющих исходное повреждение легочной ткани (пневмонии, абсцессы, хронические обструктивные заболевания легких) [4].
В послеоперационном периоде болевой синдром вследствие торакотомии ограничивает подвижность и податливость грудной клетки, уменьшает глубину дыхания, снижает эффективность кашлевых движений. В результате снижается дыхательный объем, задерживается секрет, возникают ателектазы, увеличивается внутрилегочное шунтирование. Отягощающими факторами являются возможное уплотнение секрета в дыхательных путях из-за вентиляции недостаточно увлажненным воздухом, а также накопление экссудата в плевральных полостях с последующей компрессией легких и ограничением вентиляции [5–6].
Перечисленные факторы определяют необходимость разработки и внедрения методов интраоперационной защиты легких при хирургическом лечении больных ИЭ.
Цель: оценка эффективности методов интраоперационной защиты легких в условиях различных протоколов анестезиологического ведения при хирургическом лечении больных ИЭ, осложненным дыхательной недостаточностью (ДН).
Материалы и методы
В НИССХ им Н.М. Амосова НАМН с 01.01.2010 г. по 01.12.2012 г. прошли обследование и хирургическое лечение 694 больных ИЭ. Диагноз ИЭ устанавливался в соответствии с критериями Duke University. Соотношение мужчин и женщин составило 559 (80,5 %) и 135 (19,5 %) соответственно. Средний возраст пациентов — 43,2 ± 13,6 года. Вторичный инфекционный эндокардит выявлен в 540 (73,5 %) случаях. Внутрисердечные абсцессы регистрировались в 60 (8,64 %) случаях. Частота эмболических осложнений составила 178 (25,6 %) случаев. Средняя длительность заболевания ИЭ — 3,4 ± 2,6 мес. (1–7,5 мес.) Различные нозологические формы поражения легких регистрировались у 308 (44,3 %) больных.
Стандартный протокол интраоперационного ведения больных включал: проведение вводной анестезии; искусственную вентиляцию легких (дыхательный объем 7 мл/кг; FiO2 0,7; частота дыханий 10–14 в 1 мин); гепаринизацию пациента (300 Ед/кг); искусственное кровообращение; прекращение ИВЛ на момент кардиоплегической остановки сердца; гипотермию; кардиоплегию; хирургическую коррекцию порока; возобновление сердечной деятельности и ИВЛ (дыхательный объем 3 мл/кг, FiO2 0,3, частота дыханий 4 в 1 мин); согревание больного; профилактику реперфузионных повреждений; остановку аппарата ИК; переход на исходные параметры ИВЛ.
Модифицированный протокол интраоперационного ведения больных ИЭ отличался от стандартного сохранением вентиляции легких (дыхательный объем 4 мл/кг; FiO2 0,3; частота дыханий 4 в 1 мин) и перфузии a.pulmonalis артериальной кровью через боковое ответвление артериальной магистрали без использования дополнительного нагнетающего устройства на период кардиоплегической остановки сердца.
Сравнительный анализ эффективности методов интраоперационной защиты легких был проведен у 151 больного (стандартный протокол — 80 (53,3 %), модифицированный протокол — 71 (46,7 %)). Критериями эффективности применения модифицированного протокола стали индекс оксигенации (PaO2/FiO2), общая длительности ИВЛ, частота регистрации ДН в послеоперационном периоде.
Результаты
Сравнительный анализ основных дооперационных характеристик между группами больных, оперированных в соответствии со стандартным (n = 80) и новым (n = 71) протоколами, показал отсутствие достоверных различий. Тенденция к большим значениям кардиотимического индекса у больных, оперированных в условиях нового протокола, при почти одинаковых значениях конечно-диастолического индекса объясняется нами как преобладание в этой группе пациентов с увеличенными правыми отделами сердца (табл. 1).
Сравнительный анализ длительности ИК и пережатия аорты у больных ИЭ не выявил достоверных различий. При этом пациенты, которые оперировались в условиях стандартного протокола, имели несколько большую длительность пережатия аорты и ИК. Больные, которые оперировались в условиях нового протокола, имели больший объем ультрафильтрата, удаленного во время ИК (табл. 2).
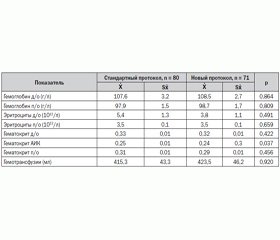
Для исключения влияния гемического фактора на величину индекса оксигенации и длительности ИВЛ в послеоперационном периоде нами был проведен сравнительный анализ показателей гемотрансфузионного статуса исследуемых пациентов, который показал, что больные, оперированные в условиях нового протокола, имели более низкий уровень эритроцитов до операции и более низкий уровень гематокрита во время ИК, однако данные различия недостоверны (табл. 3).
Первоначальный сравнительный анализ динамики показателей индекса оксигенации свидетельствует, что дооперационное значение между группами больных, оперированных в условиях разных протоколов, достоверно не различалось. При этом мы наблюдаем тенденцию к большим значениям индекса оксигенации у больных, оперированных в условиях нового протокола, — 364, 6 ± 20,5 мм рт.ст. по сравнению с 293,3 ± 20,8 мм рт.ст. у больных, оперированных в условиях стандартного протокола. Длительность ИВЛ была достоверно меньше у больных, оперированных в условиях нового протокола (р = 0,028) (табл. 4).
Итогом оценки эффективности предложенного модифицированного протокола интраоперационного ведения больных ИЭ стал анализ частоты регистрации дыхательной недостаточности и летальных исходов, ассоциированных с ДН, проведенный между 2 группами больных. Так, стандартный протокол интраоперационного ведения сопровождался регистрацией 5 (6,3 %) случаев ДН и 1 (1,3 %) летальным исходом, ассоциированным с ДН. При этом в группе больных, оперированных с использованием модифицированного протокола, частота ДН составила 2 (2,8 %) случая без летальных исходов (табл. 5).
Нами был проведен сравнительный анализ тяжести течения случаев ДН в зависимости от видов интраоперационного ведения. Так, при стандартном протоколе у пяти больных с ДН индекс оксигенации в среднем составил 222,2 ± 60,1 мм рт.ст., при этом модифицированный протокол способствовал не только снижению частоты ДН (двое больных), но и тому, что индекс оксигенации после операции в среднем составил 278,9 ± 2,2 (p < 0,05). Также сравнительный анализ длительности вентиляции в случаях ДН при стандартном протоколе был достоверно большим — 56,8 ± 20,1, чем при модифицированном протоколе — 21,6 ± 20,1 мм рт.ст. (р < 0,05).
Выводы
1. Частота регистрации послеоперационной ДН снизилась с 6,3 % (2010 г.) до 2,8 % (2012 г.).
2. Внедрение модифицированного протокола позволило уменьшить тяжесть течения послеоперационной ДН: индекс оксигенации при стандартном протоколе составил 222,2 ± 60,1 мм рт.ст., при модифицированном — 278,9 ± 2,2 мм рт.ст. (p < 0,05).
3. Длительность ИВЛ сократилась с 18,4 ± 1,9 до 13,5 ± 1,3 ч (р = 0,028).
4. Частота летальных исходов, ассоциированных с послеоперационной ДН, снизилась с 1,3 % (2010 г.) до 0 % (2012 г.).
1. Manne M. Outcomes after surgical treatment of native and prosthetic vavle infective endocarditis // Ann. Thorac. Surg. — 2012. — Vol. 93. — P. 489–494.
2. Gelsomino S. Emergency surgery for native mitral valve endocarditis: The impact of septic end cardiogenic shock // Ann. Thorac. Surg. — 2012. — Vol. 93. — P. 1469–1476.
3. Gaga J. et al. Outcomes for Endocarditis Surgery in North America: A Simplified Risk Scoring System and Need for Clinical Innovation // Ann. Thorac. Surg. — 2011. — Vol. 141. — P. 98–106.
4. Meszaros K., Nujic S., Sodeck G.H., Englberger L. Long-term results after operations for active infective endocarditis in native and prosthetic valves // Ann. Thorac. Surg. — 2012. — Vol. 94. — P. 1204–10.
5. Johnson J.A., Boyce T.G., Cetta F., Steckelberg J.M., Johnson J.N. Infective endocarditis in the pediatric patient: a 60-year single-institution review // Mayo Clin. Proc. — 2012. — Vol. 87. — P. 629–35.
6. Максименко В.Б. Кардиоанестезиология. Искусственное кровообращение. Защита миокарда. — К., 2007. — С. 49–85.

/97/97.jpg)
/98/98.jpg)