Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Динаміка рівня соматостатину при хімічному нейролізисі у пацієнтів із колоректальним раком
Авторы: Щур О.І. - Харківська медична академія післядипломної освіти
Рубрики: Медицина неотложных состояний, Онкология
Разделы: Клинические исследования
Версия для печати
У дослідженні проаналізована інтенсивність больового синдрому у пацієнтів із колоректальним раком. Больовий синдром супроводжується викидом гормонів дельта-клітин острівців Лангерганса підшлункової залози, зокрема соматостатину, що виступає медіатором болю. Задачею дослідження було вивчення інтенсивності больового синдрому у хворих із колоректальним раком залежно від гормональної реакції організму та його лікування методом епідурального хімічного нейролізису. При вивченні динаміки соматостатину в перед- і післяопераційному періоді ми проаналізували залежність інтенсивності больового синдрому від кількісної характеристики гормону. Були проаналізовані в післяопераційному періоді стандартне знеболювання наркотичними анальгетиками в I групі пацієнтів і подовжена епідуральна аналгезія з хімічним нейролізисом у II групі пацієнтів дослідження. Так, за допомогою запропонованого нами методу епідурального хімічного нейролізису як ефективного лікування больового синдрому в пацієнтів онкологічного профілю нам вдалося вивчити фізіологічну відповідь організму на біль.
В исследовании проанализирована интенсивность болевого синдрома у пациентов с колоректальным раком. Болевой синдром сопровождается выбросом гормонов дельта-клеток островков Лангерганса поджелудочной железы, в частности соматостатина, который выступает медиатором боли. Задачей исследования было изучение интенсивности болевого синдрома у больных с колоректальным раком в зависимости от гормональной реакции организма и его лечение методом эпидурального химического нейролизиса. При изучении динамики соматостатина в пред- и послеоперационном периоде мы проанализировали зависимость интенсивности болевого синдрома от количественной характеристики гормона. Были проанализированы в послеоперационном периоде стандартное обезболивание наркотическими анальгетиками в I группе пациентов и продленная эпидуральная аналгезия с химическим нейролизисом во II группе пациентов исследования. Так, с помощью предложенного нами метода эпидурального химического нейролизиса как эффективного лечения болевого синдрома у пациентов онкологического профиля нам удалось изучить физиологический ответ организма на боль.
The study analyzed the pain intensity in patients with colorectal cancer. Pain syndrome is accompanied by the release of hormones of delta-cells of islets of Langerhans of pancreas, particularly somatostatin which is a pain mediator. The aim of the study was to examine the pain intensity in patients with colorectal cancer, depending on the hormonal response of the organism and its treatment by epidural chemical neurolysis. When studying the dynamics of somatostatin in the pre- and postoperative period, we estimated the pain intensity depending on the hormone quantitative parameters. There were analyzed postoperative analgesia with standard narcotic analgesic agents in group I patients and continuous epidural analgesia with chemical neurolysis in group II patients in the study. So, using our method of epidural chemical neurolysis as an effective treatment of pain in patients with cancer, we were able to study the physiological response of the organism to pain.
хімічний нейролізис, 30° спирт, соматостатин.
химический нейролизис, 30° спирт, соматостатин.
chemical neurolysis, 30° alcohol, somatostatin.
Статья опубликована на с. 121-124
Вступ
Лікування болю у пацієнтів онкологічного профілю на сьогодні є однією з найважливіших проблем охорони здоров’я в багатьох країнах світу [1]. Пошук оптимальних методів і препаратів для лікування хронічного больового синдрому залишається актуальною проблемою сучасної медицини. Виражений больовий синдром призводить до патологічного стану, при якому порушується здатність організму пристосовуватися до нових умов життєдіяльності. У формуванні адаптивних реакцій, що виникають у відповідь на стресову дію, беруть участь вищі регуляторні центри центральної нервової системи, мобілізуючи симпатичний і вегетативний відділи нервової системи, регулюючи гемоциркуляцію, дихання, травлення, функції сечостатевої системи. Біль викликає активацію нейроендокринної та симпатоадреналової системи, що супроводжується викидом нейромедіаторів, гормонів і біологічно активних речовин, медіаторів болю, серед яких важливе значення має соматостатин. Соматостатин — гормон дельта-клітин острівців Лангерганса підшлункової залози, а також один із гормонів гіпоталамуса. За хімічною будовою є пептидним гормоном. Соматостатин викликає біль навіть у дуже високих розведеннях. Із запальних ексудатів виділяється алгогенний початок, що отримав назву лейкотоксину.
Відповідно, за дослідженням авторів [2, 5], динаміку рівня соматостатину можна вивчати як маркер больового синдрому. Тому дослідження динаміки рівня соматостатину ймовірно відображає стан больової імпульсації у пацієнтів із колоректальним раком.
Задачею дослідження було вивчення інтенсивності больового синдрому у хворих із колоректальним раком залежно від динаміки рівня соматостатину та його лікування методом епідурального хімічного нейролізису (ЕХН).
Матеріали та методи
З метою вирішення поставленої задачі на базі Харківського обласного клінічного онкологічного центру було проведено клінічне дослідження. У ньому брали участь 104 пацієнти. Серед них 43 (41,34 %) чоловіка та 61 (58,65 %) жінка. Середній вік пацієнтів становив 63,3 ± 1,2 року. У всіх пацієнтів при надходженні до стаціонару був наявний хронічний больовий синдром — біль протягом 6 місяців. Наявність колоректального раку III–IV стадії за C.E. Dukes (1956) було визначено гістохімічно. Хворим проведено органозберігаюче оперативне втручання з лімфодисекцією D2-D3. Усі пацієнти були розділені на дві групи дослідження (табл. 1).
Больовий синдром було вивчено перехресним аналізом за методикою візуально-аналогової шкали (ВАШ) [2], шкали якості життя (ШЯЖ) [2] та больового питальника Мак-Гілла [2], і на початкових етапах дослідження він був однаковим (табл. 2).
Із табл. 2. видно, що больовий синдром на початкових етапах дослідження був однаковим в обох групах дослідження. Тобто групи дослідження були рандомізовані за основними факторами больової агресії.
У I (контрольній) групі (n = 49) загальне знеболювання включало стандартні етапи та післяопераційне знеболення відповідно до «Стандартів організації та професійно орієнтованих протоколів надання невідкладної допомоги хворим з хірургічною патологією органів живота та грудної клітки». У ранньому післяопераційному періоді з метою знеболення в цій групі дослідження вводили наркотичні анальгетики. У II (основній) групі (n = 55) дослідження схема знеболювання була доповнена епідуральним хімічним нейролізисом. У післяопераційному періоді наркотичні анальгетики з метою знеболювання не застосовувались.
Пацієнтам I групи з метою аналгезії та анестезії під час операції під внутрішньовенною анестезією зі штучною вентиляцією легень (ШВЛ) у режимі помірної гіпервентиляції, залежно від загального стану, супутньої патології, об’єму операції та показників інтраопераційного моніторингу систем хворих, вводили барбітурати (розчин тіопенталу натрію 1% 3–5 мг/кг), бензодіазепіни (розчин сібазону 0,5% 0,25–1,55 мг/кг), наркотичні анальгетики (розчин фентанілу 0,005% 0,46–0,86 мкг/кг). Об’єм і швидкість інфузії інтраопераційно становили 5–8 мл/кг/год.
Пацієнтам II групи дослідження в операційній після забезпечення центрального венозного доступу під місцевою анестезією проводилася пункція та катетеризація епідурального простору на рівні Th9-Th10. Для катетеризації епідурального простору використовувалися набори Perifix G18 та 0,5% розчин бупівакаїну. Епідуральний катетер заводили каудально на 4 см. Усім пацієнтам проведено оперативне втручання під комбінованою внутрішньовенною анестезією зі ШВЛ у режимі помірної гіпервентиляції та епідуральною анестезією на рівні Th9-Th10. Пацієнтам із метою аналгезії та анестезії під час операції, залежно від загального стану, супутньої патології, об’єму операції та показників інтраопераційного моніторингу систем хворих, вводили барбітурати (розчин тіопенталу натрію 1% 3–5 мг/кг), бензодіазепіни (розчин сібазону 0,5% 0,25–1,55 мг/кг), наркотичні анальгетики (розчин фентанілу 0,005% 0,46–0,52 мкг/кг). Об’єм і швидкість інфузії інтраопераційно становили 5–8 мл/кг/год. В епідуральний катетер вводили 0,5% розчин бупівакаїну 75–150 мг із наступним інтраопераційним введенням. Тривалість анестезіологічного забезпечення в I групі дослідження становила 124,31 ± 21,22 хв, у II групі — 169,52 ± 12,43 хв. Тривалість оперативного лікування у I групі дослідження становила 98,57 ± 13,14 хв, у II групі — 89,54 ± 11,49 хв.
Рівень соматостатину в крові визначали твердофазним імуноферментним методом ELISA (enzyme-linked immunosorbent assay, ТІФА) у сироватці крові. Використовували комерційні набори фірм Human Somatostatin, SS ELISA Kit (USA).
Інтенсивність больового синдрому оцінювалась в передопераційному періоді, на 1-шу, 2-гу, 3-тю, 5-ту, 7-му, 14-ту та на 28-му добу.
У ранньому післяопераційному періоді пацієнтам контрольної групи з метою аналгезії вводили наркотичні анальгетики дозою 0,25–0,35 мкг/кг протягом 7 діб.
Пацієнтам основної групи дослідження протягом першої доби вводився епідурально 0,5% розчин бупівакаїну дозою 30–40 мг за загальноприйнятою методикою. Визначалася зона аналгезії, тривалість дії анестетика. На другу добу через 30 хвилин після введення 40 мг 0,5% розчину бупівакаїну вводився 30° розчин спирту об’ємом 4,71 ± 0,29 мл. Протягом наступних 5 діб оцінювався ефект від проведеного хімічного нейролізису. Протягом цих 5 діб в епідуральний простір вводився 0,5% розчин бупівакаїну дозами: 20 мг із різною кратністю залежно від інтенсивності больового синдрому + ревмоксикам 1% 15 мг внутрішньом’язово; на ніч вводився 0,5% розчин бупівакаїну дозою 30 мг + промедол 2% 10 мг.
Результати та їх обговорення
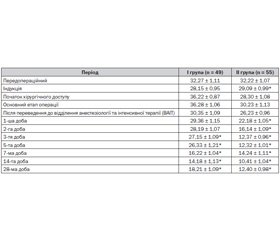
При дослідженні нами була виявлена хвильоподібна динаміка рівня соматостатину (табл. 3).
Передопераційний період характеризувався зростанням рівня соматостатину на 34,45 % (р = 0,000155) у I групі дослідження та на 34,25 % (р = 0,000537) у II групі від нормального значення, підтверджуючи однорідність груп при надходженні до стаціонару. Етап індукції характеризувався зростанням (р = 0,000748) зазначеного показника в I групі на 17,29 % та на 21,2 % (р = 0,00571) у II групі відносно фізіологічних величин. На початку хірургічного доступу ми відмітили, що рівень соматостатину мав негативну динаміку зростання (р = 0,000329): у I групі пацієнтів на 50,91 %, а в II групі — на 16,79 % (р = 0,000466) порівняно з нормальними значеннями. Основний етап операції в I групі відзначався відсутністю динаміки досліджуваного показника, що залишався вище за норму на 51,16 % (р = 0,000843), а в II групі пацієнтів — на 25,95 % (р = 0,000547). При переводі пацієнтів до ВАІТ соматостатин збільшився (р = 0,000974) на 26,45 % у I групі пацієнтів та на 9,29 % (р = 0,000833) у II групі порівняно з фізіологічними значеннями. На 1-шу добу дослідження рівень соматостатину в I групі зростав на 22,33 % (р = 0,000897) щодо фізіологічної норми. У той час як у II групі саме з 1-ї доби раннього післяопераційного періоду рівень соматостатину був зафіксований у межах фізіологічних величин і залишався таким до 28-ї доби дослідження, що визначало використання запропонованої методики ЕХН як ефективну протекцію больового синдрому у пацієнтів із колоректальним раком III–IV стадії. На 2-гу добу раннього післяопераційного періоду зберігалась негативна динаміка зростання рівня соматостатину на 17,45 % (р = 0,00158) у I групі порівняно з нормою. Третя доба характеризувалась відсутністю динаміки досліджуваного показника в I групі. На 5-ту добу рівень соматостатину в I групі пацієнтів перевищував на 9,7 % (р = 0,0088) межу фізіологічної норми, а на 7-му добу — на 9,25 % (р = 0,0049). На 14-ту добу рівень соматостатину почав знижуватися в I групі дослідження до меж фізіологічної норми.
Описана динаміка соматостатину свідчить про його роль у розвитку больового синдрому. Проте при використанні різних методик знеболення ми відмічаємо різницю в групах дослідження за рівнем медіатора вже на початку хірургічного доступу. Під час основного етапу оперативного втручання рівень соматостатину залишався підвищеним в обох групах пацієнтів, що свідчило про фізіологічну реакцію організму на хірургічний стрес. Проте вже з 1-ї доби раннього післяопераційного періоду рівень зазначеного медіатора в II групі знизився до фізіологічних значень і залишався таким упродовж наступних етапів дослідження. У той час як в I групі пацієнтів рівень соматостатину залишався підвищеним упродовж 5 діб раннього післяопераційного періоду та знизився до нормальних значень тільки на 7-му добу дослідження. Даний факт підтверджує ефективність вибраного нами методу епідурального хімічного нейролізису для купірування больового синдрому у пацієнтів із колоректальним раком III–IV стадії.
Висновок
Рівень соматостатину характеризувався хвильоподібною динамікою впродовж основного етапу операції та після переведення пацієнтів до ВАІТ як у I, так і в II групі, що підтверджує роль соматостатину в розвитку больового синдрому. Проте в II групі дослідження вже з 1-ї доби раннього післяопераційного періоду ми помітили позитивну тенденцію до зниження (р = 0,00876) рівня соматостатину, що залишався в межах фізіологічної норми впродовж наступних етапів дослідження. Така динаміка медіатора в основній групі пояснювалась використанням епідурального хімічного нейролізису як ефективного метода протекції больового синдрому у пацієнтів із колоректальним раком III–IV стадії. У той час як у I групі в зазначений період рівень соматостатину залишався підвищеним (р = 0,00658) відносно фізіологічної норми. Рівень соматостатину в цій групі дослідження сягнув значень норми тільки на 7-му добу раннього післяопераційного періоду, що свідчило про больову імпульсацію в I групі дослідження. Вивчення гормонального статусу та біохімічно активних речовин у пацієнтів із колоректальним раком III–IV стадії при больовому синдромі дозволить обрати ефективний метод знеболювання в ранньому післяопераційному періоді.
1. Алексеев В.В. Основные принципы лечения болевых синдромов / В.В. Алексеев // Русский медицинский журнал. — 2011. — № 4. — С. 35-40.
2. Волчков В.А. Болевые синдромы в онкологии и реаниматологии / В.А. Волчков, Ю.Д. Игнатов, В.И. Страшнов. — М., 2006. — 320 с.
3. Исагулян Э. Современные методы лечения хронических болевых синдромов — нейростимуляция / Э. Исагулян, В.А. Шабалов // Боль и ее лечение. — 2010. — № 1. — С. 45-48.
4. Лазебник Л.Б. Хронический болевой синдром: современные подходы к лечению / Л.Б. Лазебник // Здоровье Украины. — 2009. — № 1(1). — С. 18-19.
5. Радчук І.П. Тактика лікування хронічного больового синдрому в онкологічних хворих / І.П. Радчук // Медицина невідкладних станів. — 2008. — № 5(18). — С. 12-17.
6. Лечение болевого синдрома в онкологии / Под ред. д.м.н., проф. И.П. Шлапака и д.м.н. Е. Яроша. — Ровно, 2003. — С. 192.
7. Листровой М. Терапия хронического болевого синдрома в онкологии методом химического нейролизиса // Здоров’я України. — 2004. — № 23–24. — С. 26-27.
8. Bernatsky S. Comorbidity and physician use in fibromyalgia / S. Bernatsky // Swiss. Med. Wkly. — 2009. — № 2. — P. 76-81.
9. Ner J.G. Encapsulation of an intrathecal catheter / J.G. Ner, R. Sabatowski // Pain. — 2010. — Vol. 103, № 1–2. — P. 217-220.
10. Petzke F. Release tramadol for treatment of chronic malignant pain an open multicenter trial / F. Petzke // Support Care Cancer. — 2011. — № 9. — Р. 48-54.
11. Tunks E.R. Epidemiologic Perspective on Chronic Pain Treatment / E.R. Tunks // The Canadian Journal of Psychiatry. — 2008. — № 4. — P. 235-242.

/122/122.jpg)
/123/123.jpg)