Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Кардіотонічні і вазопресорні препарати в практиці лікаря-анестезіолога
Авторы: Гарбар М.О. - Львівський національний медичний університет імені Данила Галицького
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У статті висвітлено класифікацію, механізми дії, показання до застосування в сучасних умовах, переваги та недоліки інотропних засобів двох груп — цАМФ-залежних та цАМФ-незалежних.
В статье освещены классификация, механизмы действия, показания к применению в современных условиях, преимущества и недостатки цАМФ-зависимых и цАМФ-независимых инотропных средств.
The article highlights the classification, mechanisms of action, indications for use under current conditions, the advantages and disadvantages of two groups — cAMP-dependent and cAMP-independent inotropic agents.
цАМФ-залежні інотропи, іАМФ-незалежні інотропи, класифікація, механізм дії, застосування.
цАМФ-зависимые, цАМФ-независимые инотропы, классификация, механизмы действия, применение.
cAMP-dependent inotropics, cAMP-independent inotropes, classification, mechanisms of action, use.
Статья опубликована на с. 187-192
Кардіотонічні і вазопресорні препарати займають провідне місце серед лікарських засобів, що застосовуються для лікування гострої серцевої недостатності та гіпотензії в періопераційний період. Хоча спектр інотропів досить широкий і, окрім адреностимуляторів, включає препарати з різним механізмом дії, найскладнішими для класифікації, щодо способу дії, в тому числі дозозалежного, є, власне, агоністи адренорецепторів.
Для глибшого розуміння як класифікації, так і механізму дії інотропів коротко опишемо принцип скорочення кардіоміоцита і будови симпатичного нервового волокна та функцію адренорецепторів.
Сила скорочення міоцита серця у відповідь на потенціал дії залежить від взаємодії між кальцієм і тропоніном, що, у свою чергу, визначається вмістом кальцію всередині клітини. Надходження кальцію в клітину регулюється внутрішньоклітинним переносником — циклічним аденозин-монофосфатом (цАМФ), що утворюється з молекул АТФ під дією ферменту аденілатциклази. Власне, катехоламіни підвищують активність аденілатциклази і, відповідно, продукцію цАМФ. Деградація цАМФ відбувається під впливом ферментів — внутрішньоклітинних фосфодіестераз, особливо фосфодіестерази ІІІ. Інгібування активності фосфодіестераз зумовлює підвищення вмісту цАМФ і, відповідно, концентрації внутрішньоклітинного кальцію, що посилює скорочення міофібрил [2].
Діяльність внутрішніх органів регулюється двома частинам вегетативної нервової системи — симпатичною та парасимпатичною, що мають протилежну дію. Еферентні нервові шляхи вегетативної нервової системи перериваються у нервових вузлах — гангліях. Відповідно, існують прегангліонарні і постгангліонарні нерви. Прегангліонарні волокна як симпатичної, так і парасимпатичної систем виділяють із своїх закінчень ацетилхолін. Із закінчень постгангліонарних волокон парасимпатичної системи виділяється знову ж таки ацетилхолін, тоді ж як симпатичної — норадреналін і в невеликих кількостях — адреналін. Тому симпатичну нервову систему називають адренергічною. Окрім того, адреналін синтезується мозковим шаром надниркових залоз. Норадреналін та адреналін стимулюють адренорецептори клітин. Виділяють a1- та b2-, b1- та b2-адренорецептори. Ефекти стимуляції різних адренорецепторів наведено в табл. 1 [4].
Окрім того, існують допамінові рецептори — постсинаптичні DА1- і пресинаптичні DА2-рецептори. Стимуляція DА1 призводить до підвищення скоротливості серця, вазодилатації і посилення кровотоку до органів. Вважалось, що особливо зростає нирковий кровотік, унаслідок чого збільшується діурез [4]. Стимуляція DА2-рецепторів гальмує вивільнення норадреналіну, спричиняючи вазодилатацію. Здатність стимулювати допамінові рецептори мають допамін та допексамін.
Класифікація засобів інотропного впливу складна. Їх поділяють на дві основні великі групи — цАМФ-залежні і цАМФ-незалежні.
До першої групи належать три підгрупи:
1. Агоністи адренергічних і допамінергічних рецепторів.
2. Інгібітори фосфодіестерази.
3. Глюкагон.
Серед цАМФ-незалежних виділено чотири підгрупи:
1. Кальцій.
2. Дигоксин.
3. Трийодтиронін.
4. Левосимендан.
Агоністи адренергічних рецепторів (адреностимулятори) мають схожість структури молекули з природним адреналіном. Їх поділяють на агоністи a та bадренорецепторів — як селективні, так і змішані. У табл. 2 подано порівняльну характеристику впливу деяких адреностимулятрів на різні види рецепторів [4].
Отже, одним препаратам притаманний виражений позитивний інотропний ефект, інші мають вазоконстрикторні функції й об’єднуються під назвою «вазопресори».
Окрім того, серед адреностимуляторів виділяють прямі — їх дія зумовлена безпосередньою стимуляцією рецептора органа-мішені (наприклад, адреналін), та непрямі — впливаючи на рецептори, вони стимулюють екзоцитоз (виділення) норадреналіну, який і проявляє свою дію. Перевагою прямих адреностимуляторів є те, що їх дія не залежить від вивільнення ендогенного норадреналіну, що має важливе значення при деяких клінічних ситуаціях (наприклад, при хронічній застійній серцевій недостатності або тривалому застосуванні резерпіну спостерігається так зване виснаження нейрональних запасів норадреналіну) [6].
Також слід відмітити наявність дозозалежного ефекту адреностимуляторів, що чітко вказане у рекомендаціях до застосування. Проте автори підручника A Practical Approach to Cardiac Anesthesia [6] на запитання, чи можна прогнозувати відповідь рецептора на конкретну дозу препарату, відповіли: «Частково». І додали: «Не з усією певністю». Вираженість реакції на введення даного препарату в даній дозі визначається багатьма факторами і може змінюватись залежно від різноманітних клінічних факторів (тканинна перфузія, щільність рецепторів, чутливість рецепторів, ацидоз, гіпоксія, взаємодія медикаментів). Тому важливим є моніторинг інвазивних і неінвазивних показників гемодинаміки.
Біодоступність адреноміметиків залежить від шляху їх введення. Так, при пероральному прийомі вони швидко кон’югуються й окислюються у слизовій оболонці шлунково–кишкового тракту. При підшкірному та внутрішньом’язовому введенні швидкість всмоктування залежить від вираженості судинозвужувальних властивостей, що сповільнює цей процес. У терапевтичних дозах адреноміметики практично не проникають через гематоенцефалічний бар’єр та не викликають центральних ефектів. У системному кровотоку адреноміметики (окрім ізопротеренолу) метаболізуються ферментом моноамін-оксидазою та катехолортометилтрансферазою, які в різних кількостях знаходяться в печінці, нирках, легенях, плазмі крові. Висока активність вказаних ферментів і визначає коротку тривалість дії лікарських засобів цієї групи. Метаболіти адреноміметиків не мають фармакологічної активності, за винятком метаболітів адреналіну (їм притаманна b-адренолітична активність), що й зумовлює швидкий розвиток тахіфілаксії до препарату. Лише незначна кількість введеного b-адреностимулятора виводиться з сечею в незміненому вигляді. У табл. 3 наведено фармакокінетичні й фармакодинамічні характеристики адреностимуляторів [4].
Адреналін. В англомовній літературі застосовується термін «епінефрин». Він є препаратом вибору при проведенні серцево–легеневої реанімації і лікування анафілактичного шоку [8]. Продукується мозковим шаром надниркових залоз. Високоафінний до b1-, b2- та a1-рецепторів гладких м’язів серця та судин. b-адренергічні ефекти епінефрину більш виражені в низьких дозах, а a1-адренергічні — у великих. Є препаратом прямої дії, що є перевагою, оскільки ефект не залежить від вивільнення ендогенного норадреналіну. Йому притаманні позитивний іно-, хроно-, дромо-, батмотропний ефекти, а у великих дозах — також судинозвужувальний [5]. У дозі 1–2 мкг/кг/хв адреналін стимулює в основному aадренорецептори, при більш високих дозах на перший план виходять ефекти активації a-адренорецепторів. У всіх дозах посилює скоротливість серця і ЧСС, при цьому системний судинний опір може знижуватись, залишатись незмінним чи різко підвищуватись (дозозалежно). Комбінування з вазодилататорами (наприклад, нітропрусидом чи фентоламіном) протидіє ефекту вазоконстрикції, зберігаючи позитивний інотропний ефект. Знизити дозу адреналіну дозволяє поєднання із мілриноном, що ефективно при веденні кардіохірургічних пацієнтів [6]. Адреналін збагачує коронарний кровотік унаслідок збільшення відносної тривалості діастоли при високій ЧСС, а також унаслідок стимулювання кардіоміоцитів виділяються локальні вазодилататори, що потужно збалансовують пряму a1-медійовану коронароконстрикцію. До основних недоліків адреналіну належать здатність викликати тахікардію, шлуночкові аритмії, фібриляцію шлуночків, ішемію міокарда, раптову серцеву смерть, гостру гіпертензію з розвитком цереброваскулярних крововиливів [9]. Цікавим є механізм прямого кардіотоксичного впливу адреналіну: при тривалому застосуванні високих доз препарат пошкоджує стінки артерій, спричиняючи локальні некрози пучків кардіоміоцитів.
При проведенні серцево-легеневої реанімації препарат застосовується болюсно внутрішньовенно в дозі 1 мг кожні 3–5 хв. При анафілаксії пацієнтам із симптомами шоку, набряком дихальних шляхів або зі значним порушенням дихання рекомендоване внутрішньом’язове введення 0,5 мл у розведенні 1 : 1000 з наступним введенням ще 0,5 мл через 5 хв за відсутності ефекту. У деяких випадках слід повторювати введення препарату в зазначеній дозі, особливо при тимчасовому покращенні стану. Внутрішньом’язове введення адреналіну визнане дуже безпечним, небажані симптоми виникають рідко. При анафілаксії адреналін, як агоніст aрецепторів, викликає звуження периферичних судин та зменшує набряк, як агоніст bрецепторів, розширює бронхи, покращує скоротливість міокарда та зменшує виділення гістаміну та лейкотрієнів. Внутрішньовенне краплинне введення адреналіну (у розведенні 1 : 10 000) асоціюється з високим ризиком і рекомендоване для пацієнтів із тяжким, небезпечним для життя шоком або в особливих ситуаціях (наприклад, під час загального наркозу). Подальше 10-кратне розведення та отримання розчину 1 : 100 000 дає можливість більш оптимально дозувати препарат, зменшуючи ризик появи побічних ефектів. При цьому способі введення адреналіну необхідно проводити ЕКГ-монітринг. У деяких випадках ймовірна інфузія адреналіну впродовж кількох годин. Під’язиковий метод введення адреналіну є застарілим і більше не рекомендується [8].
Норадреналін (норепінефрин) — основний фізіологічний постгангліонарний нейротрансмітер, також синтезується мозковим шаром надниркових залоз і нейронами ЦНС. Перевагами є пряма дія, здатність перерозподіляти кровотік до головного мозку та серця (оскільки викликає вазоконстрикцію всіх інших судинних секторів). Стимулює як a1-, так і a2-адренорецептори, тому ефективний за відсутності реакції на фенілефрин (лише a1-агоніст). Серед його функцій — підвищення загального периферичного опору судин (ЗПОС) й артеріального тиску. Як правило, не збільшує хвилинного об’єму серця. Ймовірне рефлекторне зростання ЧСС у відповідь на введення норадреналіну (рефлекс із барорецепторів). Показаннями до застосування є низький ЗПОС, наприклад при септичному шоку, вазоплегія після штучного кровообігу. Дозу препарату підбирають з урахуванням клінічного ефекту. Норадреналін вводять у дозі 0,1 мкг/кг внутрішньовенно струминно чи у вигляді тривалої інфузії в дозі 20 мкг/хв. Розчин для інфузії повинен містити 4 мг норадреналіну в 500 мл 5% глюкози (8 мкг/мл) [1, 3].
Допамін є попередником норадреналіну. Вважалось, що в дозі 2–4 мкг/кг/хв (так звана ниркова доза) відбувається активація переважно DA1-рецепторів, що клінічно проявляється посиленням ниркового кровотоку [3, 5]. Проте в останні роки цей ефект піддають сумнівам: при порівнянні низьких доз допаміну з плацебо у пацієнтів у критичних станах не спостерігалось різниці ні у функції нирок, ні у виживанні, тому застосування допаміну в низьких дозах більше не рекомендують [1]. При застосуванні більш високих доз активуються b1- і aрецептори (при цьому переважають позитивні інотропні ефекти), а в дозі понад 7,5 мкг/кг/хв превалюють ефекти, пов’язані з активацією aадренорецепторів, що супроводжується вазоконстрикцією. У великих дозах (понад 10 мкг/кг/хв) допамін спричинює тахікардію, що обмежує його застосування, особливо у пацієнтів з ІХС. Встановлено, що допамін викликає більш виражену тахікардію порівняно з епінефрином у дозах, що призводять до одного й того самого інотропного ефекту [4].
Перевагою препарату є його здатність перерозподіляти кровотік із скелетних м’язів до нирок та внутрішніх органів, а також легкість контролю АТ завдяки комбінації ізотропного та вазоконстикторного ефектів. До важливих недоліків належить наявність значного компонента непрямої дії (ефективність зменшується при виснаженні запасів ендогенного норадреналіну), здатність при високих дозах викликати вазоконстрикцію, що переважає ефект ниркової вазодилатації і може спричинити некроз нирок (тому обов’язковим є моніторинг діурезу). Окрім того, допамін може негативно впливати на спланхнічний кровотік і перфузію слизової шлунка [1].
Добутамін — синтетичний катехоламін. Прямий b1-агоніст, з чим пов’язаний прямий інотропний ефект. М’яко впливає на b2-адренорецептори, розширяючи периферичні судини і спричиняючи зменшення постнавантаження та тиск наповнення ЛШ (внаслідок цього не має негативного впливу на баланс кисню в міокарді).
До переваг належать здатність менш виражено, ніж еквівалентні дози допаміну, викликати тахікардію, знижувати постнавантаження (що є важливим при СН), м’яко посилювати нирковий кровотік. Недоліком є те, що препарат має інотропну активність, проте не має вазопресорної дії. Тому може призводити до розвитку гіпотензії і тахікардії (в основному на фоні гіповолемії) та перерозподілу крові з внутрішніх органів до скелетних м’язів [5]. Спостерігались випадки тахіфілаксії до препарату при інфузії понад 72 год. Показаннями до застосування є стани, що супроводжуються зниженням серцевого викиду (гостра лівошлуночкова недостатність, кардіогенний шок), особливо з підвищеним периферичним опором судин та опором судин легень. Типова доза — 2–15 мкг/кг/хв [3, 5].
Допексамін є синтетичним аналогом добутаміну вазодилатуючої дії. Терапевтичні ефекти схожі на такі при комбінації добутаміну з допаміном (у ниркових дозах). Цікаво, що допексамін не зареєстрований для реалізації у США [7].
Ефедрин — рослинний алкалоїд із симпатоміметичними властивостями. Практично ідеальний препарат для корекції відносної гіповолемії й низького системного судинного опору при функціональній симпатектомії, спровокованій спінальною або епідуральною анестезією. Практично не викликає вазоконстрикції в системі матково-плацентарного кровообігу, через що протягом десятиліть є найбільш популярним вазопресором в акушерстві серед анестезіологів Британії. До недоліків, які обмежують застосування ефедрину, належать ризик тахіфілаксії при повторному введенні, ймовірність розвитку ектопій і тахіаритмії, здатність проникати через плацентарний бар’єр і стимулювати bрецептори плода, підвищуючи споживання кисню і утворення лактату (що призводить до падіння рН у пупковій артерії) [7].
Фенілефрин (мезатон) — селективний a1-агоніст, спричиняє вазоконстрикцію, в основному артеріальну, мінімально — венозну. До переваг належать здатність покращувати перфузійний тиск судин головного мозку, нирок і серця при станах із низьким системним судинним опором; покращувати коронарний перфузійний тиск без посилення скоротливості міокарда при гіпотонії (якщо при цьому уникати гіпертензії). Також корисний для корекції артеріальної гіпотензії у пацієнтів з ішемічною хворобою серця, гіпертрофічним субаортальним стенозом або стенозом аортального клапана. Позитивно зарекомендував себе в практиці анестезіолога в акушерстві, оскільки легко коригує АТ, покращуючи при цьому матково-плацентарну перфузію [7]. Препарат легко титрувати, оскільки дія настає швидко (1–2 хв) і є короткочасною (5 хв після болюсного введення) [4, 7]. Внутрішньовенне струминне введення 50–100 мкг фенілефрину (0,5–1 мкг/кг) швидко усуває артеріальну гіпотонію, спричинену вазодилатацією (наприклад, при спинномозковій анестезії). Безперервна інфузія в дозі 0,25–1 мкг/кг/хв дозволяє тривало підтримувати АТ (правда, знижуючи нирковий кровотік) [4].
До недоліків застосування фенілефрину належать ризик виникнення рефлекторної брадикардії (зменшується при комбінації з ефедрином), ймовірність зниження ударного об’єму (внаслідок зростання постнавантаження), зростання легеневого судинного опору, зниження ренальної й мезентеріальної перфузії. У поодиноких випадках препарат може викликати коронароспазм чи спазм шунта із внутрішньої грудної, променевої або шлунково-сальникової артерії [6].
У наступній частині подамо короткі дані про інші групи препаратів позитивної інотропної дії. Якщо повернутись до класифікації, наведеної на початку статті, то до цАМФ-залежних засобів належать ще інгібітори фосфодіестерази (інамринон та мілринон) і глюкагон.
Інамринон пригнічує активність цАМФ-фосфодіестерази і викликає зростання вмісту цАМФ в кардіоміоцитах (позитивна інотропна дія) та гладком’язових клітинах судин (вазодилатація). До особливих властивостей інамринону належать здатність зменшувати тиск у лівому передсерді й опір легеневих судин. Показанням до його застосування є синдром низького серцевого викиду, особливо при підвищеному кінцево-діастолічному тиску в лівому шлуночку, легеневій гіпертензії і правошлуночковій недостатності. Також препарат можна застосовувати як засіб тимчасової терапії перед трансплантацією серця. Серед негативних властивостей є здатність викликати тромбоцитопенію (при тривалому застосуванні — понад 24 год), артеріальну гіпотонію (легко коригується внутрішньовенним введенням рідини і aагоністів).
Мілринон — потужний інотроп із вазодилатуючими властивостями. Перевагою є позитивний вплив на співвідношення «доставка/потреба міокарда в кисні» внаслідок зниження перед- і післянавантаження за відсутності вираженої тахікардії.
Глюкагон — поліпептид із гормональною активністю, продукується підшлунковою залозою. Підвищує вміст внутрішньоклітинного цАМФ. Глюкагон посилює скоротливість, покращує атріовентрикулярну провідність, збільшує ЧСС і серцевий викид. Перевагою є наявність позитивної інотропної дії навіть за наявності bблокади. Недоліки — виникнення нудоти та блювоти, розвиток тахікардії, гіперглікемії і гіпокаліємії. Ймовірна анафілактична реакція. Глюкагон рекомендований при передозуванні bблокаторів, рефрактерній застійній серцевій недостатності, симптоматичній брадикардії, якщо потенційною її причиною є застосування b-адреноблокаторів чи інгібіторів кальцієвих каналів. У дозі 1–2 мг кожні 5 хв внутрішньом’язово або внутрішньовенно може бути ефективним у пацієнтів з анафілактичною реакцією, які не реагують на введення адреналіну, особливо, якщо вони лікуються b-адреноблокаторами [8].
До препаратів, інотропна дія яких не залежить від цАМФ, належать кальцій, дигоксин, трийодтиронін і левосимендан.
Кальцій — фізіологічно активний лише у вільно іонізованому стані (іони кальцію — Са2+). У нормі близько 50 % плазматичного кальцію зв’язано з білками та аніонами, інші 50 % існують у стані вільних іонів. На вміст іонізованого кальцію в плазмі впливають алкалоз (знижує концентрацію), ацидоз (підвищує її), цитрат та альбумін — зв’язують Са2+. Кальцій не змінює або знижує ЧСС (за рахунок вагусних впливів), підвищує скоротливість міокарда та системний судинний опір, не впливає на переднавантаження [2, 4]. У минулому препарат застосовувався для лікування асистолії та електромеханічної недостатності, незважаючи на відсутність даних, які б підтверджували його ефективність в цих випадках. Показаннями до застосування кальцію є інтраопераційна гіпотензія внаслідок зниження скоротливості міокарда при гіпокальціємії, передозуванні галогенвмісних анестетиків. Немає необхідності застосовувати препарат всім пацієнтам наприкінці періоду штучного кровообігу, оскільки при реперфузії міокарда це може мати негативний результат [6].
Дигоксин — пригнічує вбудований у мембрану кардіоміоцита білок Na,K-АТФазу, що призводить до накопичення Na+ у середині клітини, а це, у свою чергу, веде до зростання концентрації іонів внутрішньоклітинного кальцію. Внаслідок цього з кожним скороченням серця відбувається виділення великої кількості Са2+ з саркоплазматичної сітки в цитоплазму кардіоміоцитів. Таким чином, зростає скоротливість міокарда. Сповільнення атріовентрикулярної провідності часто відбувається при застосуванні паратоксичних доз препарату. Дигіталісна інтоксикація може спровокувати розвиток життєзагрозливих порушень ритму серця. Основними показаннями до застосування дигоксину є надшлуночкова тахікардія та хронічна серцева недостатність [2, 4]. Наголосимо, що короткодіючі серцеві глікозиди неефективні при гострій серцевій недостатності. У сучасних умовах дигоксин не застосовується в інтенсивній терапії при гострих критичних станах.
Трийодтиронін (Т3) — активна форма гормону щитоподібної залози. Має позитивні інотропний і люзіотропний (покращує релаксацію міокарда) ефекти. Згідно з деякими публікаціями, екзогенне введення Т3 дозволяє від’єднати від апарата штучного кровообігу пацієнтів, яких би не вдалось від’єднати при застосуванні стандартних методів терапії. Застосування Т3 у критичних пацієнтів доцільніше, ніж Т4, у зв’язку зі зниженою здатністю перетворювати Т4 у Т3 [3, 5].
Левосимендан — може стабілізувати індуковані іонами кальцію зміни конформації тропоніну С, інгібує фосфодіестеразу ІІІ типу, наслідком чого є зростання ЧСС, серцевого викиду, зменшення системного судинного опору. Препарат не підвищує концентрації внутрішньоклітинного Са2+. Показанням до застосування є низький серцевий викид, недоліком — недостатня клінічна база застосування, також невідома відносна активність порівняно з іншими препаратами. Тому може застосовуватись лише стаціонарно як альтернатива добутаміну [3, 4].
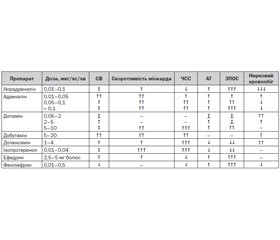
У табл. 4 наведено узагальнену інформацію про ефекти адреностимуляторів залежно від застосованої дози [4].
Висновок
В арсеналі анестезіолога наявний широкий спектр препаратів для корекції порушених показників гемодинаміки й підтримки перфузії органів. Ці засоби мають багатогранні механізми впливу, й часто їм притаманні специфічні ефекти, нюанси, що можуть бути корисними в найрізноманітніших клінічних ситуаціях. Принципова мета використання інотропних та вазоактивних препаратів — покращити баланс між доставкою кисню до органів та потребою в кисні. Принципово неправильно вважати, що інотропи і вазопресори використовуються для підвищення артеріального тиску. У кожній клінічній ситуації анестезіолог повинен визначити, який механізм домінує в порушенні гемодинаміки: дефіцит скоротливості міокарда, зміна тонусу судин чи гіпо- або гіперволемія, і на основі цього вибрати інотропний препарат або вазопресор у відповідній дозі.
1. Бараш П. Клиническая анестезиология / П. Бараш, Б. Куллен, Р. Стэлтинг. — М.: Медицинская литература, 2010. — 720 с.
2. Лилли С. Патофизиология заболеваний сердечно-сосудистой системы / С. Леонард Лилли; перевод под. ред. Д.М. Аронова. — М.: Бином, 2007. — 598 с.
3. Морган Дж. Клиническая анестезиология / Дж. Эдвард Морган, Мэгид С. Михаил. — М.: БИНОМ, 2005. — 389 с.
4. Рациональная фармакоанестезиология / Под ред. А.А. Бунятяна, В.М. Мизикова. — М.: Литература, 2006. — 795 с.
5. Ревер Н. Атлас по анестезиологии / Н. Ревер, Х. Тиль. — М.: МЕДпресс-информ, 2009. — 391 с.
6. Хенсли Ф.А. Практическая кардиоанестезиология / Фредерик А. Хенсли, Дональд Е. Мартин, Гленн П. Гревл. — М.: МИА, 2008. — 1102 с.
7. Cliburn Р. Obstetric Anaestesia / Paul Cliburn, Rachel Collis, Sarah Harries, Stuart Davies. — Oxford university press, 2012. — 682 p.
8. Nolana Jerry P. European Resuscitation Council. Guidelines for Resuscitation 2010 / Jerry P. Nolana, Jasmeet Soarb, David A. Zidemanc, Dominique Biarentd et al. // Resuscitation. — 2010. — № 81. — Р. 1219–1276.
9. Overgaard B.Ch. Inotropes and vasopressors: review of physiology and clinical use in cardiovascular disease / Ch.B. Overgaard, V. Dzavik // Circulation. — 2008. — № 118. — Р. 1047–1056.

/188/188.jpg)
/189/189.jpg)
/192/192.jpg)