Журнал «Медицина неотложных состояний» 7 (62) 2014
Вернуться к номеру
Особенности мозгового кровотока при анестезиологическом обеспечении пациентов пожилого и старческого возраста
Авторы: Лоскутов О.А., Дружина А.Н. - ГУ «Институт сердца» МЗ Украины; Кафедра анестезиологии и интенсивной терапии НМАПО имени П.Л. Шупика; Судакевич С.Н. - ГУ «Институт сердца» МЗ Украины; Шлапак И.П. - Кафедра анестезиологии и интенсивной терапии НМАПО имени П.Л. Шупика; Тодуров Б.М. - ГУ «Институт сердца» МЗ Украины; Дынник О.Б. - ГУ «Медицинский центр телемедицины МЗ Украины»; Ковалевская О.А. - ГУ «Медицинский центр хирургии эндокринных органов МЗ Украины», г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Работа посвящена изучению динамики мозгового кровотока в бассейне средней мозговой артерии при операциях с искусственным кровообращением у пациентов пожилого и старческого возраста и выявлению факторов, влияющих на его скоростные параметры.
В исследование вошли 27 пациентов в возрасте 69,3 ± 4,5 года, которым было выполнено аортокоронарное шунтирование в условиях искусственного кровообращения.
В ходе работы установлено, что в исследуемой группе исходные показатели мозгового кровотока были на 53,9 ± 0,6 % меньше в сравнении с общепринятыми значениями нормы для данной категории больных.
Снижение объемных скоростей церебрального кровотока (на 46,7 ± 2,5 % относительно исходной величины) отмечалось на этапе индукции в анестезию и на этапе подключения аппарата искусственного кровообращения и начала гипотермии (на 64,2 ± 3,9 % от первоначальных значений).
В ходе перфузии при ламинарном и пульсирующем режимах искусственного кровообращения не наблюдалось достоверной разницы в показателях средней линейной скорости кровотока в бассейне среднемозговой артерии. На величину церебральной перфузии достоверно влияла производительность аппарата искусственного кровообращения.
Робота присвячена вивченню динаміки мозкового кровотоку в басейні середньої мозкової артерії при операціях зі штучним кровообігом у пацієнтів літнього та старечого віку та виявленню факторів, що впливають на його швидкісні параметри.
У дослідження ввійшли 27 пацієнтів віком 69,3 ± 4,5 року, яким було виконано аортокоронарне шунтування в умовах штучного кровообігу.
Під час роботи встановлено, що в досліджуваній групі вихідні показники мозкового кровотоку були на 53,9 ± 0,6 % меншими порівняно із загальноприйнятими значеннями норми для даної категорії хворих.
Зниження об’ємних швидкостей церебрального кровотоку (на 46,7 ± 2,5 % порівняно з початковою величиною) відзначалося на етапі індукції в анестезію й на етапі підключення апарата штучного кровообігу й початку гіпотермії (на 64,2 ± 3,9 % від початкових значень).
Під час перфузії при ламінарному й пульсуючому режимах штучного кровообігу не спостерігалося вірогідної різниці в показниках середньої лінійної швидкості кровотоку в басейні середньомозкової артерії. На величину церебральної перфузії вірогідно впливала продуктивність апарата штучного кровообігу.
This work deals with the studying the cerebral blood flow dynamics in the middle cerebral artery area during operations with extracorporeal circulation in elderly and senile patients and identifying factors influencing its velocity parameters.
The study included 27 patients aged 69.3 ± 4.5 years, who underwent coronary artery bypass grafting with cardiopulmonary bypass.
The work revealed that in the study group baseline cerebral blood flow parameters were by 53.9 ± 0.6 % lower in comparison with the standard values of the norm for this category of patients.
Reduction of volume velocity of cerebral blood flow (by 46.7 ± 2.5 % relative to the baseline value) was noted at the stage of induction of anesthesia and at the stage of heart-lung machine connection and the beginning of hypothermia (by 64.2 ± 3.9 % of the initial values).
During perfusion with laminar and pulsed modes of cardiopulmonary bypass, significant difference in terms of the average linear velocity of blood flow in the middle cerebral artery circulation was not observed. The magnitude of cerebral perfusion was significantly influenced by the performance of heart-lung machine.
аортокоронарное шунтирование, искусственное кровообращение, пожилой и старческий возраст, мозговой кровоток.
аортокоронарне шунтування, штучний кровообіг, літній та старечий вік, мозковий кровотік.
coronary artery bypass surgery, cardiopulmonary bypass, elderly and senile age, cerebral blood flow.
Статья опубликована на с. 71-76
Введение
Повреждение головного мозга занимает одно из первых мест в списке послеоперационных осложнений при выполнении кардиохирургических операций и проявляется, как правило, в виде спектра нарушений, включающих ишемический инсульт, делирий и когнитивную дисфункцию [1].
Ишемический инсульт (в результате воздушной или материальной эмболии либо гипоперфузии) представляет собой наиболее отчетливое клиническое проявление неврологического повреждения центральной нервной системы (ЦНС) и выявляется у 1–3 % пациентов, прооперированных с искусственным кровообращением (ИК) [1, 2].
Послеоперационный делирий — одно из часто встречающихся осложнений, особенно среди пациентов пожилого возраста. В общей хирургии данное патологическое состояние выявляется с частотой 10–18 %, в ортопедотравматологической практике оно наблюдается в 13–41 % случаев, а при операциях на открытом сердце частота его регистрации может достигать 44,31 % [3, 4]. Делирий увеличивает продолжительность пребывания в стационаре от 5 до 10 дней [5], что, по данным D.L. Leslie и соавт., влечет за собой увеличение расходов на лечение одного пациента в среднем на $16 000 [6]. К тому же в 35–40 % случаев делирий является причиной летальных исходов в течение первого года после хирургического вмешательства [7].
Когнитивная дисфункция является наиболее распространенным послеоперационным неврологическим осложнением в кардиохирургии, которое выявляется у 30–65 % пациентов в течение 1 мес. после реваскуляризации миокарда и у 20–40 % обследованных в течение последующих пяти послеоперационных месяцев [8]. Данное понятие включает когнитивные расстройства, развивающиеся в раннем и сохраняющиеся в позднем послеоперационном периоде, которые клинически проявляются нарушениями памяти и других высших корковых функций (мышление, речь), а также трудностями концентрации внимания, что подтверждается данными нейропсихологического тестирования (снижение показателей тестирования в послеоперационном периоде не менее чем на 10 % по сравнению с дооперационным уровнем) [9]. При этом следует особо отметить, что нарушения когнитивных функций после общехирургических вмешательств, выполненных в условиях общей анестезии, наблюдаются во всех возрастных группах больных [10].
Вполне очевидно, что для профилактики интраоперационных нарушений со стороны ЦНС первостепенное значение имеет поддержание адекватного мозгового кровотока. Данное положение обусловлено тем, что нервная ткань не имеет собственных энергетических запасов, а также не располагает достаточными возможностями энергообеспечения путем анаэробного гликолиза. Ее функциональная деятельность зависит от доставки кислорода и глюкозы системой кровообращения. Это основная причина того, что мозг может «переживать» лишь очень короткий период гипоперфузии, после чего происходят необратимые повреждения нейронов [11].
Поддержание адекватной перфузии головного мозга приобретает особую актуальность при проведении анестезиологического обеспечения операций у возрастных пациентов. Как указывает в своих работах ряд авторов [12, 13], с возрастом, при присоединении атеросклеротического поражения сосудов и артериальной гипертензии (АГ), происходит уменьшение показателей церебральной гемодинамики и снижение ауторегуляторных возможностей мозгового кровотока, что способствует нарушению сосудистых реакций, делая их инертными и торпидными. На этом фоне возникает относительная циркуляторная гипоксия, что в неблагоприятных условиях может привести к срыву ауторегуляции кровообращения мозга и расстройству метаболизма [12, 13].
Целью данной работы являлось изучение динамики мозгового кровотока в бассейне средней мозговой артерии (СМА) при операциях с искусственным кровообращением у пациентов пожилого и старческого возраста и выявление факторов, влияющих на его скоростные параметры.
Материалы и методы
В исследование было включено 27 пациентов с ишемической болезнью сердца (ИБС), которым на базе ГУ «Институт сердца» была выполнена операция аортокоронарного шунтирования с наложением 2–3 коронарно-венозных анастомозов в условиях ИК. Среднее количество коронарно-венозных анастомозов — 2,4 ± 0,3.
Средний возраст обследованных составлял 69,3 ± 4,5 года, средний вес — 82,5 ± 7,4 кг. Мужчин было 22 человека (81,5 %), женщин — 5 (18,5 %).
В зависимости от функционального класса (ФК) стенокардии все пациенты распределились следующим образом: II ФК — 5 человек (18,5 %), III ФК — 16 человек (59,3 %), IV ФК — 6 человек (22,2 %).
Один инфаркт миокарда (ИМ) в прошлом перенесли 17 (63 %) пациентов, два ИМ — 4 (14,8 %) больных. У 6 (22,2 %) обследованных ИБС протекала без ИМ в анамнезе.
Фракция выброса левого желудочка (ФВ) выше 40 % была зарегистрирована у 21 (77,8 %) больного, ниже 40 % — у 6 (22,2 %).
При дуплексном сканировании магистральных сосудов шеи на дооперационном этапе у всех пациентов из группы обследования гемодинамически значимых стенозов в области общей сонной или внутренней сонной артерии выявлено не было.
Сахарный диабет 2-го типа определялся у 8 человек (29,6 %), артериальная гипертензия была зарегистрирована у 21 обследованного (77,8 %).
Все пациенты оперировались в условиях общей анестезии на основе севофлурана (1,5–2 МАК). Вводный наркоз включал в себя пропофол (1,5 ± 0,3 мг/кг) и фентанил (1 мкг/кг). Миорелаксация обеспечивалась пипекурония бромидом (0,07–0,08 мг/кг), дальнейшая анальгезия — фентанилом (21,5 ± 3,4 мкг/кг на все время оперативного вмешательства).
Искусственная вентиляция легких у обследованных пациентов проводилась воздушно-кислородной смесью (FiO2 = 50 %) в режиме нормовентиляции, под контролем газового состава крови (среднее значение рСО2 артериальной крови составляло 35,3 ± 2,4 мм рт.ст.).
Искусственное кровообращение проводилось на аппаратах System-1 (Terumo, США) с использованием одноразовых мембранных оксигенаторов Affinity (Medtronic, США) в условиях умеренной гипотермии (32 °С). Подключение апарата ИК и перфузия до искусственной фибрилляции сердца проводились с использованием ламинарного режима с последующим переходом в пульсирующий режим ИК (перфузионный индекс 2,4–2,5 л/мин/м2, объемная скорость перфузии в среднем составляла 4,50 ± 0,02 л/мин). В ходе ИК использовалась нормоволемическая гемодилюция при среднем уровне гематокрита 29,5 ± 3,4 %, гемоглобина — 90,1 ± 2,4 г/л и среднем уровне лактата 1,80 ± 0,43 ммоль/л. Свертываемость крови контролировали по времени активированного свертывания, поддерживая его в пределах 500–600 с. Адекватность перфузии оценивали по показателям кислотно-основного, газового и электролитного состава крови, темпу диуреза, пищеводно-ректального температурного градиента.
При этом контролировали следующие показатели: ЭКГ, инвазивное артериальное и центральное венозное давление, сатурацию по пульсоксиметру. Всем больным интраоперационно проводилась оценка глубины анестезии, которую оценивали с помощью монитора VISTA (Aspect Medical System Inc, США). При этом электроэнцефалограмму регистрировали в лобных отведениях по схеме, рекомендуемой фирмой-производителем, с дальнейшим расчетом биспектрального индекса (BIS) (ver 3.1). Среднее значение BIS в исследуемой группе составляло 43,7 ± 4,5 %.
Для регистрации количественных параметров мозгового кровотока в бассейне СМА пациентам выполнялась транскраниальная допплерография (ТКДГ) ультразвуковым аппаратом «Ангиодин-2К» («Биос», Россия). Измерения проводились транстемпоральным доступом по стандартной методике [14]. Базовая оценка линейных показателей кровотока производилась накануне операции, в последующем — интраоперационно, начиная с этапа вводного наркоза. При этом использовались ультразвуковые датчики линейного формата с частотным диапазоном 5–10 МГц.
Результаты и обсуждение
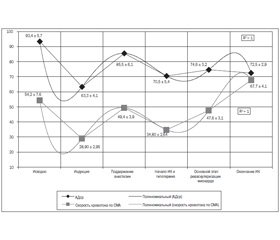
У 21 обследованного пациента, ФВ у которых составляла 52,7 ± 4,3 %, средняя линейная скорость в бассейне СМА до начала вводного наркоза была в пределах 54,2 ± 7,6 см/с (рис. 1) и на 53,9 ± 0,6 % меньше в сравнении с общепринятыми показателями нормы для лиц в возрасте от 35 до 50 лет (р = 0,0237) [14].
Данные о снижении зарегистрированных показателей средней линейной скорости в бассейне СМА, полученные нами, соотносятся с данными исследований P.N. Ainslie и S. Demirkaya и соавт. [15, 16], которые сообщают о том, что церебральный кровоток постепенно уменьшается с возрастом на 25–30 % в период от 20 до 80 лет.
Уменьшение скоростных параметров мозгового кровотока у обследованных нами пациентов с сохраненной ФВ левого желудочка (более 40 %) можно объяснить инволюцией сосудистого тонуса центральных мозговых артерий и нарушением сосудистой ауторегуляции.
На этапе индукции в анестезию показатели среднего артериального давления (АДср) у всех обследованных пациентов уменьшались на 32,2 ± 1,2 % и составляли 63,3 ± 4,1 мм рт.ст. (рис. 1). При этом на фоне достоверного снижения АДср (р = 0,0372) отмечалась депрессия средней линейной скорости кровотока в бассейне СМА, которая составляла 28,90 ± 2,95 см/с (46,7 ± 2,5 % относительно исходной величины (р = 0,0139)) (рис. 1). То есть в процентном соотношении уменьшение скоростных показателей кровотока по церебральным сосудам было на 14,5 ± 1,3 % больше в сравнении с процентным снижением АДср, зафиксированным на данном этапе исследования.
Дальнейшие наблюдения показали, что на этапе поддержания анестезии показатели АДср и церебрального кровотока стабилизировались и были близки по своим значениям к исходным величинам (рис. 1).
После подключения аппарата искусственного кровообращения и начала гипотермии отмечалось снижение скорости мозгового кровотока, которая в среднем составляла 34,80 ± 2,64 см/с (64,2 ± 3,9 % от исходной величины) (рис. 1).
Основной этап реваскуляризации миокарда в условиях расчетной величины объемной скорости перфузии характеризовался стабилизацией исследуемых показателей. При этом средняя линейная скорость кровотока в бассейне СМА фиксировалась в пределах 47,6 ± 3,1 см/с (78,6 ± 9,2 % от первоначальных значений) (рис. 1).
Следует отметить, что во время основного этапа перфузии, при ламинарном и пульсирующем режимах ИК, мы не наблюдали достоверной разницы в показателях средней линейной скорости кровотока в бассейне СМА (р = 0,758).
В ходе проведения ИК у 19 пациентов (70,4 % случаев) отмечалось снижение АДср, требующее терапевтической коррекции. С этой целью 10 больным проводилось болюсное внутривенное введение микродоз мезатона, а у 9 человек для поддержания АДср на адекватном уровне увеличивали объемную скорость перфузии на 20 % от расчетной.
Анализ полученных данных показал, что увеличение АДср за счет болюсного внутривенного введения 0,4–0,5 мл 0,01% раствора мезатона обеспечивало повышение артериального давления в среднем на 45,8 ± 4,5 % (с 36,5 ± 2,4 мм рт.ст. до 67,4 ± 3,1 мм рт.ст.). При этом увеличение АДср обеспечивало повышение линейной скорости кровотока в бассейне СМА в среднем на 19,3 ± 3,1 %. Увеличение же объемной скорости перфузии на 20 % от расчетной сопровождалось достоверным увеличением скорости кровотока в бассейне СМА в среднем на 48,50 ± 3,32 % (с 32,1 ± 3,5 мм рт.ст. до 62,3 ± 5,2 мм рт.ст.), что сопровождалось повышением церебрального кровотока в среднем на 36,4 ± 2,9 %. Таким образом, во время ИК мозговой кровоток находится в большей зависимости от объемной скорости перфузии, чем от величины АДср.
После окончания основного этапа операции, возобновления сердечной деятельности и достижения нормотермии наблюдались стабилизация линейной скорости кровотока в бассейне СМА и прогрессивное ее увеличение до 67,7 ± 4,1 см/с, что превышало предыдущие значения в среднем на 29,7 ± 2,1 %, а исходные показатели — на 19,9 ± 2,5 % на фоне меньших соответствующих значений АДср (рис. 1).
Как было указано выше, основную часть обследованных нами пациентов составляли больные с АГ (77,8 %). Данная категория пациентов особо чувствительна к гемодинамическим колебаниям вследствие формирования у них патологических изменений микроциркуляции на фоне существующей АГ.
Так, по данным П.А. Лебедева и соавт. [17], при длительном воздействии повышенного давления на капиллярную сеть происходит уменьшение просвета резистивных сосудов, а в ряде случаев — полное их закрытие за счет сокращения прекапиллярных сфинктеров. При этом уменьшение плотности поперечного сечения просвета мелких сосудов сопровождается увеличением сосудистой реактивности. Впоследствии констрикция микрососуда с отсутствием перфузии приводит к исчезновению неперфузируемого сосуда, что ведет ко второй стадии — структурного или анатомического разрежения, которое может сохраняться даже при максимальной вазодилатации [17]. Как указывается в исследованиях зарубежных авторов, для АГ характерно наличие эндотелиальной дисфункции, снижение податливости аорты и крупных эластических артерий с повышением скорости распространения пульсовой волны, увеличением постнагрузки левого желудочка и развитием процессов сердечно-сосудистого ремоделирования, что выражается в повышении периферического сосудистого сопротивления [18, 19].
При АГ наблюдаются также выраженные полиморфные структурные изменения микроциркуляторного русла церебральных сосудов, обозначаемые термином «гипертоническая ангиоэнцефалопатия» [20]. В сосудах головного мозга происходят деструктивные изменения (плазморрагии в стенку с набуханием и резким сужением просвета вплоть до полной его облитерации и формирования гипертонического стеноза, образование милиарных аневризм), а также процессы, направленные на адаптацию (гиперэластоз, перекалибровка сосудов). Плазматическое пропитывание артериол и мелких артерий развивается в связи с гипоксическим повреждением эндотелия, его мембраны, мышечных клеток и волокнистых структур стенки, к которому ведет спазм сосуда [20]. Элементы деструкции стенки, как и пропитывающие ее белки и липиды, резорбируются с помощью макрофагов, однако эта резорбция, как правило, неполная. Развивается гиалиноз артериол или артериолосклероз. Аналогичные изменения появляются в мелких артериях мышечного типа. Появление артерий с тонкой стенкой, не имеющей средней оболочки, — один из распространенных типов изменений церебральных сосудов при АГ [20].
Поэтому для регуляции АД во время проведения операции у подобного контингента больных следует применять гипотензивные препараты с управляемым и предсказуемым действием. По данным Европейского реестра по изучению лечения острой гипертонии (Euro-STAT), основанного на обсервационном исследовании, проведенном в 11 клиниках 7 европейских стран (Австрия, Бельгия, Германия, Италия, Испания, Швеция и Соединенное Королевство), одним из наиболее часто используемых препаратов для коррекции АД во время проведения общей анестезии является урапидил (Эбрантил) [21].
Данный препарат имеет центральный и периферический механизмы действия. На периферическом уровне урапидил (Эбрантил) блокирует в основном постсинаптические a1-адренорецепторы. На центральном уровне модулирует активность центра регуляции кровообращения, что предупреждает повышение тонуса симпатической нервной системы и снижает тонус сосудистого русла. Внутривенное введение урапидила (Эбрантила) приводит к снижению систолического и диастолического АД путем уменьшения общего периферического сосудистого сопротивления. При этом частота сердечных сокращений остается практически неизменной, а эффект от введения препарата предсказуем и дозозависим.
В работе A. Grabowska-Gaweł и соавт. были изучены эффекты урапидила (Эбрантила) при выполнении различных хирургических операций [22]. В результате было показано, что монотерапия урапидилом (Эбрантилом) (в средней внутривенной дозе от 26,3 ± 2,4 до 30,5 ± 3,5 мг) оказалась эффективной у 81,1 % пациентов. Остальным 18,9 % пациентов потребовалось дополнительное внутривенное введение нитроглицерина, что было продиктовано клинической ситуацией, связанной с манипуляциями на брюшном отделе аорты [21].
Как следует из исследований Е.А. Запольской [23], при проведении анестезиологического обеспечения у пациентов с АГ наблюдалось снижение артериального притока, увеличение тонуса церебральных сосудов, а у 72 % обследованных выявлялась межполушарная асимметрия кровотока с преобладанием левополушарного дефицита.
В свете всего вышеизложенного особого внимания заслуживают данные опроса, проведенного среди 85 врачей-анестезиологов, касающегося причин углубления анестезии во время проведения оперативного вмешательства [24], согласно которым в 20 % случаев дополнительное введение гипнотиков производилось для усиления действия миорелаксантов, в 30,6 % — для снижения артериального давления с целью уменьшения кровоточивости, в 20 % — на «болевом» этапе операции, в 75,3 % — в случае повышения частоты сердечных сокращений, в 100 % случаях все анкетируемые углубляли анестезию при повышении АД вне зависимости от этапа операции [24]. Однако согласно ранее опубликованным нами исследованиям [24], углубление анестезии для регуляции интраоперационного повышения АД может являться фактором риска возникновения послеоперационных когнитивных дисфункций, что с большой долей вероятности может быть связано с депрессией мозгового кровотока. И хотя последнее положение нуждается в исследовании и подтверждении, результаты данной работы подчеркивают патофизиологическую целесообразность использования Урапидила (Эбрантила) у пациентов с АГ при проведении им анестезиологического обеспечения хирургических операций.
Выводы
1. В результате проведенного исследования было установлено, что с увеличением возраста на фоне атеросклероза и длительно существующей АГ снижается мозговой кровоток, реактивность и ауторегуляторный диапазон изменения просвета мозговых сосудов.
2. При проведении основного этапа кардиохирургических операций в условиях ИК, для обеспечения адекватного мозгового кровотока, величину объемной скорости перфузии следует поддерживать на уровне 120 % от расчетной, при этом величина АДср может составлять менее 70 мм рт.ст. без угрозы развития гипоперфузии головного мозга.
3. Внедрение в клиническую практику метода транскраниальной допплерографии дает возможность не только качественно и количественно оценить скоростные параметры кровотока в интракраниальных артериях, но и определить цереброваскулярную реактивность, дать оценку ауторегуляции мозгового кровотока, отражающей сосудистую резистентность, предупредить гипоперфузию головного мозга и снизить процент неврологических осложнений.
4. Для коррекции повышенного артериального давления во время проведения общей анестезии следует использовать препараты с управляемым и прогнозируемым антигипертензивным действием, отдавая предпочтение урапидилу (Эбрантилу).
1. The preoperative neurological evaluation / J. Probasco, B. Sahin, T. Tran [et al.] // Neurohospitalist. — 2013. — Vol. 3, № 4. — Р. 209-220.
2. Hogue C.W. Cardiopulmonary bypass management and neurologic outcomes: an evidence-based appraisal of current practices / C.W. Hogue, C.A. Palin, J.E. Arrowsmith // Anesthesia & Analgesia. — 2006. — Vol. 103 (Issue 1). — Р. 21-37.
3. Postoperative delirium after elective orthopedic surgery / A.M. Contín, J. Perez-Jara, A. Alonso-Contín [et al.] // Geriatr. Psychiatry. — 2005. — Vol. 20, № 6. — Р. 595-597.
4. Prevalence of delirium in opium users after coronary artery bypass graft surgery / N. Eizadi-Mood, O. Aghadavoudi, M.R. Najarzadegan [et al.] // Int. J. Prev. Med. — 2014. — Vol. 5, № 7. — Р. 900-906.
5. Allen S.R. Postoperative complications: delirium / S.R. Allen, H.L. Frankel // Surg. Clin. North. Am. — 2012. — Vol. 92, № 2. — Р. 409-431.
6. One-year health care costs associated with delirium in the elderly population / D.L. Leslie, E.R. Marcantonio, Y. Zhang [et al.] // Arch. Intern. Med. — 2008. — Vol. 168, № 1. — Р. 27-32.
7. Inouye S.K. Delirium in older persons / S.K. Inouye // N. Engl. J. Med. — 2006. — Vol. 354, № 11. — Р. 1157-1165.
8. A randomized comparative study of patients undergoing myocardial revascularization with or without cardiopulmonary bypass surgery: The MASS III Trial / W. Hueb, N.H. Lopes, B.J. Gersh [et al.] // Trials. — 2008. — Vol. 28, № 9. — Р. 52-58.
9. Postoperative cognitive dysfunction after noncardiac surgery: a systematic review / S. Neuman, J. Stygall, C. Hurani [et al.] // Anesthesiology. — 2007. — Vol. 106, № 3. — P. 572-590.
10. Predictors of cognitive dysfunction after major noncardiac surgery / T.G. Monk, B.C. Weldon, C.W. Garvan [et al.] // Anesthesiology. — 2008. — Vol. 108, № 1. — P. 18-30.
11. Markus H.S. Cerebral perfusion and stroke / H.S. Markus // J. Neurol. Neurosurg. Psychiatry. — 2004. — Vol. 75, № 3. — Р. 353-361.
12. Elevation in cerebral blood flow velocity with aerobic fitness throughout healthy human ageing / P.N. Ainslie, J.D. Cotter, K.P. George [et al.] // J. Physiol. — 2008. — Vol. 586, № 16. — Р. 4005-4010.
13. Normal blood flow velocities of basal cerebral arteries decrease with advancing age: a transcranial Doppler sonography study / S. Demirkaya, K. Uluc, S. Bek [et al.] // Tohoku J. Exp. Med. — 2008. — Vol. 214, № 2. — Р. 145-149.
14. Транскраниальная допплерография в интенсивной терапии: Методическое пособие для врачей / [А.А. Белкин, А.М. Алашеев, С.Н. Инюшкин]. — Петрозаводск: Интел Тех, 2006. — 103 с.
15. Elevation in cerebral blood flow velocity with aerobic fitness throughout healthy human ageing / P.N. Ainslie, J.D. Cotter, K.P. George [et al.] // J. Physiol. — 2008. — Vol. 586, № 16. — Р. 4005-4010.
16. Normal blood flow velocities of basal cerebral arteries decrease with advancing age: a transcranial Doppler sonography study / S. Demirkaya, K. Uluc, S. Bek [et al.] // Tohoku J. Exp. Med. — 2008. — Vol. 214, № 2. — Р. 145-149.
17. Дисфункция эндотелия и артериальная гипертензия / С.П. Власова, М.Ю. Ильченко, Е.Б. Казакова и др. / Под ред. П.А. Лебедева. — Самара: Офорт, 2010. — 192 с.
18. Agabiti-Rosei E. Structural and functional changes of the microcirculation in hypertension: influence of pharmacological therapy / E. Agabiti-Rosei // Drugs. — 2003. — Vol. 63, № 1. — Р. 19-29.
19. Schiffrin E.L. Vascular changes in hypertension in response to drug treatment: Effects of angiotensin receptor blockers / E.L. Schiffrin // Can. J. Cardiol. — 2002. — Vol. 18 (Suppl. A). — Р. 15A-18A.
20. Верещагин Н.В. Патология головного мозга при атеросклерозе и артериальной гипертонии / Н.В. Верещагин, В.А. Моргунов, Т.С. Гулевская. — М.: Медицина, 1997. — 288 с.
21. Characteristics, practice patterns, and outcomes in patients with acute hypertension: European registry for Studying the Treatment of Acute hyperТension (Euro-STAT) / А. Vuylsteke, J.L. Vincent, D.P. de La Garanderie [et al.] // Crit. Care. — 2011. — Vol. 15, № 6. — R271.
22. Grabowska-Gaweł A. Usefulness of urapidil during intraoperative rise of arterial blood pressure in patients operated under general anesthesia / A. Grabowska-Gaweł, K. Porzych, G. Grześk // Przegl. Lek. — 2005. — Vol. 62, № 3. — Р. 148-151.
23. Запольская Е.А. Мониторинг мозгового кровотока и центральной гемодинамики при различных видах анестезии у пожилых больных с сопутствующей артериальной гипертензией: дис… к. мед. наук: 14.00.37 «Анестезиология и реаниматология» / Запольская Е.А. — М., 2005. — 98 с.
24. Глубина анестезии и послеоперационные когнитивные дисфункции / О.А. Лоскутов, С.Н. Судакевич, А.Н. Дружина и др. // Біль, знеболювання і інтенсивна терапія. — 2013. — № 2д. — С.305-307.

/73/73.jpg)