Журнал «Медицина неотложных состояний» 7 (62) 2014
Вернуться к номеру
Упреждающая аналгезия в хирургии грыж пахового канала
Авторы: Поталов С.А., Михеев Ю.А., Отарашвили К.Н., Шаповалов Е.М., Задорожко Е.М., Потапова И.И., Илькаев Д.В. — ГУ «Запорожская медицинская академия последипломного образования МЗ Украины»
Рубрики: Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 159-161
Введение. Качество хирургического лечения во многом определяется полноценным обезболиванием как во время операции, так и в послеоперационном (п/о) периоде. Эффективная интра- и послеоперационная аналгезия оказывает содействие ранней реабилитации оперированных, уменьшает вероятность возникновения п/о осложнений — дыхательных, реологических нарушений, нарушений функции кишечника, тошноты, рвоты, что приводит к сокращению сроков госпитализации. Стремление обеспечить беспрерывную аналгезию от начала операции вплоть до выписки больного из стационара легло в основу концепции упреждающей аналгезии (УА, Preemptive Аnalgesia). Достигается упреждающая аналгезия путем продолжительной регионарной анестезии или предоперационного системного введения фармакологических средств (опиоидов, нестероидных противовоспалительных препаратов (НПВП), кетамина). Сведения об эффективности и клинической значимости УА противоречивые, а оценки влияния УА на течение послеоперационного периода, по данным опубликованных работ, неоднозначные. Поэтому до сих пор не регламентированы оптимальные соединения, дозы и режимы введения фармакологических средств, которые обеспечивают упреждающую аналгезию.
Среди методов анестезиологического обеспечения герниопластики все большую популярность приобретает спинальная анестезия (СА), при которой блокада ноцицепции уже к началу операции отвечает основной цели УА. Однако продолжительность послеоперационной аналгезии после СА ограничена фармакодинамическими характеристиками локального анестетика, применяемого для СА. Поврежденные ноцицепторы в зоне операции продолжают посылать болевую импульсацию в центральную нервную систему (ЦНС), что и объясняет недостаточную эффективность СA в предупреждении послеоперационной боли. Идея использовать инфильтрацию тканей области операции локальным анестетиком на фоне общей анестезии не новая, однако ее комбинация с регионарным блоком не изучалась.
Данное исследование было проведено с целью определения эффективности сочетанного применения спинальной анестезии и некоторых методик УА, наиболее перспективных, на наш взгляд, компонентов анестезиологического пособия при оперативном лечении грыж пахового канала.
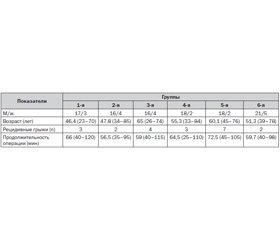
Материалы и методы. Обследовано 126 пациентов (106 мужчин и 20 женщин, средний возраст — 54 ± 12 лет, ASA — 1–2), оперированных в плановом порядке по поводу грыж пахового канала. Большинство из них имели хронические заболевания систем дыхания и кровообращения в стадии компенсации.
Пациенты были случайным образом разделены на 6 групп в зависимости от метода упреждающей аналгезии. Пациенты 1-й группы (n = 20) оперированы в условиях спинальной анестезии без применения других методик УА. Пациентам 2-й группы (n = 20) после выполнения СА за 5–10 минут к кожному разрезу в/в вводили кетамин в дозе 0,5 мг/кг. В 3-й группе (n = 20) пациентам за 30 мин до операции вводили внутримышечно 75 мг диклофенака. В 4-ю группу вошли 20 пациентов, которым после СА выполнялась инфильтрация тканей зоны предполагаемого разреза 25–30 мл 0,5% раствора лидокаина. У 20 пациентов 5-й группы применялся мультимодальный метод профилактики послеоперационной боли, которая включала дополнительно к СА в/м введение 75 мг диклофенака в премедикации, в/в — 0,5 мг/кг кетамина за 5 мин к кожному разрезу и инфильтрационную анестезию зоны разреза 0,5% раствором лидокаина.
Контрольная (6-я группа) — 26 больных, оперированных в условиях инфильтрационной анестезии 0,5% раствором лидокаина.
Протокол спинальной анестезии
Премедикация — накануне операции: феназепам — 10–20 мг, клофелин — 0,075–0,15 мг.
В операционной: катетеризация периферической вены, инфузия 400–800 мл 0,9% раствора хлорида натрия.
В положении лежа на боку на уровне L4/3 спинальной иглой 27G Spinocan через иглу-проводник достигали субарахноидального пространства. После верификации субарахноидально вводили 9–12 мг (0,066 мг/см) 0,5% р-ра бупивакаина (анекаин, Pliva, Хорватия) с добавлением 0,02 мг фентанила. Пациенты всех групп оперировались при сохраненном сознании.
Протокол послеоперационного обезболивания
Во всех группах послеоперационное обезболивание проводили в режиме «по требованию пациента». Базисное обезболивание включало в/м инъекцию диклофенака 75 мг каждые 8–12 часов. Дополнительное обезболивание осуществляли в/м введением 5–10 мг морфина. Критерием для назначения морфина было ощущение послеоперационной боли через 30 мин после инъекции диклофенака, оцениваемое пациентом по 100-мм визуально-аналоговой шкале (ВАШ) больше 30 мм. Интервал между инъекциями морфина был не менее 4 часов.
В послеоперационном периоде все пациенты, включенные в исследование, находились под наблюдением врача-анестезиолога. Интенсивность послеоперационного болевого синдрома оценивали на основании критериев, признанных Международной ассоциацией по изучению боли:
— продолжительность безболевого периода после окончания операции;
— время требования первого введения анальгетика;
— средняя интенсивность послеоперационной боли по 100-мм ВАШ на протяжении 48 часов после операции;
— средняя суммарная доза морфина за 48 часов после операции;
— количество пациентов, которые не нуждаются в назначении морфина.
Результаты и их обсуждение. Основные демографические и клинические данные пациентов представлены в табл. 1.
Установлено, что интенсивность послеоперационной боли у пациентов, у которых применялся один из методов УА, была значительно меньшей, чем в контрольной группе больных, которые оперировались в условиях инфильтрационной анестезии. Средняя продолжительность послеоперационной аналгезии в данной группе была 29 ± 13 мин. Продолжительность безболевого периода в 1-й группе составила 229 ± 17 мин. Пациенты 2–5-й групп, в которых применялись варианты УА, имели достоверно более продолжительный безболевой период и более низкую интенсивность послеоперационной боли. Самый продолжительный безболевой период отмечен в 4-й и 5-й группах, он составил 334 ± 31 мин и 373 ± 42 мин соответственно, а показатели средней интенсивности боли не имели больших расхождений.
Контроль послеоперационной боли в группах с использованием исследуемых методов УА достигался достоверно меньшими суточными дозами опиоидов, а число больных, не нуждавшихся в назначении морфина в послеоперационном периоде, было самым высоким в 4-й и 5-й группах.
Качество обезболивания после операции, оцененное как отличное (полное обезболивание) или хорошее (незначительная боль), — у 8 пациентов 1-й группы, у 12 пациентов во 2-й группе, у 18 — в 3-й и у 17 — 4-й и 5-й групп. Только у 3 пациентов контрольной группы послеоперационное обезболивание оценено как хорошее.
У пациентов исследуемых групп число эпизодов тошноты, рвоты и задержки мочеиспускания было достоверно меньшим в 2,5 раза в сравнении с контрольной группой и тесно коррелировало с общей дозой морфина.
Обоснование и подтверждение необходимости применения анальгетиков периферического действия с целью профилактики послеоперационного болевого синдрома отражены в работе Н.А. Осиповой с соавторами. Авторы пришли к заключению, что превентивное внутримышечное введение кеторолака за 1 час до начала абдоминальных онкологических операций, а потом в раннем послеоперационном периоде предотвращает развитие сильного послеоперационного болевого синдрома и снижает потребность в сильных опиоидах (бупренорфин) в 3 раза.
Уменьшение афферентного ноцицептивного потока может быть достигнуто также с помощью местной инфильтрационной анестезии. Но местные анестетики, которые временно блокируют передачу болевых импульсов в соответствующих нервных структурах, не влияют на гуморальные процессы развития боли в травмированных тканях, не уменьшают избыточный простагландино- и кининогенез. Поэтому необходимо использовать местную анестезию как отдельный компонент в общей схеме упреждающей аналгезии.
Учитывая данные о роли активации N-метил-D-аспартат (NMDA)-рецепторов в генезе острой боли, представляется патогенетически обоснованным применение препаратов, способных блокировать NMDA-рецепторы. Известно, что диссоциативный анестетик кетамин, который используется в анестезиологии больше 30 лет, в субанестетических дозах, не вызывающих выраженного психотомиметического действия, является неконкурентным блокатором NMDA-рецепторов, влияя на передачу болевых импульсов и следующую сенситизацию ЦНС.
В последнее время появились работы, в которых обсуждается принцип мультимодального подхода к профилактике послеоперационного болевого синдрома (ПОБС), что позволяет максимально препятствовать реализации как центральных, так и периферических механизмов острой боли. Основой мультимодального подхода является максимально возможное устранение всех факторов, оказывающих содействие развитию боли на протяжении пред-, интра- и послеоперационного периода, путем влияния на все процессы ноцицепции: трасдукцию, трансмиссию и модуляцию. Афферентная блокада за счет местной анестезии и/или регионарной блокады блокирует поток ноцицептивных импульсов из периферии, опиаты угнетают первичный ответ спинальных нейронов на травму, ингибиторы NMDA-рецепторов тормозят развитие феномена раздувания их активности, НПВП блокируют гуморальную фазу ноцицепции.
При сравнительном анализе исследуемых нами методов УА выявлено бесспорное преимущество мультимодального подхода к профилактике ПОБС по сравнению с влиянием на отдельные механизмы боли. Результатом применения комбинированных методов явилось полное предотвращение развития ПОБС в 46,2 % случаев. В других случаях интенсивность ПОБС не достигала клинически значимых величин и сопровождалась снижением потребности в опиоидных анальгетиках. Это позволило повысить адекватность послеоперационного обезболивания до 88,2 %.
Выводы. Сочетание спинальной анестезии и инфильтрационной анестезии тканей зоны операции в сочетании с предоперационным введением НПВС и кетамина является наиболее эффективным методом предупреждения послеоперационного болевого синдрома после герниопластики.

/161/161.jpg)