Журнал «Медицина неотложных состояний» 8 (63) 2014
Вернуться к номеру
Клинические результаты применения инъекционного имплантата гиалуроновой кислоты и сукцината натрия в комбустиологии
Авторы: Коркунда С.В., Григорьева Т.Г., Олейник Г.А. — Харьковская медицинская академия последипломного образования, кафедра комбустиологии, реконструктивной и пластической хирургии
Рубрики: Медицина неотложных состояний, Хирургия
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 64-73
Анализ данных литературных источников свидетельствует о прямом влиянии состояния внеклеточного матрикса (ВКМ) на процессы регенерации тканей при травмах и оперативных вмешательствах. В частности, усиление пролиферативной активности фибробластов сопровождается увеличением продукции гликозаминогликанов (ГАГ), а именно — гиалуроновой кислоты (ГК) и сукцината натрия. То есть обеспечение оптимальных условий неоколлагеногенеза локально обусловливает повышение потребности тканей в ГК с особыми биологическими свойствами. R. Donoff расценивает функциональное значение ГАГ:
— как осуществление контроля биосинтеза коллагена;
— непосредственное участие в организации фиброзной сети;
— обеспечение стабилизации коллагеновых волокон.
Таким образом, процесс заживления ран и формирования рубцов находится в прямой зависимости от способности тканей синтезировать сульфатсодержащие ГАГ [1–19]. Современные медицинские технологии позволяют реализовать механизм непосредственного введения ГК в ткани с повышенными потребностями.
Цель исследования: оценка эффективности и переносимости инъекционного имплантата на основе гиалуроновой кислоты 1,5% и cукцината натрия в предварительно наполненных шприцах производства ООО «Юрия-Фарм» у обожженных пациентов с донорскими ранами после аутодермопластики площадью до 5 % поверхности тела.
Задачи исследования:
— изучить терапевтическую эффективность исследуемого препарата инъекционного имплантата на основе гиалуроновой кислоты 1,5% и сукцината натрия, применяемого у обожженных пациентов с донорскими ранами после аутодермопластики;
— изучить переносимость и возможные побочные явления/реакции при использовании исследуемого препарата;
— сравнить результаты лечения, полученные при использовании инъекционного имплантата на основе гиалуроновой кислоты 1,5% и сукцината натрия и стандартной терапии для оценки превосходящей эффективности препарата в сравнении со стандартной терапией.
Инъекционный имплантат на основе гиалуроновой кислоты 1,5% и сукцината натрия — бесцветный, прозрачный, вязкий гель нестабилизированной гиалуроновой кислоты неживотного (биоферментного) происхождения, стерильный, апирогенный, с физиологическим рН. Гиалуроновая кислота — природный полисахарид (гликозаминогликан), важный структурный элемент кожи и соединительной ткани. Сукцинат натрия обеспечивает мощный восстановительный и антиоксидантный эффект, усиливает клеточное и тканевое дыхание, транспорт ионов, синтез белка, а также мощную стимуляцию производства энергии (АТФ) и усиление микроциркуляции.
Дизайн исследования. Данное клиническое исследование проводилось как открытое сравнительное одногрупповое. Дизайн предполагал набор одной группы больных (исследуемый препарат и референтное лечение использовались у каждого пациента одновременно на раневой поверхности, условно разделенной на две равные части).
Данное клиническое исследование проводилось в соответствии с Законом Украины «О лекарствах» и этическими принципами Хельсинкской декларации. Настоящее исследование было начато после одобрения протокола клинического испытания Центральной комиссией по вопросам этики МЗ Украины. Пациенты, являющиеся потенциальными участниками исследования, были проинформированы о его характере, исследуемом препарате, а также о возможном риске, связанном с приемом препарата. Каждому пациенту была предоставлена письменная информация о проводимом исследовании, содержащаяся в Информации для пациента. Все больные, включаемые в исследование, дали письменное согласие на участие в испытании. Заказчик исследования обеспечил страхование клинического исследования и возмещение ущерба в случае возникновения угрозы для жизни или здоровья пациента вследствие приема исследуемого препарата. Данные хранились и обрабатывались с учетом сохранения конфиденциальности информации о пациентах.
Критерии включения пациентов в исследование:
— мужчины и женщины;
— возраст — 18–65 лет;
— пациенты с донорской раной непосредственно после проведенной аутодермопластики при лечении ожогов кожи IIIА–IIIБ ст. без ожоговой болезни;
— площадь донорской раны не более 5 % поверхности кожи;
— информированное письменное согласие пациента на участие в исследовании;
— для женщин детородного возраста — отрицательный тест на беременность, соблюдение адекватных мер контрацепции.
Критерии исключения:
— беременность, лактация;
— ожоговая болезнь;
— известная гиперчувствительность к любому из компонентов исследуемого препарата;
— активные воспалительные процессы в местах предполагаемого введения;
— склонность к образованию гипертрофических рубцов;
— нарушение свертываемости крови;
— сахарный диабет;
— тромболитическая или антикоагулянтная терапия в течение 2 недель, предшествующих скрининговому визиту;
— сопутствующие декомпенсированные заболевания или острые состояния, наличие которых, по мнению исследователя, может повлиять на результаты исследования;
— необходимость в назначении нерекомендуемых лекарственных средств во время проведения исследования;
— участие в любом другом клиническом исследовании.
Схема назначения исследуемых препаратов. Лечение начинали сразу же после завершения аутодермопластики. Донорская рана условно делилась на две равные части. По периметру половины донорской раны (зона А) внутрикожно вводился имплантат в объеме 1–2 мл (в зависимости от площади раны). Препарат вводится по следующей схеме: 1–2 мл в зависимости от размеров раны (но не более) непосредственно после операции и через 3 суток. Другая половина донорской раны (зона В) обрабатывалась по стандартному протоколу: на всю поверхность раны накладывалась стерильная марлевая салфетка и проводилось высушивание тепловентилятором до образования сухого струпа. Лечение продолжали до полной эпителизации раневого дефекта, в качестве основного критерия учитывались результаты 14-дневного назначения. По окончании исследования учитывались средние сроки полного заживления ожоговой раны при использовании различных методов лечения. В случае полной эпителизации раневого дефекта в срок менее 14 дней лечение следовало прекратить и произвести обследование, запланированное на 14-й день. В процессе исследования пациенты могли также получать препараты, постоянно используемые для лечения сопутствующих заболеваний. Доза назначаемых препаратов должна была оставаться неизменной на протяжении всего периода исследования. В процессе исследования не разрешалось назначение средств, которые могли значимо повлиять на результат.
Для включения пациентов в исследование и оценки терапевтической эффективности и переносимости исследуемого препарата пациентам проводили обследование с помощью клинических, инструментальных и лабораторных методов:
— объективный осмотр: визуальный осмотр ожоговой раны, определение площади ожоговой раны, определение площади донорской раны, оценка наличия признаков патологического рубцеобразования (интенсивный зуд кожи, интенсивность окраски кожи, неравномерность рельефа кожи), выраженности воспаления, характера и степени эпителизации;
— общий анализ крови (эритроциты, гемоглобин, лейкоциты, скорость оседания эритроцитов (СОЭ), тромбоциты);
— общий анализ мочи (рН, удельный вес, белок, сахар, эпителиальные клетки, лейкоциты, эритроциты, цилиндры);
— биохимический анализ крови (аланинаминотрансфераза, аспартатаминотрансфераза, креатинин, глюкоза, общий билирубин);
— общий осмотр: измерение температуры тела, аускультация сердца и легких, пальпация и перкуссия живота, осмотр кожи и видимых слизистых; регистрация субъективных жалоб;
— тест на беременность для женщин репродуктивного возраста — до начала исследования.
При визуальной оценке ожоговой раны учитывали следующие параметры:
— площадь поверхности раны, в % поверхности тела;
— параметры, характеризующие процесс репарации (выраженность воспалительных изменений, характер эпителизации, степень эпителизации), выражаемые в баллах 0–3;
— параметры, характеризующие процесс патологического рубцеобразования (интенсивный зуд кожи в области раны, интенсивность окраски кожи, неравномерность рельефа кожи), выражаемые в баллах 0–3.
Исследование включало следующие этапы: скрининг, период лечения (до полной эпителизации раневого дефекта). В скрининговый период проводилась предварительная оценка соответствия пациента критериям включения/исключения. Потенциальному больному предоставлялась устная и письменная информация об исследуемом препарате и условиях проведения исследования. Предусмотренное настоящим протоколом предварительное обследование производилось после подписания больным Формы информированного согласия. В период лечения пациенты получали назначенное лечение и проходили обследование в определенные для контроля дни.
Критерии эффективности:
— длительность лечения (суток) до полного заживления донорской раны.
Оценка эффективности:
— препарат эффективен — полная эпителизация раневого дефекта;
— препарат неэффективен — частичная эпителизация раневого дефекта и/или наличие осложнений.
Анализ исходной однородности групп. Термин «группа» в настоящем анализе носит условный характер, поскольку дизайн исследования одногрупповой. Под термином «основная группа» мы понимаем число случаев применения исследуемого препарата гиалуроновой кислоты и сукцината натрия, под термином «контрольная группа» — число случаев применения референтного лечения.
Выполнялся анализ исходной однородности групп по клинико-демографическим показателям и показателям эффективности.
1. Использованы методы описательной статистики для описания исходного состояния основной и контрольной групп (для количественных показателей — n, среднее арифметическое, медиана, стандартное отклонение, минимальное и максимальное значения; для качественных показателей — частота и доля в %).
2. Для количественных показателей исследована нормальность распределения данных в группах с помощью критерия Шапиро — Уилка. Если данные в группах по определенным показателям распределены нормально, то группы сравнивались по этим показателям посредством критерия Стьюдента для независимых выборок (предварительно проверив однородность дисперсий в группах критерием Левена с целью выбора варианта критерия Стьюдента). В противном случае (данные распределены ненормально) выполнялось сравнение групп при помощи критерия Манна — Уитни.
3. Для категориальных показателей группы сравнивались посредством критерия хи-квадрат Пирсона. Если предпосылки применения данного критерия не выполняются, то для сравнения применялся точный критерий Фишера.
4. Сделаны статистические выводы касательно исходной однородности групп по указанным переменным.
Работа с данными осуществлена согласно базовым принципам управления данными с целью обеспечения их целостности и валидности. Для этого проводился ввод данных в предварительно спроектированные электронные таблицы Excel, с использованием принципа «двойного ввода» и последующей перекрестной валидации.
Полученные результаты и их анализ
В клиническое исследование было включено 50 пациентов с ожогами ІІІА–ІІІБ степени площадью до 5 % поверхности тела, которые дали письменное согласие на участие в исследовании и соответствовали критериям отбора. Все пациенты получили полный курс лечения и были включены в анализ эффективности и переносимости. Все больные были госпитализированы в первые сутки от момента получения ожоговой травмы и находились на стационарном лечении в клинике кафедры комбустиологии, реконструктивной и пластической хирургии Харьковской медицинской академии последипломного образования на базе городской клинической больницы скорой и неотложной медицинской помощи им. проф. И. Мещанинова.
Группу исследуемых составили 32 (64 %) мужчины и 18 (36 %) женщин в возрасте от 18 до 65 лет. Средний возраст составил 43,47 года. Распределение исследуемых по возрасту и полу представлено в табл. 1.
Все пациенты были госпитализированы по поводу ожогов кожи ІІІА–ІІІБ степени. У всех ожоги носили локализованный характер, пациентов с ожоговой болезнью не включали в исследование. У части больных обеих групп определялись сочетанные поражения (голень — стопа, плечо — предплечье — кисть и т.д.). По локализации ожоги были распределены следующим образом (табл. 2).
У включенных в исследование пациентов были термические и химические ожоги. Больные с сопутствующими травмами, кровопотерей, наличием признаков отравления продуктами горения или ожогами верхних дыхательных путей в исследование не включались.
В группе исследуемых была произведена аутодермопластика на площади от 0,2 до 5 % поверхности тела. Средняя площадь донорской раны в группе больных составила 1,93 % поверхности тела. Наибольшую долю (86 %) составили пациенты, у которых площадь донорской раны составляла до 3 % поверхности тела. Распределение исследуемых по площади донорской раны представлено в табл. 3.
При объективном осмотре были выявлены некоторое повышение частоты сердечных сокращений (ЧСС) и артериального давления (АД), лабильность пульса и артериального давления, у части больных — незначительное повышение температуры. Кожа и слизистые вне зоны поражения оставались чистыми, периферических отеков не наблюдалось. Суточный диурез у всех больных был в пределах нормы. Также при осмотре не было выявлено пациентов с наличием сопутствующей патологии, требующей изменения схемы лечения или препятствующей дальнейшему участию пациентов в исследовании. Исходные результаты оценки в группе больных по данным объективного осмотра методами описательной статистики представлены в табл. 4.
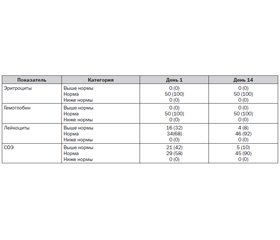
Лабораторные исследования крови и мочи, проведенные до начала клинического исследования, выявили у части больных повышение СОЭ, уровня лейкоцитов в крови. Данные лабораторных исследований представлены в табл. 5–7.
Таким образом, в клиническое исследование были включены 50 пациентов с донорскими ранами после аутодермопластики от 0,3 до 5 % поверхности тела, соответствующие критериям включения и давшие письменное согласие на участие в исследовании.
Данные, полученные в процессе проведения исследования. В соответствии с протоколом лечение начинали сразу же после завершения аутодермопластики (см. выше). Лечение продолжали до полной эпителизации раневого дефекта, в качестве основного критерия учитывались результаты 14-дневного лечения. Кроме этого, пациентам назначалась инфузионно-трансфузионная терапия, при необходимости — анальгетики, а также средства симптоматической терапии.
Оценка состояния донорской раны в динамике. В ходе проведения исследования на 3, 7, 10 и 14-й день наблюдали за состоянием донорской раны. Клинически у пациентов в зоне донорских ран отмечалась разная клиническая картина в сравниваемых зонах начиная с 7-го дня лечения. Так, на 7-й день лечения в зоне А (инъекции имплантата) отмечалось появление краевой эпителизации, тогда как в зоне В (стандартная терапия) отмечалось сохранение дермального струпа. В дальнейшем отмечалась более выраженная эпителизация раневого дефекта в зоне А по сравнению с зоной В с во всех точках наблюдения. Качество восстановленного кожного покрова на 14-й день лечения в зоне А отличалось от такового в зоне В: характеристики вегетативной активности, присущей патологическому рубцеобразованию, в зоне А были выражены достоверно меньше. Результаты осмотра донорской раны, выражаемые в категориальной шкале, представлены в табл. 8, 9.
Оценка длительности лечения (суток) до полного заживления донорской раны. Лечение продолжали до полной эпителизации донорских ран. По окончании курса лечения оценивали среднюю продолжительность лечения в группах. Анализ средней продолжительности лечения методами описательной статистики представлен в табл. 10.
Оценка переносимости. Результаты анализа данных объективного осмотра
С целью оценки переносимости лечения на 3, 7, 10 и 14-й день лечения производилось физикальное обследование пациентов: осмотр кожи и видимых слизистых, измерение температуры тела, ЧСС и АД, оценка субъективных жалоб. В ходе исследования не было выявлено негативных изменений гемодинамических показателей, исходно повышенные у части исследуемых ЧСС и АД постепенно снижались, достигая нормальных значений к 3–4-му дню лечения. Повышенная у части пациентов температура тела также нормализовалась ко 2–3-му дню лечения. Анализ гемодинамических показателей методами описательной статистики представлен в табл. 11.
При проведении физикального обследования ни в одном случае не было выявлено патологических изменений. При осмотре кожи не было выявлено негативных изменений, связанных с введением исследуемого препарата. Пациенты не отмечали усиления боли или жжения в ране или окружающих участках кожи после инъекций исследуемого препарата.
Не было зарегистрировано каких-либо непредвиденных реакций, острых состояний или случаев обострения хронических заболеваний.
Результаты по каждой переменной были преобразованы в категориальную шкалу с категориями «норма/патология». Показатели описательной статистики для преобразованной переменной в каждой группе и для каждого визита (частота и доля в %) приведены в табл. 12.
Результаты анализа лабораторных данных
По окончании курса лечения повторно проведено лабораторное исследование крови и мочи. Хорошая переносимость лечения подтверждалась данными лабораторного исследования. Изменения лабораторных показателей соответствовали нормальному течению раневого процесса — наблюдалась тенденция к уменьшению уровня лейкоцитов в крови и СОЭ. Негативных изменений лабораторных показателей отмечено не было. Данные оценки методами описательной статистики динамики общего анализа крови в группах больных представлены в табл. 13.
Результаты по каждой переменной были преобразованы в категориальную шкалу с категориями «норма», «выше нормы», «ниже нормы». Показатели описательной статистики для преобразованной переменной в каждой группе и для каждого визита (частота и доля в %) приведены в табл. 14.
Данные оценки методами описательной статистики динамики биохимического анализа крови в группах больных представлены в табл. 15.
Результаты по каждой переменной были преобразованы в категориальную шкалу с категориями «норма», «выше нормы», «ниже нормы». Показатели описательной статистики для преобразованной переменной в каждой группе и для каждого визита (частота и доля в %) приведены в табл. 16.
Показатели общего анализа мочи также не претерпели негативных изменений, не выходя за пределы нормальных значений. Результаты по каждой переменной были преобразованы в шкалу с категориями «норма», «выше нормы», «ниже нормы». Показатели описательной статистики для преобразованной переменной в каждой группе и для каждого осмотра (частота и доля в %) приведены в табл. 17.
С целью выбора критерия для оценки значимости различий лабораторных показателей для Тдень 1 по сравнению с Тдень 14 была проверена нормальность распределения dT = Тдень 1 – Тдень 14 при помощи критерия Шапиро — Уилка.
Так как разности распределены нормально, то сравнение значений для Тдень 1 и Тдень 14 выполнялось при помощи парного критерия Стьюдента (табл. 18).
Вывод: по большинству лабораторных показателей отсутствуют значимые различия между визитами. Присутствуют статистически значимые отличия между визитами только по показателям «лейкоциты» и «СОЭ».
Сведения о побочных реакциях. За время проведения клинического исследования не было зарегистрировано побочных реакций, которые можно было бы связать с назначением исследуемого препарата.
Сравнение переносимости в группах. Таким образом, переносимость исследуемых препаратов была оценена как хорошая во всех случаях (табл. 19).
Выводы
1. Инъекционный имплантат на основе гиалуроновой кислоты 1,5% и сукцината натрия в предварительно наполненных шприцах производства ООО «Юрия-Фарм» по эффективности превосходит стандартное лечение донорских ран после аутодермопластики. Эффективность лечения при использовании исследуемого препарата по совокупности исследуемых показателей составила 100 %, эффективность референтного лечения — 58 %.
2. Назначение инъекционного имплантата на основе гиалуроновой кислоты 1,5% и сукцината натрия способствовало сокращению сроков эпителизации раневого дефекта после аутодермопластики. Длительность лечения до полного заживления донорской раны в зоне применения исследуемого препарата составила 11,68 суток, что было значимо меньше, чем в зоне сравнения, — 15,22 суток.
3. Назначение инъекционного имплантата на основе гиалуроновой кислоты 1,5% и сукцината натрия способствовало уменьшению вегетативной активности восстановленных тканей, присущей патологическому рубцеобразованию. Выраженность показателей патологического рубцеобразования (зуд кожи, интенсивность окраски кожи, неравномерность рельефа кожи) в зоне использования исследуемого препарата была значимо меньше по всем показателям по сравнению с зоной контроля.
4. Исследуемый препарат — инъекционный имплантат на основе гиалуроновой кислоты 1,5% и сукцината натрия в предварительно наполненных шприцах производства ООО «Юрия-Фарм» — хорошо переносится больными и не вызывает побочных реакций при внутрикожном введении по периметру донорской раны.
5. Инъекционный имплантат на основе гиалуроновой кислоты 1,5% и сукцината натрия в предварительно наполненных шприцах производства ООО «Юрия-Фарм» может быть рекомендован к медицинскому применению в качестве средства, оптимизирующего лечение раневых дефектов на уровне сосочкового и сетчатого слоев дермы площадью до 5 % поверхности тела.
1. Christensen L., Breiting V., Janssen M., Vuust J., Hogdall E. Adverse reactions to injectable soft tissue permanent fillers // Aesthetic Plast. Surg. — 2005 Jan-Feb. — 29(1). — 34–48. — Epub. 2005 Mar 11.
2. Cosmetic Medical Devices and their FDA regulations // Arch. Dermatol. — 2006 Feb. — Vol. 142. — Р. 225–228; www.archdermatol.com.
3. Ghislanzoni M., Bianchi F., Barbareschi M., Alessi E. Cutaneous granulomatous reaction to injectable hyaluronic acid gel // Br. J. Dermatol. — 2006 Apr. — 154(4). — 755–8.
4. Коркунда С.В., Григорьева Т.Г. Патогенетические аспекты медикаментозного обеспечения в пластической хирургии // Kharkiv surgical school. — 2010. — № 1(39). — С. 37–41.
5. Liskina I.V., Derkach N.M., Kuzukova S.D. Comparative clinical-morphological investigation of influence on skin of two remedies on base of Hуaluronic acid // Украинский журнал дерматологии, венерологии, косметологии. — 2010. — № 2(37). — С. 57–63.
6. Rohrich R.J., Ghavami A., Acrosby М. The role of Hyaluronic acid fillers (Restylane) in facial cosmetic surgery: review and technical considerations // Plastic and Reconstructive Surgery Journal. — P. 41S–54S; www.PRSJournal.com.
7. Performance of medical device «Lhac1» (hyaluronic acid — collagenase) for the management of chronic venous ulcers. — ISR CTN Register (ISRCTN12579869).
8. Costagliola M., Agros M. Second-degree burns: a comparative, multicenter, randomized trial of hyaluronic acis plus silver sulfadiazine vs. sulfadiazine alone // Curr. Med. Res. Opin. — 2005 Aug. — 21(8). — 1235–40; PMID 16083533 [PubMed — indexed for Medline].
9. Gooderham M., Solish N. Use of hyaluronic acid for soft tissue augmentation of HIV-associated facial lipodystrophy // Dermatol. Surg. — 2005 Jan. — 31(1). — 104–8; PMID 15720106 [PubMed — indexed foMedline].
10. Hons K.B., Cantor A.J. Treating Recalcitrant Diabetic Wounds with Hzaluronicacid: A Review of Patients. — OWM Ostomy Wound Managementwww.o-wm.com.
11. Galasi G., Brun P., Radice M., Cortivo R., Zanon G.F., Genovese P., Abatangelo G. In vitro reconstracted dermis implanted in human wounds: degradation studies of HA-based supporting scaffold // Biomaterials. — 2000 Nov. — 21(21). — 2183–91; PMID: 10985492 [PubMed — indexed for Medline]. — www.ncbi.nlm.nih.gov.
12. Becker L.C., Bergfeld W.F., Belsito D.V., Klaassen C.D., Marks J.G. Jr, Shank R.C., Slaga T.J., Snyder P.W. Cosmetic Ingredient Review Expert Panel, Andersen FA. Final report of the safety assessment of hyaluronic acid, potassium hyaluronate, and sodium hyaluronate // Int. J. Toxicol. — 2009 Jul–Aug. — 28(4 Suppl.). — 5–67; PMID: 19636067 [PubMed — indexed for Medline].
13. Hasson A., Romero W.A. Treatment of facial atrophic scars with Esthélis, a hyaluronic acid filler with polydense cohesive matrix (CPM) // J. Drugs Dermatol. — 2010 Dec. — 9(12). — 1507–9; PMID: 21120258 [PubMed — indexed for Medline].
14. De Santis P., Savoia A. Dermofunctional treatment of hypertrophyc burn scars // Annals of Burns and Fire Disasters. — 1997 Sept. — Vol. X, № 3.
15. Glogau R.G., Kane M.A. Effect of injection techniques on the rate of local adverse events in patients implanted with nonanimal hyaluronic acid gel dermal fillers // Dermatol. Surg. — 2008 Jun. — 34(Suppl. 1). — S105–9; PMID: 18547173 [PubMed — indexed for Medline].
16. Williams S., Tamburic S., Stensvik H. Changes in skin physiology and clinical appearance after microdroplet placement of hyaluronic acid in aging hands // Journal of Cosmetic Dermatology. — 2009. — 8. — 216–225.
17. Dover J.S. Procedures in cosmetic dermatology / Ed. by Kenneth A.
18. Sredkova M., Gospodinov D., Yordanova I. In vitro assesment of 0,2% Zinc — Hyaluronate activity against microorganismus isolated from patients with difficult healing leg ulcers // Biotechnol. & Biotechnol. Eq. 20/2006/2. — Р. 110–114; www.diagnosisp.com.
19. European patent specification. Hyaluronic acid esters for the treatment of normotrophyc scarring of the skin. — EP 1 196 179 B1, www.data.epo.org.

/66/66.jpg)
/67/67.jpg)
/68/68.jpg)
/69/69.jpg)
/70/70.jpg)
/71/71.jpg)
/72/72.jpg)