Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Медикаментозна підготовка пацієнтів перед спінальною анестезією в абдомінальній хірургії
Авторы: Бишовець С.М. — Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Досліджено 40 пацієнтів, яким виконувалися абдомінальні операції під спінальною анестезією, та 20 добровольців (вік 48,5 ± 2,6 року; маса тіла 81,5 ± 3,5 кг; I–II за ASA). Проводили таку премедикацію: мелатонін орально 6 мг перед сном та за 1 годину до операції й перед сном у перший післяопераційний день, солпадеїн (1 капсула включала парацетамолу 500 мг, кодеїну 8 мг, кофеїну 30 мг) орально по 2 капсули за 2 години до втручання та кожні 8 годин протягом 2 діб, декскетопрофен внутрішньовенно 50 мг за 20 хв до операції та кожні 8 годин протягом 2 діб, нефопам внутрішньом’язово 20 мг за 40 хв до втручання, дексаметазон внутрішньовенно 8 мг за 30 хв до операції, ондансетрон внутрішньовенно 8 мг за 5 хв до втручання. Застосування мелатоніну та нефопаму перед операцією дозволяло ефективно корегувати психоемоційний статус та розлади сну в пацієнтів. Запобіжна аналгезія декскетопрофеном, парацетамолом, нефопамом та дексаметазоном покращувала аналгетичний профіль хворих у післяопераційному періоді. Поєднання дексаметазону з ондансетроном ефективно запобігало виникненню синдрому післяопераційної нудоти та блювання.
Исследование выполнено у 40 пациентов, которым проводились абдоминальные операции под спинальной анестезией, и 20 добровольцев (возраст 48,5 ± 2,6 года; масса тела 81,5 ± 3,5 кг; I–II класс по ASA). Проводили такую премедикацию: мелатонин орально 6 мг перед сном и за 1 ч до операции, а также перед сном в первый послеоперационный день, солпадеин (1 капсула включает парацетамола 500 мг, кодеина 8 мг, кофеина 30 мг) орально по 2 капсулы за 2 ч до вмешательства и каждые 8 ч на протяжении 2 суток, декскетопрофен внутривенно 50 мг за 20 мин до операции и каждые 8 ч на протяжении 2 суток, нефопам внутримышечно 20 мг за 40 мин до вмешательства, дексаметазон внутривенно 8 мг за 30 мин до операции, ондансетрон внутривенно 8 мг за 5 мин до вмешательства. Применение мелатонина и нефопама перед операцией позволяло эффективно корригировать психоэмоциональный статус, а также расстройства сна у пациентов. Упреждающее обезболивание декскетопрофеном, парацетамолом, нефопамом и дексаметазоном улучшало аналгетический профиль больных в послеоперационном периоде. Совместное применение дексаметазона и ондансетрона эффективно предупреждало развитие синдрома послеоперационной тошноты и рвоты.
The study involved 40 patients underwent abdominal surgery under spinal anaesthesia and 20 volunteers (aged 48.5 ± 2.6 years old; weight 81.5 ± 3.5 kg; I–II ASA). Premedication was following: melatonin — 6 mg orally before bed and an hour before surgery, and in the first postoperative day at bedtime; solpadein (1 capsule consists of paracetamol 500 mg, codeine 8 mg, caffeine 30 mg) 2 capsules orally 2 hours before the intervention and every 8 hours over 2 days; dexketoprofen 50 mg intravenously 20 minutes prior to surgery and every 8 hours over 2 days; nefopam 20 mg intramuscularly 40 minutes before surgery; dexamethasone 8 mg intravenously 30 minutes before surgery; ondansetron 8 mg intravenously 5 minutes before surgery. Melatonin and nefopam use before surgery has effectively allowed correct the psycho-emotional status, as well as sleep disorders in patients. Preemptive analgesia with dexketoprofen, paracetamol, nefopam and dexamethasone has improved the analgesic profile in patients in the postoperative period. The combined use of dexamethasone and ondansetronhas effectively prevented the development of the syndrome of postoperative nausea and vomiting.
премедикація, мелатонін, нефопам, парацетамол, декскетопрофен, дексаметазон, ондансетрон.
премедикация, мелатонин, нефопам, парацетамол, декскетопрофен, дексаметазон, ондансетрон.
premedication, melatonin, nefopam, paracetamol, dexketoprofen, dexamethasone, ondansetron.
Статья опубликована на с. 49-56
— Балаганов!.. Разденьте и приготовьте Берлагу.
І.А. Ільф, Є.П. Петров [11]
Медикаментозна підготовка пацієнтів є важливим етапом анестезіологічного забезпечення хірургічних операцій. Потрібно відмітити, що проблема премедикації, незважаючи на столітню історію, постійно переглядається. Науково-практичні аспекти передопераційної підготовки та премедикації постійно перебували у фокусі уваги кафедри анестезіології та інтенсивної терапії Національної академії післядипломної освіти імені П.Л. Шупика [4, 26, 32]. Одна з перших фундаментальних праць у вітчизняній анестезіології, присвячена вказаній вище проблемі, була опублікована В.О. Троцевичем у 1968 р. [26].
Очікування операції викликає відповідну емоційно-стресову реакцію організму [10]. Мозкові структури, що забезпечують генералізацію тривожності, належать до комплексу поведінкового гальмування та складаються із септуму, тенторіальної кори, зубчатої звивини й гіпокампу. Класична премедикація, іншими словами, медикаментозна підготовка хворого до анестезії та операції, мала такі завдання [9]: усунення тривоги, амнезія, седація, знеболювання, пригнічення вагусних рефлексів, гальмування слинотечі та бронхіальної секреції, пригнічення шлункової секреції й підвищення рН шлункового соку, запобігання нудоті та блюванню. Ці традиційні завдання, що іноді виконуються дотепер, можна прокоментувати таким чином.
На сьогодні найбільш важливою метою премедикації залишається усунення тривоги (анксіолізис). Седація потрібна тільки пацієнтам із лабільною психікою, хворим у стані збудження та в педіатричній практиці. Нині в Україні для цього широко застосовують сибазон. Він зменшує ступень тривожності, викликає антероградну амнезію, має достатньо тривалий ефект дії (період напіввиведення діазепаму й активних метаболітів — до 96 годин). Це погіршує керованість анестезії, утруднює післяопераційне відновлення та викликає когнітивні дисфункції [8]. Дуже важливим є забезпечення адекватного сну перед операцією й запобігання післяопераційній нудоті та блюванню (ПОНБ). Також потрібно відмітити, що якісна передопераційна медикаментозна підготовка разом з інтраопераційним знеболюванням повинна мати тривалий післяопераційний аналгетичний «хвіст».
Призначення опіоїдів необхідне пацієнтам, які страждають від болю, а в інших випадках опіоїдні аналгетики можуть тільки погіршити статус хворого за рахунок відомих побічних ефектів (депресія дихання, вивільнення гістаміну, ПОНБ, спазм сфінктера Одді тощо). Премедикція опіоїдами та антигістамінними препаратами не запобігає емоційному стресу й не забезпечує адекватність реакцій гомеостатичних систем [2, 21, 40, 50].
Усунення вагусних рефлексів, пригнічення слинотечі та бронхіальної секреції було вкрай необхідним в епоху історичних інгаляційних анестетиків, наприклад ефіру. Сучасні препарати для інгаляційної та інтравенозної анестезії не стимулюють слинотечу й бронхорею, за винятком кетаміну, що має незначний відповідний ефект. Рутинне застосування атропіну може спровокувати центральний холінергічний синдром (делірій, збудження, сплутана притомність), особливо в геронтологічній практиці. Відома парадоксальність атропіну пояснюється як ваголітичною, так і вагоміметичною дією [37]. Препарати атропінового ряду на 20–25 % збільшують об’єм «мертвого» простору, сприяють тахікардії, викликають сухість слизових, мідріаз, циклоплегію, а в дітей — гіпертермію. Інгібуючий вплив на шлункову секрецію відмічається тільки при введенні значних доз холінолітиків, що пов’язано з ризиком токсичних ефектів. Атропін пригнічує перистальтику, гальмує спорожнення шлунка та знижує тонус нижнього стравохідного сфінктера, що підвищує ризик аспірації. Однією з причин затримки сечі після операції є включення до премедикації атропіну [38]. Відносна брадикардія (55–60 уд/хв) під час анестезії не є показанням для призначення атропіну. У хворих з обмеженим коронарним резервом частота серцевих скорочень (ЧСС) має принципове значення, особливо це стосується інтраопераційного періоду. Існує прямий зв’язок між смертністю й ступенем тахікардії, причому ішемія міокарду еволюціонує при збільшенні ЧСС, а уповільнення пульсу призводить до зворотного ефекту [15].
Медикаментозне гальмування шлункової секреції та підвищення рН шлункового соку доцільне в таких випадках: стеноз пілоричного відділу шлунка, кишкова непрохідність, вагітність, грижа стравохідного отвору діафрагми, цукровий діабет (порушення евакуації за рахунок нейропатії), надмірна маса тіла (МТ), алкогольна або наркотична інтоксикація (уповільнення перистальтики). Але в багатьох випадках достатньо ефективним є назогастральне зондування. Зонд потрібно вилучити перед коіндукцією анестезії, тому що він, зменшуючи тонус нижнього стравохідного сфінктера, сприяє аспірації.
Також необхідно відмітити, що передопераційна медикаментозна підготовка, як, до речі, і будь-яка інтенсивна терапія, не повинна бути невиправдано місткою. Неадекватну премедикацію вважають анестезіологічним ускладненням [13].
Мета роботи — розробити медикаментозну підготовку пацієнтів перед спінальною анестезією (СА) в абдомінальній хірургії.
Матеріали та методи
Після отримання інформованої згоди в Київській міський клінічній лікарні № 8, Київській обласній клінічній лікарні та Київській міський клінічній лікарні швидкої медичної допомоги досліджено 20 добровольців (група К) та 40 пацієнтів, яких було рандомізовано у дві групи по 20 осіб у кожній. Групу П становили хворі (15 жінок і 5 чоловіків), яким виконувалися операції після премедикації. Спектр захворювань: жовчнокам’яна хвороба (12 пацієнтів), кіста яєчника (2 пацієнти), гострий апендицит (2 пацієнти), післяопераційна вентральна кіста (4 хворі). Фізичні параметри пацієнтів групи П: вік 50,6 ± 2,7 року, МТ 83,3 ± 2,9 кг, індекс МТ (ІМТ) 29,8 ± 1,2 кг/м2, фізичний статус — I–II клас за ASA.
Групу БП становили хворі (17 жінок і 3 чоловіки), яким виконувалися операції без премедикації. Спектр захворювань: жовчнокам’яна хвороба (14 пацієнтів), кіста яєчника (2 пацієнти), гострий апендицит й кіста яєчника (1 пацієнтка), післяопераційна вентральна кіста (2 пацієнти), гігантська ліпома (1 пацієнтка). Фізичні параметри пацієнтів групи БП: вік 52,8 ± 3,0 року, МТ 81,0 ± 3,5 кг, ІМТ 29,5 ± 1,2 кг/м2, фізичний статус — I–II клас за ASA.
Контрольна група К — добровольці (12 жінок і 8 чоловіків) — співробітники відділення інтенсивної терапії Київської обласної клінічної лікарні. Фізичні параметри волонтерів групи К: вік 42,1 ± 2,2 року, МТ 80,2 ± 4,0 кг, ІМТ 28,2 ± 1,2 кг/м2, фізичний статус — I–II клас за ASA.
Оцінювання ступеня тривоги та депресії добровольців і хворих і, відповідно, якості премедикації проводилося за допомогою модифікованого опитувальника Цунга (ОЦ) [1]. Вираженість післяопераційного болю визначали за числовою рейтинговою шкалою болю (ШБ) від 0 до 10 балів [5, 42] через 3, 10, 24 та 48 годин після операції.
Артеріальний тиск (АТ), ЧСС, пульсоксиметрію, що характеризують клінічний стан хворих та добровольців, визначали неінвазивно за допомогою мультифункціональних пристроїв Viridia T3 (Hewlett Packard) та Ohiko ON9000.
Запропонована методика премедикації була такою. Мелатонін призначався перорально в дозі 6 мг перед сном та за 1 годину до операції й перед сном у перший післяопераційний день. Солпадеїн, одна капсула якого складалася з 500 мг парацетамолу, 8 мг кодеїну фосфату та 30 мг кофеїну, хворі приймали орально по 2 капсули за 2 години до втручання та кожні 8 годин протягом 2 діб. Декскетопрофен (ДК) вводили внутрішньовенно по 50 мг за 20 хв до операції та кожні 8 годин протягом 2 діб. Нефопам призначали внутрішньом’язово в дозі 20 мг за 40 хв до втручання. Дексаметазон вводили внутрішньовенно в дозі 8 мг за 30 хв до операції. Ондансетрон призначали внутрішньовенно в дозі 8 мг за 5 хв до втручання.
У групі БП знеболювання в післяопераційному періоді проводили аналогічно групі П.
Усі операції виконувалися в плановому порядку в першу або другу чергу в період від 9:30 до 14:00. Метод знеболювання — СА гіпербаричним маркаїном (бупівакаїну гідрохлорид із додаванням декстрози) в дозі 15–20 мг та бупренорфіну гідрохлоридом у дозі 0,12 мг.
Матеріали оброблено з використанням пакету статистичного аналізу програм Excel Microsoft Office.
Результати дослідження та їх обговорення
Досліджувані групи були тотожними за фізичними параметрами. Після підсумовування балів за ОЦ у групі П одержали результат 5,4 ± 0,6 бала, 4 (20 %) пацієнти поскаржилися на інсомнію. У групі БП за ОЦ отримано 13,4 ± 0,6 бала, 13 (65 %) пацієнтів повідомили про розлади сну напередодні операції. Відповідний аналіз групи К дав показник за ОЦ 4,7 ± 0,5 бала, 2 (10 %) волонтерів поскаржилися на інсомнію. Порівняння отриманих результатів показує, що ступінь неспокою або депресивної тривожності в пацієнтів, яким планувались абдомінальні операції без премедикації, був у 2,9 раза вищим, ніж у волонтерів. Результати статистично вірогідні (р = 0,0001). При порівнянні балів за ОЦ в групах П і К визначений коефіцієнт становив 1,1 (статистично невірогідно, р = 0,232). На підставі отриманих даних можна зробити висновок про необхідність фармакологічної корекції психоемоційного статусу пацієнтів (анксіолізис), яким планується хірургічне втручання. Має бути проведена не тільки відповідна премедикація, а й лікування розладу сну напередодні операції.
Вегетативний баланс, що оцінювали за індексом I. Kérdö, в групі контролю дорівнював –4,5 бала. У групі БП відповідний показник був –0,8 бала, а в групі з премедикацією дорівнював –3,1 бала. У середньому в осіб всіх груп панувала помірна парасимпатикотонія. Трактування індексу I. Kérdö таке: при значенні «0» вегетативна рівновага характеризується як ейтонія, при позитивному показнику — симпатикотонія, а при від’ємному значенні — парасимпатикотонія. Якщо індекс I. Kérdö менше нуля, організм відновлюється швидше (зберігаються енергія й ресурси), а чим більше значення (чим далі від нульової позначки), тим суттєвіше виражене напруження (стан мобілізації). У групі К індекс > 5 спостерігався в 5 добровольців, від 0 до 5 — в 1 волонтера, а від’ємний — у 14 добровольців. Група БП мала такі дані: симпатикотонія — у 7 хворих, ейтонія — у 3 пацієнтів, а парасимпатикотонія — у 10 хворих. У групі П показник > 5 спостерігався в 5 пацієнтів, від 0 до 5 — у 1 хворого, від’ємний — у 14 хворих. Як видно, результати дослідження вегетативної рівноваги майже не відрізнялися в усіх групах.
У хворих групи БП були такі параметри гемодинаміки: АТ систолічний (АТС) 141,9 ± 3,7 мм рт.ст.; АТ діастолічний (АТД) 81,7 ± 2,9 мм рт.ст.; середній АТ (САТ) 101,9 ± 2,8 мм рт.ст.; ЧСС 83,9 ± 3,4 уд/хв. У добровольців групи К спостерігали такі параметри гемодинаміки: АТС 124,2 ± 3,0 мм рт.ст.; АТД 79,6 ± 2,3 мм рт.ст.; САТ 94,9 ± 2,5 мм рт.ст.; ЧСС 77,9 ± 2,0 уд/хв. Аналіз показників гемодинаміки висвітлив, що в групі БП вірогідно (р = 0,0001) АТС був на 12,5 % вищий, ніж у групі К. АТД, САТ й ЧСС також були невірогідно незначно більшими в групі БП на 2,6 % (р = 0,601), 6,9 % (р = 0,066) і 7,2 % (р = 0,139) відповідно.
У хворих групи БП відзначена частота дихання (ЧД) 18,9 ± 0,4 вдихів/хв і сатурація (SpO2) 95,8 ± 0,5 %. У добровольців групи К спостерігались ЧД 14,8 ± 0,6 вдихів/хв і SpO2 97,0 ± 0,3 %. Статистично вірогідно (р = 0,0001) ЧД на 21,7 % була більшою в пацієнтів без премедикації, ніж у волонтерів. SpO2 невірогідно (р = 0,05) на 1,2 % була кращою у добровольців, ніж у хворих групи БП.
Параметри гемодинаміки та дихання в групах БП й К наведено в табл. 1.
У хворих групи П були такі параметри гемодинаміки: АТС 128,5 ± 2,3 мм рт.ст.; АТД 82,0 ± 2,0 мм рт.ст.; САТ 97,8 ± 1,9 мм рт.ст.; ЧСС 76,2 ± 1,8 уд/хв. Аналіз показників гемодинаміки висвітлив, що в групі П невірогідно вищими були АТС — на 3,1 % (р = 0,270), АТД — на 2,9 % (р = 0,466) та САТ — на 3 % (р = 0,365) порівняно з групою К. ЧСС невірогідно була меншою в групі П на 2,2 % (р = 0,537), ніж у волонтерів.
У хворих групи П були ЧД 15,3 ± 0,5 вдихів/хв і SpO2 96,8 ± 0,3 %. Статистично незначно (р = 0,552) ЧД на 3,3 % була більшою в пацієнтів із премедикацією, ніж у добровольців. SpO2 невірогідно (р = 0,615) була кращою на 0,2 % у волонтерів, ніж у хворих групи П.
Параметри гемодинаміки та дихання в групах П й К наведено в табл. 2.
Якість постопераційного аналгетичного профілю в групах П та БП характеризується позитивно. Необхідності в додатковому призначенні опіоїдних аналгетиків не виникло. Динаміку ступеня післяопераційного болю в балах за ШБ відображено в табл. 3.
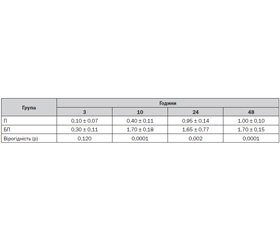
Хоча СА розчином гіпербаричного бупівакаїну гідрохлориду з ад’ювантом бупренорфіну гідрохлоридом ефективно знеболювала пацієнтів під час операції та в післяопераційному періоді, кращий аналгетичний профіль відмічався у хворих групи П. Так, через 3 години після операції в групі П рівень болю за ШБ був 0,10 ± 0,07 бала, а в групі БП — 0,30 ± 0,11 бала (результат невірогідний, р = 0,120). Через 10 годин досліджений показник вірогідно (р = 0,0001) був у 4,25 раза кращий у групі П, ніж у групі БП. Через 24 години відповідного періоду вірогідно (р = 0,002) більш якісна аналгезія (у 1,74 раза) була в пацієнтів групи П, ніж у хворих групи БП. Через 48 годин після операції ефективність знеболювання вірогідно (р = 0,0001) в 1,70 раза була кращою в групі П, ніж у групі БП.
ПОНБ відмічалися у 12 хворих групи БП (60 %). У групі П подібне ускладнення було у 2 пацієнтів (10 %).
Доцільність запропонованого медикаментозного супроводу пояснюється таким чином. Епіфіз продукує мелатонін — дуже важливий регуляторний нейропептид. Також джерелом цього гормону є шлунково-кишковий тракт, що виробляє мелатоніну набагато більше. Основний ефект мелатоніну полягає в гальмуванні секреції гонадотропіну, меншою мірою — кортикотропіну, тиреотропіну й соматотропіну. Під впливом мелатоніну в середньому мозку й гіпоталамусі підвищується вміст гамма-аміномасляної кислоти та серотоніну. Це призводить до нормалізації циркадних ритмів, позитивної зміни сну-неспання (стресорна інсомнія), відновлення ритмічності гонадотропних ефектів і статевої функції, підвищення розумової й фізичної працездатності, зменшення проявів стресових реакцій. Використання екзогенного мелатоніну сприяло більш високій якості сну без суттєвого підвищення рівня седації в хірургічних хворих [18]. Призначення мелатоніну нормалізувало циркадні ритми пацієнтів у відділеннях інтенсивної терапії й тим самим нівелювало побічні ефекти депривації сну [17].
Препарат має антиоксидантні та мембраностабілізуючи властивості, нормалізує проникність судинної стінки і її резистентність, поліпшує мікроциркуляцію. Мелатонін покращує функціональний стан ендотелію, нормалізує АТ, ЧСС й автономну нервову регуляцію. Препарат має імуномодулюючі ефекти [6]. Мелатонін є ефективним та безпечним гіпнотиком, анксіолітиком й антидепресантом, не викликає залежності. Препарату властиві позитивний вплив на когнітивну функцію та нейрогеропротекторна дія (хвороби Альцгеймера й Паркінсона, депресії, цереброваскулярна патологія) [3]. Нейропротекторна активність мелатоніну при глобальній або фокальній ішемії центральної нервової системи (ЦНС) була пов’язана зі зменшенням пошкодження нервових клітин та блокадою розвитку оксидативного стресу. Мелатонін знижує утворення нейротоксичних вільнорадикальних сполук, акумуляцію внутрішньоклітинного кальцію, накопичення глутамату й оксиду азоту, зменшує апоптоз та запобігає уповільненню нейротрофічних факторів росту [28].
Перспективне застосування мелатоніну в лікуванні гастроезофагеальної рефлюксної хвороби, а також при її поєднанні з хронічним обструктивним захворюванням легень [27]. Препарат значно зменшував частоту та інтенсивність регургітації й печії за рахунок позитивної дії на функцію нижнього стравохідного сфінктеру, що є важливим і для анестезіологічної практики. Мелатонін, протективно впливаючи на шлунок та підшлункову залозу (активація МТ2-рецепторів), прискорював загоєння виразок шлунково-кишкового тракту [41]. Препарат зменшував пошкодження при ішемії мозку, захищав від негативного впливу анестетиків шляхом гальмування індукованої останніми каспази-3, збільшуючи концентрацію антиапоптозного білка BCL-X [7].
Мелатонін бере участь у регуляції вуглеводного обміну й підвищує толерантність до глюкози. Це пояснюється специфічними рецепторами (МТ1) мелатоніну в підшлунковій залозі. Також гормон стимулює секрецію соматотропіну та соматомединів. Мелатонін позитивно впливав на регуляцію ліпідного обміну [31]. Призначення мелатоніну зменшувало нефротоксичність антибіотикотерапії (колістин), розширюючи терапевтичне вікно [59].
Нефопам — потужний й швидкодіючий неопіоїдний аналгетик. Він не пригнічує дихання, має антидепресорний й слабкі антихолінергічний, антигістамінний та симпатоміметичний ефекти. Механізм дії нефопаму пов’язаний із блоком зворотного захоплення норадреналіну, серотоніну й допаміну в синаптосомах ЦНС, а також із неконкурентним антагонізмом NMDA-рецепторів. Препарат діє на спінальному й супраспінальному рівнях, впливаючи на низхідні моноамінергічні тракти контролю больового імпульсу. Розроблений у 70-х роках минулого сторіччя як антидепресант, нефопам до сьогодні застосовується для лікування спастичних станів [12]. Препарат ефективно ліквідував періопераційне дрижання та частково нівелював симпатичний блок, викликаний нейроаксіальною анестезією [19]. Премедикація нефопамом сприяла більш тривалому післяопераційному знеболюванню й супроводжувалась меншою частотою побічних ефектів, ніж відповідне застосування промедолу [16]. Поєднане періопераційне застосування нефопаму та ДК у онкохірургічних хворих дозволяло досягнути більш якісного знеболювання, ніж традиційна аналгезія опіатами, при кращій переносимості й суттєво меншій частоті побічних ефектів [29].
Парацетамол — неопіоїдний аналгетик, якому властиві знеболюючий, антипіретичний і протизапальний ефекти. Механізм дії парацетамолу пов’язаний з інгібіцією циклооксигенази в ЦНС та впливом на центри болю й терморегуляції. Препарат незначно блокує утворення простагландинів у периферичних тканинах. Це обумовлює відсутність негативного впливу парацетамолу на водно-електролітний обмін та слизову травного тракту. З усіх неопіоїдних аналгетиків парацетамол є найбільш безпечним. На сьогодні в Європі парацетамол є базовим для 90–95 % хірургічних хворих у дозі 4 г на добу [20]. Acute Pain Management Scientific Evidence (2nd edition, 2005) свідчить: парацетамол є ефективним у лікуванні гострого болю (докази I рівня); поєднання парацетамолу з нестероїдними протизапальними препаратами (НПЗП) покращує якість знеболювання (докази I рівня); парацетамол є важливим компонентом мультимодальної аналгезії (докази II рівня).
Застосування парацетамолу разом із неселективними НПЗП при великих операціях статистично вірогідно зменшувало потребу в морфіні, прояви ПОНБ, але на 0,4 % підвищувало кровоточивість хірургічного поля [45]. Пероральне застосування парацетамолу та кодеїну або внутрішньовенне введення парацетамолу входить до багатьох періопераційних протоколів [33, 35, 39]. Пероральне призначення парацетамолу за 30 хв до хірургічної травми у 67 % пацієнтів створювало терапевтичну концентрацію препарату в плазмі (при внутрішньовенній формі — у 96 % хворих) [57], але перший варіант був комфортнішим й економічно вигіднішим. Однократне пероральне або парентеральне застосування парацетамолу на 50 % покращувало контроль болю в перші 4 години післяопераційного періоду, ніж плацебо [46]. Поєднання парацетамолу з нефопамом викликало ефективну синергічну аналгезію [58].Сумісне застосування парацетамолу й ДК за методикою превентивного знеболювання при СА відповідало стратегії антигіпералгезії та клінічно вагомо зменшувало інтенсивність післяопераційного болю [24]. Парацетамол значимо підвищував АТС та АТД, причому ЧСС і функціонування ендотелію, ранніх ендотеліальних клітин-попередників й тромбоцитів залишались незмінними [56]. Цей вплив є безумовно позитивним, враховуючи, що внаслідок СА розвивається прогнозована гіпотензія.
ДК — сучасний НПЗП, що має знеболюючу, протизапальну й жарознижуючу дії, пригнічуючи синтез простагландинів унаслідок неселективної блокади циклооксигенази. Препарат впливає на первинний (периферичний) тригерний механізм болю, що пов’язано з подразненням відповідних рецепторів простагландинами, кінінами й збуджуючими амінокислотами при хірургічній травмі. Також ДК проникає через гематоенцефалічний бар’єр і діє на рівні задніх стовпів спинного мозку, блокуючи проходження аферентних больових сигналів [12].
Періопераційне застосування неселективних НПЗП зменшувало потребу в опіоїдах, а також частоту ПОНБ [47]. Введення до початку операції НПЗП забезпечувало якісний контроль післяопераційного болю [14]. НПЗП зменшують втрату м’язової маси (гальмування синтезу PGE2 й зниження деградації протеїнів), позитивно впливають на коефіцієнт летальності хірургічних пацієнтів у стаціонарі [20]. Не доведено, що при нейроаксіальній анестезії НПЗП підвищують ризик утворення епідуральних гематом та геморагічних ускладнень в абдомінальній хірургії [20]. Широке впровадження НПЗП до схем мультимодальної аналгезії стало можливим завдяки відкриттю феномену стереоселективності та відповідному появленню нових, більш безпечних препаратів — правообертаючих енантіомерів (ДК).
Acute Pain Management Scientific Evidence (2nd edition, 2005) висвітлює такі властивості цих препаратів. НПЗП є ефективними в лікуванні гострого болю (докази I рівня). Селективні й неселективні НПЗП мають еквіпотенціальний аналгетичний ефект, а також тотожні в побічній дії на функцію нирок (докази I рівня). Ризик нефротоксичного впливу підвищується в пацієнтів при нирковій недостатності, гіповолемії й при паралельному призначенні інших нефротоксичних препаратів. НПЗП є важливим компонентом мультимодальної аналгезії (докази II рівня). Для післяопераційного знеболювання доцільне поєднане застосування ДК та нефопаму [30]. Комбінування НПЗП з парацетамолом забезпечувало набагато кращу аналгезію, ніж знеболювання кожним агентом окремо [48].
Дексаметазон — синтетичний глюкокортикоїд тривалої дії без мінералокортикоїдної активності. Основні ефекти дексаметазону: протизапальний, антиалергійний, протисвербіжний, антиексудативний, також препарат зменшує проникливість судин, гальмує міграцію лейкоцитів й фагоцитоз, блокує вивільнення кінінів та утворення антитіл. Дексаметазон у дозі 8 мг значимо зменшував післяопераційний біль, системні гострофазні реакції та розвиток синдрому ПОНБ [43], але при цьому підвищувався ризик післяопераційної інфекції [52]. Механізм протиблювотної дії дексаметазону пов’язаний із блокуванням активності простагландин-синтетази, що призводить до послаблення стимулюючої дії простагландинів на хеморецепторну тригерну зону, яка розташована на дні четвертого шлуночка головного мозку зовні гематоенцефалічного бар’єру [23]. Можливо, так само діють парацетамол і неселективні НПЗП (селективні НПЗП не гальмують розвиток ПОНБ). Поєднання дексаметазону, парацетамолу та ДК покращує антиеметичний ефект.
Після кесаревого розтину, що був виконаний під СА розчином гіпербаричного бупівакаїну з додаванням морфіну, попереднє введення 10 мг дексаметазону значно зменшувало інциденти ПОНБ, а також інтенсивність болю [36]. До того ж покращувалась післяопераційна аналгезія [34]. При порівнянні двох препаратів для антиеметичної профілактики при СА в акушерстві дексаметазон мав вірогідну перевагу перед метоклопрамідом [22].
Періопераційне застосування стероїдів покращувало результати після резекції печінки, зменшуючи ушкодження, пов’язане з ішемією-реперфузією й хірургічним стресом. Спостерігалось підвищення рівня інтерлейкіну-10, а показники білірубіну, інтерлейкіну-6 та С-реактивного протеїну знижувалися. Також аналіз розвитку інфекційних ускладнень і процесу загоювання ран не виявив різниці з контрольною групою [49]. Передопераційне застосування дексаметазону призводило до значимого зменшення післяопераційної астенії, що було пов’язане з послабленням ранньої перитонеальної відповіді цитокінів [60]. Значна передопераційна доза глюкокортикоїду перед СА вірогідно зменшувала післяопераційні біль, ПОНБ, а також втомлюваність протягом операційного дня. Призначення глюкокортикоїдів може викликати інсомнії [44]. Мелатонін є антагоністом кортизолу [6], тому застосування мелатоніну може нівелювати відповідні розлади сну. Запобіжне введення глюкокортикоїдів знижувало частоту ускладнень та зменшувало ліжко-день після великих абдомінальних хірургічних втручань унаслідок послаблення післяопераційної запальної відповіді [55].
Ондансетрон — протинудотний і протиблювотний препарат, механізм дії якого обумовлений конкурентною високоселективною блокадою центральних та периферичних 5НТ3-рецепторів серотоніну (рецептори тригерної зони блювотного центру) [23]. Препарат використовують для профілактики нудоти й блювання під час та після СА [25]. Поєднання ондансетрону з дексаметазоном було більш ефективним для терапії вказаної вище мети, ніж застосування одного ондансетрону у хворих, які отримують опіоїди [54]. До того ж внутрішньовенне введення 8 мг ондансетрону при СА зменшувало депресії АТС й САТ, що було прогнозованим (унаслідок десимпатизації), не впливаючи на ЧСС та АТД [51]. За даними [53], застосування 4 мг ондансетрону перед СА викликало меншу депресію АТД та зменшувало потребу у вазопресорі. Механізм цих позитивних ефектів ондансетрону пов’язано з блокадою серцевих серотонінових 5НТ3-рецепторів, що беруть участь у рефлексі Бецольда — Яриша.
Висновки
1. Застосування мелатоніну та нефопаму перед операцією дозволяло ефективно корегувати психоемоційний статус та розлади сну в пацієнтів.
2. Запобіжна аналгезія декскетопрофеном, парацетамолом, нефопамом та дексаметазоном покращувала аналгетичний профіль хворих у післяопераційному періоді.
3. Поєднання дексаметазону з ондансетроном ефективно запобігало виникненню синдрому післяопераційної нудоти та блювання.
1. Бишовець С.М. Оцінка ступеню неспокою перед спінальною анестезією в абдомінальній хірургії // Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. — 2009. — Вип. 18, кн. 1. — С. 13–19.
2. Бобринская И.Г., Ялтонский В.М., Хайкин С.С., Быкова О.А. Влияние премедикации на тревожность в предоперационном периоде женщин с гинекологическими заболеваниями // Общая реаниматология. — 2007. — Т. III, № 4. — С. 65–69.
3. Бурчинский С.Г. Мелатонин и его возможности в неврологической практике // Consilium medicum Ukraina. — 2013. — Т. 7, приложение 5. — С. 3–6.
4. Бышовец С.Н. Премедикация производными бензодиазепина в сочетании с клофелином // Материалы XVIII науч.-практ. конф. молодых ученых и специалистов КГИУВ. — К.: Киевская книжная типография научной книги, 1990. — С. 171–173.
5. Волочков В.А., Игнатов Ю.Д., Страшнов В.И. Болевые синдромы в анестезиологии и реаниматологии. — М.: МЕДпресс-информ, 2006. — 320 с.
6. Головач І.Ю. Новітні підходи до оптимізації застосування глюкокортикоїдів у ревматологічній практиці // Ревматология. — 2011. — № 1. — С. 15–20.
7. Грицук С.Ф., Мороз В.В., Порошенко Г.Г. Анестезия и механизмы защиты мозга // Вестник интенсивной терапии. — 2011. — № 1. — С. 61–66.
8. Доморацький О.Е. Стан когнітивних функцій хворих в періоперативному періоді при загальнохірургічних втручаннях, виконаних в умовах тотальної інтравенозної анестезії: Автореф. дис… канд. мед. наук: спец. 14.01.30 «Анестезіологія та інтенсивна терапія» / О.Е. Доморацький. — К.: Науковий світ, 2011. — 16 с.
9. Дормикум в анестезиологии и интенсивной терапии. — М.: Универсум Паблишинг, 1998. — 100 с.
10. Заболотских И.Б., Малышев Ю.П. На пути к индивидуальной премедикации. — Петрозаводск: ИнтелТек, 2006. — 80 с.
11. Ильф И.А., Петров Е.П. Двенадцать стульев. Золотой теленок. — М.: Гослитиздат, 1956. — 656 с.
12. Кабанова Н.В., Ясногор Л.А. Оптимизация послеоперационного обезболивания в абдоминальной хирургии: место Акупана в послеоперационном обезболивании хирургических пациентов // Острые и неотложные состояния в практике врача. — 2011. — № 1. — С. 42–45.
13. Кабанова Н.В., Ясногор Л.А. К вопросу о премедикации: компоненты, критерии адекватности (Обзор литературы) // Медицина неотложных состояний. — 2011. — № 4 (35). — С. 19–24.
14. Клигуненко Е.Н., Ехалов В.В., Кравец О.В., Кизь С.Г., Фурсенко А.Г., Галущак А.Я. Перспективы сочетанного применения НПВС и налоксона в периоперационном периоде // Біль, знеболювання і інтенсивна терапія. — 2010. — № 2-д. — С. 99–100.
15. Клиническое значение снижение частоты сердечных сокращений: мнение экспертов // Medicus Amicus. — 2006. — № 6. — С. 4.
16. Кобеляцкий Ю.Ю., Машин А.М., Рац И.Г., Голубничий В.А., Плис М.А., Захарченко С.С. Премедикация нефопамом при анестезии для обеспечения малоинвазивных хирургических вмешательств // Біль, знеболювання і інтенсивна терапія. — 2012. — № 1-д. — С. 208–209.
17. Лесной И.И. Коррекции сна у хирургических больных отделений интенсивной терапии // Український журнал екстремальної медицини імені Г.О. Можаєва. — 2011. — Т. 12, № 2. — С. 108–114.
18. Лесной И.И., Черний В.И. Выбор препаратов для седации и коррекции сна у хирургических больных в отделении интенсивной терапии // Біль, знеболювання і інтенсивна терапія. — 2011. — № 2. — С. 21–27.
19. Малеев С.Б. Решение проблемы периоперационной дрожи, индуцированной спинномозговой анестезией // Медицина неотложных состояний. — 2010. — № 4 (29). — С. 96–97.
20. Овечкин А.М., Свиридов С.В. Послеоперационная боль и обезболивание: современное состояние проблемы // Медицина неотложных состояний. — 2011. — № 6 (37). — С. 20–31.
21. Осипова Н.А., Абузарова Г.Р. Третий международный конгресс «Всемирный институт боли» (аналитический обзор) // Анестезиол. и реаниматол. — 2005. — № 5. — С. 73–76.
22. Погодин А.М., Шифман Е.М. Сравнение дексаметазона и метоклопрамида как средств профилактики тошноты и рвоты при спинномозговой анестезии во время операции кесарева сечения // Біль, знеболювання і інтенсивна терапія. — 2012. — № 1–д. — С. 406–408.
23. Просоленко К.О. Еметичний синдром при захворюваннях травного каналу // Гастроентерологія. — 2011. — № 2. — С. 44–47.
24. Строгуш О.М., Шлапак І.П., Дроботун О.В. Стратегія антигіпералгезії у травматології: варіант системної періоперативної мультимодальної аналгезії. 1. Оцінка ефективності післяопераційного знеболювання // Український журнал екстремальної медицини імені Г.О. Можаєва. — 2011. — Т. 12, № 2. — С. 92–102.
25. Суслов В.В., Фесенко У.А., Фесенко В.С. Спинальная анестезия и аналгезия: Руководство для врачей. — Харьков: СИМ, 2013. — 544 с.
26. Троцевич В.А. Клинико-фармакологические исследования анальгетического эффекта лекарственных средств и их сочетаний, наиболее часто применяемых для премедикации: Автореф. дис… канд. мед. наук. — К., 1968.
27. Фадеенко Г.Д., Каменир В.М. Динамика клинических проявлений у пациентов с гастроэзофагеальной рефлюксной болезнью в сочетании с хроническим обструктивным заболеванием легких на фоне лечения мелатонином // Сучасна гастроентерологія. — 2010. — № 3 (53). — С. 18–24.
28. Чекман И.С., Беленичев И.Ф., Горчакова Н.А., Кучеренко Л.И., Бухтиярова Н.В., Поготова Г.А. Антиоксиданты: клинико-фармакологический аспект // Український медичний часопис. — 2014. — № 1 (99). — С. 22–28.
29. Черний В.И., Ермилов Г.И., Колганова Е.А., Егоров А.А. Применение мультимодальной аналгезии с использованием акупана, дексалгина и налбуфина в периоперационном периоде // Медицина неотложных состояний. — 2011. — № 6 (37). — С. 39–44.
30. Черний В.И., Смирнова Н.Н., Егоров А.Н., Егоров А.А., Ступаченко Д.О., Горечий И.В. Полимодальная послеоперационная аналгезия акупаном, дексальгином и налбуфином при резекции легкого // Острые и неотложные состояния в практике врача. — 2013. — № 1. — С. 9–10.
31. Шатило В.Б., Бондаренко О.В., Антонюк-Щеглова І.А. Дисметаболічні фактори серцево-судинного ризику у хворих похилого віку на гіпертонічну хворобу та участь пінеальної залози в розвитку цих порушень // Український терапевтичний журнал. — 2011. — № 3. — С. 27–33.
32. Шлапак И.П., Бышовец С.Н., Лесной И.И., Недашковский С.М., Куцая Т.П. Клинические и фармакологические аспекты предоперационной подготовки и премедикации // Журнал практичного лікаря. — 2004. — № 3. — С. 48–53.
33. Allegaert K., Kulo A., Verbesselt R., Hopchet L., Deprest J., de Hoon J., Devlieger R., van de Velde M. The pharmacokinetics of high intravenous dose of paracetamol after caesarean delivery: the effect of gestational age // Eur. J. Anaesthesiol. — 2012. — Vol. 29 (10). — P. 484–488.
34. Allen T.K., Jones C.A., Habib A.S. Dexamethasone for the prophylaxis of postoperative nausea and vomiting associated with neuraxial morphine administration: a systematic review and meta-analysis // Anesth. Analg. — 2012. — Vol. 114 (4). — P. 813–822.
35. Brett C.N., Barnett S.G., Pearson J. Postoperative plasma paracetamol levels following oral or intravenous paracetamol administration: a double-blind randomized controlled trial // Anaesth. Intensive Care. — 2012. — Vol. 40 (1). — P. 166–171.
36. Cardoso M.M., Leite A.O., Santos E.A., Gozzani J.L., Mathias L.A. Effect of dexamethasone on prevention of postoperative nausea, vomiting and pain after caesarean section: randomized, placebo-controlled, double-blind trial // Eur. J. Anaesthesiol. — 2013. — Vol. 30 (3). — P. 102–105.
37. Domino E.F., Corssen G. Central and peripheral effects of muscarinic cholinergic blocking agents in man // Anesthesiology. — 1967. — Vol. 28. — P. 568.
38. Dreijer B., Møller M.H., Bartholdy J. Post-operative urinary retention in general surgical population // Eur. J. anaesthesiol. — 2011. — Vol. 28 (3). — P. 190–194.
39. Fassoulaki A., Melemeni A., Tsaroucha A., Paraskeva A. Perioperative pregabalin for acute and chronic pain after abdominal hysterectomy or myomectomy: a randomized controlled trial // Eur. J. Anaesthesiol. — 2012. — Vol. 29 (11). — P. 531–536.
40. Filey G.A., Stewart S.H., Buffet-Jerrott S. High levels of impulsivity may contraindicate midazolam premedication in children // Can. J. Anaesth. — 2006. — Vol. 53 (1). — P. 73–78.
41. Jaworek J., Brzozowski T., Konturek S.J. Melatonin as an organoprotector in the stomach and pancreas // J. Pineal. Res. — 2005. — Vol. 38 (2). — P. 73–83.
42. Kainzwaldner V., Rachinger-Adam B., Mioc-Curic T., Wöhrle T., Hinske L.C., Luchting B., Ewert T., Azad S.C. Quality of postoperative pain therapy: evaluation of an established anesthesiology acute pain service // Anaesthesist. — 2013. — Vol. 62 (6). — P. 453–459.
43. Karaman K., Bostanci E.B., Aksoy E., Ulas M., Yigit T., Erdemli M.O., Ercin U., Bilgihan A., Saydam G., Akoglu M. Effects of dexamethasone and pheniramine hydrogen maleate on stress response in patients undergoing elective laparoscopic cholecystectomy // Am. J. Surg. — 2013. — Vol. 205 (2). — P. 213–219.
44. Lunn T.H., Kristensen B.B., Andersen L., Husted H., Otte K.S., Gaarn-Larsen L., Kehlet H. Effect of high-dose preoperative methylprednisolone on pain and recovery after total knee arthroplasty: a randomized, placebo-controlled trial // Br. J. Anaesth. — 2011. — Vol. 106 (2). — P. 230–238.
45. Maund E., McDaid C., Rice S., Wright K., Jenkins B., Woolacott N. Paracetamol and selective and non-selective non-steroidal anti-inflammatory drugs for the reduction in morphine-related side-effects after major surgery: a systematic review // Br. J. Anaesth. — 2011. — Vol. 106 (3). — P. 292–297.
46. McNicol E.D., Tzortzopoulou A., Cepeda M.S., Francia M.B., Farhat T., Schumann R. Single-dose intravenous paracetamol or proparacetamol for prevention or treatment of postoperative pain: a systematic review and meta-analysis // Br. J. Anaesth. — 2011. — Vol. 106 (6). — P. 764–775.
47. Michelet D., Andreu-Gallien J., Bensalah T., Hilly J., Wood C., Nivoche Y., Mantz J., Dahmani S. A meta-analysis of the use of nonsteroidal anti-inflammatory drugs for pediatric postoperative pain // Anesth. Analg. — 2012. — Vol. 114 (2). — P. 393–406.
48. Ong C.K., Seymour R.A., Lirk P., Merry A.F. Combining paracetamol (acetaminophen) with nonsteroidal anti-inflammatory drugs: a qualitative systematic review of analgesic efficacy for acute postoperative pain // Anesth. Analg. — 2010. — Vol. 110 (4). — P. 1170–1179.
49. Orci L.A., Toso C., Mentha G., Morel P., Majno P.E. Systematic review and meta-analysis of the effect of perioperative steroids on ischaemia-reperfusion injury and surgical stress response in patients undergoing liver resection // Br. J. Surg. — 2013. — Vol. 100 (5). — P. 600–609.
50. Ornaque I., Carrero E., Villalonga A. Study of presurgical anxiety in urologic, gynecologic and ophthalmologic surgery as a function of the administration or non administration of anxiolytic premedication // Rev. Esp. Anestesiol. Reanim. — 2000. — Vol. 47 (4). — P.151–156.
51. Owerzuk R., Wenski W., Polak-Krzeminska A., Twardowski P., Arszulowicz R., Dylczyk-Sommer A., Wujtewicz M.A., Sawicka W., Morzuch E., Smietanski M., Wujtewicz M. Ondansetron given intravenously attenuates arterial blood pressure drop due to spinal anesthesia: a double-blind, placebo-controlled study // Reg. Anesth. Pain Med. — 2008. — Vol. 33 (4). — P. 332–339.
52. Percival V.G., Riddell J., Corcoran T.B. Single dose dexamethasone for postoperative nausea and vomiting — a matched case-control study of postoperative infection risk // Anaesth. Intensive Care. — 2010. — Vol. 38 (4). — P. 661–666.
53. Sahoo T., Sen Dasgupta C., Goswami A., Hazra A. Reduction in spinal-induced hypotension with ondansetron in parturients undergoing caesarean section: a double-blind randomised, placebo-controlled study // Int. J. Obstet. Anesth. — 2012. — Vol. 21 (1). — P. 24–28.
54. Song J.W., Park E.Y., Lee J.G., Park Y.S., Kang B.C., Shim Y.H. The effect of combining dexamethasone with ondansetron for nausea and vomiting associated with fentanyl-based intravenous patient-controlled analgesia // Anaesthesia. — 2011. — Vol. 66 (4). — P. 263–267.
55. Srinivasa S., Kahokehr A.A., Yu T.S., Hill A.G. Preoperative glucocorticoid use in major abdominal surgery: systematic review and meta-analysis of randomized trials // Ann. Surg. — 2011. — Vol. 254 (2). — P. 183–191.
56. Sudano I., Flammer A.J., Périat D., Enseleit F., Hermann M., Wolfrum M., Hirt A., Kaiser P., Hurlimann D., Neidhart M., Gay S., Holzmeister J., Nussberger J., Mocharla P., Landmesser U., Haile S.R., Corti R., Vanhoutte P.M., Lüscher T.F., Noll G., Ruschitzka F. Acetaminophen increases blood pressure in patients with coronary artery disease // Circulation. — 2010. — Vol. 122 (18). — P. 1789–1796.
57. Van der Westhuizen J., Kuo P.Y., Reed P.W., Holder K. Randomised controlled trial comparing oral and intravenous paracetamol (acetaminophen) plasma levels when given as preoperative analgesia // Anaesth. Intensive Care. — 2011. — Vol. 39 (2). — P. 242–246.
58. Van Elstraete A.C., Sitbon P. Median effective dose (ED50) of paracetamol and nefopam for postoperative pain: isobolographic analysis of their antinociceptive interaction // Minerva Anestesiol. — 2013. — Vol. 79 (3). — P. 232–239.
59. Yousef J.M., Chen G., Hill P.A., Nation R.L., Li J. Melatonin attenuates colistin-induced nephrotoxicity in rats // Antimicrob. Agents Chemother. — 2011. — Vol. 55 (9). — P. 3977–3984.
60. Zargar-Shoshtari K., Sammour T., Kahokehr A., Connolly A.B., Hill A.G. Randomized clinical trial of the effect of glucocorticoids on peritoneal inflammation and postoperative recovery after colectomy // Br. J. Surg. — 2009. — Vol. 96 (11). — P. 1253–1261.

/51/51.jpg)
/52/52.jpg)