Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Опыт использования экстракорпоральной мембранной оксигенации в лечении острого инфаркта миокарда, осложненного кардиогенным шоком
Авторы: Дружина А.Н., Лоскутов О.А. — Национальная медицинская академия последипломного образования имени П.Л. Шупика, кафедра анестезиологии и интенсивной терапии, г. Киев; ГУ «Институт сердца» МЗ Украины, г. Киев; Шлапак И.П. — Национальная медицинская академия последипломного образования имени П.Л. Шупика, кафедра анестезиологии и интенсивной терапии, г. Киев; Тодуров Б.М. — ГУ «Институт сердца» МЗ Украины, г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Работа посвящена описанию клинического случая использования экстракорпоральной мембранной оксигенации в лечении острого инфаркта миокарда, осложненного кардиогенным шоком. Целью работы является представление собственного опыта проведения эндоваскулярной реваскуляризации миокарда в условиях экстракорпоральной мембранной оксигенации.
Использование экстракорпоральной мембранной оксигенации у пациента с острым инфарктом миокарда на фоне кардиогенного шока позволило эффективно восстановить гемодинамику и в полном объеме провести реваскуляризацию миокарда.
Экстракорпоральную мембранную оксигенацию можно рассматривать как метод жизнеобеспечения при хирургическом лечении острого инфаркта миокарда, осложненного рефрактерным кардиогенным шоком.
Робота присвячена опису клінічного випадку використання екстракорпоральної мембранної оксигенації в лікуванні гострого інфаркту міокарда, ускладненого кардіогенним шоком. Метою роботи є надання власного досвіду проведення ендоваскулярної реваскуляризації міокарда в умовах екстракорпоральної мембранної оксигенації.
Використання екстракорпоральної мембранної оксигенації у пацієнта з гострим інфарктом міокарда на тлі кардіогенного шоку дозволило ефективно відновити гемодинаміку і в повному обсязі провести реваскуляризацію міокарда.
Екстракорпоральну мембранну оксигенацію можна розглядати як метод життєзабезпечення при хірургічному лікуванні гострого інфаркту міокарда, ускладненого рефрактерним кардіогенним шоком.
This paper describes a clinical case of using extracorporeal membrane oxygenation in the treatment of acute myocardial infarction complicated by cardiogenic shock. The objective of this paper is to present our own experience of endovascular myocardial revascularization under extracorporeal membrane oxygenation.
Application of extracorporeal membrane oxygenation in patient with acute myocardial infarction on the background of cardiogenic shock helped to restore hemodynamics effectively and to carry out myocardial revascularization on a full scale.
Extracorporeal membrane oxygenation can be considered as a method of life support during surgical treatment for acute myocardial infarction complicated by refractory cardiogenic shock.
инфаркт миокарда, кардиогенный шок, экстракорпоральная мембранная оксигенация.
інфаркт міокарда, кардіогенний шок, екстракорпоральна мембранна оксигенація.
myocardial infarction, cardiogenic shock, extracorporeal membrane oxygenation.
Статья опубликована на с. 174-177
Введение
Несмотря на успехи, достигнутые в лечении ишемической болезни сердца (ИБС), кардиогенный шок как осложнение острого инфаркта миокарда (ОИМ) продолжает оставаться актуальной проблемой современной медицины в связи со значительным процентом летальности, который может достигать 60–80 % [1, 2]. По данным H.R. Reynolds и соавт., кардиогенный шок развивается у 5–8 % пациентов, госпитализированных с диагнозом ОИМ и элевацией сегмента ST [3].
Лечение пациентов с ОИМ, осложненным кардиогенным шоком, в основном базируется на медикаментозной терапии, а также на использовании внутриаортальной баллонной контрпульсации как методике улучшения коронарного кровотока. Однако, согласно данным S.K. Sia и соавт., вышеуказанные методы терапии зачастую не приводят к эффективному улучшению сердечного выброса [4].
Тромболизис, проводимый позже 2 ч после возникновения ОИМ, также существенно не изменяет прогноз этих пациентов. В рандомизированном исследовании GISSI-1, в котором оценивалась эффективность стрептокиназы при лечении ОИМ, процент летальности у пациентов с кардиогенным шоком на фоне проводимого тромболизиса составил 71,1 %, тогда как в группе обследованных, у которых тромболизис не применялся, летальность регистрировалась в 69,9 % случаев [5].
Летальность у пациентов с ОИМ, осложненным кардиогенным шоком, достоверно может быть уменьшена только путем реваскуляризации миокарда [5]. Однако при проведении операций аортокоронарного шунтирования у подобного контингента пациентов процент фатальных осложнений остается довольно высоким и может достигать 27,9–41 % случаев [6, 7].
В настоящее время наиболее распространенным методом в лечении острого коронарного синдрома, ОИМ, осложненного кардиогенным шоком, является чрескожная ангиопластика [8, 9]. Однако и этот вид малоинвазивного хирургического вмешательства в 3–10 % случаев может сопровождаться летальными исходами [9].
В последнее время при проведении чрескожной ангиопластики у пациентов с ОИМ на фоне кардиогенного шока все чаще используется экстракорпоральная поддержка жизнедеятельности как метод для коррекции низкого сердечного выброса [5, 10].
Экстракорпоральная мембранная оксигенация (ЭКМО) — процедура продленного экстракорпорального кровообращения, выполняющая временное замещение сократительной функции миокарда и/или функции внешнего дыхания. Она используется у пациентов с остро развившейся и потенциально обратимой респираторной, сердечной или кардиореспираторной недостаточностью, которая не отвечает на стандартную терапию [5, 10].
Безопасность и эффективность использования методики ЭКМО в данный момент широко изучается, однако в литературе описаны лишь отдельные случаи использования данной методики при проведении чрескожной ангиопластики у пациентов с ОИМ, осложненным кардиогенным шоком.
Целью данной работы явилось представление клинического случая проведения экстракорпоральной мембранной оксигенации пациенту с острым инфарктом миокарда на фоне развившегося кардиогенного шока.
Клинический случай
Пациент Л. поступил в ГУ «Институт сердца» с диагнозом: ИБС, ОИМ, кардиогенный шок, отек легких. Начало заболевания — 4 часа от развития болевого приступа. Больной был ургентно доставлен в рентген-операционную для проведения коронарографии и возможной чрескожной ангиопластики.
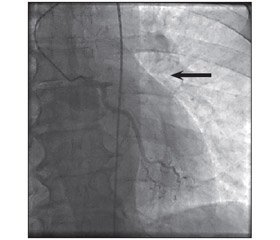
По результатам ангиографического исследования коронарных артерий диагностирована 100% окклюзия устья передней межжелудочковой ветви левой коронарной артерии (ПМЖВ ЛКА) (рис. 1).
/175/175.jpg)
В момент проведения диагностического исследования была констатирована остановка сердечной деятельности, начата сердечно-легочная реанимация (СЛР). Больной переведен на искусственную вентиляцию легких. Пациенту была налажена инфузия адреномиметиков (допамин — 10 мкг/кг/мин, адреналин — 0,15 мкг/кг/мин, норадреналин — 0,2 мкг/кг/мин) и вазодилататоров (нитроглицерин — 1 мкг/кг/мин). На фоне СЛР по методу Сельдингера в бедренную вену и бедренную артерию справа были установлены канюли с внутренним диаметром 23 и 21 Fr соответственно.
После гепаринизации (гепарин в/в в дозе 100 Ед/кг) пациент был подключен к аппарату для проведения ЭКМО System 1 (USA).
В качестве оксигенатора использовалась система Maquet PLS (Germany). Функцию нагнетания крови выполнял центрифужный насос Rotaflow (Germany). Кровоток в экстракорпоральном контуре поддерживался на уровне 4,5–5,0 л/мин, поток газовой смеси через оксигенатор — 3 л/мин, FiO2 подаваемой газовой смеси — 50 %.
После стабилизации гемодинамических параметров была прекращена инфузия адреналина и норадреналина, а доза допамина уменьшена до 7 мкг/кг/мин.
Слева трансфеморальным доступом проведена механическая реканализация окклюзии устья ПМЖВ ЛКА. На фоне хирургических манипуляций в области устья коронарной артерии возникали повторные эпизоды фибрилляции желудочков, что требовало проведения электрокардиоверсии с энергией разряда 200 Дж.
После предилатации в зоне окклюзии в устье ПМЖВ ЛКА был имплантирован коронарный стент размером 3,5 x 24 мм. Выполнена постдилатация баллоном высокого давления с размером 3,5 x 18 мм в проксимальной части стента.
На контрольной коронарной ангиографии после стентирования на фоне ЭКМО кровоток в оперированной коронарной артерии оценивался на уровне 3 баллов по шкале ТIМI (рис. 2).
/176/176.jpg)
После завершения оперативного вмешательства на фоне продолжающейся ЭКМО пациент был переведен в отделение интенсивной терапии, где была выполнена контрольная эхокардиография, по данным которой зоны нарушения локальной сократимости оставались прежними, регистрировалась акинезия верхушки левого желудочка (ЛЖ), а фракция выброса левого желудочка (ФВ ЛЖ) составляла 20 %.
Для поддержания достаточной реологии крови пациенту начата инфузия гепарина в дозе 5–10 ЕД/кг/ч для поддержания времени активированного свертывания в пределах 180–200 с.
Через 36 часов после начала ЭКМО, по данным эхокардиографического мониторинга, у больного появилась положительная динамика в виде повышения ФВ ЛЖ до 47 %.
Было принято решение уменьшать производительность ЭКМО под постоянным контролем гемодинамики. В последующие 6 часов на фоне стабильной гемодинамики проводилось снижение скорости экстракорпорального кровотока вплоть до полной его остановки.
Через 30 минут, после пробного отключения ЭКМО и эхокардиографического контроля (ФВ ЛЖ составляла 48 %), на фоне стабильной гемодинамики и без кардиотонической поддержки была выполнена деканюляция бедренных сосудов.
Через сутки пациент был переведен на самостоятельное дыхание. А на следующий день в удовлетворительном состоянии пациент был переведен из реанимации в отделение интенсивной терапии.
В последующем состояние пациента улучшилось, ангинозные боли не рецидивировали, гемодинамика была устойчивой.
Через неделю больной выписан из стационара в удовлетворительном состоянии. По данным эхокардиографического исследования ФВ ЛЖ увеличилась до 52 %.
Обсуждение
За последние несколько лет для поддержки кровообращения при ургентных и плановых вмешательствах на коронарных артериях у пациентов с крайне высоким риском операции (низкая фракция выброса ЛЖ, тяжелое поражение коронарных артерий, нестабильная гемодинамика, сопутствующая тяжелая патология) с успехом применяется ЭКМО [9, 10].
Так, J. Vainer и соавт. описывают успешное стентирование коронарных артерий у 15 пациентов высокого риска, которое проводилось на фоне ЭКМО, с последующим 100% отключением экстракорпоральной поддержки и 80% выживаемостью в течение последующего года [11]. В целом ряде работ других авторов также описывается успешное лечение пациентов с ОИМ, осложненным кардиогенным шоком, с использованием ЭКМО [9, 10].
Современные системы для экстракорпоральной мембранной оксигенации обладают высокой степенью надежности и безопасности для пациента, в том числе и при длительных (до 28 дней) процедурах механической поддержки кровообращения [12]. Они компактны, могут использоваться для ургентного подключения в любой клинике, с последующей транспортировкой в специализированное лечебное учреждение.
ЭКМО на сегодняшний день можно рассматривать как наиболее эффективный метод жизнеобеспечения при рефрактерном кардиогенном шоке, в том числе и на этапе диагностики и принятия решения о способе и методе дальнейшего лечения.
ЭКМО позволяет обеспечить необходимую степень поддержки кровообращения в период развития реперфузионного синдрома и тяжелой сердечной недостаточности, после ангиопластики инфарктзависимой артерии [12].
В исследованиях F. Bakhtiary и соавт. [13] продемонстрировано, что до 50–75 % больных с рефрактерным кардиогенным шоком могут быть спасены с помощью подключения ЭКМО, которая в современных условиях является высокоэффективной методикой поддержания адекватного сердечного выброса и коррекции гемодинамики.
Вывод
Проведение эндоваскулярной реваскуляризации путем чрескожной ангиопластики на фоне подключения экстракорпоральной мембранной оксигенации является эффективным методом лечения острого инфаркта миокарда, осложненного тяжелым кардиогенным шоком.
1. Trends in management and outcomes of patients with acute myocardial infarction complicated by cardiogenic shock / A. Babaev, P.D. Frederick, D.J. Pasta [et al.] // JAMA. — 2005. — Vol. 294, № 4. — Р. 448-454.
2. Topalian S. Cardiogenic shock / S. Topalian, F. Ginsberg, J.E. Parrillo // Crit. Care Med. — 2008. — Vol. 36(1 Suppl.). — Р. 66-74.
3. Reynolds H.R. Cardiogenic shock: current concepts and improving outcomes / H.R. Reynolds, J.S. Hochman // Circulation. — 2008. — Vol. 117, № 5. — Р. 686-697.
4. Double vessel acute myocardial infarction showing simultaneous total occlusion of left anterior descending artery and right coronary artery / S.K. Sia, C.N. Huang, K.C. Ueng [et al.] // Circ. J. — 2008. — Vol. 72, № 6. — Р. 1034-1036.
5. Mechanical circulatory support in cardiogenic shock — what every interventional cardiologist should know / L. Pyka, D. Pres, R. Przybylski [et al.] // Postepy Kardiol. Interwencyjnej. — 2014. — Vol. 10, № 3. — Р. 195-200.
6. Cardiogenic shock complicating acute myocardial infarction-etiologies, management and outcome: a report from the shock Trial Registry. Should we emergently revascularize occluded coronaries for cardiogenic shock? / J.S. Hochman, C.E. Buller, L.A. Sleeper [et al.] // J. Am. Coll Cardiol. — 2000. — Vol. 36(3 Suppl. A). — Р. 1063-1070.
7. Trends in cardiogenic shock: report from the SHOCK Study. The should we emergently revascularize occluded coronaries for cardiogenic shock? / L. Carnendran, R. Abboud, L.A. Sleeper [et al.] // Eur. Heart J. — 2001. — Vol. 22, № 6. — Р. 472-478.
8. Impact of thrombus aspiration during primary percutaneous coronary intervention in cardiogenic shock complicating ST-segment elevation myocardial infarction / F. Tomassini, A. Gagnor, N. Montali [et al.] // Cardiovasc. Revasc. Med. — 2013. — Vol. 14, № 6. — Р. 307-310.
9. Clinical outcomes after PCI for acute coronary syndrome in unprotected left main coronary artery disease: insights from the Swiss Acute Left Main Coronary Vessel Percutaneous Management (SALVage) study / S. Puricel, P. Adorjan, M. Oberhаnsli [et al.] // EuroIntervention. — 2011. — Vol. 7, № 6. — Р. 697-704.
10. ECMO as a bridge to highriskrotablation of heavily calcified coronary arteries / P. Dardas, N. Mezilis, V. Ninios [et al.] // Herz. — 2012. — Vol. 37, № 2. — Р. 225-230.
11. Elective high risk percutaneous coronary interventions supported by extracorporeal life support / J. Vainer, V. van Ommen, J. Maessen [et al.] // Am. J. Cardiol. — 2007. — Vol. 99, № 6. — Р. 771-773.
12. Westaby S. Cardiogenic shock in ACS. Part 2: role of mechanical circulatory support / S.Westaby, K. Anastasiadis, G.M. Wieselthaler // Nat. Rev. Cardiol. — 2012. — Vol. 9, № 4. — Р. 195-208.
13. Veno arterial extracorporeal membrane oxygenation for treatment of cardiogenic shock: clinical experiences in 45 adult patients / F. Bakhtiary, H. Keller, S. Dogan [et al.] // J. Thorac. Cardiovasc. Surg. — 2008. — Vol. 135, № 2. — Р. 382-388.