Журнал «Медицина неотложных состояний» 3 (66) 2015
Вернуться к номеру
Инфекционный эндокардит: диагноз и дифференциальная диагностика
Авторы: Никонов В.В., Нудьга А.Н., Киношенко Е.И., Ковалева Е.А. — Харьковская медицинская академия последипломного образования; Харьковская городская клиническая больница скорой и неотложной медицинской помощи; Городской центр лечения инфекционных эндокардитов, г. Харьков
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 13-19
Проблема диагностики, а следовательно, и адекватного лечения «лихорадки неясного генеза» очень актуальна как для госпитального, так и для догоспитального этапов. И это связано в первую очередь с тем, что с такой проблемой больной неделями обращается за помощью — а ответа нет, диагноза нет, лечения нет. И как следствие — инвалидность, хронизация процесса, дорогостоящее обследование, в худшем случае через какое-то время мы разводим руками и уже сделать ничего не можем.
Если взять «Дифдиагностику» Хегглина, Виноградова, то в разделе «Лихорадка» мы найдем множество интересных, толковых диагностических алгоритмов, которые могут (правда, не всегда) помочь решить эту задачу. Но кто заглядывает в эти книги?
Мы не будем пересказывать эти книги, а остановимся на одной из частых причин этой так называемой «лихорадки неясного генеза».
Речь пойдет об инфекционном эндокардите (ИЭ). Много десятилетий назад это заболевание называлось «септический эндокардит», и чаще всего врачи того времени ставили этот диагноз на фоне ревматической болезни сердца. Это было связано с наличием у больного выраженного септического компонента, что трактовалось как вторичный септический эндокардит.
В более поздний период появился диагноз «бактериальный эндокардит», и в настоящее время это ИЭ, так как возбудителем этой болезни могут быть не только бактерии, но и грибы, вирусы и др.
От прогресса в медицине никуда не уйти, и в последние десятилетия отмечаются протезные эндокардиты, электродные эндокардиты (например, электроды кардиостимулятора), причиной чему может стать и длительное нахождение катетеров в магистральных сосудах и т.д. В то же время мы забываем, что любое вмешательство, будь то эндоскопическое исследование, экстракция зуба, цистоскопия и т.д., обязательно приводит к бактериемии, а если она массивная и по характеру возбудителя агрессивная, то может свидетельствовать об ИЭ. Как следствие возникают одонтогенный, урологический сепсис и поражение клапанов. И нужно быть настороже, если у таких больных отмечается лихорадочное состояние через несколько дней после, например, малой хирургии или, как ее еще называют, хирургии одного дня. И если возникает хоть малейшая опасность ИЭ, должна быть проведена адекватная антибиотикопрофилактика до начала вмешательства. То есть прежде чем напасть на больного с эндоскопом, оцените опасность возникновения ИЭ.
Особое значение имеет ИЭ наркоманов: появляется лихорадка плюс внутривенно вводятся наркотические вещества, что практически всегда вызывает сепсис и поражение клапанов. И если раньше, в далекие времена, ИЭ наркоманов был редкостью, то на сегодняшний день только в нашем центре при ХГКБСНМП за последний год наблюдалось не менее 15 больных с таким диагнозом. Как правило, или с микст-инфекцией, или с полиорганной патологией, или с септической пневмонией, или с септическими отсевами в жизненно важных органах, или после безуспешного лечения (часто в связи с финансовым положением больного).
Иногда поражает многогранность причин этого заболевания. У одного молодого больного после успешного проведения тромболизиса по поводу ИИ (ревматизм, искусственный клапан, фибрилляция предсердия) через 4 дня появилась гектическая лихорадка (поставлен диагноз «сепсис»), а еще через 2–3 дня — вегетации на протезном клапане, т.е. острый вторичный ИЭ. Антибактериальной профилактики не было, так как не было настороженности у наших коллег. И, к сожалению, такие случаи не редкость.
Вы, наверное, обратили внимание на то, что очень часто мы отождествляем слово «сепсис» и ИЭ. По нашему глубокому убеждению, к ИЭ, острому или подострому, первичному или вторичному, необходимо относиться как к сепсису, так как адекватные диагностика и лечение (а слово «сепсис» настораживает) позволяют добиться определенных успехов в лечении или, как мы это еще называем, контроля за инфекцией, в то же время не каждый септический процесс заканчивается инфекционным эндокардитом.
Об этом еще в 2001 году говорил В.П. Тюрин. В его классификации приведены определения острого, подострого, хронического рецидивирующего (затяжного) вариантов ИЭ по этиологическим и временным критериям. В основу характеристики острого и подострого течения положены высокая активность инфекционно-воспалительного процесса, выраженность клинической картины, степень вирулентности микроорганизмов. Разработаны критерии выздоровления, рецидива, повторного ИЭ.
Острый (септический) ИЭ — воспалительное поражение эндокарда длительностью до 2 месяцев, вызванное высоковирулентными микроорганизмами, протекающее с выраженными инфекционно-токсическими (септическими) проявлениями, частым формированием гнойных метастазов в различные органы и ткани, преимущественно без иммунных проявлений, которые не успевают развиться из-за скоротечности болезни. Острый ИЭ — осложнение сепсиса.
Подострый ИЭ — особая форма сепсиса продолжительностью более 2 месяцев, обусловленная наличием внутрисердечного инфекционного очага, который вызывает рецидивирующую септицемию, эмболии, нарастающие изменения в иммунной системе, приводящие к развитию нефрита, васкулита, синовита, полисерозита. Этот вариант заболевания возникает при маловирулентном возбудителе (энтерококк, эпидермальный стафилококк, гемофилюс), определенных соотношениях патогенности возбудителя и реактивности организма, а также при недостаточно эффективной антибактериальной терапии.
Затяжной (хронический рецидивирующий) ИЭ является этиологическим вариантом подострого эндокардита. Его вызывают зеленящий стрептококк или близкие к нему штаммы стрептококка. Характеризуется пролонгированным течением (более 6 месяцев), отсутствием гнойных метастазов, преобладанием иммунопатологических проявлений, обусловленных поражением циркулирующими иммунными комплексами.
Пациента следует считать выздоровевшим через один год после завершения лечения по поводу ИЭ, если в течение этого срока сохранялись нормальные температура тела, СОЭ, не выделялся возбудитель из крови. Рецидивы болезни классифицируют на ранние (в течение 2–3 месяцев после лечения) и поздние (от 3 до 12 месяцев). Повторным ИЭ считается развитие заболевания через один год и более после завершения лечения или выделение из крови другого возбудителя в срок до одного года.
Особыми формами ИЭ являются ИЭ протеза клапана, у наркоманов, у пациентов с имплантированным электрокардиостимулятором, у пациентов с трансплантированным целым органом, у пациентов, находящихся на программном гемодиализе, нозокомиальный ИЭ, ИЭ у людей пожилого и старческого возраста.
Современное клиническое течение ИЭ характеризуется: преобладанием острых форм эндокардита; возрастанием числа атипичных вариантов течения заболевания со стертой клинической симптоматикой; преобладанием иммунопатологических проявлений (васкулит, миокардит, гломерулонефрит), иногда выступающих на первый план в клинической картине заболевания. Большинство исследователей отрицают существование особой хронической (затяжной, рецидивирующей) формы инфекционного эндокардита, поскольку рецидивы заболевания — это лишь результат неадекватного лечения больных подострым ИЭ.
Клиническая картина ИЭ отличается большим многообразием симптомов. Помимо типичных клинических проявлений, эндокардит может протекать атипично, под маской других заболеваний:
1. Общие: недомогание, анорексия, уменьшение массы тела, бледность кожных покровов, ночная потливость.
2. Со стороны сердца: миокардит, перикардит, поражение клапанов, инфаркт (шумы, нарушения ритма сердца, сердечная недостаточность).
3. Со стороны легких: чаще наблюдаются при поражении клапанов правых отделов сердца и обусловлены развитием повторных инфаркт-пневмоний, инфаркта легкого (плеврит, кровохарканье, отек легких).
4. Со стороны органа зрения: внезапная слепота, петехии на веках, на глазном дне — петехиальные кровоизлияния и пятна Рота (белые округлые пятна диаметром 1–2 мм, расположенные поверхностно, иногда закрывающие сосуды сетчатки, состоящие из скоплений клеток, образовавшихся вследствие инфарктов сетчатки), отек и неврит зрительного нерва.
5. Церебральные: протекают под видом острого нарушения мозгового кровообращения, реже — менингита или менингоэнцефалита (гемиплегия, афазия, атаксия, головная боль, психические нарушения).
6. Почечные: проявляются симптомами диффузного гломерулонефрита или инфаркта почки (протеинурия, гематурия, гипертензивный криз).
7. Гематологические: проявляются анемией.
8. Со стороны опорно-двигательного аппарата: артрит, остеомиелит.
9. Сосудистые: воспроизводят клинику системного васкулита, тромбангиита (геморрагический синдром, тромбоэмболические осложнения (ТЭО)).
Большие трудности возникают при диагностике инфекционного эндокардита протезированных клапанов (ИЭПК), несмотря на то, что внимание врачей привлечено к факту имплантации искусственного клапана. Отсутствие гемодинамических нарушений или признаков дисфункции протеза даже при транзиторной бактериемии не позволяет считать диагноз верифицированным. Диагностическое значение придают изменениям аускультативной картины со стороны сердца, при развитии парапротезной фистулы в аортальной позиции выявляют диастолический шум, нередко быстро прогрессирует сердечная недостаточность (тромбоз механического протеза). Эхокардиография в диагностике ИЭПК (особенно шарикового протеза) малоинформативна, лишь в отдельных случаях позволяет обнаружить тромбоз механического протеза и вегетации.
Диагностика инфекционного эндокардита у больных пожилого возраста особенно затруднительна, причем число диагностических ошибок достигает 50 %.
Инфекционный эндокардит, являющийся полиорганным заболеванием, может манифестировать симптомами, обусловленными поражением не только сердца, но и других органов и систем. В связи с этим на первый план могут выступать следующие симптомы: отеки под глазами, кровь в моче, головные боли, боли в поясничной области, нарушения мочеиспускания (симптомы гломерулонефрита или инфаркта почки); интенсивные головные боли, головокружения, тошнота, рвота, общемозговые и очаговые неврологические симптомы (цереброваскулит или тромбоэмболия мозговых сосудов с развитием ишемического инсульта); резкие боли в левом подреберье (инфаркт селезенки); высыпания на коже по типу геморрагического васкулита; клинические проявления инфарктной пневмонии; внезапная потеря зрения; боли в суставах.
Полиморфизм клинической картины ИЭ определяется полиорганным поражением. Для современного течения заболевания свойственно развитие множества осложнений, которые формируют ведущую органную патологию. Частыми осложнениями ИЭ являются: со стороны сердца — миокардит, перикардит, абсцессы, нарушение ритма и проводимости; почек — инфаркт, диффузный гломерулонефрит, очаговый нефрит, нефротический синдром, острая почечная недостаточность; легких — тромбоэмболия легочных артерий (ТЭЛА), инфаркт-пневмония, плеврит, абсцесс, легочная гипертензия; печени — гепатит, абсцесс, цирроз; селезенки — спленомегалия, инфаркт, абсцесс; нервной системы — острое нарушение мозгового кровообращения, менингит, менингоэнцефалит, абсцессы головного мозга; сосудов — васкулит, эмболии, аневризмы, тромбозы. Фатальными осложнениями инфекционного эндокардита являются: септический шок, респираторный дистресс-синдром, полиорганная недостаточность, острая сердечная недостаточность, эмболии в головной мозг, сердце.
В сравнении с серединой XX столетия в последние десятилетия увеличилось количество ТЭО. По-видимому, это обусловлено значительным ростом первичных форм инфекционного эндокардита (до 50–75 %). Если ранее ТЭО наблюдали у 25–31 % больных, то в настоящее время — у 75–85 %. Эмболии и инфаркты внутренних органов определяются у 35 % больных, множественные эмболические осложнения — у 38 %.
Структура ТЭО при современном течении ИЭ следующая: инфаркт селезенки — 41 % случаев, эмболии головного мозга — 35 %, эмболии в конечности — 25 %, эмболии в коронарные артерии — 15,5 %, инфаркты легких — 8,5 %, эмболии в артерии сетчатки — 2,8 %. В 2–8,5 % случаев ИЭ развиваются эмбологенные инфаркты миокарда, которые в 50–60-е годы выявлялись в 0,8–1 % случаев. Их происхождение обусловлено попаданием в венечные артерии тромботических частиц из микробных вегетаций (MB) и обызвествленных наложений клапанов.
В последние десятилетия ТЭО церебральных артерий стали наблюдаться значительно чаще (22 %), чем в 50–60-е годы (8–11 %). В 80–90-е годы частота выявления церебральных осложнений у больных ИЭ составила 6,7–41 %, среди них чаще встречались инфаркты головного мозга (24–64,6 %), внутримозговые гематомы (5,6–32 %), интракраниальные микотические аневризмы (17–24 %), менингиты (1–14 %), абсцессы (2,8 %), субарахноидальные кровоизлияния и артерииты (4–7,6 %). Смертность больных ИЭ с церебральными осложнениями достигает 39–74 %.
На развитие ТЭО оказывают влияние вид бактерий, локализация инфекционного очага на клапанах сердца, размер, форма, степень подвижности MB. Эмболические осложнения чаще диагностируют при стафилококковом (65 %), несколько реже при стрептококковом (34,8 %), энтерококковом ИЭ (33 %). В сравнении с серединой XX столетия увеличилось количество инфарктов и абсцессов селезенки. На современном этапе их удельный вес в патологии селезенки составляет 12–46 и 6 % соответственно. Чаще развиваются ишемические (55 %), реже — геморрагические (45 %) инфаркты селезенки, эмболии артерий почек развиваются у 9–17 % больных. Значительно увеличилось количество эмболий легочной артерии, которые выявляют в 44–56 % случаев ИЭ у наркоманов. Как правило, это множественные легочные эмболии с клиникой ТЭЛА, осложняющиеся в 12–27 % инфаркт-пневмониями и абсцессами легких. Легочно-плевральные осложнения развиваются у 75 % больных ИЭ.
В настоящее время гломерулонефрит, являющийся одним из иммунных осложнений ИЭ, встречается реже (40–56 %). Это осложнение диагностируется клинически у 8–32 % больных. Значительно чаще патология почек проявляется умеренным мочевым синдромом (до 67–78 %). Нефротический синдром и острая почечная недостаточность развиваются редко. Спленомегалия регистрируется в 21–67,5 % случаев. Миокардит при современном течении первичного ИЭ диагностируется клиницистами у 23–54 % больных, а патологоанатомами — у 86 %.
Распространение новых клинических форм болезни (ИЭ протезного клапана, ИЭ у наркоманов) вызвано увеличением числа кардиохирургических операций, эпидемией внутривенной наркомании, иммунодефицитом. Заболеваемость ИЭ у наркоманов составляет 2–6 % в год, что значительно превышает частоту встречаемости ИЭ в общей популяции. Эта группа больных ИЭ характеризуется преимущественным поражением ТК, клапана легочной артерии, эндокарда правых предсердия и желудочка.
Выделение в особую форму ИЭ у наркоманов вызвано рядом особенностей: атипичностью клинической картины, поражением легких в результате ТЭЛА, выраженностью септических проявлений, ранним развитием сепсиса и полиорганной недостаточности, резистентностью к антибиотикам.
Наиболее частым возбудителем ИЭ правых камер сердца является золотистый стафилококк, при котором резистентность к антибиотикам возникает у 90 % больных в течение 1–2 недель. Многие авторы считают золотистый стафилококк специфическим возбудителем ИЭ у наркоманов. Важность акцентирования внимания на этиологическом факторе обусловлена высокой смертностью в этой группе больных — 70–80 %.
Причинами развития ИЭ с преимущественным поражением правых камер сердца могут быть длительные катетеризации вен, внутрисердечные диагностические и лечебные манипуляции (зондирование сердца, длительное использование катетера Svan-Ganz и т.д.). Чаще инфицируются гемодиализные шунты (57–61 %), внутривенные катетеры (21 %) и катетеры Svan-Ganz (18 %), реже — катетеры подключичной и яремной вен (10 %), легочной артерии (8–8,5 %).
Клиническое течение ИЭ правых камер сердца весьма неспецифично, что обусловливает частые ошибки и трудности в диагностике. Наиболее типично начало заболевания с развитием множественных легочных инфекционных очагов. Весьма характерна манифестация с «лихорадки неясного генеза», которая является характерным симптомом и встречается у 90–95 % больных. Появление озноба сопровождается обильным потоотделением без улучшения самочувствия больных. Приблизительно у одной трети пациентов наблюдаются петехии и геморрагическая сыпь. Изменения центральной гемодинамики при разрушении ТК менее выражены, чем при поражении митрального и аортального клапанов, поэтому СН III–IV ФК развивается на поздних стадиях заболевания. Тромбоэмболии легочной артерии часто осложняются инфаркт-пневмониями, абсцессами легких и двусторонним пневмотораксом.
После хирургического лечения врожденных и приобретенных пороков сердца развивается ИЭПК (11–18 %). Термин «ИЭПК» характеризует генерализованную реакцию организма и подразумевает воспалительные изменения в эндокарде. Эта форма ИЭ является вариантом ангиогенного сепсиса с первичным очагом в протезе клапана. Риск развития ИЭ в течение первого года после имплантации искусственного клапана составляет 2–4 %, значительно увеличивается у пациентов пожилого возраста. Летальность при этой форме ИЭ составляет 23–80 %.
Частота возникновения ИЭ значительно выше при протезировании аортального клапана, что обусловлено продолжительностью операции, большими гемодинамическими нагрузками и турбулентным кровотоком на искусственном клапане. По времени возникновения различают ранний (в течение 60 дней после операции) и поздний (позднее 60 дней) ИЭПК. Деление на ранний и поздний ИЭ вызвано особенностями микробиологических, клинических и диагностических данных, течением и прогнозом заболевания.
За последние 20–30 лет этиология ИЭПК существенно изменилась. Основными возбудителями рассматриваемой формы ИЭ являются эпидермальный и золотистый стафилококк. Все большее значение приобретают условно-патогенная микрофлора, грамотрицательные аэробы, стрептококки, грибы. Их видовой состав сходен с ИЭ нативных клапанов. Однако количество положительных гемокультур выше: грамотрицательная микрофлора — 20 %, грибы — 10–12 %, стрептококки — 5–10 %, дифтероиды — 8–10 %, другие бактерии — 5–10 %.
Смертность при ИЭПК, вызванном Staph.aureus, составляет 86–90 %, а при ИЭ, вызванном Staph.еpidermidis, — 52–60 %. Инфекционный эндокардит протеза клапана, вызванный грамотрицательными бактериями, встречается в 2–4,6 % случаев. Грамотрицательные аэробы выделяются в 20 % случаев раннего и в 10 % случаев позднего ИЭПК. Спектр грамотрицательных бактерий довольно широк: Hemophilus species, E.coli, Klehsiella species, Proteuss pecies, Pseudomonas species, Serratia, Alcaligenes feacalis, Eikenella corrodens.
Инфицирование во многом определяется физическими свойствами и химическим составом имплантируемого клапана, способностью бактерий к адгезии на шовном материале. Инфицирование может начинаться с абактериальных тромботических наложений при транзиторной бактериемии. За счет адгезии стафилококков на внутрисердечных швах развивается ранний послеоперационный ИЭПК. Дополнительными периоперационными источниками инфекции являются артериальные системы, внутривенные и уретральные катетеры, сердечные заплаты, эндотрахеальные трубки. При имплантации протеза миокард становится более восприимчивым к инфекции. Воспаление начинается с манжеты искусственного клапана и локализуется в фиброзном кольце.
Далее образуются аннулярные и/или кольцевые абсцессы, которые вызывают формирование парапротезных фистул, отрыв протеза. Такому осложнению чаще подвержена аортальная позиция. Для этой локализации свойственно распространение абсцесса фиброзного кольца на миокард, вовлечение в патологический процесс проводящих путей сердца. Наибольшая частота ИЭ биопротезного клапана наблюдается в митральной позиции, которая значительно труднее поддается консервативному и оперативному лечению. В 13–40 % случаев ИЭПК образуются тромбы на протезе, являющиеся источниками ТЭО.
Частым симптомом ИЭПК является лихорадка, которая встречается у 95–97 % больных. Сердечная недостаточность, обусловленная инфекционно-токсическим миокардитом и параклапанными фистулами, формируется у подавляющего большинства больных при раннем ИЭПК и только у трети пациентов — при позднем. Септический шок встречается у 33 % больных с ранним и у 10 % — с поздним ИЭПК. Нарушения атриовентрикулярной проводимости регистрируются на ЭКГ в 15–20 % случаев раннего и в 5–10 % позднего ИЭПК. Спленомегалию отмечают у 26 % пациентов с ранним и у 44 % — с поздним ИЭПК. Частота развития ТЭО составляет 10–32 %. Наиболее характерны ТЭО для течения ИЭПК, вызванного грибами. При раннем ИЭПК частота ТЭО составляет 10–11 %, при позднем — 23–28 %.
Клиническое течение ИЭПК зависит от многих факторов, вида возбудителя, возраста больного, эффективности антибактериальной терапии. При высоковирулентном возбудителе (золотистый стафилококк, грамотрицательная микрофлора) преобладает острое течение с развитием острой сердечной и полиорганной недостаточности, ТЭО. При маловирулентном возбудителе разворачивается классическая картина sepsis lenta, что более характерно для позднего ИЭПК.
По сравнению с серединой XX столетия основными возбудителями стали золотистый и эпидермальный стафилококки. В структуре возбудителей вырос удельный вес грамотрицательных, анаэробных бактерий и грибов, которые в большинстве случаев резистентны к антибактериальной терапии. Это способствовало увеличению количества первичного острого ИЭ с развитием множественных тромбоэмболических осложнений.
Дифференциальная диагностика ИЭ проводится с группой заболеваний, наиболее важными из которых являются: острая ревматическая лихорадка (ОРЛ), ревматоидный артрит с системными проявлениями (РА), системная красная волчанка (СКВ), узелковый полиартериит (УП), антифосфолипидный синдром (АФЛС), инфекционные заболевания, протекающие с лихорадкой, сыпью и спленомегалией (холера, бруцеллез и др.), врожденные и приобретенные пороки сердца, злокачественные новообразования (лимфома, лимфогранулематоз и др.), сепсис.
Трудности в дифференциальной диагностике ИЭ с болезнями соединительной ткани определяются системным поражением сосудов и развитием панартериита. Примером этого может служить ОРЛ, которая протекает у больных с поражением суставов и формированием порока сердца (Шамов И.И., 1999). Трудность постановки диагноза ОРЛ в последние несколько десятилетий связана с тем, что не всегда развивается полный симптомокомплекс ревматизма. Нередко наблюдается изолированное поражение сердца или суставов (Насонова В.А., 1998). При первых атаках развиваются полиартриты, при повторных — артралгии. Уменьшилась частота рецидивов болезни (Насонова В.А., 1998). Тем не менее ОРЛ является болезнью с преимущественным развитием у подростков и молодых людей. Для нее характерны асимметричные мигрирующие полиартриты, вальвулит, поражение миокарда, нарушение проводимости и ритма. Повышение титра антистрептококковых антител больше связано с ОРЛ, чем с ИЭ, так как возбудителем эндокардита является зеленящий стрептококк. Однако некоторые признаки этих заболеваний в виде лихорадки, патологии суставов и сердца при отсутствии проявлений ТЭО и MB на клапанах сердца определяют актуальность дифференциальной диагностики.
Высокочувствительными признаками ОРЛ являются: молодой возраст больных, поражение миокарда с различными нарушениями ритма и проводимости, поражение кожи в виде кольцевой эритемы, повышение титра антистрептококковых антител. Для ИЭ более характерны ТЭО, спленомегалия, пневмония, плевриты, септическое и/или иммунокомплексное поражение печени и почек, выраженный лейкоцитоз, гипохромная анемия, значительное увеличение в крови концентрации иммуноглобулинов и циркулирующих иммунных комплексов, эхокардиографические признаки поражения сердца (MB на клапанах, выраженная регургитация, перфорация и отрыв створок клапанов) и органов брюшной полости (септический гепатит, спленит, нефрит), положительная гемокультура (золотистый и эпидермальный стафилококк, зеленящий стрептокк, энтерококки, грибы и др.) (Татарченко И.П., Комаров В.Т., 2001).
Среди системных заболеваний, с которыми надо проводить дифференциальную диагностику ИЭ, важное место занимает РА с системными проявлениями. Они значительно осложняют течение болезни, приводят к быстрому прогрессированию и формированию эрозивно-деструктивных поражений суставов, формированию в 50–60 % случаев ревматоидного эндокардита (Насонов Е.Л., 1988). К тому же современный ИЭ довольно часто проявляется иммунокомплексной патологией, в которой на одно из первых мест выходит поражение опорно-двигательного аппарата (23–60 %), проявляющееся артралгиями, артритами, тендинитами, энтезопатиями, дисцитом поясничного отдела позвоночника (Белов Б.С., 1997; Комаров В.Т. и соавт., 2000).
В 40–50 % случаев РА может проявляться высокой лихорадкой и поражением клапанов сердца с нарушением ритма и проводимости. Однако у большинства больных ревматоидный эндокардит с формированием недостаточности аортального (АК), митрального клапанов (МК) протекает относительно благоприятно и клинически бессимптомно. Для системных проявлений РА характерны фиброзирующий альвеолит, лимфаденопатия, аутоиммунный тиреоидит, синдром Рейно, ревматоидные узлы, синдром Шегрена, которые не встречаются при ИЭ (Татарченко И.П., Комаров В.Т., 2001). Тем не менее на практике проведение дифференциальной диагностики между РА с системными проявлениями и ИЭ остается достаточно трудной задачей (Балабан С.Я. и соавт., 1986).
Сходство клинических и лабораторных проявлений между ИЭ и СКВ значительно затрудняет проведение дифференциальной диагностики. У больных ИЭ и СКВ с одинаковой частотой встречаются лихорадка, полисерозит, миокардит, васкулиты, гломерулонефрит. В случае формирования (30–45 %) тромботического неинфекционного эндокардита (ТНЭ) возникают затруднения в трактовке поражений клапанов. Однако при ИЭ чаще отмечается деструктивная пневмония, а при СКВ — сосудистые поражения легких в виде пульмонитов. Отсутствие выраженной деструкции клапанов сердца и регургитации, отрицательная гемокультура, положительный эффект от применения преднизолона и цитостатиков свидетельствуют в пользу СКВ.
В клинической практике могут быть полезны диагностические критерии СКВ, разработанные Американской ревматологической ассоциацией (Насонова В.А., 1995): наличие LE-клеток, антинуклеарных антител, эритемы на лице, дискоидная волчанка, фотосенсибилизация, язвы в полости рта, артрит, серозит, поражение почек с протеинурией до 0,5 г/сут, неврологические нарушения (судороги или психоз), изменения крови (гемолитическая анемия, уменьшение количества лейкоцитов до 4 x 109/л, тромбоцитов — до 100 x 103/л, лимфопения в двух и более пробах крови). Наличие любых 4 критериев делает диагноз СКВ достоверным. Однако постановка диагноза затруднена при своеобразных вариантах течения (сочетанные или пограничные с другими болезнями соединительной ткани), а также на ранних этапах формирования СКВ.
Нередко приходится проводить дифдиагностику между ИЭ и НТЭ при вторичном АФЛС, развивающемся у больных СКВ, УП, подагрой (Синяченко О.В., 1997). Формирование НТЭ при системных васкулитах связано с образованием антител к эндотелию (Насонов Е.Л. и соавт., 1995; Фомичева О.А., 1997). Довольно трудно бывает дифференцировать ИЭ от УП при наличии выраженной лихорадки, суставного синдрома, поражения почек и кожи. Однако для УП характерно развитие асимметричного полиневрита, поражения почек с формированием микроаневризм и артериальной гипертензии, ишемических поражений конечностей (сетчатое ливедо, дигитальный артериит), сосудов мозга (с развитием ишемического инсульта) и желудочно-кишечного тракта (с развитием кишечной непроходимости).
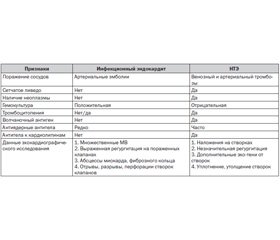
Из группы заболеваний с НТЭ следует исключать первичный АФЛС, развивающийся в результате аутоиммунных реакций к фосфолипидам, находящимся на мембране эритроцитов, в клетках эндотелия сосудов, нервной системы. Нередко в практике врача приходится проводить дифдиагностику ИЭ с паранеопластическим (карциноидным) НТЭ, вызванным развитием повышенного тромбообразования при злокачественных опухолях. На основании изучения литературы разработаны дифференциально-диагностические признаки ИЭ и группы НТЭ, которые приведены в табл. 1 (Татарченко И.П., Комаров В.Т., 2001).
Таким образом, при проведении дифференциальной диагностики ИЭ возрастает значение НТЭ, АФЛС, болезней соединительной ткани и костно-мышечной системы, злокачественных новообразований, которые нередко сопровождаются поражением эндокарда с формированием недостаточности клапанов сердца, артериальными и венозными тромбозами, тромбоцитопенией, сетчатым ливедо, образованием антител к кардиолипинам. Знание дифференциально-диагностических признаков, своевременное проведение клинико-лабораторной диагностики, ультразвукового исследования сердца и органов брюшной полости в динамике помогают установить диагноз инфекционного эндокардита.
1. Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита. — СПб.: Наука, 1995. — 230 с.
2. Абрикосов Н.Н. Инфекционный эндокардит // Частная патологическая анатомия: Руководство для врачей / Под ред. Н.Н. Абрикосова. — М.: Медгиз, 1954. — Т. 2. — С. 268–297.
3. Теодори М.И. Затяжной септический эндокардит. — М.: Медицина, 1965. — 243 с.
4. Гиляревский С.А. Эндокардиты. — М.: Медгиз, 1955. — 226 с.
5. Давыдовский И.В. Sepsis lenta // Патологическая анатомия и патогенез болезней человека: Руководство для врачей / Под ред. А.И. Абрикосова. — М.: Медгиз, 1956. — Т. 1. — С. 566–574.
6. Демин А.Л. Затяжной септический эндокардит // Руководство по внутренним болезням: Учебник / Под ред. А.Л. Мясникова. — М.: Медицина, 1962. — Т. 1. — С. 354–361.
7. Von Reyn C.F., Levy B.S., Arbeit R.D., Friedland G., Crumpacker C.S. Infective endocarditis, an analysis based on strict case definitions // Ann. Intern. Med. — 1981. — Vol. 94. — P. 505–518.
8. Durack D.T., Lukes A.S., Bright D.K. Duke endocarditis servis. Nev criteria for diagnosis of infective endocarditis: utilizatione of specific echocardiographic findings // Amer. J. Med. — 1994. — Vol. 96. — P. 200–209.
9. Виноградова Т.Л. Диагностика подострого инфекционного эндокардита и вопросы патогенеза заболевания: Автореф. дис... д-ра мед. наук. — М., 1996. — 35 с.
10. Тюрин В.П. Инфекционный эндокардит: современное течение, диагностика и лечение: Автореф. дис... д-ра мед. наук. — М., 1998. — 48 с.
11. Барт Б.Я. Современная клиника первичного инфекционного эндокардита и возможности диагностики его на поликлинических условиях // Мед. помощь. — 1994. — № 5. — С. 13–16.
12. Якушин С.С., Филоненко С.П., Косов И.Н. Инфекционный эндокардит — эволюция болезни // Рос. мед. журнал. — 1996. — № 5. — С. 14–17.
13. Буткевич О.М., Виноградова Т.Л. О трудностях диагностики инфекционного эндокардита современного течения // Тер. архив. — 1996. — № 8. — С. 21–24.
14. Ребров А.П., Пономарева Е.Ю., Белова А.А. Инфекционный эндокардит: качество диагностики и клинические особенности // Тер. архив. — 2000. — № 9. — С. 50–53.
15. Виноградова Т.Л. Рецидивирующий инфекционный эндокардит // Тер. архив. — 1991. — № 9. — С. 23–26.
16. Виноградова Т.Л. Инфекционный эндокардит у больных пожилого и старческого возраста // Тер. архив. — 1993. — № 9. — С. 44–47.
17. Таранова M.B., Белокриницкая О.А., Козловская Л.В., Мухин Н.А. «Маски» подострого инфекционного эндокардита // Тер. архив. — 1999. — № 1. — С. 47–50.
18. Демин А.А., Дробышева В.П. Бактериальный эндокардит: современное течение и диагностика // Тер. архив. — 1998. — № 11. — С. 157–158.
19. Маслянюк О.В. Роль эхокардиографии в комплексной диагностике и определении тактики хирургического лечения инфекционного эндокардита: Автореф. дис... канд. мед. наук. — СПб., 1999. — 22 с.
20. Шевченко Ю.Л., Хубулава Г.Г., Черепанин И.М., Прокофьев А.В., Пырьев В.Б., Маслянюк О.В. Современные возможности и роль эхокардиографии в диагностике инфекционного эндокардита // Вестник хирургии. — 1998. — № 4. — С. 17–23.
21. Буткевич О.М., Виноградова Т.Л. Актуальные проблемы инфекционного эндокардита: обзор литературы и собственные данные // Тер. архив. — 1982. — Т. 54, № 6. — С. 147–151.
22. Балабан С.Я., Дьякон С.Я. Ревматические маски инфекционного эндокардита // Тер. архив. — 1986. — № 7. — С. 137–140.
23. Savae Y. Current diagnosis of infective endocarditise // Jap. Circulation J. — 1985. — Vol. 49. — 5. — P. 519–528.
24. Виноградова Т.Л. Инфекционный эндокардит — диагностика, особенности современного течения и вопросы терапии // Тер. архив. — 1981. — № 7. — С. 53–58.
25. Голочевская B.C. Трудности диагностики подострого инфекционного эндокардита // Клин. мед. — 1991. — Т. 69, № 6. — С. 108–113.
26. Татарченко И.П., Комаров В.Т. Дифференциальная диагностика // Инфекционный эндокардит: современное течение, диагностика и лечение. — Пенза: Изд. Пензенского ГИУВ, 2001. — С. 145–178.
27. Шевченко Ю.Л., Хубулава Г.Г. Инфекционный эндокардит правых камер сердца. — СПб.: Наука, 1996. — 170 с.
28. Виноградова Т.Л. Анализ течения и результаты терапии инфекционного эндокардита за последние 10 лет // Кардиология. — 1995. — 6. — С. 46–49.
29. Виноградова Т.Л. Клиническая и патологоанатомическая характеристика инфекционного эндокардита в период 1960–80 гг. // Архив патологии. — 1982. — № 3. — С. 27–38.
30. Тюрин В.П. Инфекционный эндокардит с отрицательной гемокультурой // Клин. мед. — 1997. — № 7. — С. 68–71.
31. Виноградова Т.Л., Чипигина Н.С. Подострый инфекционный эндокардит — вопросы диагностики // Тер. архив. — 1998. — № 6. — С. 15–18.
32. Dodds G.A., Sexton D.J., Durack D.T., Bashore T.M., Corey G.R., Kisslo J. Negative predictive value of the Duke criteria for infective endocarditis // Amer. J. Med. — 1996. — Vol. 77, № 5. — P. 403–407.
33. Thalme A., Nygren A.T., Julander I., Freyschuss U. Classification of infective endocarditis by Duke’s criteria and transesophageal echocardiography: a 1-year retrospective analysis // Scand. J. Infect. Dis. — 1996. — Vol. 28, № 4. — P. 407–410.
34. Del Pont J.M., De Cicco L.T., Vartalitis C., Ithurralde M., Gallo J.P. et al. Infective endocarditis in children: clinical analyses and evaluation of two diagnostic criteria // Pediatr. Infect. Dis. J. — 1995. — Vol. 14, № 12. — P. 1079–1086.
35. Тюрин В.П. Дифференциальный диагноз // Инфекционный эндокардит. — М.: ГЭОТАР-МЕД, 2001. — С. 151–160.
36. Тюрин В.П. Инфекционный эндокардит: современное течение, диагностика и лечение. Автореф. дис... д-ра мед. наук. — М., 1998. — 48 с.
37. Тюрин В.П. Современная диагностика и лечение инфекционного эндокардита. — М.: Изд. ГВКГ им. Н.Н. Бурденко, 1999. — 40 с.
38. Францев В.И., Селиваненко В.Т. Бактериальный эндокардит при врожденных пороках сердца. — М.: Медицина, 1986. — 143 с.
39. Гуревич М.А. Особенности современного течения инфекционного эндокардита // Клин. мед. — 1997. — № 6. — С. 37–43.
40. Симоненко В.Б., Колесников С.А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики // Клин. мед. — 1999. — № 3. — С. 44–49.
41. Тазина С.Я., Гуревич М.А. Современный инфекционный эндокардит (Часть 1) // Клин. мед. — 1999. — № 12. — С. 19–23.
42. Иванов А.С., Мишаевский А.Л., Погромов А.П. Особенности клиники, диагностики и лечения инфекционного эндокардита трикуспидального клапана // Клин. мед. — 2001. — № 1. — С. 22–25.
43. Мазуров В.И., Уланова В.И. Течение инфекционного эндокардита у инъекционных наркоманов и лиц с предрасполагающими заболеваниями // Клин. мед. — 2001. — № 8. — С. 23–28.
44. Мишаевский А.Л. Инфекционный эндокардит трикуспидального клапана // Клин. мед. — 2001. — № 2. — С. 21–25.
45. Кузяев А.И., Соболева Л.Г., Ласкин Г.М., Соболева Л.Р. Септическое поражение легких у наркоманов // Клин. мед. — 2000. — № 5. — С. 50–52.
46. Шевченко Ю.Л., Шихвердиев Н.Н. Ангиогенный сепсис. — СПб.: Наука, 1995. — 125 с.
47. Черепанин И.М. Инфекционный эндокардит протезированного клапана: Автореф. дис... д-ра мед. наук. — СПб., 1999. — 34 с.
48. Шевченко Ю.Л., Хубулава Г.Г., Черепанин И.М., Прокофьев А.В., Пырьев В.Б., Маслянюк О.В. Современные возможности и роль эхокардиографии в диагностике инфекционного эндокардита // Вестник хирургии. — 1998. — № 4. — С. 17–23.
49. Acar I., Michel P.L., Varenne О., Michaud P., Rafik T. Surgical treatment of infective endocarditis // Eur. Heart J. — 1995. — Vol. 16 (suppl. B). — P. 94–98.
50. Shapiro S.M., Young E., De Guzman S. Transesophageal echocardiography in diagnosis of infective endocarditis // Chest. — 1994. — Vol. 105. — P. 377–382.
51. Bansal R.C. Infective endocarditis // Med. Clin. North. Am. — 1995. — Vol. 79. — P. 1205–1240.
52. Mugge A., Daniel W.G., Frank G., Lichtlen P.R. Echocardiography in infective endocarditis: reassessment of prognostic implications of vegetation size determined by the transthoracic and the transesophageal approach // J. Am. Coll. Cardiol. — 1999. — Vol. 14. — P. 631–638.
53. Daniel W.G., Mugge A., Martin R.P. Improvement in the diagnosis of abscesses associated with endocarditis by transesophageal echocardiography // N. Engl. J. Med. — 1998. — Vol. 324. — P. 795–800.
54. Lytle B.W., Priest B.P., Taylor P.C. Surgical treatment of prosthetic valve endocarditis // J. Thorac. Cardiovasc. Surg. — 1996. — Vol. 111. — P. 198–207.
55. Cowgill L.G., Addonizio V.P., Hopeman A.R., Harken A.H. A practical approach to prosthetic valve endocarditis // Ann. Thorac. Surg. — 1997. — Vol. 43, № 4. — P. 450–457.
56. Chastre I., Trouillet J.L. Early infective endocarditis on prosthetic valves // Eur. Heart J. — 1995. — Vol. 16, suppl. B. — P. 32–38.
57. Petrou M., Wong K., Albertucci M., Brecker S.J., Yacoub M.H. Evaluation of prosthetic valve endocarditis // Circulation. — 1994. — Vol. 90. — P. 198–204.
58. Sett S.S., Hudon M.P.J., Jamicson W.R.E. Prosthetic valve endocarditis // J. Throrac. Cardiovasc. Surg. — 1993. — Vol. 105, № 3. — P. 428–434.
59. Нарсия Б.Е. Повторные операции у больных с протезами клапанов сердца // Грудная хирургия. — 1991. — № 2. — С. 45–48.
60. Maroni J.P., Terdjman M., Montely J.M., Hanania G. Prosthetic valve endocarditis: current problems // Arch. Mai. Coeur Vaiss. — 1993. — Vol. 86, suppl. 12. — P. 1837–1843.
61. Horstkotte D., Piper C., Niehues R., Wiemer M. Late prosthetic valve endocarditis // Eur. Heart J. — 1995. — Vol. 16, suppl. B. — P. 39–47.
62. Clarkson P.M., Barratt-Boyes B.G. Infective endocarditis following replacement of organs // Circulation. — 1992. — Vol. 42. — P. 987–991.
63. Paterson D.L. Infective endocarditis in solid organ transplant recipient // Clin. Infect. Dis. — 1998. — Vol. 26. — P. 689–694.
64. Horstkotte D., Bodhar E. Infective endocarditis. — London: ICR, 1990. — P. 167–192.

/18/18.jpg)