Статья опубликована на с. 90-96
ВИЧ-инфекция остается одной из основных проблем глобального общественного здравоохранения: на сегодняшний день она унесла более 39 миллионов человеческих жизней. В 2013 году 1,5 (1,4–1,7) миллиона человек в мире умерли от причин, связанных с ВИЧ.
В конце 2013 года в мире насчитывалось примерно 35 (33,2–37,2) миллионов человек с ВИЧ-инфекцией, а 2,1 (1,9–2,4) миллиона человек в мире приобрели ВИЧ-инфекцию в 2013 году.
Наиболее пораженным регионом является Африка к югу от Сахары: здесь в 2013 году проживало 24,7 (23,5–26,1) миллиона человек с ВИЧ. На этот регион приходится также почти 70 % глобального общего числа новых ВИЧ-инфекций.
Распространение ВИЧ-инфекции во всем мире по-прежнему определяется наличием групп риска (связанные с образом жизни, ятрогенные, другие). Отнесение пациента к группе риска возможно путем целенаправленного расспроса, тщательного сбора анамнеза жизни и т.д.
Для дебюта заболевания характерен гриппоподобный синдром: лихорадка, артралгии, признаки поражения верхних дыхательных путей, напоминающие ОРВИ. Типичными проявлениями могут быть генерализованная лимфаденопатия, диарея. В дальнейшем в клинической картине заболевания на первый план могут выступать симптомы вовлечения любой системы органов (дыхательной, сердечно-сосудистой, почечной и т.д.), затрудняющие интерпретацию их в рамках ВИЧ-инфекции. Вовлечение почек при ВИЧ-инфекции не является редким явлением. По данным литературы, признаки повреждения почек выявляются в 20–30 % случаев.
Варианты поражения почек у ВИЧ-инфици–ро–ванных разнообразны. ВИЧ-ассоциированная нефропатия (ВИЧ-АН) представляет собой один из вариантов фокально-сегментарного гломерулосклероза, характерными чертами которого являются изменения эндотелиальных клеток клубочка с последующим коллапсом части или большинства капиллярных петель (коллабирующая гломерулопатия), вовлечением мезангиальных клеток в процесс повреждения, изменениями в подоцитах (висцеральных эпителиальных клетках), заканчивающиеся сегментарным и/или глобальным гломерулосклерозом (Charg J. et al., 1995).
Первые описания коллабирующего фокально-сегментарного гломерулосклероза, развившегося у афроамериканцев и выходцев с островов Гаити, с поздними стадиями ВИЧ-инфекции появились в начале 1980-х гг., вскоре после описания ВИЧ-инфекции как таковой. ВИЧ-АН характеризуется быстрым снижением функции почек, особенно у афроамериканцев.
В США ВИЧ-АН занимает третье место среди заболеваний, которые вызывают потребность в диализе, у афроамериканцев в возрасте от 20 до 64 лет (Winston, 2008).
К началу 2000-х гг. стало ясно, что ВИЧ-АН представляет собой реальную причину терминальной почечной недостаточности, особенно у представителей афроамериканской расы: сегодня в данной группе пациентов она уступает только сахарному диабету (СД) и артериальной гипертензии (АГ). Показано, что принадлежность к афроамериканской расе сопряжена с увеличением риска развития ВИЧ-АН в 18 раз. Другими факторами риска развития ВИЧ-АН являются снижение количества CD4+ < 200 мм3 и высокая вирусная нагрузка, пожилой возраст, женский пол, внутривенное использование наркотических препаратов, наличие СД и АГ.
Однако не следует считать, что ВИЧ-АН встречается исключительно у афроамериканцев. Сегодня во всем мире ВИЧ-АН все чаще наблюдают у представителей белой расы.
Патогенез ВИЧ-нефропатии сложен, предложено несколько механизмов развития повреждения почек при этом (Striker G., 1997, Fogo A.B., Kashgarian M., 2012):
— прямое повреждающее действие вируса на эпителиальные клетки (подоциты, клетки эпителия канальцев, мезангиоциты);
— опосредованное повреждение циркулирующими вирусными компонентами;
— опосредованное повреждение цитокинами, через повреждение лимфоцитов и моноцитов как локально, так и генерализованно.
Поскольку помимо классической ВИЧ-АН при ВИЧ-инфекции развиваются разные формы нефрита, ассоциированные с данной инфекцией, сравнение их клинических проявлений и прогностических позиций представляет большой интерес.
Прогноз заболевания серьезный и в значительной степени зависит от своевременности диагностики, в частности от установления наличия повреждения почек с его морфологической верификацией и оценкой степени выраженности поражения, а также назначаемой адекватной лечебной программы.
В качестве иллюстрации особенностей диагностики, как клинической, так и морфологической, приводим 2 собственных наблюдения.
Клинический случай 1. Пациент С., 46 лет, в мае 2014 г. после острого респираторного заболевания впервые отметил отеки нижних конечностей, повышение АД до 140/90 мм рт.ст. За медицинской помощью не обращался. Отеки самостоятельно регрессировали в течение недели. Настоящее ухудшение состояния отмечено в сентябре 2014 г., когда после физической нагрузки (копал картошку) появились выраженные отеки нижних конечностей, АД — 140/90 мм рт.ст. При обследовании в поликлинике по месту жительства в общем анализе мочи белок — 1,5 г/л, лейкоциты — 5–10 в п/зр, эритроциты — 2–3 в п/зр. Пациент был госпитализирован в Центр нефрологии и диализа 15.11.14 г. При поступлении жалобы на небольшую слабость, периодическую боль тянущего характера в поясничной области, отеки нижних конечностей. При осмотре — состояние средней тяжести, положение активное, телосложение правильное, нормостенический тип конституции. Кожные покровы физиологической окраски. Видимые слизистые влажные, чистые. Отеки голеней умеренные. Температура тела до 36,9 °С. В легких — дыхание везикулярное, хрипы не выслушиваются. Тоны сердца отчетливые, ритм правильный, ЧСС — 78/мин.
АД — 145/90 мм рт.ст., живот мягкий, безболезненный при пальпации. Печень и селезенка не увеличены. Почки не пальпируются. Мочеиспускание свободное, дизурии нет.
При обследовании в общем анализе крови: гемоглобин — 125 г/л, эритроциты 4 • 1012/л, тромбоциты — 200 • 109/л, СОЭ — 45 мм/ч. В общем анализе мочи: удельный вес — 1018, белок — 3,0 г/л, лейкоциты 5–8 в п/зр, эритроциты — 10–15 в п/зр.
Суточная протеинурия — 4,32 г. Посев мочи на флору — отрицательный результат. В биохимическом анализе крови: общий белок — 49 г/л, холестерин — 6,3 ммоль/л, креатинин — 300 мкмоль/л, мочевина — 9,5 ммоль/л, общий билирубин — 17,7 мкмоль/л, АЛТ — 20,4 МЕ/л, АСТ — 28,5 МЕ/л, глюкоза — 4,6 ммоль/л, калий —
4,28 ммоль/л. СКФ — 20 мл/мин/1,73 м2.
Маркеры вирусного гепатита В, С — отрицательны. При обследовании в отделении обнаружены антитела к ВИЧ.
При серологическом обследовании данные о СКВ, криоглобулинемический васкулит, АНЦА-васкулит — отрицательны.
Выполнены рентгенография органов грудной клетки: вариант нормы. ЭхоКГ: фракция выброса левого желудочка (ФВЛЖ) — 64 %. УЗИ: печень: толщина правой доли до 160 мм, левой доли — до 60 мм, контур ровный, структура паренхимы однородная, эхогенность повышена. Внутрипеченочные желчные протоки и холедох не расширены. Воротная вена — до 11 мм. Желчный пузырь узкий, стенки утолщены, протоки не расширены. Поджелудочная железа обычных размеров, ткань однородная. Селезенка: 120 × 48, контур ровный, структура однородная. Почки расположены типично, левая 115 × 39, паренхима 18 мм, правая 110 × 42, паренхима 18 мм. Контуры четкие, ровные, паренхима почек средней эхогенности. Дифференциация на слои сохранена. Чашечно-лоханочная система (ЧЛС) не расширена, конкременты не обнаружены. Свободной жидкости и увеличенных лимфатических узлов в брюшной полости не выявлено.
25.11.14 выполнена пункционная биопсия почки.
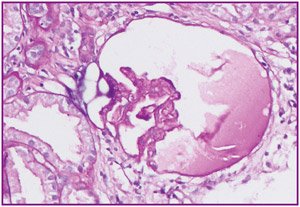
Описание биопсии: в биоптате 2 кусочка, в одном клубочки отсутствуют, в другом кусочке — 8 клубочков, один практически полностью склерозирован, один клубочек с коллапсом капиллярных петель (рис. 1), в клубочках неравномерно выраженная — от умеренной до выраженной степени — пролиферация мезангиальных клеток, набухание и пролиферация эндотелиальных клеток, очаги кариорексиса (рис. 2), в просвете части капиллярных петель лимфоциты, моноциты, утолщение и расщепление части капиллярных петель, в некоторых петлях утолщение за счет фибриноидного некроза, единичные капиллярные петли коллапсированы, очаги склероза разного размера в мезангиальной зоне и распространяются на капиллярные петли. Во всех клубочках — неравномерно выраженная гипертрофия и гиперплазия клеток эпителия капсулы, утолщение и очаговое расщеп–ление базальной мембраны капсулы Боумена.
/91.jpg)
/92-1.jpg)
В канальцах — выраженные дистрофические изменения (по типу зернистой, вакуольной, очагов гиалиново-капельной дистрофии), очаговый некроз клеток эпителия (рис. 3). Повреждение в канальцах по типу формирования тубулярных микрокист (рис. 3). Крупные поля атрофии канальцев с утолщением и расщепление тубулярной базальной мембраны. В просвете части атрофированных канальцев — гиалиновые цилиндры. В кусочке без клубочков в мозговом слое в одном из канальцев геминовые цилиндры. В строме очаговые интертубулярные, перигломерулярные, периваскулярные лимфогистиоцитарные с примесью плазматических клеток, очаги интерстициального фиброза. В сосудах мелкого калибра — утолщение стенки за счет очагов фибриноидного некроза, в части сосудов — склероз.
Иммуноморфологическое исследование:
СD3: в клубочках единичные позитивные клетки в просвете капиллярных петель, много позитивных клеток в клеточных инфильтратах, в строме между канальцами (рис. 4).
СD20: единичные позитивные клетки в капсуле Боумена в некоторых клубочках, в клеточных инфильтратах позитивные клетки.
CD68: в клубочках разных размеров макрофаги, макрофаги в клеточных инфильтратах, в строме между канальцами.
Заключение: морфологические изменения свидетельствуют в пользу фокально-сегментарного гломерулосклероза с выраженным тубуло-интерстициальным компонентом (преобладание хронических изменений), Т-лимфоцитарным преобладанием в клеточных инфильтратах, макрофагальной реакцией в клубочках и строме.
Учитывая морфологические особенности и данные клинико-лабораторного исследования, можно заключить, что имеет место HIV(ВИЧ)-ассоциированная нефропатия.
Пациент консультирован инфекционистом центра СПИДа. Рекомендовано проведение высокоактивной антиретровирусной терапии в условиях центра СПИДа.
Пациент выписан для прохождения лечения в специализированном учреждении с последующей консультацией нефролога.
Клинический случай 2. Мужчина 33 лет обратился в клинику нефрологии с жалобами на наличие отеков нижних конечностей, одутловатость лица, уменьшение количества мочи до 1,0 л/сутки, повышение АД до 160/90 мм рт.ст. Из анамнеза известно, что пациент считает себя больным около 3 месяцев, когда после перенесенного ОРВИ впервые отметил появление отеков на нижних конечностях. После обследования у семейного врача была диагностирована анемия легкой степени, протеинурия, гематурия. Был направлен для дообследования в нефрологическое отделение.
Из анамнеза жизни известно, что пациент перенес вирусный гепатит В в 2001 году без клинико-лабораторных признаков хронизации заболевания. Гемотрансфузий, оперативных вмешательств не было.
Объективно: состояние средней степени тяжести, астенический тип телосложения. Рост 168 см, вес 57 кг. Кожные покровы бледные, acne vulgaris на коже лица. Язык обложен белесоватым налетом у корня. Щитовидная железа не увеличена. Периферические лимфатические узлы не увеличены, безболезненны при пальпации. Над всей поверхностью легких определялся ясный легочный звук, аускультативно — жесткое дыхание, хрипы не выслушивались. Перкуторно — границы сердца не изменены. Тоны сердца звучные, ритмичные. ЧСС 78 уд/мин. АД — 160/100 мм рт.ст. При аускультации отмечался акцент ІІ тона над аортой. Патологические тоны и шумы не выслушивались. Живот правильной формы, принимает участие в акте дыхания, при пальпации безболезненный. Нижний край печени пальпировался по краю реберной дуги по среднеключичной линии. Селезенка не увеличена. Симптом поколачивания отрицательный с обеих сторон. Обращали на себя внимание отеки нижних конечностей до уровня средней трети голеней, одутловатость лица. Диурез, со слов пациента, до 1,0 л/сутки.
Общий анализ крови: нормохромная анемия легкой степени. Уровень гемоглобина 104 г/л, эритроциты — 3,52 • 1012/л, количество лейкоцитов и тромбоцитов — 9,0 • 109/л и 173 • 109/л соответственно, СОЭ — 30 мм/час. В общем анализе мочи: относительная плотность 1015, белок — 3,3 г/л, эритроциты измененные и неизмененные покрывают п/зр, лейкоциты — 3–4 в п/зр, зернистые цилиндры 1–3 в п/зр. Биохимический анализ крови: концентрация креатинина — 146 мкмоль/л, СКФ — 54 мл/мин
(по EPI-GFR), гипо- и диспротеинемия (общий белок — 48,8 г/л, альбумин — 18,9 г/л ), гиперхолестеринемия — 6,68 ммоль/л, гипертриглицеридемия — 2,4 ммоль/л, гиперурикемия — 429 ммоль/л, гипокальциемия — 2,03 ммоль/л, ПТГ — 129 пг/мл. Уровень суточной протеинурии составил 6,27 г.
Маркеры вирусных гепатитов В, С отрицательны.
На УЗИ почек: правая почка размером 112 × 47 мм,
паренхима — 18 мм. Левая почка размером 110 × 2 мм, паренхима — 18 мм. Эхоструктура паренхимы не изменена. ЭКГ: ритм синусовый, регулярный, ЧСС — 78 уд/мин, нормальное положение электрической оси сердца. Согласно данным эхокардиоскопии, патологии не выявлено. Рентгенография ОГК: легочные поля прозрачны, множественные консолидированные переломы ребер. По данным ЭФГДС — поверхностная гастродуоденопатия.
Пациенту назначены ИАПФ, статины, дезагреганты, диуретики, препараты кальция, альфакальцидол.
С целью верификации диагноза пациенту выполнена чрескожная пункционная биопсия почки.
По данным биопсии: в препарате в двух биоптатах до 33 клубочков, большинство клубочков увеличены в размере, во всех клубочках неравномерная, преимущественно диффузная выраженная пролиферация мезангиальных и эндотелиальных клеток, очаги фибриноидного некроза, очаговый кариорексис, в просвете части капилляров — моноциты, полиморфноядерные лейкоциты, неравномерно выраженное утолщение капиллярных петель клубочков за счет фибриноидного некроза (по типу «проволочных» петель), неравномерно выраженное увеличение мезангиального матрикса (рис. 5, 6). В некоторых клубочках — очаговый коллапс капиллярных петель. В одном клубочке — фиброклеточное микрополулуние, в 5 клубочках — точечные сращения периферических капиллярных петель с капсулой Боумена (рис. 6). Во всех клубочках неравномерно выраженные утолщения и очаговое расщепление базальной мембраны капсулы Боумена.
/93.jpg)
/94-1.jpg)
В канальцах выраженные дистрофические изменения (по типу зернистой, вакуольной, очагов гиалиново-капельной дистрофии), некроз групп клеток, очаги субатрофии и атрофии канальцев с нерезким утолщением тубулярной базальной мембраны; в просвете некоторых канальцев гиалиновые цилиндры, в некоторых расширенных канальцах — геминовые цилиндры, слущенные клетки и белковые массы. Часть канальцев неравномерно расширена по типу формирования микрокист (рис. 7, 8). В строме между канальцами перигломерулярно периваскулярно лимфогистиоцитарные с примесью плазматических клеток инфильтраты (рис. 6, 7), небольшие очаги начального интерстициального фиброза, в том числе и периваскулярного (рис. 7). В сосудах мелкого калибра — утолщение стенки за счет отложения фибриноида (фибриноидный некроз), очаговой клеточной инфильтрации. В сосуде среднего калибра — явления спазма, эластоза, очаговый склероз. Имеется сосуд небольшого калибра с выраженными признаками эндо- и периваскулита, резкое сужение просвета, вокруг — выраженная клеточная инфильтрация (рис. 7).
/94-2.jpg)
/94-3.jpg)
Иммуноморфологическое исследование:
IgA: в клубочках неравномерные очаговые гранулярные субэндотелиальные депозиты до +, очаговые депозиты в мезангиуме до +, очаговые депозиты в базальной мембране капсулы Боумена от + до ++, в строме между канальцами, в петитубулярных капиллярах депозитов от + до ++, в клеточных инфильтратах от + до ++, в эпителии канальцев в виде зернистости депозитов до +.
IgG: в клубочках очаговые гранулярные субэндотелиальные и вдоль капилляров клубочков депозиты от + до ++, в некоторых капиллярных петлях субэндотелиальные депозиты до +++, очаговые депозиты в мезангиуме до +, в строме между канальцами, в перитубулярных капиллярах, в клеточных инфильтратах от + до ++, в эпителии канальцев в виде зернистости депозитов до ++.
IgM: в клубочках неравномерные очаговые гранулярные субэндотелиальные депозиты до ++, очаговые депозиты в мезангиуме от + до ++, очаговые депозиты в базальной мембране капсулы Боумена от + до ++, в строме между канальцами, в петитубулярных капиллярах депозиты от + до ++, в клеточных инфильтратах от + до ++, в эпителии канальцев в виде зернистости депозитов до ++.
С3: в клубочках очаговые гранулярные субэндотелиальные депозиты до +, единичные гранулярные депозиты в мезангиуме до +, очаговые депозиты в строме между канальцами, в эпителии канальцев от + до ++.
Заключение: морфологические изменения свидетельствуют в пользу вторичного характера поражения — наиболее вероятен волчаночный гломерулонефрит IV класса (диффузный) морфологический класс (классификация 2004 г.) с выраженным тубуло-интерстициальным компонентом.
С целью уточнения диагноза был выполнен анализ крови на определение суммарных антинуклеарных антител в крови, наличие антител к двухспиральной ДНК: ANA — 1 : 160 (норма < 1 : 80), dsDNA Antibody Ig G — < 25,0 IU/ml (результат отрицательный). Уровень С3 компонента комплемента составил 0,63 г (норма 0,9–1,8 г/л). Антитела к фосфатидилсерину, фосфатидилинозитолу, фосфатидилэтаноламиду — отрицательны.
Пациент был осмотрен ревматологом, диагноз СКВ на момент осмотра исключен. По результатам проведенного консилиума пациенту был установлен диагноз: хроническая болезнь почек III ст.: гломерулонефрит (с высокой степенью вероятности — люпус-нефрит, диффузный пролиферативный волчаночный нефрит IV класса), нефротический синдром. Ренопаренхимная артериальная гипертензия ІІІ ст., 2 ст., риск 3. Анемия легкой степени. Вторичный гиперпаратиреоз (ВГП)Т легкой степени. Вторичная гиперурикемия.
Пациенту была проведена терапия согласно рекомендациям EULAR по лечению СКВ: пульс-терапия метилпреднизолоном, циклофосфамидом с последующим переходом на пероральный прием метилпреднизолона.
Раннее развитие кандидозного поражения слизистой оболочки ротовой полости обусловило необходимость определения наличия антител к ВИЧ-инфекции. Выполненный анализ крови методом ИФА на наличие антител к ВИЧ-1 оказался положительным. Количество CD4+-клеток — 330 кл/мл3.
При пересмотре данных морфологического исследования (биопсии) (12.06.2014 г.) скорректирован заключительный морфологический диагноз — морфологические изменения, клинико-лабораторные данные свидетельствуют в пользу вторичного характера поражения — HIV/ВИЧ-нефропатии с выраженным тубулоинтерстициальным компонентом.
Пациент направлен на консультацию в Центр борьбы со СПИДом и оппортунистическими инфекциями и их профилактики. На момент написания статьи пациент проходит дообследование с целью назначения высокоактивной антиретровирусной терапии.
Данный клинический случай был крайне сложен как для клинической, так и для морфологической диагностики. По данным литературы, проведение дифференциальной диагностики ВИЧ-АН с волчаночным гломерулонефритом (lupus-glomerulonephrities) встречается не так часто, однако в этих наблюдениях морфологическая верификация ВИЧ-АН крайне затруднена, особенно на ранних этапах заболевания. Это сопряжено с тем, что подоциты являются главной (таргетной) целью повреждения вирусом при ВИЧ, с последующей потерей маркеров дифференцировки, таких как Wilms tumor antigen WT-1, циклинзависимые киназные ингибиторы (Fogo A.B., Kashgarian M., 2012). Это, в свою очередь, поясняет особенности эпителиальных повреждений в почке — пролиферации висцеральных эпителиальных клеток (подоцитов), повреждения эпителиальных клеток канальцев с формированием микрокист. Следует отметить, что у части пациентов, как и в нашем случае, имеет место повреждение вследствие формирования так называемых lupus-like иммунных комплексов. При этом не следует забывать, что в патогенезе поражения почек при системной красной волчанке (СКВ) — волчаночном гломерулонефрите (ВГН) ведущая роль отводится повреждению подоцитов, а некоторые авторы вообще считают уместным использование термина «подоцитопатия» при ВГН (Fogo A.B., Kashgarian M., 2012).
Особенности патогенеза ВИЧ-инфекции и СКВ могут в какой-то мере объяснить сложности клинико-морфологической диагностики поражений почек при этих заболеваниях.
Выводы
1. Учитывая увеличение популяции ВИЧ-инфицированных за счет новых случаев заболевания и риск развития у них многих осложнений, связанных с ВИЧ-инфекцией, в том числе и патологии почек, целесообразно проводить скрининг на наличие ВИЧ-инфекции у всех пациентов с наличием нефротического синдрома и/или снижением функции почек.
2. Пациенты с ВИЧ-инфекцией относятся к группе высокого риска поражения почек, что обусловливает необходимость усиления мониторинга маркеров почечного повреждения.
3. Пациентам с верифицированной ВИЧ-инфекцией или подозрением на нее рекомендовано проведение прижизненного морфологического исследования почек с оценкой выраженности повреждения гломерулярного, тубулярного, интерстициального аппарата, установление характера изменений — преобладания параметров активности или хроничности — для проведения адекватной патогенетической терапии.
Комментарий специалиста
 |
Федорченко С.В., д.м.н., - зав. научным отделом вирусных гепатитов и СПИДа ГУ «Институт эпидемиологии и инфекционных болезней» НАМНУ, г. Киев |
В представленной работе описываются клинические случаи развития поражения почек у пациентов с HIV-инфекцией. Несмотря на то, что HIV-ассоциированная нефропатия встречается преимущественно у афроамериканцев, не следует считать, что в славянской популяции это заболевание наблюдается редко. По данным ауто–псии, морфологические признаки поражения почек выявляются примерно у 7 % HIV-инфицированных. Вопрос о доминирующей этиологической роли HIV в развитии патологии почек вызывает у клиницистов затруднения, поскольку более 80 % анти-HIV-позитивных пациентов инфицированы HCV и 15 % — HBV (по данным Института эпидемиологии и инфекционных болезней НАМН Украины), а развитие гломерулонефрита является одним из вариантов внепеченочных проявлений хронического гепатита С и В. Морфологический вариант ВИЧ-нефропатии — фокальный сегментарный гломерулосклероз, при хронической HCV- и HBV-инфекции чаще диагностируют мезангиопролиферативный или мезангиокапиллярный гломерулонефрит, реже — IgA-нефропатию, хотя клинико-лабораторная картина может быть схожа. Определенные трудности возникают при развитии клинико-лабораторных признаков поражения почек у пациентов, находящихся на высокоактивной антиретровирусной терапии. Ингибиторы протеаз и нуклеотидные ингибиторы обратной транскриптазы (тенофовир) могут вызывать синдром Фанкони и тубулопатии, проявляющиеся протеинурией, проксимальноканальцевым ацидозом, нормогликемической глюкозурией, гипофосфатемией, снижением клиренса креатинина. В группе больных с коинфекцией HCV/HIV, HBV/HIV, находящихся на ВААРТ, практикующим врачам будет чрезвычайно сложно определить этиологический фактор, вызывающий повреждение почек. Тем и интересны представленные клинические случаи, когда клинико-лабораторные признаки поражения почек вышли на авансцену клинической картины HIV-инфекции, опережая появление классических оппортунистических инфекций (церебральный токсоплазмоз, внелегочной туберкулез, пневмоцистная пневмония и т.д.). Описанные авторами в статье пациенты не были инфицированы HCV и HBV, что еще раз подтверждает важную роль HIV в развитии патологии почек.


/91.jpg)
/92-1.jpg)
/92-2.jpg)
/93.jpg)
/94-1.jpg)
/94-2.jpg)
/94-3.jpg)