Журнал «Актуальная инфектология» 4 (9) 2015
Вернуться к номеру
Вирусный гепатит С. Адаптированные клинические рекомендации, основанные на доказательствах (обновленные) — 2015
Рубрики: Инфекционные заболевания
Разделы: Руководства
Версия для печати
Статтю опубліковано на с. 115-186
Державний експертний центр
Міністерства охорони здоров’я України
Всеукраїнська асоціація інфекціоністів
Всеукраїнська асоціація гастроентерологів
Українська асоціація сімейної медицини
Українська асоціація з вивчення захворювань печінки
Всеукраїнська громадська організація «Зупинимо гепатит»
Всеукраїнська благодійна організація «Всеукраїнська мережа ЛЖВ»
Благодійний фонд «Дорадча рада спільнот з питань доступу до лікування в Україні»
Міжнародний благодійний фонд «Міжнародний альянс з ВІЛ/СНІД в Україні»
Вірусний гепатит С. Адаптована клінічна настанова, заснована на доказах (оновлена) — 2015
Скорочення
CASL Канадська асоціація з вивчення захворювань печінки (англ. Canadian Association of the Stady of the Liver)
EASL Європейська асоціація з вивчення печінки (англ. European Association for the Study of the Liver)
FDA Управління з контролю харчових продуктів та лікарських засобів США (англ. Food and Drug Administration) IL Інтерлейкін
NHS Національна система охорони здоров’я
NICE Національний інститут досконалості медичної допомоги
SIGN Шотландська міжуніверситетська мережа настанов
АЛТ Аланінамінотрансфераза
АФП Альфа-фетопротеїн
БЦП Боцепревір
ВГВ Вірус гепатиту В
ВГС Вірус гепатиту С
ВІЛ Вірус імунодефіциту людини
ВООЗ Всесвітня організація охорони здоров’я
ВР Відносний ризик
ГЦК Гепатоцелюлярна карцинома
ДАК Даклатасвір
ДАС Дасабувір
ДІ Довірчий інтервал
ІМТ Індекс маси тіла
ІП Інгібітор протеази
ІФА Імуноферментний аналіз
ІФН Інтерферон
КН Клінічна настанова
ЛЕД Ледіпасвір
ОЗТ Опіоїдзамісна терапія
ОМБ Омбітасвір
ПАР Паритапревір
ПАРР Паритрапревір, посилений ритонавіром
Пег-ІФН Пегільований інтерферон
ПЛР Полімеразна ланцюгова реакція
ПППД Противірусний препарат прямої дії
РАШ Резистент-асоційовані штами
РБВ Рибавірин
РВВ Рання вірусологічна відповідь
РКД Рандомізоване контрольоване дослідження
РНК Рибонуклеїнова кислота
РТВ Ритонавір
СВВ Стійка вірусологічна відповідь
СИМ Симепревір
СІН Споживачі ін’єкційних наркотиків
СОФ Софосбувір
СШ Співвідношення шансів
США Сполучені Штати Америки
ТЛП Телапревір
УЗД Ультразвукове дослідження
ХГС Хронічний гепатит С
ШВВ Швидка вірусологічна відповідь
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
ШКАЛА ДОКАЗІВ І ГРАДАЦІЯ РЕКОМЕНДАЦІЙ
Рівні доведеності первинних даних
1++ Високоякісні метааналізи, систематичні огляди рандомізованих контрольованих досліджень (РКД) або РКД з дуже низьким ризиком систематичної помилки
1+ Належним чином проведені метааналізи, систе матичні огляди РКД або РКД з низьким ризиком систематичної помилки
1– Метааналізи, систематичні огляди РКД або РКД з високим ризиком систематичної помилки
2++ Високоякісні систематичні огляди досліджень «випадок-контроль» або когортних досліджень. Високоякісні дослідження «випадок-контроль» або когортні дослідження з дуже низьким ризиком похибки, систематичних помилок або відхилень і високою вірогідністю причинного зв’язку
2+ Належним чином проведені дослідження «випадок-контроль» або когортні дослідження з низьким ризиком похибки, систематичних помилок або відхилень і помірною вірогідністю причинного зв’язку
2– Дослідження «випадок-контроль» або когортні дослідження з високим ризиком похибки, систематичних помилок або відхилень і значним ризиком того, що цей зв’язок не є причинним
3 Неаналітичні дослідження, наприклад, повідомлення про випадки, серії випадків
4 Думка експерта
Градація рекомендацій
Примітка. Рівні доказів рекомендацій пов’язані з силою доказів, на яких вони засновані. Вони не відображають клінічного значення рекомендацій.
А Принаймні один метааналіз, систематичний огляд або РКД, оцінені як 1++ і безпосередньо застосовних до цільової популяції або Сукупність доказів, що складаються в основному з досліджень, оцінених як 1+ і безпосередньо застосовних до цільової популяції, і які мають узгоджувані результати
В Сукупність доказів, включаючи дослідження 2++, безпосередньо застосовних до цільової популяції, мають узгоджувані результати Екстрапольовані докази з досліджень 1++ або 1+
С Сукупності доказів, включаючи дослідження, застосовні до цільової популяції, які мають узгоджувані результати; Екстрапольовані докази з досліджень, які оцінюються як 2++
D Докази рівня 3 або 4, або Екстрапольовані докази з досліджень 2+
ПОЛОЖЕННЯ НАЛЕЖНОЇ ПРАКТИКИ
- Рекомендована належна практика, заснована на клінічному досвіді групи з розробки настанови
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
Система градації рекомендацій
Класифікація - Опис
Клас доказовості
Клас 1 Стани, для яких існують докази та/або загальна згода, що запропонована діагностична або лікувальна процедура корисна та ефективна
Клас 2 Стани, для яких існують суперечливі докази та/або розходження думок щодо корисності/ефективності діагностичної процедури, оцінки або лікування
Клас 2a Сила доказів або думок на користь корисності/ефективності
Клас 2b Корисність/ефективність менше підтверджена доказами та думками
Клас 3 Стани, для яких існують докази та/або загальна згода, що діагностична оцінка/процедура/лікування не є корисними, ефективними, а в деяких випадках навіть можуть бути шкідливими
Рівень доказовості
Рівень A Дані, отримані з декількох рандомізованих клінічних випробувань або метааналізів
Рівень B Дані, отримані з одного рандомізованого випробування або нерандомізованих досліджень
Рівень C Тільки консенсусні думки експертів, описи випадків або стандарти лікування
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Методологія
Ці рекомендації EASL підготовлені колегією експертів, обраних Керівною радою EASL. Ці рекомендації були схвалені Керівною радою EASL. Ці рекомендації ґрунтувалися, наскільки це було можливим, на інформації з існуючих публікацій та виступів на міжнародних зустрічах. Якщо докази були недоступні, то експерти наводили особистий досвід та погляди. Де це було можливим, наводяться рівні обґрунтованості та рекомендацій. Докази та рекомендації були оцінені у відповідності із системою розробки, оцінки та експертизи ступеня обґрунтованості клінічних рекомендацій (GRADE). Сила рекомендацій, таким чином, віддзеркалює якість основних доказів. Були сформульовані принципи системи GRADE [15]. Якість доказів рекомендацій було класифіковано на три рівні: високий (А), середній (В) та низький (С). Сила рекомендацій за системою GRADE поділяється на сильну (1) та слабку (2) (табл. 1). Таким чином, рекомендації розглядають якість доказів: чим вища якість доказів, тим більша вірогідність сильної рекомендації; чим більша мінливість оцінок та преференцій, або чим більша невизначеність, тим більша вірогідність рекомендацій слабкої сили.
Ці рекомендації обов’язково ґрунтуються на препаратах, зареєстрованих в даний час. Вони будуть регулярно оновлюватися Європейською агенцією з лікарських засобів після затвердження нових схем лікування.
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
Коментар робочої групи:
Актуальність для України
Вірусні гепатити з парентеральним механізмом передачі збудників, один з яких гепатит С, є важливою проблемою сучасної медичної науки і практичної охорони здоров`я усіх країн світу. Це обумовлено значним поширенням, високим рівнем захворюваності, вираженим поліморфізмом клінічних проявів, численністю шляхів та факторів передачі збудника, а також надзвичайно несприятливими наслідками, до яких може призвести гепатит — формуванню всього спектра хронічних уражень печінки, в тому числі цирозу і гепатоцелюлярної карциноми. Останніми роками помітна тенденція до збільшення випадків хронічних форм захворювання. За оцінками експертів ВООЗ, на хронічний гепатит С страждає близько 150 млн осіб, а 350 тис. щорічно помирає внаслідок ураження печінки вірусом гепатиту С. Захворюваність та летальність внаслідок гепатиту С прогресивно збільшується на планеті та, за даними експертів, подвоїться до 2015–2020 рр. Вже зараз загальна кількість хворих на гепатити у світі в 14–15 разів перевищує кількість ВІЛ-інфікованих. Вірусні гепатити у 50–100 разів є більш заразними, ніж ВІЛ.
За оцінними даними ВООЗ, 57 % випадків цирозу печінки і 78 % випадків первинного раку печінки зумовлено впливом вірусів гепатиту В або С. Окрім цього, гепатит С має багато позапечінкових проявів, що ускладнює їх діагностику та може перешкоджати призначенню відповідного лікування.
За ступенем негативного впливу на здоров’я населення та масштабами захворюваності вірусні гепатити в Україні посідають домінуюче місце в структурі інфекційної патології разом із грипом та гострими інфекційними захворюваннями верхніх дихальних шляхів.
Україна належить до країн із середнім рівнем поширення вірусного гепатиту С — інфіковано приблизно 3 % громадян, що становить ~ 1 170 000 осіб. Однак, за результатами вибіркового моніторингу груп ризику, рівень інфікування вірусом гепатиту С серед деяких з них значно перевищує середньосвітові показники і сягає 40–60 %.
Разом з цим слід зазначити, що на теперішній час досягнуто значний прогрес у лікуванні гепатиту С, зараз його можна вважати виліковним захворюванням. Окрім цього, наукові дослідження в цьому напрямку продовжуються та нові препарати здатні значно підвищити ефективність лікування. Велике значення у досягненні основної мети терапії — стійкої вірусологічної відповіді — має своєчасне виявлення хвороби, визначення її стадії та призначення оптимальної схеми лікування. Оскільки вірусний гепатит С є мультидисциплінарною проблемою, дуже важливо адаптувати найкращі клінічні настанови, що використовуються в світі, до реальної медичної практики України задля підвищення якості надання допомоги таким хворим.
СИНТЕЗ НАСТАНОВИ
За прототип Адаптованої клінічної настанови «Вірусний гепатит С» взято Клінічну настанову «SIGN 133 — Management of hepatitis C. A national clinical guideline» (2013) — http://www.sign.ac.uk/pdf/sign133.pdf.
Додаткові докази включені з джерел:
1. An Update on Treatment of Genotype 1 Chronic Hepatitis C Virus Infection: 2011 Practice Guideline by the American Association for the Study of Liver Diseases (AASLD).
2. AASLD Practice Guideline. Management of Hepatocellular Carcinoma: An Update (2011).
3. An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver (2012).
4. EASL Clinical Practice Guidelines: Management of hepatitis C virus infection (2011).
Під час позачергового перегляду медико-технологічних документів за темою «Вірусний гепатит С» в 2015 році докази залучені з джерел:
1. «WHO Guidelines for the screening, care and treatment of persons with hepatitis c infection» (2014).
2. «An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver».
3. «EASL Recommendations on Treatment of Hepatitis C 2015».
І. ВСТУП
1.1. Необхідність розробки клінічної настанови
Вірус гепатиту C (ВГС) було вперше виявлено у 1989 [1] році, а ВГС-інфекція стала значною проблемою в усьому світі. Вважається, що приблизно 0,8 % населення Шотландії мають хронічну інфекцію ВГС (близько 37 500 осіб). Поширеність інфекції варіюється між групами населення і може досягати від 50 % серед споживачів ін’єкційних наркотиків (СІН) до менше ніж 0,04 % серед нових донорів крові [1].
До 80 % пацієнтів, які інфіковані ВГС, стають хронічно хворими, і в більшості в таких пацієнтів проявляються ознаки ХГС [2].
Гепатит C, зазвичай, прогресує дуже повільно. Цей процес триває багато років. Серед 5–15 % пацієнтів з ХГС може розвинутися цироз печінки через 20 років [3]. Серед 4–9 % пацієнтів з цирозом розвивається печінкова недостатність, а серед 2–5 % пацієнтів з цирозом розвивається первинна ГЦК.
Двома основними шляхами передачі ВГС у Сполученому Королівстві є спільне використання засобів для ін’єкцій серед СІН та переливання інфікованої крові або продуктів крові. Обробка продуктів крові для інактивації вірусу почалася у 1987 році, а з 1991 року проводиться скринінг крові на гепатит С, що виключає продукти крові з переліку джерела інфікування ВГС.
Коментар робочої групи: підходи стосовно адаптації надання медичної допомоги хворим на вірусний гепатит С потребують приведення у відповідність з доказами найкращої практики.
ВГС можна ефективно лікувати, використовуючи терапію комбінованими препаратами (Пег-ІФН-α та РБВ) зі СВВ у 50–80 % пацієнтів. І хоча існують клінічні настанови щодо відбору пацієнтів до лікування [4–7], досі не існує національних клінічних настанов щодо скринінгу, тестування, діагностування, конфігурування послуг, надання допомоги протягом лікування чи контроль після лікування для дітей та дорослих. У даний час по всій Шотландії існують різноманітні розбіжності у наданні послуг особам, які інфіковані ВГС.
Коментар робочої групи: в Україні адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С», є першим документом, в якому наведені докази щодо необхідного обсягу діагностичних обстежень та строків їх виконання; лікарських засобів, що зарекомендували свою ефективність у лікуванні ВГС, та схеми їхнього призначення; очікуваних побічних дій противірусного лікування та поради щодо їхньої корекції.
WHO Guidelines for the screening, care and treatment of persons with hepatitis c infection (2014):
Епідеміологія ВГС
За останніми оцінками, понад 185 мільйонів людей у світі були інфіковані ВГС, 350 000 з яких помирають щороку [1, 2]. Більшість людей, інфікованих вірусом, не знають про свою інфекцію, і для багатьох, кому був встановлений діагноз, лікування залишається недоступним [3]. Лікування успішне у більшості осіб серед лікованих пацієнтів; показники ефективності лікування серед пролікованих осіб у країнах з низьким і середнім рівнем доходу схожі на показники в країнах з високим середнім рівнем доходів [4]. У третини з тих, хто має хронічну інфекцію, прогнозується розвиток цирозу печінки або ГЦК [5].
Поширеність ВГС значно варіюється в світі (табл. 2.1). Коли країни згруповані в Регіони Глобального тягаря хвороб, оцінна поширеність ВГС є найвищою в регіонах Центральної і Східної Азії і в регіонах Північної Африки/Близького Сходу. Зважаючи на велику популяцію Азії, регіони Південної та Східної Азії на сьогодні мають найбільшу кількість осіб, які інфіковані ВГС.
Деякі групи належать до груп підвищеного ризику інфікування ВГС; за оцінками, поширеність інфікування ВГС у цих групах подана в табл. 2.2. Відносна значимість факторів ризику для інфекції ВГС значно варіюється залежно від географічного регіону і досліджуваної популяції. Розширення доступу до тестування на ВГС і кращого епіднагляду — важливі кроки як до збільшення числа осіб із діагностованим ВГС, так і до покращення розуміння розподілення ВГС у загальній популяції та в групах підвищеного ризику.
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
1.1.1. Оновлення доказів
Ця настанова оновлює настанову SIGN 92: Лікування гепатиту С, аби відобразити останні дані з лікування ІП як доповнення до поточної стандартної подвійної терапії.
Це оновлення було обмежене за своїми масштабами і стосується лікування ХГС, надання інформації для пацієнтів і доглядачів і декілька інших незначних оновлень (розд. 1.2.3 і додат. 1). У розділах неоновлений текст і рекомендації дослівно повторюють настанову SIGN 92. Оригінальні підтверджуючі докази не були повторно оцінені поточною групою в індивідуальному порядку.
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
Чинне керівництво було створене для допомоги лікарям та іншим спеціалістам сфери охорони здоров’я у веденні пацієнтів з хронічною інфекцією ВГС. Воно було розроблено канадськими експертами з ВГС на прохання Виконавчого комітету Канадської асоціації вивчення захворювань печінки (CASL). Документ був представлений на розгляд членів CASL, і проект, переглянутий на основі такого зворотного зв’язку, був наданий Виконавчому комітету CASL для затвердження. Інформація, що міститься в чинному керівництві, являє собою синтез доказів з опублікованої літератури і наукових абстрактних уявлень, доступних на момент написання, з додаванням експертної думки авторів. Будь-яку рекомендацію слід вважати скоріше переважним підходом до надання допомоги, ніж суворим стандартом. У деяких випадках автори рекомендують використовувати схеми терапії за межами інструкції із застосування. Для більш повної характеристики якості доказів, що обґрунтовують ці рекомендації, ми присвоювали клас (відображає відношення користь/ризик) і рівень (оцінює силу визначеності) доказам за шкалою, адаптованою з такої, що використовується в Американській колегії кардіології та Практичних керівництвах Американської асоціації з вивчення захворювань серця, а також в подібних настановах CASL та Американської асоціації з вивчення захворювань печінки [4] (табл. 1). За цю роботу авторам не було надане жодне фінансування.
З моменту останнього оновлення керівництва CASL з ведення ХГС у 2012 р. [3] відбулися серйозні досягнення, включаючи затвердження нових противірусних препаратів прямої дії (ПППД), що застосовуються разом з Пег-ІФН, які мають покращену ефективність та переносимість порівняно з ПППД першого покоління та/або стандартною терапією, що базується на Пег-ІФН [5–7], та затвердження комбінацій ПППД як повністю пероральних безінтерферонових режимів лікування зі значно покращеною ефективністю, переносимістю й активністю за межами ВГС генотипу 1 [5, 8–15]. Чинний документ був розроблений як оновлена версія попереднього керівництва з акцентом скоріше на ведення ВГС-інфікованих пацієнтів, аніж на вичерпний огляд скринінгу на ХГС або ВГС. Майбутнє керівництво буде включати «особливі популяції» з ХГС, включаючи споживачів ін’єкційних наркотиків (СІН), ув’язнених осіб, пацієнтів з декомпенсованим цирозом печінки, пацієнтів до чи після трансплантації та пацієнтів з поєднаною інфекцією ВІЛ/ВГС (для яких нещодавно мережа Канадського інституту проведення досліджень у сфері ВІЛ опублікувала відповідне керівництво) [16]. Через швидкість досягнень у цій сфері рекомендації в цьому документі будуть регулярно оновлюватися, як тільки нова інформація буде з’являтися, а нові засоби затверджуватися.
Препарати прямої противірусної дії (ПППД)
На багатьох етапах життєвого циклу ВГС існують підтверджені належні мішені для нових фармакологічних засобів лікування (рис. 2). Особливо перспективні засоби, направлені на серинову протеазу NS3/4A, РНК-залежну РНК полімеразу NS5B та білок NS5A [73]. Інгібітори полімерази NS3/4A, БЦП і ТЛП, були першими ПППД, затвердженими Міністерством охорони здоров’я Канади для лікування ВГС генотипу 1. ІП другого покоління, СИМ, був затверджений у 2013 р. для застосування в комбінації з Пег-ІФН та РБВ для лікування ВГС генотипу 1. В 2013 р. перший нуклеотидний інгібітор полімерази ВГС, СОФ, був затверджений для застосування в комбінації з Пег-ІФН та РБВ для лікування генотипів 1 і 4 та разом лише з РБВ для генотипів 2 і 3. В 2014 р. схему із застосуванням однієї комбінованої таблетки, СОФ в комбінації з інгібітором NS5A ЛЕД, було затверджено для пацієнтів з ВГС генотипу 1, включаючи тих, хто отримував попереднє лікування із застосуванням БЦП та ТЛП. Окрім того, комбінацію ІП ПАР, підсиленого РТВ (ПАРР), інгібітору NS5A омбітасвіру (ОМБ) та ненуклеозидного інгібітору полімерази дасабувіру (ДАС) з РБВ або без нього було затверджено для лікування пацієнтів з ВГС генотипу 1. Враховуючи значно покращену ефективність та переносимість цих схем, всі пацієнти зможуть отримати користь із застосування терапії без ІФН. Отже, ці нещодавно затверджені засоби рекомендуються як терапія першої лінії для всіх показань, представлених у цьому керівництві. Проте в Канаді доступ до схем без ІФН є обмеженим. Ініціювати терапію із застосуванням схеми без ІФН або чекати наявності пероральних схем є індивідуальним рішенням, яке має враховувати бажання пацієнта, терміновість терапії, тяжкість захворювання печінки, прогнозовану переносимість Пег-ІФН, імовірність досягнення СВВ і очікуваний строк появи доступу до схем без ІФН.
/119.jpg)
МАЙБУТНІ ВАРІАНТИ ЛІКУВАННЯ
Численні додаткові противірусні препарати знаходяться на різних етапах клінічної розробки: від I фази до етапу отримання реєстраційного посвідчення. Перспективні ПППД включають інгібітори NS3/4A протеази (наприклад, асунапревір, гразопревір, совапревір, ведропревір), інгібітори NS5A (наприклад, ДАК, GS-5816, елбасвір, ACH-3102 і саматасвір) та ненуклеозидні (наприклад, беклабувір і GS-9669) і нуклеотидні інгібітори NS5B полімерази (наприклад, MK-3682 і ACH-3422). З появою нових даних щодо цих агентів, включаючи їх затвердження регуляторними органами, це керівництво з ведення ВГС буде оновлюватися.
Коментар робочої групи: на момент підготовки оновленої адаптованої клінічної настанови лікарські засоби даклатасвір (АТС-код: J05AX14), дасабувір, ледіпасвір, омбітасвір, паритапревір в Україні не зареєстровані.
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
1.2. СФЕРА КОМПЕТЕНЦІЇ КЛІНІЧНОЇ НАСТАНОВИ
1.2.1. ЗАГАЛЬНІ ЦІЛІ
Клінічна настанова надає рекомендації на основі доказів, що охоплюють всі етапи надання допомоги пацієнту; скринінгу, тестування, діагностування, направлення, лікування, надання допомоги та контроль для немовлят, дітей та дорослих, які інфіковані або піддаються впливу інфекції ВГС. Сфера компетенції включає запобігання вторинної трансмісії вірусу, але при цьому виключає первинне запобігання інфікуванню на ВГС. Первинне запобігання інфекції гепатиту С є важливим питанням громадського здоров’я, але складною темою для того, щоб охопити її в рамках доказової КН. Принципи і докази запобігання поширенню вірусів, що передаються через кров, нічим особливим не виділяються, а перегляд всіх доказів виходить за межі роботи будь-якої групи з розробки КН; водночас розгляд доказів лише по ВГС міг би справити порушене бачення цього питання.
1.2.2. ЦІЛЬОВІ КОРИСТУВАЧІ НАСТАНОВИ
Дана КН зацікавить професіоналів сфери охорони здоров’я первинної та вторинної ланки надання допомоги, що залучаються до ведення пацієнтів, які інфіковані вірусом гепатиту С.
1.2.3. РЕЗЮМЕ ОНОВЛЕНЬ НАСТАНОВИ ПО РОЗДІЛАХ
/120.jpg)
1.3. ЗАЯВА ПРО НАМІРИ
Даний посібник не призначений для сприйняття як стандарт лікування. Стандарти надання допомоги визначаються на основі всіх клінічних даних, доступних для конкретного випадку, і можуть бути змінені відповідно до наукових знань, технологічних досягнень та розвитку моделей надання допомоги. Дотримання настанов не забезпечить успішний результат у кожному випадку; не треба сприймати їх такими, що включають всі належні методи надання допомоги або виключають інші прийнятні методи лікування, що спрямовані на ті ж результати. Остаточне рішення має бути прийнято відповідним лікарем, який відповідає за клінічні рішення щодо конкретної клінічної процедури або плану лікування. Це рішення має бути прийняте тільки після відповідного обговорення варіантів з пацієнтом, що включає можливість вибору методів діагностики та лікування. Водночас радимо, щоб істотні посилання у національних чи будь-яких місцевих КН на основі даного документу були повністю задокументовані в історії пацієнта перед прийняттям адекватного рішення.
1.3.1. ПРИЗНАЧЕННЯ ЛІЦЕНЗОВАНИХ ЛІКІВ ЗА МЕЖАМИ ЇХ РЕЄСТРАЦІЙНОГО СВІДОЦТВА
Рекомендації даної настанови засновані на кращих клінічних доказах. Деякі рекомендації можуть стосуватися ліків за рецептами за межами їх реєстраційного свідоцтва, також відомого як ліцензія на продукт. Це відомо як використання за «незареєстрованими показаннями».
Лікарські засоби можуть бути призначені за «незареєстрованими показаннями» у таких випадках:
• за показаннями, не зазначеними у торговій ліцензії;
• для введення іншим шляхом;
• для введення інших доз;
• для інших пацієнтів.
Неліцензовані препарати — це препарати, які не мають реєстраційного свідоцтва для медичного застосування у людей.
Загалом, використання ліків за «незареєстрованими показаннями» стає необхідним, якщо клінічна потреба не може бути задоволена ліцензованими лікарськими препаратами відповідно до реєстраційного свідоцтва. Таке використання повинно бути підтверджене відповідними доказами та досвідом [8].
«Призначення препаратів поза умов їх дозволу на продаж змінює (і, ймовірно, збільшує) професійну відповідальність тих, хто їх призначає» [8].
Генеральна медична рада (GMC) рекомендує, що при призначенні препаратів не за прямим показанням лікарі повинні:
• бути впевненими, що таке використання краще послужить потребам пацієнта, ніж офіційно затверджені альтернативи (якщо такі існують);
• бути впевненими, що є достатньо доказів/досвіду використання ліків, що свідчать про їх безпеку та ефективність, при пошуку необхідної інформації з відповідних джерел;
• записати в медичних картках пацієнта призначені препарати і, якщо лікар не слідує загальноприйнятій практиці, причини такого вибору;
• взяти на себе відповідальність за призначення препаратів та догляд за пацієнтом, у тому числі моніторинг наслідків препаратів.
Немедичні консультанти повинні переконатися, що вони знайомі із законодавчою базою і своїми професійними нормативними стандартами.
Перед будь-яким призначенням необхідно перевірити статус ліцензування ліків у поточній версії Британського національного формуляра [8]. Особа, яка призначає препарат, повинна бути компетентною, діяти в рамках професійної етики і практики призначення свого роботодавця [9].
1.3.2. ДОДАТКОВІ ПОРАДИ ДЛЯ NHS ШОТЛАНДІЇ ВІД HEALTHCARE IMPROVEMENT SCOTLAND І ШОТЛАНДСЬКОГО КОНСОРЦІУМУ ЛІКАРСЬКИХ ЗАСОБІВ
Healthcare Improvement Scotland здійснює багатофункціональні оцінки технологій для NHSScotland, які були підготовлені Національним інститутом досконалості медичної допомоги (NICE) в Англії та Уельсі.
Шотландський консорціум лікарських засобів консультує NHS та його комітети з лікарських засобів та терапії про статус усіх нових зареєстрованих препаратів і будь-які серйозні зміни у показаннях для вже зареєстрованих препаратів.
Рекомендації Шотландського консорціуму лікарських засобів щодо даної настанови наводяться у розд. 14.
Коментар робочої групи: в Україні застосування лікарських засобів регламентоване ст. 7 Закону України «Про лікарські засоби», ст. 4 Закону України «Про захист прав споживачів», наказом МОЗ України № 651 від 26.07.2013 р. Відповідно до законодавчої бази, лікарський засіб слід застосовувати згідно з інструкцією.
ІІ. КЛЮЧОВІ РЕКОМЕНДАЦІЇ
Наступні рекомендації були виділені групою з розробки настанови як ключові клінічні рекомендації, які повинні бути пріоритетними для реалізації. Градація рекомендацій відноситься до сили доказів, на яких рекомендація заснована. Вона не відображає клінічної важливості рекомендації.
2.1. ЛІКУВАННЯ ХРОНІЧНОГО ГЕПАТИТУ С (ХГС)
A Всіх нелікованих пацієнтів, інфікованих ВГС генотипу 1, необхідно розглядати кандидатами на отримання лікування Пег-ІФН і РБВ з урахуванням маси з додаванням ІП як потрійну терапію.
A Всіх раніше лікованих пацієнтів, інфікованих ВГС генотипу 1, необхідно розглядати на лікування Пег-ІФН і РБВ з урахуванням маси з додаванням ІП як потрійну терапію.
В Неліковані пацієнти з коінфекцією ВІЛ і ВГС генотипу 1, яким не підходить лікування за схемою, що включає ІП ВГС, повинні бути розглянуті на лікування Пег-ІФН і РБВ з урахуванням маси впродовж 48–72 тижнів залежно від вірусологічної відповіді.
Коментар робочої групи: в даній настанові словосполучення «з урахуванням маси тіла» стосується виключно рибавірину.
Можливість використовувати ІП з Пег-ІФН і РБВ у потрійній терапії, що з’явилася нещодавно, значно поліпшила СВВ у пацієнтів з ВГС генотипу 1 з перспективою зниження загальної тривалості лікування залежно від відповіді на терапію. Пацієнти, інфіковані ВГС генотипу 2 і 3, продовжують досягати високої СВВ з подвійною терапією Пег-ІФН і РБВ. Це комбіноване лікування повинно бути обговорене і запропоноване як стандарт лікування для всіх відповідних пацієнтів із ВГС.
An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver (2012):
Рекомендації:
Всіх пацієнтів з ХГС слід розглядати для противірусної терапії, особливо пацієнтів з ознаками фіброзу печінки (клас 1, рівень А).
Пацієнти з позапечінковими проявами інфекції ВГС повинні бути розглянуті для противірусної терапії (клас 1, рівень В).
Постійно нормальний рівень активності АЛТ не виключає ні значного захворювання печінки, ні необхідності противірусної терапії (клас 1, рівень А).
EASL Clinical Practice Guidelines: Management of hepatitis C virus infection (2011):
Всі пацієнти, які не отримували лікування, з компенсованою хворобою печінки внаслідок ВГС підлягають лікуванню (А2).
Лікування слід починати невідкладно при тяжкому фіброзі (F3–F4). Наполегливо рекомендується призначення лікування у пацієнтів з помірним фіброзом (F2) (B2).
У пацієнтів з менш тяжким ураженням печінки показання до лікування є індивідуальними (C2).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
2.2. ДІТИ І ГЕПАТИТ С
А Дітей, інфікованих усіма генотипами вірусу гепатиту С з ознаками помірного або тяжкого захворювання печінки, слід розглядати для лікування Пег-ІФН і РБВ.
В Дітей, інфікованих генотипом 2 і 3 ВГС, слід розглядати для лікування Пег-ІФН і РБВ, незалежно від стадії захворювання.
С У дітей з легкою формою захворювання та інфекцією інших генотипів переваги лікування повинні бути збалансовані з ризиками побічних ефектів.
У дітей результат лікування Пег-ІФН і РБВ рівнозначний тому, що спостерігається у дорослих [10]. Побічні ефекти лікування спостерігаються з однаковою частотою, а щотижневі ін’єкції спричиняють незручності. Переваги досягнення СВВ в ранньому віці, усуваючи ризик подальшої передачі (особливо до досягнення дівчатами віку дітонародження) і до настання хронічного захворювання печінки, переважать ці недоліки в багатьох дітей, інфікованих сприятливими генотипами. Проте для тих, хто має менш сприятливі генотипи і не має ознак хронічного захворювання печінки, доцільно почекати, поки більш ефективне і прийнятне лікування не стане доступним.
2.3. ТЕСТУВАННЯ
D Тестування методом сухої краплі крові слід розглядати як зручний і економічно ефективний спосіб доступу до деяких цільових груп населення.
D Необхідно приділяти увагу методам підвищення обізнаності та виділення важливої інформації щодо гепатиту С серед груп ризику та широкої громадськості. Рекомендується направлення пропаганди на конкретну аудиторію. Співробітники повинні мати доступ до відповідної підготовки.
D Кожному, хто має негативний тест, але залишається з ризиком зараження, мають бути запропоновані подальші тестування на щорічній основі.
D Тестування на ВГС має бути запропоноване мігрантам з країн із середнім або високим рівнем поширеності ВГС.
Настанова NICE «Hepatitis B and C: Ways to promote and offer testing to people at increased risk of infection» [11] містить ряд ключових рекомендацій з тестування. Хоча вона призначена для служб NHS в Англії та Уельсі, вона має пряме застосування до тестування на ВГС в Шотландії.
ІІІ. ТЕСТУВАННЯ
3.1. КЛІНІЧНІ ТА ЕКОНОМІЧНО ЕФЕКТИВНІ ТЕСТУВАННЯ НА ВГС
Національні та міжнародні КН рекомендують особам, які мають підвищений ризик інфікування і можуть отримати вигоду від знання ВГС-статусу, запропонувати тестування на ВГС. Така рекомендація базується в основному на необхідності діагностування прихованої інфекції, що дозволяє розпочати швидке противірусне лікування, якщо це необхідно [15]. Оскільки лікування не може бути запропоноване до встановлення діагнозу ХГС, інформування населення з ризиком інфікування ВГС щодо необхідності тестування має клінічні переваги.
Подальші переваги у діагностуванні осіб, які інфіковані ВГС, включають можливість інформування з метою зниження швидкості прогресування ВГС (напр., поради щодо небезпеки надмірного споживання алкоголю) та зниження шансів передачі інфекції іншим особам. Надійних і переконливих доказів, що вказують на ефективність таких втручань, виявлено не було.
Керівні документи Сполученого Королівства наполегливо рекомендують особам, які можуть мати ризик передачі ВГС пацієнтам у закладах охорони здоров’я, проходити тестування на ВГС [5, 12–14]. Було зареєстровано кілька випадків передачі ВГС від медпрацівника до пацієнта і від донора крові/органу до реципієнта [16, 17].
Контрольовані дослідження або когортні дослідження для оцінки економічної ефективності ВГС-тестування в різних групах населення не проводилися. Обмежені дані з робіт економічного моделювання вказують, що пропонування ВГС-тестів колишнім СІН на лікуванні та, можливо, в інших закладах матимуть економічно ефективні клінічні переваги [18]. Рівень поширеності ВГС та прихильності до лікування вище серед колишніх СІН порівняно з дійсними СІН. Моделі кращих практик для виявлення і тестування колишніх СІН не розроблялися і не оцінювалися. Експертна думка зазначає, що загальні практики, а особливо ті, що застосовуються при високих рівнях поширеності споживання наркотиків, можуть складати умови, де сфокусовані, добре підтримані ініціативи з тестування можуть мати успіх. Тюрми також можуть мати такі можливості [19]. Проводилися цільові та генералізовані кампанії з інформування/тестування, але не проводилася оцінка їх успішності з підтримки людей (включаючи колишніх СІН), що мають високий ризик ВГС, для надання їм допомоги.
Серед населення, яке має низький рівень поширеності ВГС (напр., відвідувачі гінекологічних, урологічних та венерологічних клінік), економічне моделювання вказує, що універсальне тестування не несе в собі економічно ефективної користі [18].
D На ВГС необхідно тестувати такі групи населення:
● донори крові/тканин;
● пацієнти на гемодіалізі;
● медичні працівники, які планують працювати у сфері, яка передбачає проведення процедур, що становлять ризик інфікування.
D Наступним групам населення необхідно пропонувати тестування на ВГС:
● пацієнти з нез’ясованим постійно підвищеним рівнем активності АЛТ;
● особи, які мають в анамнезі споживання ін’єкційних наркотиків;
● особи, які є ВІЛ-позитивними;
● реципієнти фактору згортання крові до 1987 року;
● реципієнти крові та її компонентів до вересня 1991 року та трансплантованих органів/тканин у Сполученому Королівстві до 1992 року;
● діти, мати яких інфікована ВГС;
● медичні працівники, які мають контакт через шкіру або слизові мембрани з кров’ю, що є або може бути інфікована ВГС;
● особи, які отримали медичну чи стоматологічну допомогу в країнах, де ВГС є поширеним явищем, а інфекційний контроль є низьким;
● особи, у яких є татуювання або пірсинг на тілі, що були зроблені в умовах, де інфекційний контроль є або може бути недостатнім;
● особи, які мали статевого партнера/побутові контакти з особою, яка інфікована ВГС;
● особи, які народилися в період з 1945 по 1965 рік.
Настанова NICE «Hepatitis B and C: Ways to promote and offer testing to people at increased risk of infection» [11] містить ряд ключових рекомендацій з тестування. Хоча вона призначена для служб NHS в Англії та Уельсі, вона має пряме застосування до тестування на ВГС в Шотландії.
D Тестування цільної крові слід розглядати як зручний і економічно ефективний спосіб доступу до деяких цільових груп населення.
D Необхідно приділяти увагу методам підвищення обізнаності і виділення важливої інформації щодо гепатиту С серед груп ризику та широкої громадськості. Рекомендується направлення пропаганди на конкретну аудиторію. Співробітники повинні мати доступ до відповідної підготовки.
D Кожному, хто має негативний тест, але залишається з ризиком зараження, мають бути запропоновані подальші тестування на щорічній основі.
D Тестування на ВГС має бути запропоноване мігрантам з країн із середнім або високим рівнем поширеності ВГС.
Коментар робочої групи: в Україні при визначенні груп ризику доцільно не враховувати часові періоди, встановлені для Сполученого Королівства.
WHO Guidelines for the screening, care and treatment of persons with hepatitis c infection (2014):
Скринінг на вірус гепатиту С
Скринінг на вірус гепатиту С виконується за допомогою серологічних тестів на ВГС. Якщо результат позитивний, з метою підтвердження ХГС необхідно проводити ПЛР на РНК ВГС. Кілька скринінгових тестів були оцінені ВООЗ; було отримано дані про чутливість, специфічність а також позитивні і негативні прогностичні результати [81]. Це важливо для розгляду ймовірності інфікування іншими вірусами, що передаються з кров’ю, серед осіб з ВГС; скринінг на ВГВ і ВІЛ слід запропонувати на додаток до ВГС. Скринінг на інші інфекції (наприклад, туберкульоз) також показані в деяких групах ризику, таких як ВІЛ-інфіковані, ув’язнені і СІН.
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Скринінг на хронічний вірусний гепатит С (ХГС)
Завдяки впровадженню доволі ефективних нових схем лікування гепатиту доступ до лікування повинен бути розширений. Значна частка пацієнтів з ХГС не знають про свою хворобу. Окрім того, точні дані щодо поширеності та захворюваності ВГС необхідно проаналізувати в масштабах пандемії в різних регіонах, також необхідно розробити заходи в галузі охорони здоров’я. Отже, необхідно обстежувати на ВГС для ідентифікації інфікованих осіб та залучення їх до спостереження та лікування; необхідно застосовувати цільовий скринінг на маркери ВГС. Повинні виявлятися та обстежуватися групи високого ризику інфікування ВГС. Групи високого ризику, які повинні проходити обстеження, визначаються залежно від локальної епідеміологічної ситуації щодо інфекції ВГС. На додаток до ІФА швидкі діагностичні тести можуть бути використані для скринінгу антитіл. Швидкі діагностичні тести використовують різні матриці, в тому числі сироватку, плазму, цільну капілярну кров з пальця чи, для деяких з них, рідину ротової прожнини (кревікулярну), тим самим полегшуючи скринінг і уникаючи необхідності у проведенні венепункції, центрифугуванні пробірок, заморожуванні та кваліфікованих працівниках. Швидкі діагностичні тести прості в користуванні при кімнатних температурах, не потребують спеціального обладнання чи посиленого навчання методики проведення тесту.
• Скринінг на ВГС інфекцію повинен бути рекомендований для застосування в певних цільових групах у відповідності з місцевою епідеміологічною картиною щодо ВГС (в ідеалі) в рамках національних програм (А1).
• Скринінг на ВГС повинен засновуватися на виявленні антитіл до ВГС (А1).
• Швидкі діагностичні тести можуть бути використані замість класичних ІФА з метою полегшення скринінгу на антитіла та покращення доступу до лікування (В1).
• Якщо виявлені антитіла, то необхідно визначати РНК ВГС за допомогою чутливого методу молекулярної діагностики з метою виявлення тих, які в даний час мають інфекцію ВГС (А1).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
3.2. ДІАГНОСТИЧНЕ ТЕСТУВАННЯ НА ВГС
3.2.1. ПРИНЦИПИ ТЕСТУВАННЯ
Виявлення вірусної РНК за допомогою тесту ампліфікації нуклеїновими кислотами, зазвичай за використання зворотньотранскриптазної ПЛР, вказує на перенесену або наявну інфекцію. Алгоритм тестування наведено на рис. 1. Він базується на таких ключових принципах:
• діагностичні аналізи є найбільш надійними, коли використовується плазма чи сироватка крові [20]; 2++
• аналізи на антитіла в слині є дуже чутливими за умови використання оптимальних засобів відбору слини та використання модифікованих твердофазних імуноферментних аналізів (ELISA), але тест ампліфікації нуклеїнових кислот для вірусної РНК є ненадійним [20–22]; 2++
• для виявлення наявної інфекції необхідно проводити тестування нуклеїновими кислотами, що є достатньо чутливими для виявлення 50–100 МО/мл вірусу [23].
EASL Clinical Practice Guidelines: Management of hepatitis C virus infection (2011)
Недавні розробки ґрунтуються на полімеразній ланцюговій реакції (ПЛР) у режимі реального часу. Завдяки цьому стало можливим визначення кількості РНК вірусу гепатиту С за хвилину (до 10 МО/мл) та точне визначення рівня РНК вірусу гепатиту С приблизно до 107 МО/мл. Динамічний режим підрахунку відповідає клінічним потребам діагностики та моніторингу.
Визначення та кількісний підрахунок РНК вірусу гепатиту С слід проводити використовуючи чутливі методики (нижня межа визначення — 50 МО/мл чи нижче). Ідеальним варіантом є ПЛР у режимі реального часу. Рівень РНК вірусу гепатиту С слід визначати в міжнародних одиницях на 1 мл (C1).
An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver(2012):
Виявлення РНК вірусу гепатиту С слід проводити з використанням чутливого кількісного аналізу (нижча межа виявлення від 10 МО/мл до 15 МО/мл або менше) з широким динамічним діапазоном. Результати повинні бути стандартизовані та виражені в МО/мл; строк виконання обстеження не повинен перевищувати 7 днів (клас 1, рівень С).
Коментар робочої групи: ВООЗ стандартизувала кількісну ПЛР, порадивши використовувати виключно МО/мл. В Україні ще продовжують використовувати копії в мл, що не відповідає міжнародному стандарту.
• Вірусна РНК може бути виявлена вже в перший-другий тижні після інфікування, в той час як антитіла можуть бути виявлені на сьомому-восьмому тижні після інфікування [24]. 4
• Антитіла до інфекції можуть не вироблятися, особливо коли імунітет такої особи пригнічений [25]. 4
• Після гострого перебігу інфекції РНК ВГС може коливатися між позитивними та негативним значеннями кілька місяців. Результати зразків, що відібрані у даний час, можуть бути оманливими [24]. В особи, яка позитивна на антитіла до ВГС, але негативна на РНК ВГС, необхідно провести аналіз другого зразка для підтвердження початкового діагнозу, особливо, коли в більшості випадків дата інфікування невідома. 4
• Особи з позитивним результатом тесту на антитіла до ВГС і повторно негативним РНК не потребують подальшого активного ведення гепатиту С [25]. 4
• Оскільки гепатит С є серйозним інфекційним захворюванням, після початкового лабораторного діагностування у пацієнта необхідно взяти другий зразок для підтвердження правильності результатів першого зразка [26]. 4
• Необхідним є проведення генотипування вірусу в осіб з підтвердженою ВГС-інфекцією для визначення ймовірної відповіді на лікування. Особи з інфекцією вірусу генотипу 1 потребують лікування довшої тривалості, ніж особи з інфекцією генотипу 2 і 3 (розд. 10.2.1) [27]. 1++
• Експертні вказівки передбачають, що медичним працівникам, які мають або можуть мати тривалий професійний контакт з ВГС, необхідно пропонувати проведення РНК- тестування на 6, 12 та 24-й тиждень з тестуванням на антитіла до ВГС на 12-й та 24-й тиждень [28]. 4
B Діагностичне тестування на ВГС має проводитися на сироватці або плазмі крові, коли це можливо.
D Генотипування ВГС має проводитися у випадку, коли розглядається питання призначення противірусної терапії.
D Після черезшкірної експозиції з інфікованою кров’ю або потенційно інфікованою кров’ю медичним працівникам необхідно запропонувати проведення тестування РНК ВГС на 6, 12 та 24-му тижнях з тестуванням на антитіла до ВГС на 12-му та 24-му тижнях.
«EASL Clinical Practice Guidelines: Management of hepatitis C virus infection» (2011):
Особам, які зазнали травмування голкою, що була контамінована вірусом гепатиту С, необхідно провести аналіз на РНК вірусу гепатиту С протягом 4 тижнів.
Аналізи на активність АЛТ та антитіла до вірусу гепатиту С слід проводити через 12 і 24 тижні (B2).
Працівники закладів охорони здоров’я повинні здавати аналізи на антитіла до вірусу гепатиту С. Медичні працівники з позитивним ПЛР на РНК вірусу гепатиту С повинні уникати діяльності, що пов’язана з підвищеним ризиком випадкового проколу чи травмування шкіри чи слизових оболонок (C2).
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
ОБСТЕЖЕННЯ ПЕРЕД ПОЧАТКОМ ЛІКУВАННЯ
Стандартне обстеження
Стандартне обстеження ВГС-інфікованих пацієнтів має включати оцінку факторів ризику набуття вірусу (наприклад, вживання ін’єкційних наркотиків, отримання потенційно контамінованих продуктів крові або тканин, походження з регіону з високою поширеністю інфекції), ознаки та симптоми пізньої стадії захворювання печінки (наприклад, жовтяниці, асциту, енцефалопатії, крововилив, пов’язаний з портальною гіпертензією) або позапечінкові прояви ХГС, наявність супутніх факторів, які можуть прискорити прогресування захворювання (наприклад, вживання алкоголю, ожиріння, коінфекції) і потенційні протипоказання до терапії, що базується на ІФН (табл. 2), при яких безінтерферонові схеми можуть мати додаткові переваги. Необхідне лабораторне тестування включає вірусологічні тести для підтвердження та характеризації ВГС-інфекції, біохімічні показники функції печінки, ультразвукове дослідження органів черевної порожнини, оцінку стадії фіброзу і тести для виключення коінфекцій, проведення відповідної вакцинації та виявлення протипоказань до лікування. Для пацієнтів з відхиленнями біохімічних показників функції печінки від норми слід розглянути необхідність проведення серологічних тестів з метою виключення супутніх захворювань печінки (табл. 3).
Вірусологічні дослідження
Приблизно у чверті пацієнтів, інфікованих ВГС, відбувається спонтанна ерадикація вірусу [45]. Тому хронічна інфекція ВГС має бути підтверджена в усіх анти-ВГС-позитивних осіб шляхом виявлення РНК ВГС за допомогою достатньо чутливих методів. Виявлення та кількісне визначення РНК ВГС методом полімеразної ланцюгової реакції в реальному часі є стандартом через чутливість, специфічність, точність і широкий динамічний діапазон. Результати мають бути виражені в МО/мл та приведені до міжнародного стандарту ВООЗ. Рекомендується проведення кількісних аналізів з нижчою межею виявлення приблизно 10–15 МО/мл. Результати тестування РНК ВГС мають бути надані в розумний термін (протягом семи діб) для сприяння прийняттю рішень щодо лікування. Швидке виявлення невдачі лікування допоможе скоротити прийом пацієнтом дорогих препаратів, зменшити потенційну токсичність та, ймовірно, обмежити розвиток РАШ.
Генотип ВГС має оцінюватися в усіх пацієнтів, оскільки він робить важливий внесок у рішення ініціювати лікування та вибір схеми. При застосуванні схеми Пег-ІФН та РБВ було потрібно знати тільки основний генотип (від 1 до 6). Однак сьогодні знання підтипу має важливе значення, особливо для генотипу 1, через різні генетичні бар’єри до резистентності ВГС підтипів 1a і 1b для багатьох класів ПППД [46, 47]. У випадку деяких ПППД може знадобитися додаткове тестування (наприклад, на поліморфізм Q80K [див. нижче]) та/або альтернативне лікування з урахуванням підтипу (наприклад, застосування РБВ).
Рекомендації:
7. Тестування на РНК ВГС, генотип і підтип (тобто 1a проти 1b) є невід’ємною частиною ведення пацієнтів із ХГС (клас 1, рівень A).
8. Тестування на РНК ВГС має проводитися з використанням чутливого кількісного аналізу (нижча межа виявлення ≤ 10–15 МО/мл) з широким динамічним діапазоном. Стандартизовані результати мають бути виражені в МО/мл та надані протягом максимум семи діб для сприяння прийняттю рішень щодо лікування (клас 1, рівень A).
Оцінка ступеня тяжкості захворювання печінки
Оцінка ступеня тяжкості фіброзу печінки має важливе значення для визначення прогнозу для ВГС-інфікованих пацієнтів та встановлення необхідності противірусного лікування. Виявлення пацієнтів з цирозом печінки особливо важливе через підвищений ризик печінкових ускладнень, зниження ймовірності отримати відповідь на лікування та потребу у спостереженні за можливим виникненням ГЦК і варикозного розширення вен стравоходу. Хоча в деяких випадках результати стандартних тестів (наприклад, вузлувата зморщена печінка, спленомегалія або колатеральний кровообіг при портальній гіпертензії на УЗД) роблять наявність цирозу печінки очевидною, традиційно еталонним методом для визначення стадії фіброзу була біопсія печінки, яка дозволяє визначити тяжкість інших гістологічних уражень (наприклад, некрозапалення, стеатозу) і виключити співіснуючі захворювання печінки (наприклад, гемохроматоз). Різноманітні валідовані бальні системи продемонстрували достатню відтворюваність та варіабельність результатів у різних дослідників для обґрунтування їх клінічного використання (наприклад, індекси активності захворювання печінки Scheuer, Ishak та Knodell) [48]. Однак біопсія печінки має ряд обмежень, в тому числі інвазивність і потенціал розвитку серйозних ускладнень, включаючи крововилив (приблизно в одного з 1000) і смерть (приблизно в одного з 10 000) [49, 50], помилку вибірки і мінливість в патологічній інтерпретації, високу вартість, обмежений доступ у багатьох центрах і труднощі повторення біопсії з метою моніторингу тимчасових змін у стані. У світлі цих обмежень були розроблені численні неінвазивні альтернативи біопсії [51], включаючи маркери сироватки (наприклад, APRI — індекс відношення аспартатамінотрансферази/тромбоцитів [52]), FibroTest (FibroSure, LabCorp, США) [53], транзиторна еластографія (FibroScan, Echosens, Франція) [54–57] та інші інструменти візуалізації [58, 59].
Аналіз літератури підтвердив, що ці неінвазивні інструменти можуть бути використані замість біопсії печінки для визначення стадії фіброзу, пов’язаного з ВГС, на прийнятному рівні точності і відтворюваності. За результатами нещодавнього опитування канадських фахівців, які ведуть пацієнтів з хронічним захворюванням печінки [60], транзиторна еластографія була основним способом оцінки фіброзу у ВГС-інфікованих осіб серед 53 % респондентів, на другому місці — біопсія печінки (37 %). Майже половина респондентів вважає, що ці неінвазивні альтернативи скоротили застосування біопсії печінки більш ніж на 50 %. Загалом, ці тести мають високу точність при діагностиці цирозу печінки і прийнятну, але нижчу, результативність у визначенні помірної та тяжкої стадії фіброзу (F2 або вище). Ідентифікація легкої стадії фіброзу (F1) і диференціації між окремими стадіями є поганою, однак ці обмеження поширюються і на біопсію печінки. Нові дані також продемонстрували кореляцію між цими тестами і клінічними наслідками, пов’язаними з ВГС [61–63], їхню економічну ефективність порівняно з біопсією [64] і чутливість до ерадикації вірусу [65, 66]. Для визначення того, які мінімальні зміни цих маркерів є клінічно значущими, та для полегшення послідовного моніторингу фіброзу необхідне проведення додаткових досліджень.
Рекомендації:
9. Оцінка стадії фіброзу печінки має вкрай важливе значення для ведення пацієнтів з ХГС (клас 1, рівень A).
10. Прийнятні методи оцінки фіброзу включають біопсію печінки, транзиторну еластографію (FibroScan) та панелі біомаркерів сироватки (наприклад, FibroTest), як окремо, так і в комбінації. Всі провінції країни мають надати доступ щонайменше до одного точного неінвазивного методу оцінки фіброзу (клас 1, рівень A).
11. Як альтернатива, цироз печінки може бути з упевненістю діагностований у деяких пацієнтів з чітким клінічним або радіографічним підтвердженням (клас 2a, рівень C).
Застосованість тестування на інтерлейкін 28B
Загальногеномні дослідження асоціацій виявили одиничний нуклеотидний поліморфізм (SNP) біля гену інтерлейкіну 28B (IL28B) на хромосомі 19, який тісно пов’язаний як зі спонтанним, так і індукованим лікуванням кліренсом ВГС [67–70]. Для пацієнтів зі сприятливим CC-генотипом на локусі rs12979860 імовірність спонтанного кліренсу ВГС є більш ніж у два рази вищою порівняно з гетерозиготами (CT) і гомозиготами (TT) [67]. CC-генотип також асоціюється з приблизно дворазовим підвищенням СВВ при застосуванні схеми Пег-ІФН та РБВ порівняно з несприятливими алелями у пацієнтів з ВГС генотипу 1 [68, 70]. Релевантність у випадку генотипів 2 і 3 та у пацієнтів, які раніше отримували лікування, є менш чіткою. Існує значне варіювання в поширеності генотипу IL28B, обумовлене етнічним фактором.
CC-генотип надзвичайно поширений серед азіатів, але порівняно рідко зустрічається серед африканців, у той час як європейці та вихідці з Латинської Америки демонструють середню поширеність [68]. Подібні асоціації були відзначені для локусу rs8099917 (сприятлива алель = T і несприятлива алель = G) [71], та для нещодавно описаних варіантів ІФН-лямбда 4 (IFNL4) в локусі ss46915590 (сприятлива алель = T і несприятлива алель = ΔG) [72]. Для спрощення подальше обговорення буде посилатися на поліморфізм локусу rs12979860.
Вплив генотипу IL28B на успіх лікування є ниж-чим, якщо лікування включає ПППД. Пацієнти з CC-генотипом продемонстрували дуже високий показник СВВ при застосуванні ПППД з Пег-ІФН та РБВ, який досягав 98 % при застосуванні потрійної терапії, що базується на СОФ, у пацієнтів з ВГС генотипу 1 [5]. Застосування ПППД призводить до значного відносного підвищення показника СВВ у пацієнтів з не-CC-генотипом. У той час як генотип IL28B має обмежене значення в контексті показника СВВ при застосування схем лікування без ІФН [8, 15], залишається неясним, чи зможуть пацієнти зі сприятливим генотипом IL28B стати належними кандидатами для скорочення терміну лікування чи застосування меншої кількості ПППД.
Рекомендації:
12. Генотип IL28B може надати цінну інформацію щодо ймовірності досягнення СВВ залежно від генотипу ВГС та обраної терапії (клас 2b, рівень A).
13. Несприятливий генотип IL28B не виключає застосування противірусної терапії (клас 1, рівень A).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
ІV. ЗАПОБІГАННЯ ВТОРИННІЙ ТРАНСМІСІЇ
Поняття вторинної трансмісії визначається як подальша передача інфекції від осіб, про яких відомо, що вони інфіковані ВГС.
4.1. ТРАНСМІСІЯ ЧЕРЕЗ СТАТЕВИЙ АБО ПОБУТОВИЙ КОНТАКТ
Спостережні дослідження вказують, що існує дуже низький ризик передачі інфекції від осіб, які інфіковані ВГС, до членів їх сімей, близьких або статевих партнерів. Когортні дослідження дискордантних пар по ВГС вказують на захворюваність ВГС у 0–2 на 1000 років статевих контактів [29–31]. Особи, які мають коінфекцію з ВІЛ, особливо чоловіки, які мають статеві стосунки з чоловіками, можуть мати більшу вірогідність передачі свого ВГС-захворювання своїм статевим партнерам [32, 33]. З’ясовані факти передбачають, що передача відбувається через контакт з кров’ю, наприклад внаслідок спільного користування лезами для гоління та зубними щітками (тобто ті види діяльності, що призводять до черезшкірного контакту та контакту слизових мембран з інфікованою кров’ю), а також через незахищений статевий акт. 2+
Не проводилося жодних досліджень для підтвердження ефективності таких інтервенцій, як освітні ініціативи, включаючи пропаганду використання презервативів, що націлені на осіб, у яких діагностовано ВГС, у зниженні частоти ризикованої поведінки та/або запобігання асоційованій вторинній трансмісії ВГС. Експертна думка наголошує, що особи, які інфіковані ВГС, мають отримувати консультації щодо використання презервативів та уникнення видів діяльності, що можуть призвести до через-шкірного контакту та контакту слизової тканини з інфікованою кров’ю. Це дозволить, хоча і невеликою мірою, зменшити ризик трансмісії вірусу до інших осіб [14, 34]. 4
- Після консультації про низький ризик передачі ВГС статевим шляхом особам, які інфіковані ВГС, необхідно рекомендувати розглянути питання використання презервативів впродовж статевого контакту, якщо це чоловік, який має статеві контакти з чоловіком, або один з партнерів, інфікований ВІЛ.
D Особам, які мають коінфекцію ВГС/ВІЛ, необхідно рекомендувати завжди практикувати тільки безпечний статевий контакт і використовувати презервативи.
D Особам, які інфіковані ВГС, необхідно рекомендувати уникати дій, що можуть призвести до контакту з їх інфікованою кров’ю через шкіру чи через слизові мембрани, як то спільне використання лез для гоління та зубних щіток.
4.2. ТРАНСМІСІЯ ЧЕРЕЗ СПОЖИВАННЯ ІН’ЄКЦІЙНИХ НАРКОТИКІВ
Спільне використання ін’єкційних засобів споживачами наркотиків є головним способом передачі інфекції у розвинутих країнах [14, 34]. Спостережні дослідження демонструють, що такі інтервенції, як обмін голок та шприців, а також підтримуюча терапія метадоном, мають велику вірогідність знизити, хоча і неконтрольовано, трансмісію ВГС серед СІН у багатьох країнах, включаючи Шотландію [35]. Дослідження інтервенцій, що направлені конкретно на запобігання поширенню інфекції від інфікованих СІН до інших осіб через спільне використання ін’єкційного приладдя, не виявлені. 2+
Жодних надійних переконливих доказів впливу знання свого ВГС-статусу серед СІН на їх ризиковану ін’єкційну поведінку не виявлено. Експертна думка пропонує рекомендувати активним СІН із ХГС як запобігти трансмісії інфекції іншим СІН, наприклад, завдяки впровадженню безпечних ін’єкційних практик. Така інтервенція може бути ефективною [14, 34]. 4
D СІН, які знають, що вони інфіковані ВГС, мають отримати рекомендації щодо того, як вони можуть запобігти трансмісії інфекції іншим споживачам ін’єкційних наркотиків.
4.3. ТРАНСМІСІЯ МІЖ МЕДИЧНИМИ ПРАЦІВНИКАМИ ТА ПАЦІЄНТАМИ
4.3.1. РИЗИК ІНФІКУВАННЯ МЕДИЧНИХ ПРАЦІВНИКІВ
За експертною думкою, заходи інфекційного контролю мають бути стандартизованими та універсальними, а не визначатися знанням про статус пацієнта та вірус, що передається через кров [36]. 4
Оцінки ризику трансмісії після уколу голкою різняться. Було проведено одне оглядове дослідження із залученням 4403 медичних працівників, які мали контакти з такими пацієнтами. Дослідження виявило, що загальний рівень трансмісії становить 0,31 %, в той же час як оцінка 25 менших досліджень дала комбінований результат з рівнем у 1,9 % при залученні 2357 осіб [16, 37]. Відносний ризик вище, коли поранення глибокі, а в голці була кров. Ризик від поверхневого контакту або контакту слизової ймовірно значно вищий, але його важче обрахувати, в той час як трансмісія через тверді голки є дуже низькою [37]. Трансмісія відбувається лише від РНК-позитивних джерел. 2+
- Стандартні заходи інфекційного контролю проти трансмісії вірусних захворювань, що передаються через кров, мають проводитися всіма медичними працівниками незалежно від знання пацієнта свого статусу або підозри на інфекцію.
- Медичні працівники, які отримали травми від голки з інфікованого ВГС джерела, мають знати:
• загальний ризик трансмісії ймовірно нижче 2 %, а може бути і набагато нижче;
• ризик вище при нанесенні глибоких ран та при пораненні голками, що наповнені кров’ю;
• ймовірність трансмісії через безпорожнинні голки є низькою.
4.3.2. РИЗИК ІНФІКУВАННЯ ПАЦІЄНТІВ
Існують документи, що посвідчують передачу ВГС від медичних працівників до пацієнтів [17]. Більшість з них відбулися в результаті контакту після проведення процедур, зазвичай після порожнинних хірургічних втручань. Оцінка значення трансмісії до пацієнтів у двох ретроспективних аналізах за участі кардіохірургів становила 2,3 % і 0,36 %, в той час як ризик трансмісії від інфікованого гінеколога становив лише 0,04 % [38–40]. Управління охорони здоров’я Сполученого Королівства рекомендує, щоб медичні працівники, які є ВГС РНК-позитивними, не проводили небезпечних процедур з пацієнтами [17, 41]. 3
D Медичні працівники, які знають, що вони є ВГС РНК-позитивними, не повинні проводити небезпечних процедур з пацієнтами.
V. НАПРАВЛЕННЯ
Необхідно розглядати можливість направлення на надання спеціалізованої допомоги для всіх пацієнтів з активною ВГС-інфекцією (ВГС РНК-позитивні), а не обмежуватися лише потенційними кандидатами на противірусну терапію. Спеціалізовані клініки часто є джерелом інформації для пацієнтів та їх родичів, включаючи пропаганду охорони здоров’я та методів уникнення вторинної трансмісії вірусу.
Нещодавні моделювання вказують, що 90 % осіб із ВГС у Шотландії є активними або колишніми СІН [1]. Фактори, що асоціюються зі споживанням ін’єкційних наркотиків (напр., бідність, безладний спосіб життя, супутні захворювання, включаючи алкогольну залежність), можуть стати перешкодою для осіб, які перебувають в процесі дослідження, направлення та лікування [15, 19]. Експерти дійшли консенсусу, що надання послуг може бути вдосконалено шляхом інтегрованої мультидисциплінарної допомоги, що також допомагає особам, які мають проблеми з алкоголем та наркотиками, одночасно з наданням їм допомоги спеціалістами з ВГС [15]. 4
Не було виявлено жодних доказів на підтримку превалюючої думки, що дослідження та лікування активних СІН із ВГС-інфекцією не повинно пропагуватися, оскільки вони навряд чи мають хоча би помірний гепатит або навряд чи будуть дотримуватися такого лікування.
Два спостережні дослідження та одне контрольне п’ятирічне дослідження не виявили різниці в дотримуванні протоколів лікування та показали, що СІН, які описані як «активні» на момент реєстрації та проходження лікування наркозалежності, дотримувалися противірусного лікування такою ж мірою, як і ті, хто ніколи не вживав ін’єкційних наркотиків [42–44]. Дані дослідження були маломасштабними і не містили деталей про ін’єкційну поведінку учасників дослідження. 2
Всі пацієнти з гострим ВГС мають негайно направлятися на надання спеціалізованої допомоги, оскільки лікування впродовж гострої фази має більшу ймовірність бути успішним (розд. 7.3) [45]. 1++
За ідеальних умов, спеціалізована клініка повинна бути інтегрована з іншими службами, що мають можливість забезпечити безперешкодне пересування пацієнтів, особливо тих, яким важко отримати медичну допомогу. Така інтеграція має заохочувати служби, такі як служба з наркотичних проблем та медичні тюремні служби, до позитивного та безперервного реагування на питання ВГС-інфекції.
D Особи, включаючи СІН, у яких діагностовано ХГС, повинні отримувати інтегровану мультидисциплінарну допомогу, що може максимізувати початок лікування та утримування пацієнта на лікуванні.
A Пацієнти з гострою ВГС-інфекцією мають негайно направлятися на надання спеціалізованої допомоги.
- Активні СІН, які інфіковані ВГС, не повинні виключатися з розгляду можливості клінічного ведення ВГС, включаючи противірусну терапію, на основі їх ін’єкційного статусу.
- Всі пацієнти мають направлятися до медичного закладу, щоб періодично проводити оцінку стану інфекції та прогресування хвороби печінки, для визначення необхідності подальших заходів або терапії.
VІ. ДІТИ І ВІРУСНИЙ ГЕПАТИТ С
6.1. ТРАНСМІСІЯ ВІД МАТЕРІ ДО ДИТИНИ
Вагітні жінки, які є ВГС РНК-негативними, не становлять ризику трансмісії для своєї дитини [46, 47]. 2+
Ризик серед жінок, які інфіковані ВГС і є РНК-позитивними, у передачі інфекції дитині внутрішньоутробно або протягом пологів 2++
становить приблизно 5 %, а для тих, хто має коінфекцію з ВІЛ, ризик є вдвічі вищим [48]. Ризик дитини в інфікуванні ВГС від матері не залежить від методу народження чи грудного годування [48]. Одне перспективне дослідження вказує, моніторинг шкіряного покриву голови плода може підвищити ризик передачі інфекції від матері до дитини [49]. Велике ретроспективне дослідження не продемонструвало жодного підвищеного ризику [48]. Вагінальні пологи можуть підвищити ризик трансмісії ВГС, якщо мати дитини має коінфекцію з ВІЛ з очевидним вірусним навантаженням [48].
B ВГС РНК-позитивний статус вагітної жінки не повинен впливати на акушерське ведення вагітності або на стандартні поради щодо грудного вигодовування.
Коментар робочої групи: Українська нормативна база з акушерсько-гінекологічної допомоги відповідає положенням даної настанови.
6.2. ТЕСТУВАННЯ ДІТЕЙ ТА НЕМОВЛЯТ НА ВІРУСНИЙ ГЕПАТИТ С
Метою тестування немовлят, які народилися у жінок з гепатитом С, є не стільки виявлення всіх дітей, яким передалося захворювання, а виявлення тих, хто має ризик хронічної інфекції та довготривалих наслідків цього.
Немовлята, які народилися у жінок з позитивним результатом на антитіла до ВГС, матимуть позитивні результати на антитіла до ВГС після народження [50]. Немовлята, які не є інфікованими, стають негативними на антитіла до ВГС в період з 6-го по 20-й місяць від народження. Близько 80 % будуть негативні до 12 місяців від народження [46, 51]. Позитивні результати на вірусну РНК за тестом ампліфікації нуклеїнових кислот можуть бути отримані в перші місяці життя дітей, які пізніше стануть негативними і втратять антитіла до ВГС [51–54]. Деякі інфіковані немовлята можуть не бути ВГС РНК-позитивними до 12 місяців від народження або після цього періоду [54]. Нещодавнє дослідження вказує, що чутливість позитивних результатів зворотньотранскриптазної ПЛР, які отримані з двох досліджень (у період з 2-го до 6-го місяця життя), для прогнозування інфекції становить 81 % (95 % довірчий інтервал; ДІ 58–97 %) [55]. 2+
У випадку коінфекції з ВІЛ немовлята, які є стабільно позитивні за РНК, можуть мати негативні результати тесту на антитіла до ВГС між 12-м та 18-м місяцями життя [53]. 3
B Немовлята, які народилися у жінок з позитивним результатом на антитіла до ВГС і негативним до ВГС РНК, не потребують тестування.
B У дітей, які народилися у жінок з ВГС, тест на антитіла до ВГС має проводитися на 12-му місяці життя або пізніше для виявлення меншості дітей, які є інфікованими.
B Діти, матері яких мають коінфекцію з ВІЛ, та немовлята, у яких виявлено позитивні результати тесту на антитіла до ВГС після 12 місяців, мають пройти тест на РНК ВГС. А коли це можливо — підтвердити результати за допомогою другого зразка.
B Якщо інформація про ризик інфікування ВГС окремої дитини необхідна раніше ніж на 12-й місяць життя, тест на РНК ВГС та повторний аналіз може бути проведено після 2 місяців від народження. Для отримання остаточного діагнозу необхідне подальше тестування.
6.3. ПЕРЕБІГ ВІРУСНОГО ГЕПАТИТУ С У ДІТЕЙ
Перехресні дослідження вказують, що у 20–40 % дітей, які мають позитивний результат на антитіла до вірусу гепатиту С після 18 місяців, не виявляється РНК вірусу гепатиту С, що свідчить про спонтанний кліренс [57, 58]. Серед хронічно інфікованих, які залишаються позитивні на РНК вірусу гепатиту С, подальша ймовірність спонтанного кліренсу є низькою (3,5 %) [59]. 3
Рівні активності трансаміназ (АЛТ), що вдвічі вищі від верхньої межі норми, спостерігаються у 50 % інфікованих дітей [59]. 3
D Діти, які інфіковані ВГС, повинні проходити моніторинг для виявлення меншості, що має ризик прогресуючого фіброзу в дитинстві, і які можуть бути кандидатами на лікування.
- Діти, які інфіковані ВГС, повинні проходити клінічну оцінку кожні 6–12 місяців, здавати кров на аналіз та проводити тест на функціональність печінки. За наявності клінічних або УЗ-порушень, або у випадку підвищення РТ в сироватці крові вдвічі вище від верхньої межі норми, необхідно розглянути питання проведення біопсії печінки.
6.4. ЛІКУВАННЯ ДІТЕЙ З ВГС
Рівні відповіді на лікування у дітей мають подібні значення, вказують на той самий вплив генотипу, як і у дорослих (розд. 10) [60]. Комбіноване лікування ІФН та РБВ дає загальну СВВ на рівні 50–60 % [60–63]. Існує потенційна загроза впливу на функції щитоподібної залози та спричинення проблем росту [62, 63]. 3
Комбінована терапія Пег-ІФН і РБВ краща, ніж лише Пег-ІФН, і призводить до результатів, подібних до результатів у дослідженнях дорослих (розд. 10) [10]. 1+
Комбіноване лікування ІФН і РБВ забезпечує СВВ на рівні 80–93 % у дітей з інфекцією генотипу 3, але тільки 47–59 % у дітей з генотипом 1, що схоже на дані у дослідженнях дорослих [10, 64, 65]. 2+
А Дітей, інфікованих усіма генотипами вірусу гепатиту С з ознаками помірного або тяжкого захворювання печінки, слід розглядати для лікування Пег-ІФН і РБВ.
В Дітей, інфікованих генотипом 2 і 3 ВГС, слід розглядати для лікування Пег-ІФН і РБВ, незалежно від стадії захворювання.
С У дітей з легкою формою захворювання та інфекцією інших генотипів переваги лікування повинні бути збалансовані з ризиками побічних ефектів.
- Лікування дітей з генотипом 1 ВГС з використанням ІП слід розглядати тільки як частину клінічних досліджень.
- Випадки захворювання дітей на ВГС необхідно вести у консультаціях з педіатричною службою зі спеціалістом з питань гепатиту С.
VІІ. ГОСТРИЙ ВІРУСНИЙ ГЕПАТИТ С
7.1. ПЕРЕБІГ ХВОРОБИ
Захворюваність на гострий гепатит С є невідомою, але її можна оцінити на основі поширеності ХГС [66]. Гострий гепатит С зазвичай є асимптоматичним [67]. Повний клінічний спектр симптомів гострого гепатиту С проявляється дуже рідко (< 15 % пацієнтів) [68]. Рівень смертності від гострого гепатиту С є дуже низьким (0,1 % або менше), а найбільш поширеним результатом захворювання є хронічна інфекція [67–69]. 3
Лабораторне діагностування має починатися з аналізу на антитіла до ВГС, але у ранніх випадках ВГС РНК може бути єдиним маркером інфекції (розд. 3.2) [70]. 2+
Спонтанне одужання спостерігається у 30–50 % пацієнтів із симптомами інфекції впродовж, як правило, 3 місяців після діагностування. Найбільше це поширено серед жінок із жовтяничною формою хвороби [66, 67, 71, 72]. 3
D Пацієнти з гострим гепатитом С потребують клінічного та лабораторного моніторингу (нагляд за спонтанним кліренсом вірусу) протягом 3 перших місяців після діагностування, оскільки у таких пацієнтів часто відбувається самообмеження хвороби.
WHO Guidelines for the screening, care and treatment of persons with hepatitis c infection (2014):
Природний перебіг інфекції ВГС
Вірус гепатиту С спричиняє як гостру, так і хронічну інфекцію. Гострий ВГС визначається як наявність ВГС впродовж шести місяців після контакту та інфікування вірусом гепатиту С. Він, як правило, має безсимптомний перебіг і дуже рідко асоціюється з небезпечною для життя хворобою. Спонтанне одужання від гострого ВГС відбувається впродовж шести місяців після інфікування у 15–45 % інфікованих осіб при відсутності лікування. Майже всі інші (55–85 % осіб) залишаться інфікованими (якщо не лікувати) ВГС до кінця життя, і вважатимуться такими, які мають хронічну інфекцію ВГС. Антитіла до вірусу гепатиту С утворюються впродовж гострого періоду інфекції і зберігаються впродовж усього життя. В осіб, які мають антитіла до вірусу гепатиту С, діагноз ХГС необхідно підтверджувати тестуванням на РНК ВГС, що свідчить про наявність вірусу гепатиту С [58, 59].
При відсутності лікування хронічна інфекція ВГС може призвести до цирозу печінки, печінкової недостатності і ГЦК. У тих, хто має хронічну інфекцію ВГС, ризик розвитку цирозу печінки становить 15–30 % впродовж 20 років [60–62]. Ризик розвитку ГЦК у осіб з цирозом печінки становить приблизно 2–4 % на рік [63].
Ризик розвитку цирозу і ГЦК змінюється залежно від певних характеристик пацієнта або способу життя. Наприклад, до групи високого ризику розвитку цирозу або ГЦК належать: чоловіки; особи, які споживають надмірну кількість алкоголю; особи з гепатитом B або коінфекцією ВІЛ та з ослабленим імунітетом [64]. Хвороба, асоційована з вірусом гепатиту С, не обмежується печінкою. Позапечінкові прояви інфекції вірусу гепатиту С включають: кріоглобулінемію, гломерулонефрит, тиреоїдит і синдром Шегрена, інсулінорезистентність, цукровий діабет 2-го типу, захворювання шкіри, такі як пізня шкірна порфирія і червоний плоскатий лишай. У осіб з хронічною інфекцією ВГС, швидше за все, розвиваються когнітивна дисфункція, втома і депресія [65]. Ці наслідки можуть бути асоційовані з реплікацією вірусу в мозку; однак причинно-наслідковий зв’язок між цими проявами та хронічною інфекцією ВГС сумнівний [66].
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Рекомендації
Діагностика гострого та хронічного ВГС
Діагноз гострої та хронічної інфекції ВГС ґрунтується на виявленні РНК ВГС чутливим молекулярним методом (нижня межа визначення < 15 МО/мл). Антитіла до ВГС виявляються за допомогою імуноферментного анализу (ІФА) у переважної більшості пацієнтів з ВГС, але результати ІФА можуть бути негативними на початку гострого періоду гепатиту С і у пацієнтів із сильно ослабленим імунітетом. Після спонтанного чи пов’язаного з лікуванням кліренсу вирусу антитіла (анти-ВГС) зберігаються за відсутності РНК ВГС, але можуть знижуватися і врешті-решт зникають у деяких [16, 17].
Діагноз гострого гепатиту С можна з упевненістю встановити тільки у разі задокументованої сероконверсії до появи анти-ВГС, оскільки не існує серологічного маркера, що доводить, що інфекція ВГС de novo з’явилася після гострої фази. Не всі пацієнти з гострим гепатитом С будут анти-ВГС-позитивними під час діагностики. В таких випадках можно запідозрити гострий гепатит С, якщо клінічні ознаки та симптоми відповідають гострому гепатиту С (АЛТ > 10 ВМН, жовтяниця) при відсутності в анамнезі хронічних хвороб печінки чи інших причин гострого гепатиту, та/чи якщо останнє ймовірне джерело передачі можливо ідентифікувати. У всіх випадках РНК ВГС можно виявити під час гострої фази, хоча можуть виникати короткочасні перерви такого рівня РНК ВГС, що неможливо виявити тест-системами.
Діагноз хронічного гепатиту С ґрунтується на виявленні антитіл (анти-ВГС) та РНК ВГС за наявності біологічних і гістологічних ознак хронічного гепатиту. Так, у разі недавнього інфікування ВГС спонтанний кліренс вирусу дуже рідко виходит за рамки від 4 до 6 місяців, діагностика ХГС може бути проведена після цього періоду.
• Антитіла (анти-ВГС) є першою ланкою діагностики інфекції ВГС (А1).
• У випадку підозри на гострий ВГС чи у пацієнтів з імунодефіцитом визначення РНК ВГС повинно бути частиною первинної оцінки (А1).
• У разі виявлення антитіл (анти-ВГС) необхідно проводити визначення РНК ВГС чутливим методом молекулярної діагностики (А1).
•Анти-ВГС-позитивні, РНК ВГС-негативні пацієнти повинні бути повторно обстежені на РНК ВГС через три місяці з метою підтвердження факту одужання.
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
7.2. ПРОФІЛАКТИКА ПІСЛЯ КОНТАКТУ
Не існує досліджень, що виявили б ефективність імуноглобуліну, терапії ІФН або противірусними препаратами у запобіганні транс-місії при прийомі одразу після ризикованого контакту. Дві оцінки розглядали старі дослідження щодо імуноглобуліну і не встановили ніякої його ефективності, та дійшли висновку, що імуноглобулін та терапія ІФН не рекомендовані після контакту з ВГС [28, 73]. 4
7.3. ЛІКУВАННЯ ПАЦІЄНТІВ З ГОСТРИМ ГЕПАТИТОМ С
7.3.1. ЧАС ЛІКУВАННЯ
У більшості пацієнтів, у яких спостерігається спонтанний кліренс вірусу гепатиту С, це відбувається у період 12 тижнів після діагностування [66, 72]. Немає даних, що вказували б на те, що відкладене лікування від трьох до шести місяців після діагностування знижує відповідь на лікування, хоча дозволяє спонтанний кліренс [45]. Відкладення лікування на один рік після виявлення знижує СВВ [45]. 3
D Лікування має починатися у період від 3 до 6 місяців після діагностування гострого гепатиту С, якщо інфекція не зникла самостійно.
3.2. ВИБІР ТА ТРИВАЛІСТЬ ЛІКУВАННЯ
Два систематичні огляди розглянули ефективність застосування непегільованих ІФН для лікування пацієнтів з гострим гепатитом С [74, 75]. В одному з досліджень учасники груп лікування мали вищий рівень СВВ (62 %), ніж учасники груп без лікування (12 %) [74]. Оцінка Кокрейна продемонструвала, що збільшення дози непегільованих ІФН протягом початкової фази лікування асоціювалось із вищим рівнем СВВ [75]. Немає даних про залежність відповіді на лікування гострого ВГС від генотипу вірусу. 1++
Не було виявлено РКД Пег-ІФН проти звичайних ІФН для пацієнтів з гострим гепатитом С. У серії випадків 16 пацієнтів, які не мали сероконверсії за три місяці, проходили лікування лише Пег-ІФН протягом 24 тижнів. Повідомлялося, що СВВ становила 94 % [66]. 3
A Пацієнти з гострим гепатитом С мають лікуватися ІФН, якщо інфекція не зникла самостійно.
D Пацієнтів можна лікувати Пег-ІФН або непегільованими ІФН.
D Пацієнти з гострим ВГС повинні проходити лікування ІФН протягом 24 тижнів незалежно від генотипу захворювання.
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Лікування гострого гепатиту С
У більшості пацієнтів гострий ВГС має безсимптомний перебіг, але без лікування очікується високий рівень хронізації (50–90 %). Симптоматичний перебіг з жовтяницею, жіноча стать, молодий вік, генетичний поліморфізм ділянки вище гена IL28B були асоційовані зі спонтанним кліренсом вірусу, але жоден цей параметр не є точним предиктором спонтанного одужання на індивідуальному рівні.
Пацієнтів з гострим ВГС необхідно розглядати для призначення противірусного лікування з метою попередження розвитку ХВГ. Висока частота СВВ (> 90 %) була зареєстрована при монотерапії Пег-ІФН незалежно від генотипу. Менший рівень СВВ був зареєстрований при використанні даної схеми у пацієнтів з ВІЛ. Комбіноване лікування з РБВ не призводить до збільшення частоти СВВ у пацієнтів з моноінфекцією ВГС, але раніше використовувалася для лікування пацієнтів з повільною відповіддю, поєднаною з ВІЛ-інфекцією та іншими негативними факторами відповіді на лікування [122–130]. Дослідження показало більш високий рівень СВВ після додавання ТЛП до Пег-ІФН-альфа та РБВ у ВІЛ-інфікованих з генотипом 1 [131]. Дані щодо використання нових безінтерферонових схем лікування пацієнтів з гострим ВГС відсутні.
Ідеальний час для початку лікування не був впевнено визначений. Деякі дослідники вважають, що початок підвищення АЛТ, з клінічними симптомами чи без таких, може бути ідеальним моментом для лікування [132–135]. Окрім того, передбачається, що у пацієнтів слід визначати кількість РНК ВГС раз у чотири тижні і лікувати слід тільки тих із них, хто залишається РНК ВГС-позитивним через 12 тижнів від початку дослідження [136].
Рекомендації щодо лікування пацієнтів з гострим ВГС можуть бути виведені тільки з результатів, отриманих від апріорі важковиліковних пацієнтів з хронічною інфекцією ВГС. Наразі відсутні будь-які показання щодо противірусного лікування як післяконтактна профілактика у відсутність підтвердженого ВГС.
Рекомендації
• Спираючись на наявні дані, монотерапія Пег-ІФН альфа (Пег-ІФН-α2а, 180 мкг в тиждень чи Пег-ІФН-α2b, 1,5 мкг/кг в тиждень) впродовж 12 тижнів може використовуватися у пацієнтів з гострим ВГС і дозволяє досягти СВВ серед 90 % випадків (А1).
• Пег-ІФН альфа (Пег-ІФН-α2а, 180 мкг в тиж-день чи Пег-ІФН-α2b, 1,5 мкг/кг в тиждень) необхідно комбінувати зі щоденним прийомом РБВ залежно від маси тіла (1000 чи 1200 мг у пацієнтів з масою тіла < 75 кг чи ≥ 75 кг відповідно) впродовж 24 тижнів у пацієнтів з гострим ВГС, з коінфекцією ВІЛ (В1).
• Хоча відповідні дані ще відсутні, безінтерферонові схеми можуть бути використані у пацієнтів з гострим ВГС, оскільки це, як очікується, дозволяє досягти високого рівня СВВ. Ті ж дози і строки, як для пацієнтів з хронічним ВГС, можуть використовуватися без РБВ, доки не з’являться нові дані щодо того, чи буде більш коротка та/чи менш інтенсивна терапія достатньою для досягнення високого відсотка виліковування від інфекції (В1).
• Показань для противірусного лікування як постконтактної профілактики немає за відсутності достовірного інфікування ВГС (В1).
VІІІ. ОЦІНКА СТАНУ ПЕЧІНКИ
8.1. КЛІНІЧНА ОЦІНКА
Клінічна оцінка тяжкості захворювання печінки пацієнтів з ХГС є неточною і недооцінює тяжкість змін, як це показує біопсія печінки. 3
8.2. МАРКЕРИ ФІБРОЗУ
Дослідження неінвазивних методів виявлення тяжкості хвороби печінки з використанням комбінації клінічних та біохімічних показників виявили, що може бути можливим розрізняти пацієнтів з цирозом від тих, у кого легкий перебіг захворювання. Проміжні етапи не розрізняються [77]. 2++
Систематична оцінка продемонструвала, що сурогатні маркери фіброзу, які відображають порушення функції печінки (активність АЛТ, тромбоцити) або метаболізм фіброзу (напр., тканинний інгібітор матричних металопротеїназ 1, гіалуронова кислота), не можуть використовуватися окремо для прогнозування фіброзу. В окремих пацієнтів такі маркери, використані самі по собі, не можуть надійно диференціювати стадії фіброзу. Якщо маркери використовуються в панелях, вони можуть визначати, чи має особа високий або низький рівень фіброзу. 14 досліджень у систематизованій оцінці застосовували 10 різних панелей маркерів, жоден з яких не був кращий за інші з точки зору статистичного порівняння. Тест порівнювали із золотим стандартом біопсії печінки як частину процесу їх валідації, хоча і біопсія печінки потенційно може бути неточною через похибку вибірки. Порівняння сурогатних маркерів та біопсії печінки з клінічними результатами може бути більш релевантним [78]. 2++
B Біохімічні маркери не треба використовувати як альтернативу біопсії печінки для визначення проміжних стадій фіброзу.
B Біохімічні тести можуть використовуватися як альтернатива біопсії печінки для діагностування цирозу або прямого скринінгу ускладнень фіброзу.
- Вимірювання щільності печінки може бути корисним як неінвазивна оцінка фіброзу печінки.
Коментар робочої групи: останніми роками виявлено недоліки біопсії, результатом цього стала поява неінвазивних методів оцінки фіброзу у пацієнтів із ХГС, що включають всебічний аналіз. Вони включають біохімічні маркери та транзиторну еласто-графію.
8.3. БІОПСІЯ ПЕЧІНКИ
Біопсія печінки має бути принаймні 25 мм завдовжки для того, щоб визначити ступінь фіброзу з точністю у 75 % [79]. Смертність в результаті біопсії печінки становить 0,13–0,33 %, а ступінь значної захворюваності становить близько 5,9 % [80]. 3
8.3.1. КОЛИ ПРОВОДИТИ БІОПСІЮ
Біопсія печінки для пацієнтів з ХГС може забезпечити додатковий діагноз, такий як алкогольна хвороба печінки або стеатоз (10 % пацієнтів), і може вплинути на прийняття рішення щодо ведення випадку захворювання у 5 % пацієнтів [81]. Повторна біопсія печінки може бути корисна для ідентифікації осіб для лікування; третина пацієнтів з легкою формою ХГС мають один ступінь прогресування фіброзу за шкалою Іцхака (0–6) в середньому за 30 місяців [82]. Частота і час проведення біопсії печінки мають відповідати потребам індивідуального пацієнта, оскільки прогресування фіброзу не є лінійним. 3
Виражений фіброз або цироз за результатами біопсії печінки порівняно з легкою формою захворювання прогнозує помірне зниження СВВ після противірусної терапії [83]. 1++
Біопсія печінки до та після успішної противірусної терапії (середній інтервал 20 місяців) показала як покращення з точки зору фіброзу (277 з 1094 пацієнтів), так і в зниженні ступеня цирозу (75 з 153 пацієнтів) [84]. 1+
D Біопсія печінки має проводитися тоді, коли є підозра щодо додаткових причин захворювання печінки.
D Повторна біопсія печінки має розглядатися для пацієнтів з легким перебігом захворювання, які залишаються без лікування, якщо прогресування фіброзу печінки може вплинути на рішення щодо вибору противірусної терапії.
- У пацієнтів з вродженими порушеннями згортання крові біопсія печінки має проводитися після консультації з фахівцем з питань гемофілії.
8.3.2. БІОПСІЯ ТА ГЕНОТИПИ
Показник СВВ після терапії Пег-ІФН та РБВ для пацієнтів з генотипом 2 і 3 становить 76–82 %, і 41–51 % для пацієнтів з генотипом 1 [7]. Центр оцінки технологій охорони здоров’я Сполученого Королівства рекомендує не вимагати проведення біопсії печінки перед початком лікування пацієнтів з генотипом 2 і 3 [7]. 4
D Біопсія печінки не повинна розглядатися як суттєвий тест перед початком противірусної терапії, особливо для пацієнтів з інфекцією генотипу 2 і 3.
ІХ. ПРОГРЕСУВАННЯ НЕЛІКОВАНОЇ ХВОРОБИ
ХГС асоціюється зі значним ризиком розвитку цирозу і ГЦК [3, 85]. Розрахувати величину ризику розвитку цирозу і ГЦК з часом важко, оскільки результати сильно залежать від дизайну дослідження та характеристик досліджуваної популяції [3, 85]. 2++
Систематичний огляд 57 досліджень (всі перехресні та вивчені в різні моменти часу), які включали пацієнтів клінік захворювань печінки, пацієнтів після трансфузій, донорів та пацієнтів широкої громадськості, оцінили ризик прогресування цирозу через 20 років. 2++
• Клініки захворювань печінки: 22 % (95% ДІ від 18 % до 26 %).
• Пацієнти після трансфузій: 24 % (95% ДІ від 11 % до 37 %).
• Донори: 4 % (95% ДІ від 1 % до 7 %).
• Пацієнти широкої громадськості: 7 % (95% ДІ від 4 % до 10 %).
Через систематичні похибки вибірки, притаманні перехресним клінічним даним щодо захворювань печінки, когортні дослідження для популяції можуть найбільш достовірно представляти прогресування захворювання на рівні популяції. Когорти на основі популяції вказують, що в осіб, які були інфіковані ВГС у молодому віці, лише у 10 % через 20 років розвинеться цироз. Старший вік інфікування ВГС, чоловіча стать і сильне зловживання алкоголем асоціюються з більш швидким прогресуванням хвороби [3]. 2++
Середній період часу від інфікування ВГС до розвитку ГЦК також показує значні варіації між дослідженнями, коливаючись від 9 до 31 року в одній систематизованій оцінці [85]. Фактично жодного випадку ГЦК не розвивається у першу декаду після інфікування ВГС, більшість виявляються вже після 20 років від моменту інфікування [85]. 2++
Ризик розвитку ГЦК для пацієнтів зі встановленим цирозом, що викликаний ВГС, становить 7 % впродовж контролю через 5 років [86, 87]. 2+
Пацієнти з встановленим цирозом, асоці-йованим із ВГС, схильні до ризику ускладнень, таких як асцит, шлунково-кишкові кровотечі та печінкова енцефалопатія [86, 87]. Кумулятивна ймовірність всіх форм декомпенсації пацієнтів з цирозом, у яких немає пухлин, становила 18 % на 5 років у одному дослідженні із загальним п’ятирічним рівнем виживання у 91 % [87]. 2+
9.1. ВІК, СТАТЬ, ЕТНІЧНЕ ПОХОДЖЕННЯ
Збільшення віку впродовж розвитку ВГС- інфекції пов’язано з більш швидким прогресуванням фіброзу печінки і скороченням часу від інфікування до розвитку цирозу [87–89]. Вік понад 40 років на момент зараження особливо пов’язаний з більш швидкою прогресією [89, 90]. 3
Три когортні дослідження звітують, що чоловіки, які інфіковані ВГС, мають більшу вірогідність до прогресування хвороби до прогресуючих стадій фіброзу печінки, ніж жінки [89, 91, 92]. 3
Відмінності в прогресуванні захворювання спостерігаються у пацієнтів різних рас. Два когортні дослідження продемонстрували, що захворювання прогресувало дещо не так швидко серед пацієнтів афроамериканців порівняно з пацієнтами, які не є афроамериканцями [93, 94]. Вірогідна швидкість прогресування у цих пацієнтів має розглядатися впродовж прийняття рішення про необхідність продовження противірусної терапії. 2+
D Оцінюючи ймовірну швидкість прогресування хвороби печінки, необхідно брати до уваги вік, стать та етнічне походження пацієнта.
9.2. МАСА ТІЛА
Дослідження виявили, що індекс маси тіла (ІМТ) > 25 асоціюється зі стеатозом печінки (розд. 12.1.3).
9.3. ТЮТЮНОПАЛІННЯ
Тютюнопаління є незалежним чинником ризику прогресування запалення печінки і фіброзу у хворих на ХГС [95, 96]. Даних про вплив припинення паління виявлено не було. 3
D Пацієнти з ХГС мають бути поінформовані, що тютюнопаління може прискорити прогресування хвороби печінки.
9.4. АЛКОГОЛЬ
Сильне зловживання алкоголем у пацієнтів, інфікованих ХГС, асоціюється з більш тяжким захворюванням печінки, включаючи цироз печінки, термінальні стадії захворювання печінки і ГЦК [97, 98]. Середнє споживання алкоголю більше шести одиниць у Сполученому Королівстві в день асоціюється з більш швидким прогресуванням фіброзу печінки [88, 89, 92]. 2+
Коментар робочої групи: в країнах Європи одиниця алкоголю дорівнює 10 мл чистого етанолу.
Навіть помірна (визначена Шотландськими директивами) кількість алкоголю асоціюється з підвищеним ризиком розвитку фіброзу печінки порівняно з тими, хто утримується від споживання алкоголю [89, 99].
Пацієнти, які знають свій ВГС-статус, мають вищу вірогідність прислухатися до поради припинити споживати алкоголь, аніж ті, хто вважає себе неінфікованим [100]. 2++
B Пацієнти з ХГС повинні бути поінформовані, що вживання алкоголю (навіть помірне) може прискорити прогресування хвороби печінки.
9.5. АЛАНІНАМІНОТРАНСФЕРАЗА
Приблизно 25 % (діапазон 10–40 %) пацієнтів з ХГС мають стабільно нормальний показник активності аланінамінотрансферази сироватки крові. Такі пацієнти, більш імовірно, є жінками з легким перебігом хвороби [101]. Хоча є суттєва кореляція між пацієнтами з нормальною АЛТ і пацієнтами з легкою формою захворювання печінки, ці терміни не є синонімічними, а групи розглядаються окремо в лікувальних цілях (розд. 10.3.1 і 10.3.3). Визначення «стабільно нормальний» відрізняється в довідковій літературі з показниками вимірювання активності АЛТ кожні 2–3 місяці за період часу від 6 до 18 місяців [101]. Проте загострення активності АЛТ може відбуватися у 21,5 % пацієнтів після того, як воно було нормальним протягом 12 місяців [102]. У даному випадку немає асоціації з гепатитом С, генотипом або вірусним навантаженням [101]. 1–
Прогресування фіброзу печінки відбувається повільніше у пацієнтів з нормальною АЛТ, ніж у пацієнтів з підвищеним рівнем активності АЛТ [103]. 2++
У пацієнтів, які не лікувалися, з легким перебігом захворювання, прогресування до помірного або тяжкого захворювання за час спостереження (5,6 року) становить 5 % для пацієнтів з нормальною АЛТ і 24 % для пацієнтів з підвищеним рівнем активності АЛТ.
«An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver (2012)»:
Нормальний рівень активності АЛТ не є протипоказанням до лікування. Ці пацієнти, які становлять приблизно одну третину хронічно інфікованих осіб, також реагують на терапію, як і пацієнти з підвищеним рівнем АЛТ. Більше того, приблизно одна четверта частина пацієнтів з постійно нормальним рівнем активності АЛТ мають хворобу печінки від помірної до тяжкої за даними біопсії.
Вважається, що рутинна біопсія печінки є непотрібною, якщо немає потреби у конкретній інформації щодо вибраних пацієнтів [101]. 1+
D Виявивши нормальну АЛТ, необхідно проводити вимірювання активності АЛТ кожні 2–3 місяці, щоб упевнитися, що зростання активності АЛТ не були пропущені.
- Тривалість контролю для визначення нормальної АЛТ має становити 12 місяців.
- Проведення біопсії печінки має розглядатися лише за умови клінічного занепокоєння або інших проблем з окремим пацієнтом.
9.6. КОІНФЕКЦІЯ З ВІЛ
Існує підвищений рівень розвитку термінальної стадії захворювання печінки у пацієнтів з коінфекцією ВІЛ і ВГС порівняно з тими, хто має тільки ВГС (відносний ризик, ВР = 6,14; 95% ДІ від 2,86 до 13,2) [104]. Середній період часу до цирозу печінки у хворих з коінфекцією становить 26 років порівняно з 38 роками у пацієнтів з моноінфекцією ВГС [104]. Пацієнти з ВГС з помірною імуносупресією в результаті ВІЛ також мають більш серйозні захворювання печінки, ніж ті, хто хворіє тільки на ВГС [105]. Існує помітне збільшення смертності внаслідок захворювання печінки у пацієнтів з коінфекцією ХГС і ВІЛ (ВР = 17,5) [106]. 1+
Ефективна терапія проти ВІЛ і пов’язане з цим відновлення імунітету може обмежити прогресування захворювання печінки на ВГС [107]. 2++
B Прискорення швидкості розвитку декомпенсованого захворювання печінки у пацієнтів з коінфекцією ВГС та ВІЛ повинно спонукати до якнайшвидшого призначення противірусної терапії.
9.7. КОІНФЕКЦІЯ З ВІРУСОМ ГЕПАТИТУ А АБО ГЕПАТИТУ В
Особам з ВГС рекомендована вакцинація проти гепатиту А і гепатиту В [108]. Спільний звіт про лікування гепатиту рекомендує вакцинацію проти гепатиту В, але не проти гепатиту A [109]. Одне дослідження випадку пацієнта з ВГС, який заразився гепатитом А, підтвердив високий рівень загрози фульмінантного гепатиту [110]. 4
Відповідь антитіл на вакцинацію проти гепатиту В у пацієнтів з ХГС знижена [111]. 3
D Необхідно розглянути можливість вакцинації пацієнтів з гепатитом С проти гепатиту А і В.
Пацієнти з ВГС, які мають серологічні докази наявної чи перенесеної інфекції ВГВ, мають більшу вірогідність отримати тяжке захворювання печінки [91, 112, 113]. 3
D Розраховуючи вірогідність прогресування хвороби печінки в результаті гепатиту С, необхідно зважати на наявну або перенесену хворобу ВГВ.
- Пацієнти з ВГС мають проходити тести на наявне або перенесене захворювання гепатиту В.
9.8. ВИЗНАЧЕННЯ РІВНЯ ЗАЛІЗА
Пацієнти з ХГС можуть мати підвищені показники заліза, але немає єдиної думки з приводу того, чи це має вплив на захворювання. Показники феритину сироватки і сатурації трансферину збільшені в 20–60 % пацієнтів і корелюють з активністю АЛТ, допускаючи, що вони є маркерами запалення. Існує слабка кореляція з концентрацією заліза в печінці (КЗП) [113]. Підвищені показники заліза рідко значно підвищені у пацієнтів з передцирозним станом. Від 20 % до 50 % пацієнтів з цирозом печінки матимуть підвищені значення показників заліза, але це також часто зустрічається у пацієнтів з цирозом через гепатит В та алкогольну хворобу печінки [113]. 4
Невідомо, чи має вплив підвищений показник заліза, як єдиний фактор, на відповідь на лікування лише ІФН [113]. 4
Не було знайдено доказів того, що виснаження запасів заліза (через кровопускання) має будь-який вплив на вірус чи перебіг захворювання печінки [114]. Існують попередні докази від 4 невеликих РКД, що кровопускання окремим пацієнтам з маркерами підвищення показників заліза до початку монотерапії ІФН може покращити СВВ [114, 115]. 4
D Помірне навантаження заліза не виправдовує конкретних заходів перед початком противірусної терапії, оскільки навряд чи має клінічну важливість.
D Пацієнти із суттєвим рівнем збереження заліза потребують подальшого дослідження додаткових умов, що ведуть до перевантаження залізом.
9.9. ГЕНОТИП ВІРУСНОГО ГЕПАТИТУ С
Стійкого зв’язку між генотипом ВГС та прогресуванням хвороби у кількох когортних дослідженнях виявлено не було [88, 91, 92, 116, 117]. 2+
9.10. КРІОГЛОБУЛІНЕМІЯ
Метааналіз низької якості щодо впливу кріоглобулінемії припускає, що цироз частіше діагностується у пацієнтів з кріоглобулінемією [118]. 1–
Х. ЛІКУВАННЯ ХРОНІЧНОГО ВІРУСНОГО ГЕПАТИТУ С
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
ПРОТИВІРУСНА ТЕРАПІЯ
Первинною метою терапії проти ВГС є повне знищення вірусу, що виражається у вигляді СВВ. Традиційно СВВ визначають як невиявлюваний рівень РНК ВГС в сироватці щонайменше за 24 тижні після завершення лікування (СВВ24) [24]; проте останні дані дозволяють припустити, що раннього оцінювання на 12-му тижні після лікування (СВВ12) достатньо для визначення такого результату [25]. Досягнення СВВ вважається довгостроковим звільненням від вірусу, оскільки рецидиви на пізньому етапі виникають рідко [26, 27]. СВВ асоціюється з довгостроковим покращенням здоров’я в багатьох аспектах, включаючи якість життя [28, 29], позапечінкові прояви ВГС (наприклад, кріоглобулінемічний васкуліт) [30], гістологію печінки [31, 32], частоту ГЦК [33], захворюваність та смертність, що пов’язані з ВГС [34–36], та смертність від усіх причин [33].
Картина противірусного лікування гепатиту С швидко змінюється. До останнього часу стандартом терапії була комбінація Пег-ІФН та РБВ, яка зазвичай застосовувалася протягом 48 тижнів у пацієнтів з генотипами 1, 4, 5 і 6 та протягом 24 тижнів у хворих з генотипами 2 і 3 [3]. Подвійна терапія дозволяє досягти показника СВВ 40–50 % у пацієнтів з генотипом 1 та приблизно 80 % у пацієнтів з генотипами 2, 3, 5 і 6. Результати для пацієнтів з ВГС генотипу 4 є проміжними [3]. У 2011 р. перші ПППД, БЦП і ТЛП були затверджені для лікування ВГС генотипу 1 в комбінації з Пег-ІФН та РБВ. Ці інгібітори вірусної NS3/4A протеази (ІП) суттєво підвищують показник СВВ як у пацієнтів, які раніше не отримували лікування, так і у пацієнтів, які отримували попереднє лікування, порівняно із застосуванням подвійної терапії [37–41]. Однак вони асоціюються з підвищеною токсичністю, складністю схеми, що залучає терапію, що модифікується залежно від вираженості відповіді, взаємодіями між лікарськими засобами та низьким показником відповіді у пацієнтів з цирозом печінки та невдачею попереднього лікування. Окрім того, БЦП та ТЛП потребували супутнього застосування Пег-ІФН та РБВ протягом 24–48 тижнів, що значно підвищувало вартість терапії, та асоціювалися з виникненням РАШ у більшості пацієнтів з невдачею лікування [3]. Подальше затвердження ПППД з підтвердженою ефективністю та переносимістю, скороченням тривалості лікування та можливістю вибору схеми без Пег-ІФН та РБВ надає значні можливості в цій сфері.
Лікування ХГС є складним та потребує багато ресурсів. Фактори, що сприяють, включають високу поширеність супутніх психіатричних патологій в осіб, інфікованих ВГС (наприклад, депресії та згубних звичок), різні способи прийому лікарських засобів, побічні ефекти та потребу у ретельному моніторингу симптомів та проведення лабораторних тестів в процесі лікування. Найбільш успішною моделлю надання всебічної допомоги особам з ХГС є використання багатофункціонального підходу, що включає досвідчених лікарів, медичних сестер та допоміжних спеціалістів сфери охорони здоров’я (наприклад, психологів, психіатрів, спеціалістів з питань згубних звичок та соціальних працівників). Сьогодні в Канаді відносно невелика кількість лікарів лікує ХГС, що в деяких випадках призводить до тривалого періоду очікування пацієнтами належного огляду, медичної оцінки та лікування. Ці недоліки в отриманні допомоги є значнішими у сільській та віддаленій місцевості, незважаючи на високу поширеність ВГС у багатьох регіонах з обмеженим доступом до медичної допомоги. Окрім того, державне фінансування медичних сестер, які представляють важливий компонент групи ведення захворювання, доступне не всюди. Для істотного зменшення майбутнього тягаря ХГС дуже важливо покращити доступ до лікування шляхом додаткового навчання та фінансування досвідченого персоналу та збільшення доступу до противірусних препаратів, які фінансуються державою [42]. З появою пероральних противірусних схем, які мають небагато протипоказань, мінімальну токсичність і короткий курс лікування, кількість пацієнтів, що може отримати лікування, має різко зрости. Проте для досягнення цієї мети залишається потрібним ведення захворювання за участю команди.
Рекомендація:
3. Для покращення ситуації в сфері надання допомоги особам з гепатитом С необхідно збільшити ресурсне забезпечення в Канаді, включаючи навчання фахівців та державне фінансування медичних сестер (клас 2a, рівень C).
WHO Guidelines for the screening, care and treatment of persons with hepatitis c infection (2014):
Лікування пацієнтів з інфекцією ВГС
ВГС у даний час є виліковною хворобою; також досягнення в терапії ВГС привели до стабільно високих показників лікування. Діагностика та лікування ХГС мають профілактичну користь, а особи, які лікуються від ВГС, не можуть передавати вірус іншим. Лікування ВГС також корисне для здоров’я пацієнта, оскільки це зменшує ризик розвитку ГЦК (> 75 %) в осіб на всіх стадіях фіброзу [82, 83]. На момент написання настанови (грудень 2013 року) шість препаратів ліцензовані для лікування ВГС — стандартний ІФН або Пег-ІФН-α, РБВ, ІП (БЦП, СИМ і ТЛП) і аналог нуклеотиду — інгібітор полімерази СОФ. Обмеження лікування включають: високу вартість, необхідність проведення складних лабораторних тестів і навчених лікарів, а також обмежена ефективність й висока токсичність деяких лікарських засобів. Передбачається, що ряд лікарських засобів для лікування ВГС буде швидко розширюватися найближчим часом. ВООЗ планує періодично оновлювати цю настанову, щоб включати нові ліцензовані препарати.
Перед початком лікування ВГС потрібно провести генотипування, оскільки різні генотипи вимагають різних схем лікування, а ІП (БЦП, СИМ і ТЛП) призначаються тільки для генотипу 1. Сучасне лікування генотипу 1 — цє поєднання Пег-ІФН, РБВ та ІП або інгібітора нуклеотидної полімерази, що призводить до високого рівня СВВ (негативний тест на РНК ВГС впродовж трьох або шести місяців після закінчення лікування) [84–87]. Подвійна терапія Пег-ІФН і РБВ або СОФ із РБВ використовується для генотипів 2 і 3 [88, 89]. Пацієнти з генотипом 4, які отримували лікування СОФ, Пег-ІФН і РБВ мають аналогічну відповідь порівняно з особами, які інфіковані генотипом 1. Невеликі дослідження пацієнтів з генотипами 5 і 6 показали аналогічні СВВ порівняно з пацієнтами з генотипами 2 і 3 [90, 91]. У цих групах потрібно проводити великі дослідження з метою підтвердження цих результатів і визначення предикторів відповіді або відсутності відповіді на лікування.
Лікування деякими лікарськими засобами (для лікування ВГС) може спричинити виражені побічні ефекти, тому необхідно проводити ретельну оцінку пацієнта і моніторинг [92–94].
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
ПОКАЗАННЯ ТА ПРОТИПОКАЗАННЯ ДО ПРОТИВІРУСНОГО ЛІКУВАННЯ
Всі пацієнти з ХГС мають розглядатися як кандидати на отримання противірусного лікування. Рішення щодо того, чи слід починати терапію і коли, мають базуватися на балансі між очікуваною користю та ризиками лікування й бажанням конкретного пацієнта. Фактори, які необхідно зважити, включають імовірність досягнення СВВ і можливість прогресування захворювання до занедбаної стадії захворювання печінки без знищення вірусу, наявність позапечінковіх проявів ХГС, передбачену переносимість пацієнтом лікування і очікувану тривалість життя пацієнта. Також слід враховувати перспективу розробки нових методів лікування з очевидними перевагами перед методами, доступними в даний час. У світлі цих питань слід розглянути можливість швидкого ініціювання лікування в певних підгрупах пацієнтів, особливо пацієнтів із пізньою стадією фіброзу печінки (F3 чи F4 відповідно до класифікації [мостоподібний фіброз або цироз печінки]) [43]. Такі пацієнти перебувають у групі підвищеного ризику розвитку ускладнень, пов’язаних із ВГС, включаючи печінкову недостатність та ГЦК. Слід також розглянути можливість лікування пацієнтів з легкою та помірною стадією фіброзу (F1 чи F2), оскільки прогресування до більш пізньої стадії асоціюється зі зменшеною ймовірністю досягнення СВВ. Більше того, ерадикація вірусу у пацієнтів з високим ризиком інфікування інших людей (наприклад, СІН, які продовжують спільно користуватися пристроями для ін’єкцій) може зменшити частоту появи нових випадків інфекції [44]. Виліковний характер ВГС-інфекції означає, що ті, хто досягнув СВВ до розвитку цирозу печінки, не потребують довгострокового спостереження. Окрім профілактики прогресування захворювання печінки існують і інші переваги досягнення СВВ, включаючи покращення якості життя [28, 29] і зниження смертності від усіх причин [33]. Пацієнти з позапечінковими проявами ХГС, включаючи кріоглобулінемічний васкуліт, гемохроматоз і гломерулонефрит, мають розглядатися як кандидати на отримання лікування, незалежно від тяжкості фонового захворювання печінки, оскільки такі захворювання зазвичай відповідають на ерадикацію вірусу [30].
Існує дуже мало абсолютних протипоказань до лікування із застосуванням терапії, що базується на Пег-ІФН і РБВ. Оскільки постреєстраційний досвід застосування цих методів лікування виріс, багато захворювань, які раніше вважалися абсолютними протипоказаннями, сьогодні вважаються відносними, а деякі можуть бути наявними тільки тимчасово (табл. 2) [3]. У більшості випадків лікування таких пацієнтів із застосуванням Пег-ІФН та РБВ вимагає значного досвіду, тому пацієнти з відносними протипоказаннями мають отримувати лікування в спеціалізованих центрах. Протипоказання до застосування нещодавно затверджених повністю пероральних схем зустрічаються вкрай рідко.
/137.jpg)
Рекомендації:
4. Всі пацієнти з хронічною інфекцією ВГС мають розглядатися як кандидати на отримання противірусної терапії (клас 1, рівень A).
5. Слід ретельно розглянути можливість початку противірусного лікування у пацієнтів із доказами фіброзу печінки (клас 1, рівень A).
6. Слід розглянути можливість початку противірусного лікування у пацієнтів із позапечінковими проявами ВГС (клас 1, рівень A)
WHO Guidelines for the screening, care and treatment of persons with hepatitis С infection (2014):
Протипоказання до лікування
Лікування ВГС протипоказане особам із певними станами. В табл. 8.1 наводяться такі стани; це ґрунтується на настановах Американської асоціації з вивчення захворювань печінки (AASLD) та Європейської асоціації з вивчення печінки (EASL). Лікування осіб із декомпенсованим цирозом (Чайлд — П’ю B або вище) ІФН або Пег-ІНФ ризиковане, тому що у них можуть розвиватися небезпечні для життя інфекції та прискорюватися декомпенсація, що призводить до смерті. Вагітні жінки не повинні лікуватися РБВ, оскільки він викликає пороки розвитку плода. В зв’язку з цим сексуально активним жінкам дітородного віку та їхнім партнерам (чоловікам) радять використовувати подвійну контрацепцію (включаючи презервативи зі сперміцидами) під час лікування і впродовж шести місяців після лікування. У багатьох людей, які лікувалися ІФН, розвивається депресія; а в тих, у кого депресія вже існувала, вона може посилитися. Є повідомлення про самогубство серед осіб, які лікувалися ІФН, отже, потрібен ретельний відбір пацієнтів із тих, хто має депресією.
/138.jpg)
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Протипоказання до лікування
ІФН-α та рибавірин
Лікування ХГС Пег-ІФН-альфа та РБВ абсолютно протипоказане таким групам пацієнтів: неконтрольо-вана депресія, психоз чи епілепсія, вагітні жінки чи пари, які не бажають дотримуватися достатнього рівня контрацепції; тяжкі супутні хвороби чи коморбідні стани, включаючи хвороби сітківки, автоімунні хвороби щитоподібної залози, декомпенсована хвороба печінки.
Використання Пег-ІФН-альфа не рекомендується у пацієнтів з абсолютною кількістю нейтрофілів < 1500/мм3 та/чи тромбоцитів < 90 000/мм3. Лікування пацієнтів з прогресуючою хворобою печінки, чиї параметри виходять за межі рекомендацій, можливе в кваліфікованих центрах під ретельним моніторингом і за наявності інформованої згоди.
Затверджені противірусні препарати прямої дії (ПППД)
На підставі наявних знань, не існує ніяких абсолютних протипоказань до використання ПППД, що санкціоновані для використання в регіоні ЄС у 2015 році. Необхідно з обережністю використовувати СОФ у пацієнтів із тяжкою нирковою недостатністю, оскільки ефективність виділення метаболітів препарату нирками все ще вивчається. Комбінації РТВ із ПАР, ОМБ, дасабувір проходять оцінку серед пацієнтів з декомпенсованим цирозом (Чайлд — П’ю В); ці препарати протипоказані пацієнтам із декомпенсованим цирозом (Чайлд — П’ю С). Тривають дослідження з оцінки фармакокінетики та безпеки СИМ при декомпенсованому цирозі.
Коментар робочої групи: станом на жовтень 2015 року в Україні ритонавір (АТС-код: J05AE03) не зареєстрований за показаннями для лікування ВГС.
Показання до лікування: кого слід лікувати?
Всі, хто не отримував попереднього лікування, та пацієнти, які отримали лікування, з компенсованою та декомпенсованою хронічною хворобою печінки, асоційованою з ВГС, готові лікуватися за відсутності у них протипоказань до лікування, повинні бути розглянуті щодо призначення лікування. Оскільки не кожен пацієнт, інфікований ВГС, може лікуватися впродовж наступного року чи близько до того, потрібно визначитися з пріоритетами (табл. 2). Група експертів визнає, що пріоритети можуть змінюватися відповідно до місцевих та/чи соціальних міркувань.
Пріоритет лікування повинен ґрунтуватися на стадії фіброзу, ризиках прогресування до більш пізніх стадій хвороби, наявності позапечінкових проявів інфекції ВГС ти ризиках передачі інфекції ВГС. Лікування повинно бути пріоритетним для пацієнтів із фіброзом (оцінка F3–F4), в тому числі серед пацієнтів із декомпенсованим цирозом печінки, які мають протипоказання до лікування ІФН-альфа, але яких можна лікувати безінтерфероновими схемами. Дійсно, дані клінічних досліджень і реальних груп населення показують, що ці пацієнти можуть отримати більше користі від лікування ВГС у короткотривалій перспективі, оскільки відзначалось суттєве скорочення балів при оцінці тяжкості цирозу за шкалою Чайлда — П’ю та MELD і зменшення частоти клінічних випадків. Однак докази покращення медичного прогнозу залишаються обмеженими у пацієнтів із балами класа за шкалою Чайлда — П’ю > 12 та балами MELD > 20. Безінтерферонове лікування пацієнтів із декомпенсованою хворобою повинно проводитися тільки в кваліфікованих центрах до того часу, поки не будуть зібрані дані щодо безпеки та ефективності лікування.
Високопріоритетні групи також включають пацієнтів із ВІЛ або поєднаним гепатитом, пацієнтів перед трансплантацією печінки та після того, пацієнтів із клінічно значущими позапечінковими проявами (наприклад, симптоматичний васкуліт, пов’язаний зі змішаною кріоглобулінемією та належить до ВГС, ВГС-імунна комплексозалежна нефропатія та неходжкінські лімфоми), пацієнтів із виснажливою втомлюваністю незалежно від їх стадії фіброзу печінки.
Лікування також повинно бути пріоритетним незалежно від стадії фіброзу чи позапечінкових проявів для осіб, які піддаються ризику передачі ВГС, у тому числі активних СІН; чоловіків, які мають сексуальні стосунки з чоловіками з досить ризикованою сексуальною поведінкою; жінок дітородного віку, які хочуть завагітніти; пацієнтів на гемодіалізі та в ув’язнених. СІН та чоловіки, які мають сексуальні стосунки з чоловіками з досить ризикованою сексуальною поведінкою, повинні бути поінформовані про ризик повторного інфікування, а тому повинні вживати превентивних заходів щодо успішного лікування.
Рекомендації
• Всі пацієнти, які не отримували попереднього лікування, і пацієнти, які отримали лікування, з компенсованою чи декомпенсованою хронічною хворобою печінки, асоційованим із ВГС, повинні розглядатися щодо лікування (А1).
• Лікування повинно бути пріоритетним для пацієнтів зі значним фіброзом чи цирозом печінки (METAVIR F3–F4) (А1).
• Пацієнтів із декомпенсованим цирозом печінки (клас В або С) слід терміново лікувати за безінтерфероновими схемами (А1).
• Лікування повинно бути пріоритетним незалежно від стадії фіброзу у пацієнтів із ВІЛ чи поєднаним гепатитом, пацієнтів перед трансплантацією печінки чи після того, у пацієнтів з клінічно знучущими позапечінковими проявами (наприклад, симптоматичний васкуліт, асоційований зі ВГС-пов’язаною з кріоглобулінемією, нефропатією, що пов’язана з імунними комплексами ВГС, неходжкінські лімфоми) і у пацієнтів з виснажливою втомлюваністю (А1).
• Лікування також повинно бути пріоритетним незалежно від стадії фіброзу чи позапечінкових проявів для осіб, які піддаються ризику передачі ВГС, у тому числі активних СІН; чоловіків, які мають сексуальні стосунки з чоловіками з досить ризикованою сексуальною поведінкою; жінок дітородного віку, які хочуть завагітніти; пацієнтів на гемодіалізі та в ув’язнених (В1).
• Лікування виправдане у пацієнтів з помірним ступенем фіброзу (METAVIR F2) (А2).
• У пацієнтів з відсутністю чи легким ступенем фіброзу (METAVIR F0–F1) у разі відсутності жодного з вищеперерахованих позапечінкових проявів показання для лікування та строки лікування можуть визначатися індивідуально (В1).
• Лікування не рекомендується для пацієнтів з обмеженою тривалістю життя через супутню патологію, що не пов’язана з патологією печінки (В1).
Лікування виправдане у пацієнтів з помірним ступенем фіброзу (F2). Строки та вид лікування для пацієнтів із мінімальною стадією чи відсутністю фіброзу (F0–F1) та без будь-яких позапечінкових проявів не є беззаперечними; може розглядатися зміна строків лікування. У разі прийняття рішення щодо змін лікування для конкретного пацієнта слід розглядати вподобання пацієнта та пріоритети, перебіг хвороби та ризик прогресування, наявність супутньої патології та вік пацієнта. Пацієнти, лікування яких відкладено, регулярно повинні оцінюватися щодо ознак розвитку хвороби, для перегляду призначень і обговорення нових методів лікування в міру появи чи доступності при прийнятному рівні витрат.
Лікування не рекомендується для пацієнтів з обмеженою тривалістю життя через супутню патологію, що не пов’язана з патологією печінки.
/139.jpg)
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.1. ПРОТИВІРУСНА ТЕРАПІЯ
Кілька метааналізів і систематичних оглядів підтверджують, що комбінація Пег-ІФН із РБВ ефективна при лікуванні пацієнтів із ХГС, що призводить до високого рівня СВВ [7, 119–121]. Всі пацієнти повинні розглядатися як кандидати на лікування. 1+
A Всі пацієнти з хронічною інфекцією ВГС повинні розглядатися на противірусну терапію.
Коментар робочої групи: в окремих клінічних ситуаціях лікування Пег-ІФН може бути протипоказане: алергічні реакції на рекомбінантні ІФН, поява антитіл до рекомбінантного ІФН, гематологічні зміни (нейтропенія, тромбоцитопенія як наслідок лікування ВГС), онкогематологічна патологія, вагітність, перші роки життя дитини. Тоді доцільно розглянути використання непегільованого інтерферону альфа.
10.1.1. СТІЙКА ВІРУСОЛОГІЧНА ВІДПОВІДЬ (СВВ)
СВВ стала прийнятою метою програм лікування ХГС і в даний час досягнута у 41–51 % пацієнтів із генотипом 1 і у 73–82 % пацієнтів з генотипом 2 і 3, які отримали курс комбінованої терапії Пег-ІФН і РБВ [122, 123]. Є певні дані, але їх не багато, щодо довготривалих результатів після СВВ, якості та тривалості спостереження:
• вірусологічний рецидив рідко трапляється після СВВ (у 1–13 % пацієнтів) [124–126]; 1+
• знижений рівень смертності після СВВ [127];
• пацієнти з СВВ мають знижений ризик розвитку цирозу та первинної гепатоклітинної карциноми [124, 128]; 2++
• латентний гепатит С може зберігатися в макрофагах, лімфоцитах або гепатоцитах у деяких пацієнтів, які досягли СВВ. При цьому може бути невеликий ризик рецидиву у майбутньому у наведених вище випадках [129, 130]. 3
В СВВ повинна використовуватися як маркер для кліренсу вірусу.
СВВ 80 % досягається у пацієнтів, які приймають 80 % дози Пег-ІФН та РБВ впродовж понад 80 % часу, що можна порівняти з 33 % у пацієнтів, які менше дотримуються лікування [131]. 2+
An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver (2012):
/140.jpg)
/140_2.jpg)
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.2. ВАРІАНТИ ЛІКУВАННЯ ЗА ГЕНОТИПАМИ
10.2.1. ГЕНОТИП 1 І ТРИВАЛІСТЬ ЛІКУВАННЯ
Систематичний огляд оцінив додаткову терапію ІП (БЦП і ТЛП) у пацієнтів із ВГС генотипу 1. Як у раніше нелікованих, так і у лікованих пацієнтів СВВ частіше досягалася при застосуванні ІП (БЦП або ТЛП) у складі потрійної терапії Пег-ІФН і РБВ з урахуванням маси тіла порівняно лише з Пег-ІФН і РБВ з урахуванням маси тіла. Обидва препарати добре переносилися, причому анемія була найбільш обмежуючим лікування побічним ефектом [132]. На рис. 1 і 2 показано алгоритми лікування пацієнтів із ВГС генотипу 1. 1+
Три РКД, які розглядалися у двох систематичних оглядах, виявили, що застосування ТЛП впродовж принаймні 12 і максимум 48 тижнів у комбінації з Пег-ІФН і РБВ з урахуванням маси як потрійної терапії, було ефективним у лікуванні раніше не лікованих або лікованих дорослих із ХГС генотипу 1. Випробування включало раніше лікованих дорослих, які відповіли, частково відповіли і мали рецидив після лікування Пег-ІФН і РБВ з урахуванням маси. СВВ була значно кращою, ніж із подвійною терапією Пег-ІФН і РБВ з урахуванням маси [133, 134]. 1+
Два систематичних огляди виявили, що БЦП впродовж 24–44 тижнів як потрійна терапія в поєднанні з Пег-ІФН і РБВ на основі маси впродовж 48 тижнів був ефективним у лікуванні раніше не лікованих або лікованих дорослих із ХГC генотипу 1. Ці дослідження включали раніше лікованих дорослих, які частково відповіли або мали рецидив після лікування Пег-ІФН і РБВ з урахуванням маси, але не включали пацієнтів, які раніше не відповіли на лікування. СВВ була значно кращою, ніж із подвійною терапією Пег-ІФН і РБВ з урахуванням маси; 66 % з потрійною терапією фіксованої тривалості порівняно з 63 % з потрійною терапією залежно від відповіді порівняно з 38 % у контрольній групі, яка отримувала стандартну подвійну терапію [134, 135].
Схема, що включає БЦП, потребує чотиритижневого підготовчого лікування Пег-ІФН і РБВ з урахуванням маси, в той час як ТЛП цього не потребує. Підготовче лікування БЦП, проте, не знижує СВВ. Відповідь на підготовче лікування може вказувати на ймовірність СВВ при лікуванні як раніше не лікованих, так і лікованих пацієнтів.
A Всіх нелікованих пацієнтів, інфікованих ВГС генотипу 1, необхідно розглядати на отримання лікування Пег-ІФН і РБВ з урахуванням маси тіла з додаванням ІП як потрійної терапії.
A Всіх раніше лікованих пацієнтів, інфікованих ВГС генотипу 1, необхідно розглядати на лікування Пег-ІФН і РБВ з урахуванням маси тіла з додаванням ІП якості потрійної терапії.
- У раніше лікованих пацієнтів із низькою ймовірністю СВВ користь від лікування необхідно зважувати проти потенційних ризиків і побічних ефектів.
A Терапія, залежно від відповіді, може використовуватися тільки у нелікованих пацієнтів і пацієнтів із рецидивом, які не мають цирозу, після попереднього лікування.
Немає прямих порівняльних досліджень БЦП і ТЛП, тому жоден препарат не може бути рекомендований більше, ніж інший.
Немає жодних доказів, що припускають, що певний Пег-ІФН слід використовувати у комбінації з певним ІП.
10.2.2. ГЕНОТИП 1 І ТРИВАЛІСТЬ ЛІКУВАННЯ ПАЦІЄНТІВ, ЯКІ НЕ ПІДХОДЯТЬ ДЛЯ ЛІКУВАННЯ ІНГІБІТОРАМИ ПРОТЕАЗИ
Оптимальна тривалість лікування пацієнтів із гепатитом С генотипу 1 становить 48 тижнів [7, 119, 120]. 1+
Пацієнти з інфекцією генотипу 1, які не змогли досягти ранньої вірусологічної відповіді (РВВ) через 12 тижнів, мають менше 5 % шансів досягнення РВВ [136]. Серед пацієнтів з інфекцією генотипу 1, які не змогли досягти РВВ, але продовжували лікування і залишалися позитивними на ВГС РНК впродовж 24 тижнів, жоден не мав РВВ [137]. Після ретельної клінічної оцінки деяких пацієнтів, інфікованих ВГС генотипу 1, можна вважати непридатними для лікування за схемою, що включає ІП. До них належать пацієнти з потенційно небезпечними взаємодіями призначених або 1+
недозволених засобів, і пацієнтів із супутніми захворюваннями, які гірше дотримуються лікування, що може знизити ефективність потрійної терапії і збільшити ризик розвитку медикаментозної резистентності [134].
Дослідження для реєстрації ТЛП і БЦП в post hoc аналізі продемонстрували, що пацієнти з низьким вірусним навантаженням, ліковані Пег-ІФН і РБВ з урахуванням маси, які досягли ШВВ, мають однакову частоту СВВ, що і пацієнти, які отримували лікування з додаванням ІП [138]. Метааналіз розглядав скорочення строку лікування пацієнтів, які отримували Пег-ІФН і РБВ з урахуванням маси. Загалом серед усіх пацієнтів частота рецидивів була значно вищою серед пацієнтів із ШВВ генотипу 1, якщо тривалість лікування була скорочена до 24 тижнів із загальним зниженням СВВ на –13,6 % (95% ДІ від –22,8 % до –4,4 %, р = 0,004). Якщо вірусне навантаження було менше 400 000 МО/мл, не було статистично значущого зниження СВВ при 24-тижневому лікуванні з середньою різницею в –3,1 % (96% ДІ від –8,6 % до 2,4 %) [138]. 1+
A Пацієнтів з інфекцією генотипу 1 необхідно перевірити на РВВ на 12-му тижні.
• У пацієнтів з інфекцією генотипу 1, які не досягли РВВ на 12-му тижні, необхідно розглянути припинення лікування.
• Пацієнти з інфекцією генотипу 1 з РВВ на 12-му тижні повинні продовжувати лікування впродовж 48 тижнів. Пацієнти, позитивні на ВГС РНК впродовж 24 тижнів, повинні припинити лікування.
В Після поінформованого обговорення неліковані пацієнти з інфекцією генотипу 1 та:
• з мінімальним або нульовим фіброзом;
• з низьким вірусним навантаженням (менше 400 000 МО/мл);
• ті, хто досяг ШВВ після попереднього лікування Пег-ІФН і РБВ з урахуванням маси впродовж чотирьох тижнів, може розглядатися на 24-тижневе лікування без додавання ІП.
«An Update on Treatment of Genotype 1 Chronic Hepatitis C Virus Infection: 2011 Practice Guideline by the American Association for the Study of Liver Diseases (AASLD)»:
Рекомендації:
1. Оптимальна терапія для генотипу 1 ХГС включає використання БЦП або ТЛП у комбінації з Пег-ІФН-α і РБВ (клас 1, рівень А).
2. БЦП та ТЛП не повинні використовуватися без Пег-ІФН-α і РБВ (клас 1, рівень А).
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
ПАЦІЄНТИ З ВГС ГЕНОТИПУ 1, ЯКІ РАНІШЕ НЕ ОТРИМУВАЛИ ЛІКУВАННЯ (ТАБЛ. 4)
Безінтерферонові схеми
СОФ/ЛЕД: Нуклеотидний інгібітор полімерази СОФ (400 мг) був комбінований з інгібітором NS5A ЛЕД (90 мг) в одній таблетці (СОФ/ЛЕД) для прийому раз на добу. Цю комбінацію оцінювали у пацієнтів, які раніше не отримували лікування, у відкритих випробуваннях третьої фази ION-1 [8] і ION-3 [10] з первинною кінцевою точкою — показником СВВ12. В дослідженні ION-1, яке включало пацієнтів із компенсованим цирозом печінки (16 %), учасникам було рандомізовано призначено протягом 12 або 24 тижнів застосування СОФ/ЛЕД із РБВ або без нього, дозу якого розраховано на підставі маси тіла [8]. Серед пацієнтів, які отримували СОФ/ЛЕД протягом 12 тижнів, показник СВВ12 дорівнював 97 % (211 з 217) та 99 % (211 з 214) у тих, хто приймав та не приймав РБВ, відповідно. В групах 24-тижневого лікування показник СВВ12 становив 99 % (215 з 217) у пацієнтів, які отримували РБВ, порівняно з 98 % (212 з 217) пацієнтів, які отримували СОФ/ЛЕД окремо. Не було відзначено статистично значущих відмінностей між групами лікування або характеристиками попереднього лікування, які були б предикторами відповіді. Серед 136 пацієнтів із цирозом печінки показник СВВ12 варіював у діапазоні від 94 % до 100 %, при цьому не спостерігалося відмінностей між групами лікування протягом 12 та 24 тижнів з РБВ або без нього. Генотип IL28B не був предиктором відповіді, показник СВВ12 варіював у діапазоні від 97 % до 99 % серед пацієнтів із несприятливим не-CC-генотипом. Тільки в одного пацієнта на терапії спостерігався вірусологічний прорив, а у двох пацієнтів виник рецидив. Всі три пацієнти мали NS5A-резистентність, але метод глибокого секвенування не виявив резистентності до СОФ. Хоча більшість пацієнтів скаржилися щонайменше на одне небажане явище, тяжкість 93 % з них була слабкою чи помірною, при цьому найчастіше виникали втомлюваність, головний біль, безсоння й нудота. Небажані явища частіше виникали у пацієнтів, яких було рандомізовано для отримання РБВ. В жодного пацієнта, який отримував лише СОФ/ЛЕД, не було відзначено концентрації гемоглобіну < 100 г/л.
У дослідженні ION-3 [10] пацієнтам із ВГС генотипу 1 без цирозу печінки, які раніше не отримували лікування, було рандомізовано призначено впродовж восьми тижнів застосування СОФ/ЛЕД з РБВ або без нього, дозу якого розраховано щодо до маси тіла, або СОФ/ЛЕД окремо протягом 12 тижнів. Серед 215 пацієнтів, яким було рандомізовано призначене застосування СОФ/ЛЕД протягом восьми тижнів, 202 (94 %) досягли СВВ12 порівняно з 201 з 216 (93 %), які отримували СОФ/ЛЕД/РБВ протягом восьми тижнів, та 206 з 216 (95 %), які отримували СОФ/ЛЕД протягом 12 тижнів. Частота виникнення рецидивів становила 5 % (СОФ/ЛЕД) і 4 % (СОФ/ЛЕД/РБВ) у групах восьми тижнів лікування та 1 % в групі 12 тижнів лікування. Хоча 12-тижнева схема продемонструвала нижчу частоту рецидивів, лікування всіх пацієнтів протягом додаткових чотирьох тижнів призвело до надмірного лікування більшості осіб. Тому був проведений post hoc аналіз вихідного вірусного навантаження з метою виявлення пацієнтів, яким було достатньо восьми тижнів лікування [74]. В цьому аналізі пацієнти з рівнем РНК ВГС < 6 млн МО/мл продемонстрували частоту виникнення рецидивів 2 %, як у 8-тижневій (2 з 123), так і 12-тижневій (2 з 131) групах лікування із застосуванням СОФ/ЛЕД, а показник СВВ12 становив 97 % (119 з 123) і 96 % (126 з 131) відповідно. Однак серед пацієнтів з базовим вірусним навантаженням ≥ 6 млн МО/мл, ті, які отримували лікування протягом тільки восьми тижнів застосування СОФ/ЛЕД, продемонстрували показник рецидивності, що дорівнював 10 % (9 з 92), проти тільки 1 % (1 з 85) у тих, хто отримував лікування протягом 12 тижнів. Відповідний показник СВВ12 дорівнював 90 % (83 з 92) і 94 % (80 з 85) відповідно. На підставі цих результатів Міністерство охорони здоров’я Канади і Управління з контролю харчових продуктів та лікарських засобів США (FDA) рекомендували застосування 8-тижневої схеми СОФ/ЛЕД у пацієнтів без цирозу печінки, які раніше не отримували лікування, з базовим рівнем РНК ВГС < 6 млн МО/мл та застосування 12-тижневої схеми у пацієнтів з високим вірусним навантаженням [74].
На додаток до базового вірусного навантаження вивчався вплив базових РАШ на відповідь на лікування [10]. Хоча 15 із 23 пацієнтів, в яких стався рецидив (65 %) при застосуванні СОФ/ЛЕД, мали NS5A-резистентні варіанти, які було виявлено під час рецидиву (наявні на початку дослідження у дев’яти пацієнтів), резистентність до СОФ не було виявлено. Серед 116 пацієнтів (18 %) з резистентністю NS5A на початку дослідження, 90 % досягли СВВ12, що дозволяє припустити мінімальний вплив базових РАШ NS5A на відповідь на лікування із застосуванням СОФ/ЛЕД.
Рекомендації:
14. Пацієнтам без цирозу печінки, які раніше не отримували лікування, та інфіковані ВГС генотипу 1, слід призначати СОФ/ЛЕД протягом восьми тижнів (клас 1, рівень B).
15. Пацієнтам без цирозу печінки, які раніше не отримували лікування, інфіковані ВГС генотипу 1 та мають початковий рівень РНК ВГС ≥ 6 млн МО/мл, слід розглянути можливість подовження курсу терапії СОФ/ЛЕД до 12 тижнів (клас 1, рівень C).
16. Пацієнтам з цирозом печінки, які раніше не отримували лікування, та інфіковані ВГС генотипу 1, слід призначати СОФ/ЛЕД протягом 12 тижнів (клас 1, рівень B).
ПАРР/ОМБ/ДАС ± РБВ: ІП ПАР приймають разом із малою дозою РТВ (ПАРР), що дозволяє застосування один раз на добу. ПАРР (150 мг/100 мг) та інгібітор NS5A ОМБ (25 мг) поєднані в одній таблетці, дві такі таблетки приймаються один раз на добу. Прийом цих таблеток комбінується з ненуклеозидним інгібітором полімерази ДАС (250 мг) у вигляді однієї таблетки, яку приймають двічі на добу. Плацебо або комбінація трьох ПППД плюс РТВ (під назвою «3D-режим») та РБВ, дозу якого розраховано на підставі маси тіла, призначались протягом 12 тижнів пацієнтам із ВГС генотипу 1 без цирозу печінки, які раніше не отримували лікування, у випробуванні третьої фази SAPPHIRE-I [15]. Пацієнтам, рандомізованим до призначення плацебо, пізніше було надане активне лікування. З 473 пацієнтів, які почали активну терапію, 455 (96 %) досягли СВВ12, що підтверджує явну перевагу перед історичним контролем — потрійною терапією на основі ТЛП у схожій популяції пацієнтів (очікуваний СВВ12 дорівнює 78 %). Показник СВВ12 не розрізнявся між пацієнтами з ВГС генотипу 1a (95 % [307 з 322]) чи 1b (98 % [148 з 151]). Єдиним базовим фактором, що асоціювався з відповіддю, був індекс маси тіла (ІМТ). У пацієнтів з ожирінням (ІМТ ≥ 30 кг/м2) частота досягнення СВВ12 дорівнювала 91,5 % порівняно з 97 % серед пацієнтів із нижчим ІМТ. Не було відзначено різниці у відповіді щодо генотипу IL28B, стадії фіброзу, базового рівня РНК ВГС, етнічної приналежності або модифікації дози РБВ.
Безпеку цієї схеми було оцінено шляхом порівняння з групою пацієнтів, рандомізованих до призначення плацебо [15]. Небажані явища частіше виникали у пацієнтів на активному лікуванні (88 %); однак у 73 % пацієнтів, які отримували плацебо, також спостерігалося щонайменше одне небажане явище. Тяжкі небажані явища (2,1 %), зокрема, ті, що потребували припинення застосування препарату (< 1 %), траплялися рідко. Найбільш поширеними побічними ефектами були втомлюваність та головний біль, але в групі активного лікування вони виникали не частіше, ніж у групі плацебо. Нудота, свербіж, безсоння, діарея й астенія частіше відзначалися у пацієнтів на активному лікуванні. Підвищення рівня загального білірубіну спостерігалися у 2,8 % пацієнтів на цій схемі, ймовірно, через гемоліз, пов’язаний із РБВ, та інгібування транспортерів білірубіну OATP1B1 і OATP1B3 за участі ПАРР. Випадків гепатотоксичності не спостерігалось. Анемія II ступеня (рівень гемоглобіну 80–100 г/л) спостерігалась у 5,8 % пацієнтів, які отримували лікування даною схемою, що включала РБВ. У 5,5 % пацієнтів дозу РБВ було модифіковано через появу небажаних явищ, що, однак, не вплинуло на частоту досягнення СВВ12 серед цих пацієнтів.
Дослідження 3-ї фази TURQUOISE-II оцінювало застосування схеми ПАРР/ОМБ/ДАС + РБВ (12 проти 24 тижнів) у пацієнтів з компенсованим цирозом печінки, які раніше не отримували або отримували лікування [13]. Серед пацієнтів, які раніше не отримували лікування, частота досягнення СВВ12 була подібною в групах 12 та 24 тижнів лікування (94 % [81 з 86] проти 95 % [70 з 74]) в цілому, а також при аналізі різних підтипів генотипу (генотип 1a: 12 проти 24 тижнів: 92 % [59 з 64] проти 93 % [52 з 56]; та генотип 1b: 100 % як при 12 [22 з 22], так і при 24 тижнях лікування [18 з 18]). Частота досягнення СВВ12 серед пацієнтів TURQUOISE-II, які раніше отримували лікування, обговорюється нижче.
Для оцінки необхідності прийому РБВ разом із ПАРР/ОМБ/ДАС було проведено дослідження 3-ї фази PEARL-III і PEARL-IV за участю пацієнтів без цирозу печінки, які раніше не отримували лікування, з генотипами 1b і 1a відповідно (75). У дослідженні PEARL-III пацієнти з ВГС генотипу 1b були рандомізовані для отримання ПАРР/ОМБ/ДАС без РБВ (n = 209) або разом з РБВ (n = 210) протягом 12 тижнів. Тільки в 3 із 419 пацієнтів у випробуванні спостерігалась невдача лікування, при цьому частота досягнення СВВ12 становила 99 % в обох групах. У дослідженні PEARL-IV з 205 пацієнтів з ВГС генотипу 1a, які були ранодомізовані в групу прийому ПАРР/ОМБ/ДАС без РБВ протягом 12 тижнів, 185 (90 %) досягли СВВ12. Цей показник був значно нижчим, ніж той, що спостерігався у пацієнтів, які отримували лікування ПАРР/ОМБ/ДАС + РБВ (97 % [97 з 100]), що підкреслює важливість супутнього прийому РБВ у випадку, коли цей режим призначають пацієнтам з ВГС генотипу 1a [75].
Рекомендації:
17. Пацієнтам, які раніше не отримували лікування та інфіковані ВГС генотипу 1a з цирозом печінки чи без нього, або інфіковані генотипом 1b та мають цироз печінки, слід призначати комбінацію ПАРР/ОМБ/ДАС разом із РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень A).
18. Пацієнтам, які раніше не отримували лікування, та інфіковані ВГС генотипу 1b без цирозу печінки, слід призначати комбінацію ПАРР/ОМБ/ДАС без РБВ протягом 12 тижнів (клас 1, рівень A).
СОФ та СИМ: СОФ (400 мг на добу) застосовувався в комбінації з ІП другого покоління СИМ (150 мг на добу) з РБВ чи без нього протягом 12 або 24 тижнів у фазі 2 дослідження COSMOS [76]. Дослідження було поділено на дві когорти: когорта 1 включала 80 пацієнтів, які попередньо не дали відповідь на лікування, з легкою стадією фіброзу (від F0 до F2), а когорта 2 включала 87 пацієнтів, які раніше не отримували лікування, та пацієнтів, які попередньо не дали відповідь на лікування, з прогресивною стадією фіброзу (F3 та F4). Під час лікування рівень РНК ВГС пригнічувався в усіх пацієнтів, але в шістьох стався рецидив. Загальний показник СВВ12 становив 92 % (154 з 167), при цьому результати в когортах 1 і 2 були схожими (90 % [72 з 80] проти 94 % [82 з 87] відповідно). Показник СВВ12 не розрізнявся між групами 12 та 24 тижнів лікування, з РБВ чи без нього, між пацієнтами, які раніше не отримували лікування, та пацієнтами, які отримували лікування (95 % [38 з 40] проти 91 % [116 з 127]). Наявність поліморфізму на позиції 80 із заміною K (лізин) на Q (глютамін) під назвою «поліморфізм Q80K», що асоціюється зі зниженням активності СИМ та виявляється майже виключно у пацієнтів із ВГС генотипу 1a (див. нижче) [77, 78], не впливала на досягнення СВВ12 [76]. Хоча 4 з 6 пацієнтів, в яких стався рецидив, на початку дослідження мали інфекцію генотипу 1a та поліморфізм Q80K, 88 % (51 з 58) пацієнтів із таким поліморфізмом усе ж таки досягли СВВ12. У цьому невеликому випробуванні така схема добре переносилася, головний біль, втомлюваність і нудота були найбільш поширеними побічними ефектами. Тільки четверо пацієнтів (2 %) припинили лікування через появу небажаних явищ. Хоча результати цього випробування виглядають обнадійливими, враховуючи його невеликий розмір вибірки та доступність інших ефективних та менш дорогих пероральних схем противірусного лікування, слід зважити можливість застосування цієї схеми як терапії другої лінії до появи нових даних.
Рекомендація:
19. Пацієнтам, які раніше не отримували лікування, інфікованим ВГС генотипу 1a чи 1b з цирозом печінки або без нього, слід призначати СОФ (400 мг на добу) та СИМ (150 мг на добу) протягом 12 тижнів без РБВ (клас 1, рівень B).
Схеми, що містять Пег-ІФН
Враховуючи ефективність та значно покращену переносимість СОФ чи СИМ у комбінації з Пег-ІФН та РБВ порівняно зі схемами на основі ТЛП чи БЦП, ці ІП першого покоління не мають більше використовуватися за винятком окремих обставин, коли лікування є невідкладним, а доступу до новіших препаратів немає. Застосування БЦП і ТЛП розглядається у редакції цього керівництва від 2012 р. [3].
СОФ, Пег-ІФН та РБВ: Застосування СОФ (400 мг на добу) в комбінації з Пег-ІФН та РБВ протягом 12 тижнів у пацієнтів із ВГС генотипів 1, 4, 5 і 6 оцінювалося у неконтрольованому відкритому випробуванні 3-ї фази NEUTRINO [5]. Серед пацієнтів із ВГС генотипу 1 показник СВВ12 становив 89 % (261 з 292). Хоча більша частина пацієнтів з генотипом 1a досягла СВВ12 порівняно з пацієнтами з генотипом 1b (92 % [206 з 225] проти 82 % [54 з 66]), ця різниця не була статистично значущою. При проведенні багатофакторного аналізу наявність цирозу печінки та не-CC-генотипу IL28B були єдиними предиктороами вірусологічної невдачі. Показник СВВ12 становив 92 % (252 з 273) у пацієнтів без цирозу печінки проти 80 % (43 з 54) у пацієнтів з компенсованим цирозом печінки. Показник СВВ12 становив 98 % (93 з 95) у пацієнтів з IL28B CC-генотипу порівняно з 87 % (202 з 232) у тих, хто з не-CC-генотипом. Хоча профіль побічних ефектів був схожим на той, що спостерігався при застосуванні двокомпонентної терапії Пег-ІФН та РБВ, неконтрольований характер дослідження виключив повну оцінку безпеки. Однак тільки 2 % пацієнтів припинили лікування через появу небажаних явищ. Серед 28 пацієнтів, у яких стався рецидив (9 % когорти), глибоке секвенування не виявило резистентності до СОФ [5].
Рекомендація:
20. Пацієнтам із ВГС генотипу 1a чи 1b з цирозом печінки або без нього слід призначати СОФ (400 мг на добу) разом з Пег-ІФН плюс РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень B).
СИМ, Пег-ІФН та РБВ: У фазі 3 випробувань QUEST-1 і QUEST-2 [6, 7], які проводилися у Північній Америці та Європі відповідно, ІП другого покоління СИМ (150 мг раз на добу) застосовувався в комбінації з Пег-ІФН та РБВ, дозу якого розраховано на підставі маси тіла, протягом 12 тижнів з наступними додатковими 12 або 36 тижнями застосування Пег-ІФН + РБВ порівняно з Пег-ІФН + РБВ протягом 48 тижнів у пацієнтів із ВГС генотипу 1. Пацієнти, яким рандомізовано призначили трикомпонентну терапію, з рівнем РНК ВГС < 25 МО/мл на 4-му тижні та невиявлюваною РНК ВГС на 12-му тижні, призупинили прийом Пег-ІФН плюс РБВ протягом 12 додаткових тижнів, а потім повністю припинили лікування. Пацієнти, які не відповідали критеріям ранньої відповіді, продовжили прийом Пег-ІФН та РБВ протягом додаткових 36 тижнів (тобто всього 48 тижнів). Згідно зі зведеними даними цих випробувань показник СВВ12 в групах СИМ/Пег-ІФН/ РБВ дорівнював 80 % (419 з 521), що значно вище, ніж у пацієнтів, які отримували Пег-ІФН та РБВ окремо (50 % [132 з 264]) [6, 7]. Всього 88 % (459 з 521) пацієнтів у групах СИМ/Пег-ІФН/РБВ були підходящими кандидатами на отримання скороченого курсу лікування й 88 % (405 з 459) з цих пацієнтів досягли СВВ12. У двох випробуваннях у 12 % (62 з 521) пацієнтів, які не були підходящими кандидатами на отримання скороченого курсу лікування, показник СВВ12 становив 32 %, незважаючи на 36 додаткових тижнів прийому Пег-ІФН та РБВ. Показник СВВ12 варіював залежно від базової стадії фіброзу, зменшуючись від 84 % (317 з 378) у пацієнтів зі стадією фіброзу від F0 до F2 до 60 % (29 з 48) у тих, хто із цирозом печінки. Генотип IL28B також мав важливе значення, при цьому показник СВВ12 дорівнював 95 % (144 з 152) у пацієнтів із CC-генотипом, які отримували лікування із застосуванням трикомпонентної терапії, порівняно з 80 % (63 з 79) на схемі Пег-ІФН та РБВ окремо та 75 % (275 з 369) у пацієнтів з не-CC-генотипом, які отримували трикомпонентну терапію, порівняно з 37 % (69 з 185) в контрольній групі.
Найважливішим предиктором відповіді була наявність поліморфізму Q80K на початку дослідження (див. вище). Згідно зі зведеними даними цих випробувань [6, 7], показник СВВ12 при застосуванні трикомпонентної терапії, що базується на СИМ, становив 58 % (49 з 84) у пацієнтів з генотипом 1a та Q80K; цей результат не відрізнявся від того, що спостерігався в контрольній групі Пег-ІФН та РБВ (52 % [23 з 44]). І навпаки, серед пацієнтів з генотипом 1a без Q80K показник СВВ12 становив 84 % (138 з 165), результат, схожий на той, що спостерігався у пацієнтів із генотипом 1b (85 % [228 з 267]) і значно вищий, ніж той, який було виявлено в контрольних групах (43 % [36 з 83] у пацієнтів з генотипом 1a без Q80K та 53 % [70 з 133] у пацієнтів із генотипом 1b). У цих випробуваннях поліморфізм Q80K був наявний на початку дослідження у 34 % пацієнтів з генотипом 1a та наявними даними секвенування, але тільки в одного з 400 пацієнтів із генотипом 1b [6, 7]. Частота позитивного результату аналізу на Q80K серед пацієнтів із ВГС генотипу 1a в Канаді дорівнювала 47 % [79].
СИМ добре переносився в цих випробуваннях [6, 7]. Згідно зі зведеними даними програми досліджень застосування СИМ [80], основні небажані явища, що частіше спостерігалися у пацієнтів, які отримували СИМ, були висипання (головним чином легкого ступеня) у 23 % пацієнтів (проти 17 % пацієнтів контрольної групи) та фоточутливість у 3,3 % (проти 0,5 % пацієнтів контрольної групи). Підвищення рівня загального білірубіну, обумовлене інгібуванням біліарних транспортерів та гемолітичною анемією, пов’язаною з РБВ, спостерігалося у 7,9 % пацієнтів (проти 2,8 % пацієнтів контрольної групи). Слід відзначити, що частота появи анемії була схожою серед пацієнтів, які раніше отримували лікування із застосуванням трикомпонентної терапії, що базується на СИМ, порівняно з Пег-ІФН та РБВ окремо.
Рекомендації:
21. Пацієнтам, інфікованим ВГС генотипу 1b, та пацієнтам, інфікованим генотипом 1a без поліморфізму Q80K, слід призначати СИМ (150 мг на добу) разом з Пег-ІФН + РБВ у дозі, залежній від маси тіла, протягом 12 тижнів, після чого продовжується прийом Пег-ІФН + РБВ протягом додаткових 12 тижнів (клас 1, рівень A).
22. Пацієнти з генотипом 1a повинні пройти тестування на поліморфізм Q80K перед початком терапії із застосуванням СИМ, Пег-ІФН та РБВ. Пацієнти з поліморфізмом Q80K мають отримувати лікування із застосуванням іншої схеми (клас 1, рівень A).
23. Терапія, що модифікується залежно від відповіді, не має застосовуватись для схеми СИМ, Пег-ІФН + РБВ. Пацієнтам з рівнем РНК ВГС ≥ 25 МО/мл на 4-му тижні або виявлюваною РНК ВГС на 12-му тижні, слід повністю припинити лікування, враховуючи низьку ймовірність досягнення СВВ та необхідність тривалішого прийому Пег-ІФН та РБВ (клас 2b, рівень C).
ПАЦІЄНТИ З ВГС ГЕНОТИПУ 1, ЯКІ РАНІШЕ ОТРИМУВАЛИ ЛІКУВАННЯ (ТАБЛ. 5)
Безінтерферонові схеми
Пацієнтів, які зазнали невдачі при застосуванні терапії на основі ІФН, слід розподіляти на тих, у кого стався рецидив (невиявлюваний рівень РНК ВГС протягом лікування з повторною появою РНК ВГС протягом шести місяців після припинення лікування), тих, хто дав часткову відповідь (зниження рівня РНК ВГС щонайменше на 2 log10 МО/мл без досягнення невиявлюваного рівня РНК ВГС під час терапії) або тими, хто дав нульову відповідь на лікування (зниження рівня РНК ВГС на < 2 log10 МО/мл під час терапії; або прорив [підвищення рівня РНК ВГС на > 1 log10 МО/мл порівняно з найнижчою точкою, незважаючи на триваючу противірусну терапію]) [3]. Пацієнтів із невідомою попередньою відповіддю слід лікувати як пацієнтів з нуль-відповіддю. Як і пацієнти, які раніше не отримували лікування, всі пацієнти з ВГС генотипу 1, які раніше отримували лікування, скоріше отримають користь від застосування пероральних ПППД, ніж від схем, що містять ІФН, оскільки ці пацієнти, за винятком тих, в кого стався рецидив, продемонстрували погану відповідь на ІФН.
СОФ/ЛЕД: Схема з прийомом однієї таблетки СОФ/ЛЕД оцінювалася у пацієнтів, які раніше отримували лікування, у випробуванні 3-ї фази ION-2 [9]. Дослідження включало тих, у кого стався рецидив (56 %), і тих, хто не дав відповіді (44 %), включаючи пацієнтів із невдачею подвійної терапії Пег-ІФН/РБВ (48 %) або її комбінації з ІП (52 %).
Пацієнтам було рандомізовано призначене отримання 12 або 24 тижнів лікування з РБВ чи без нього, дозу якого розраховано на підставі маси тіла. Показник СВВ12 становив 94 % (102 з 109) у пацієнтів, які отримали 12 тижнів СОФ/ЛЕД, та 96 % (107 з 111) у тих, хто також отримував РБВ. Показник СВВ12 у пацієнтів, які отримали 24 тижнів СОФ/ЛЕД, становив 99 % (218 з 220) незалежно від того, чи отримували пацієнти також і РБВ. Рецидив стався у 4–6 % пацієнтів, які отримували лікування протягом 12 тижнів, і в жодного з тих, хто отримував лікування протягом 24 тижнів. Показник СВВ12 у пацієнтів з компенсованим цирозом печінки (20 % з кожної групи лікування), які отримували СОФ/ЛЕД протягом 12 тижнів окремо, дорівнював 86 % (19 з 22) порівняно з 82 % (18 з 22) тих, хто також отримував і РБВ. У пацієнтів з цирозом печінки, які отримували лікування протягом 24 тижнів (з РБВ чи без нього), показник СВВ12 становив 100 % (44 з 44). У пацієнтів із цирозом печінки не було виявлено предикторів рецидиву ані на початку дослідження, ані в процесі лікування. Не було відзначено відмінностей у показнику СВВ12 згідно з отриманням РБВ, попереднім противірусним лікуванням (Пег-ІФН/РБВ проти Пег-ІФН/РБВ + ІП) або відповіддю на попереднє лікування (рецидив проти відсутності відповіді). Серед 62 пацієнтів (14 %) з виявлюваною NS5A-резистентністю на початку дослідження 55 (89 %) досягли СВВ12. Всі 11 пацієнтів, в яких стався рецидив, мали виявлювану NS5A-резистентність під час рецидиву, але СОФ-асоційовану резистентність не було виявлено. Серед пацієнтів, які раніше отримували лікування із застосуванням ІП, 71 % мали NS3/4A резистентність на початку дослідження та 98 % з цих пацієнтів досягли СВВ12 [9]. Переносимість СОФ/ЛЕД була схожою з тією, що спостерігалась у дослідженнях ION-1 і ION-3 (див. вище) [8, 10]; більша кількість небажаних явищ була відзначена у пацієнтів, які раніше отримували лікування разом із РБВ.
На підставі високого показника відповіді, що спостерігався у випробуванні ION-2 серед пацієнтів із компенсованим цирозом печінки, які зазнали невдачі попереднього лікування, що отримували лікування протягом 24 та 12 тижнів, Міністерство охорони здоров’я Канади та FDA рекомендували застосування 24-тижневої схеми СОФ/ЛЕД у цій підгрупі пацієнтів. Однак наступне, значно більше рандомізоване випробування у Франції (випробування SIRIUS) [81] дозволило припустити, що 12-тижнева схема СОФ/ЛЕД + РБВ, дозу якого розраховано на підставі маси тіла, настільки ж ефективна, як і 24-тижнева схема СОФ/ ЛЕД у пацієнтів з цирозом печінки, які не дали відповідь ані на Пег-ІФН/РБВ, ані на трикомпонентну терапію, що включала ІП. 74 з 77 пацієнтів (96 %), яким було рандомізовано призначене застосування СОФ/ЛЕД/РБВ протягом 12 тижнів, досягли СВВ12 (4 % показник рецидивності) порівняно з 75 з 77 пацієнтів (97 %), яким було рандомізовано призначене застосування СОФ/ЛЕД окремо протягом 24 тижнів (3 % показник рецидивності). Окрім того, аналіз зведених даних випробування SIRIUS та шести інших досліджень у фазі 2 і 3, який включав 352 пацієнтів з цирозом печінки, які отримували лікування [82], 12 тижнів прийому СОФ/ЛЕД/РБВ призвели до отримання показника СВВ12, схожого на той, що спостерігався при застосуванні СОФ/ЛЕД окремо протягом 24 тижнів (96 % проти 98 %).
Рекомендації:
24. Пацієнтам з ВГС генотипу 1 без цирозу печінки, які зазнали невдачі попереднього лікування із застосуванням Пег-ІФН та РБВ з чи без ІП, слід призначати СОФ/ЛЕД без РБВ протягом 12 тижнів (клас 1, рівень B).
25. Пацієнтам з генотипом 1 з цирозом печінки, які зазнали невдачі попереднього лікування із застосуванням Пег-ІФН та РБВ з чи без ІП, слід призначати СОФ/ ЛЕД та РБВ в дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень A).
ПАРР/ОМБ/ДАС та РБВ: Застосування комбінації ПАРР/ОМБ/ДАС разом із РБВ у дозі, залежній від маси тіла, оцінювалося у пацієнтів без цирозу печінки, які раніше отримували лікування, у дослідженні 3-ї фази SAPPHIRE-II [14]. Серед 297 пацієнтів, які були рандомізовані для призначення ПАРР/ОМБ/ДАС + РБВ протягом 12 тижнів, 286 (96 %) досягли СВВ12. Не було виявлено жодних факторів, які б могли бути предикторами відповіді до початку або під час лікування. Частота досягнення СВВ12 була схожою серед пацієнтів із генотипом 1a (96 % [166 з 173]) та 1b (97 % [119 з 123]) і не відрізнялась між пацієнтами з рецидивом (95 % [82 з 86]), частковою відповіддю (100 % [65 з 65]) та нуль-відповіддю (95 % [139 з 146]) на попереднє лікування. РАШ до одного чи більше з трьох ПППД у схемі були виявлені у п’яти з семи пацієнтів з рецидивом після лікування [14].
У дослідженні TURQUOISE-II [13] застосування схеми ПАРР/ОМБ/ДАС + РБВ протягом 12 або 24 тижнів оцінювалося у 380 пацієнтів з компенсованим цирозом печінки, з яких 58 % зазнали невдачі попереднього лікування Пег-ІФН та РБВ. Серед пацієнтів з генотипом 1b частота досягнення СВВ12 становила 99 % (67 з 68) після 12 тижнів терапії та 100 % (51 з 51) після 24 тижнів. Показник відповіді не відрізнявся залежно від тривалості лікування чи історії попереднього лікування. У пацієнтів з інфекцією генотипу 1a частота досягнення СВВ12 становила 89 % (124 з 140) після 12-тижневої та 94 % (114 з 121) після 24-тижневої терапії; ця різниця не була статистично значущою. Не було відзначено різниці між 12- та 24-тижневою групами дослідження серед пацієнтів із генотипом 1a з цирозом печінки, які раніше не отримували лікування (для 12 та 24 тижнів, відповідно 92 % [59 з 64] та 93 % [52 з 56]), які мали рецидив (93 % [14 з 15] та 100 % [13 з 13], відповідно) або мали часткову відповідь (100 % [11 з 11] та 100 % [10 з 10], відповідно). Проте, серед пацієнтів із генотипом 1a з нуль-відповіддю на попереднє лікування 24-тижнева група продемонструвала кращий результат, ніж 12-тижнева група (93 % [39 з 42] та 80 % [40 з 50], відповідно) [13].
Для визначення важливості застосування РБВ у пацієнтів із ВГС генотипу 1b без цирозу печінки, які раніше отримували лікування, у дослідженні PEARL-II пацієнтів було рандомізовано до груп прийому ПАРР/ОМБ/ДАС з РБВ або без нього протягом 12 тижнів [83]. Всі 91 пацієнти (100 %), які отримували лише ПАРР/ОМБ/ДАС, досягли СВВ12 порівняно з 97 % (85 з 88) тих, які були рандомізовані до супутнього призначення РБВ.
Очікується часткове співпадання РАШ після застосування схем лікування, що базуються на ІП. Оскільки схема ПАРР/ОМБ/ДАС містить ІП і для таких пацієнтів наявні інші схеми з підтвердженою активністю (тобто СОФ/ЛЕД) [9], цю схему не слід застосовувати у пацієнтів, які зазнали невдачі з іншим ІП (наприклад, ТЛП, БЦП або СИМ).
Рекомендації:
26. Пацієнтам без цирозу печінки, які раніше отримували лікування та інфіковані ВГС генотипу 1a, слід призначати комбінацію ПАРР/ОМБ/ДАС разом із РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень A).
27. Пацієнтам без цирозу печінки, які раніше отримували лікування та інфіковані ВГС генотипу 1b, слід призначати комбінацію ПАРР/ОМБ/ДАС без РБВ протягом 12 тижнів (клас 1, рівень A).
28. Пацієнтам з цирозом печінки, інфікованим генотипом 1a, з нуль-відповіддю на попереднє лікування Пег-ІФН та РБВ, слід призначати комбінацію ПАРР/ОМБ/ДАС разом із РБВ протягом 24 тижнів (клас 1, рівень B).
29. Пацієнтам, які зазнали невдачі попереднього лікування із застосуванням іншого ІП, не слід призначати комбінацію ПАРР/ОМБ/ДАС через можливу перехресну резистентність з ПАР (клас 2b, рівень C).
СОФ та СИМ: Як було описано вище, застосування СОФ (400 мг на добу) в комбінації з ІП СИМ (150 мг на добу) з РБВ чи без нього протягом 12 або 24 тижнів оцінювалося у фазі 2 дослідження COSMOS [76]. Когорта 1 включала 80 пацієнтів, які попередньо не дали відповідь на лікування, з легкою стадією фіброзу (від F0 до F2), а когорта 2 включала 47 пацієнтів, які попередньо не дали відповідь на лікування (плюс 40 пацієнтів, які раніше не отримували лікування), з прогресивною стадією фіброзу (F3 і F4). Загалом 116 з 127 пацієнтів, які попередньо не дали відповідь на лікування (91 %), досягли показника СВВ12, який суттєво не відрізнявся від того, що спостерігався серед піддослідних, які раніше не отримували лікування (95 % [38 з 40]). Показники СВВ12 серед пацієнтів, які попередньо не дали відповідь на лікування, були схожими незалежно від ступеня тяжкості фіброзу (від F0 до F2: 90 % [72 з 80] проти F3: 96 % [23 з 24] проти F4: 91 % [21 з 23]), тривалості лікування або отримання РБВ. Враховуючи очікувану перехресну резистентність між іншими ІП та СИМ, пацієнти, які попередньо не дали відповідь на ці препарати, були виключені з дослідження [76]. Через невеликий розмір вибірки цього випробування та наявність інших ефективних та менш дорогих схем без ІФН, застосування цієї комбінації слід розглядати які варіант терапії другої лінії до появи нових даних.
Рекомендації:
30. Пацієнтам із ВГС генотипу 1a чи 1b з цирозом печінки або без нього, які зазнали невдачі попереднього лікування із застосуванням Пег-ІФН та РБВ, слід призначати СОФ (400 мг на добу) та СИМ (150 мг на добу) без РБВ протягом 12 тижнів (клас 1, рівень B).
31. Комбінація СОФ та СИМ не повинна застосовуватися у пацієнтів, які зазнали невдачі попереднього лікування із застосуванням іншого ІП (клас 2b, рівень C).
Схеми, що містять Пег-ІФН
Враховуючи ефективність та значно покращену переносимість СОФ чи СИМ у комбінації з Пег-ІФН та РБВ порівняно зі схемами на основі ТЛП чи БЦП, ці ІП першого покоління не мають більше використовуватися за винятком рідкісних обставин (див. вище).
СОФ, Пег-ІФН та РБВ: Досвід застосування СОФ (400 мг) у комбінації з Пег-ІФН та РБВ у пацієнтів, які не дали відповідь на терапію, що базується на ІФН, обмежений. Однак Міністерство охорони здоров’я Канади та FDA США затвердили застосування цієї схеми для пацієнтів, які раніше отримували лікування. На основі моделювання FDA спрогнозував частоту досягнення СВВ12 в 78 % у пацієнтів, які не дали відповідь на Пег-ІФН та РБВ, за умови застосування СОФ + Пег-ІФН/РБВ протягом 12 тижнів. У дослідженні 3-ї фази NEUTRINO на пацієнтах, які раніше не отримували лікування [5], 52 пацієнти з ВГС генотипу 1 мали типові характеристики популяції, що отримувала лікування (тобто прогресивна стадія фіброзу [F3 та F4], не-CC-генотип IL28B та високе базове вірусне навантаження [≥ 800 000 МО/мл]). Тридцять сім з цих пацієнтів (71 %) досягли СВВ12 при застосуванні 12 тижнів СОФ/ Пег-ІФН/РБВ [74]. Хоча цю схему також не випробували на пацієнтах, які не дали відповідь на терапію із застосуванням ІП, відсутність перехресної резистентності між ІП та СОФ дає можливість припустити, що ці пацієнти мають дати таку ж відповідь, що і ті, які не дали відповіді на лікування із застосуванням Пег-ІФН/РБВ окремо.
Рекомендація:
32. Пацієнтам із ВГС генотипу 1a чи 1b з цирозом печінки або без нього, які зазнали невдачі попереднього лікування із застосуванням Пег-ІФН та РБВ з чи без ІП, слід призначати СОФ (400 мг на добу) з Пег-ІФН + РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 2b, рівень C).
СИМ, Пег-ІФН та РБВ: Застосування СИМ (150 мг на добу) оцінювалося в комбінації з Пег-ІФН та РБВ, дозу якого розраховано на підставі маси тіла, протягом 12 тижнів з подальшим застосуванням Пег-ІФН та РБВ протягом 12–36 тижнів у пацієнтів з ВГС генотипу 1, які не дали відповідь на ІФН у двох випробуваннях. Фаза 3 дослідження PROMISE [84] включала тих, в кого стався рецидив, тоді як фаза 2b випробування ASPIRE [85] також включала пацієнтів, які попередньо дали часткову відповідь, та пацієнтів, які попередньо не дали відповідь на лікування. У випробуванні PROMISE [84] оцінювався підхід терапії, що модификується залежно від вираженості відповіді, ідентичний тому, що використовувався у пацієнтів, які раніше не отримували лікування (див. вище). Лікування із застосуванням трикомпонентної терапії було більш ефективним, ніж застосування двокомпонентної терапії Пег-ІФН та РБВ (СВВ12: 79 % (206 з 260) проти 36 % (48 з 133)) у пацієнтів, в яких стався рецидив. Більшість пацієнтів, які отримували СИМ (93 % (241 з 260)), були зареєстровані для отримання скороченого лікування від 48 до 24 тижнів і 83 % з цих пацієнтів (200 з 241) досягли СВВ12. У пацієнтів з невиявлюваним рівнем РНК ВГС на 4-му тижні (77 % когорти) показник СВВ12 становив 87 % (173/200) порівняно з 60 % у тих з рівнем РНК ВГС < 25 МО/мл, але невиявлюваною РНК ВГС на 4-му тижні. Серед пацієнтів, які не були обрані для скороченої терапії, показник СВВ12 становив 40 % (6 з 15), незважаючи на 48 тижнів лікування. З 39 пацієнтів із компенсованим цирозом печінки, яким було рандомізовано призначене отримання трикомпонентної терапії, 29 (74 %) досягли СВВ12 порівняно з 5 з 19 (26 %) в контрольній групі. У піддослідних, які раніше не отримували лікування, з випробувань QUEST-1 і QUEST-2 [6, 7] пацієнти з ВГС генотипу 1a та мутацією Q80K на початку дослідження не отримали користь від прийому СИМ (показник СВВ12 в групах СИМ та плацебо: 47 % (14 з 30) проти 30 % (6 з 20) відповідно). РАШ, схожі на ті, які були відзначені при застосування ТЛП та БЦП, виникли у більшості пацієнтів (90 %), які не досягли СВВ12 в групі застосування СИМ [84].
У фазі 2b випробування ASPIRE [85] 462 пацієнтам, які не дали відповіді на Пег-ІФН/РБВ (40 % тих, у кого стався рецидив, 35 % пацієнтів, які дали часткову відповідь, і 25 % пацієнтів, які попередньо не дали відповіді на лікування), було рандомізовано призначене отримання СИМ (100 мг чи 150 мг або плацебо) протягом 12, 24 або 48 тижнів у комбінації з Пег-ІФН та РБВ протягом 48 тижнів. У пацієнтів, які раніше отримували лікування із застосуванням СИМ в дозі 150 мг на добу протягом 12 тижнів, показник СВВ24 становив 77 % (20 з 26) у тих, в кого стався рецидив, 65 % (15 з 23) у пацієнтів, які дали часткову відповідь, та 44 % (8 з 18) у пацієнтів, які попередньо не дали відповідь на лікування; всі результати переважають ті, що отримані в контрольній групі (37, 19 і 9 % відповідно). Серед пацієнтів з цирозом печінки, які попередньо не дали відповідь на лікування (в усіх групах прийому СИМ в дозі 150 мг), 31 % (4 з 13) досягли СВВ24 з СИМ порівняно з 0 з двох пацієнтів, які раніше отримували лікування із застосуванням Пег-ІФН та РБВ.
Рекомендації:
33. Пацієнтам із ВГС генотипу 1b чи генотипу 1a без поліморфізму Q80K, в яких стався рецидив після застосування Пег-ІФН та РБВ, слід призначати СИМ (150 мг на добу) разом із Пег-ІФН та РБВ у дозі, залежній від маси тіла, протягом 12 тижнів, після чого приймаються лише Пег-ІФН + РБВ протягом додаткових 12 тижнів. Лікування слід припинити повністю у пацієнтів із рівнем РНК ВГС > 25 МО/мл на 4-му тижні чи виявлюваною РНК ВГС на 12-му тижні лікування (клас 1, рівень A).
34. У пацієнтів, які попередньо дали часткову відповідь або нуль-відповідь, слід розглянути можливість застосування альтернативних схем, враховуючи низьку ймовірність досягнення СВВ та потребу в довготривалому прийомі Пег-ІФН та РБВ при застосуванні цієї схеми (клас 2b, рівень B).
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Лікування ХГС, у тому числі пацієнтів без цирозу і пацієнтів із компенсованим цирозом (клас А)
Починаючи з 2015 року, пацієнти, які попередньо не отримували лікування, та пацієнти, які отримували лікування, з компенсованою та декомпенсованою хворобою печінки отримають користь від широкого вибору комбінацій лікарських засобів. Показання будуть залежати від генотипу ВГС/підтипу, тяжкості хвороби та/чи результатів попереднього лікування. Незважаючи на відповідні витрати щодо цих варіантів лікування, безінтерферонові схеми лікування є найкращими варіантами, коли вони доступні, через їх вірусологічну ефективність, простоту використання та переносимість. Показання такі самі, як для пацієнтів із ВГС-моноінфекцією, так і для ВІЛ-інфікованих. Проте може знадобитися зміна лікування чи корекція дозування в зв’язку з останніми медикаментозними взаємодіями.
Рекомендації
• Показання для лікування ВГС у осіб з коінфекцією ВГС/ВІЛ ідентичні тим, що і у пацієнтів з ВГС-моноінфекцією (А1).
• Незважаючи на відповідні витрати цих варіантів, безінтерферонові варіанти — це найкращі варіанти, при їх доступності, у пацієнтів з ВГС-моноінфекцією, у пацієнтів з коінфекцією ВІЛ без цирозу чи з компенсованим (Чайлд — П’ю А) чи декомпенсованим (Чайлд — П’ю В чи С) цирозом, оскільки вони вірусологічно ефективні, прості у використанні та легко переносяться (А1).
• Ці ж безінтерферонові схеми можуть використовуватися у ВІЛ-інфікованих, а також у пацієнтів, не інфікованих ВІЛ, оскільки вірусологічні результати лікування ідентичні (А1).
Для кожного генотипу нижче наводяться доступні опції, а потім коротко викладені дані, доступні для даної опції, а в табл. 5 та 6 наводиться коротка характеристика.
Лікування інфекції ВГС генотипу 1
Шість варіантів лікування доступні в 2015 році для пацієнтів, інфікованих генотипом 1, в тому числі дві інтерфероновмісні схеми лікування та чотири безінтерферонові схеми лікування. Комбінацію СОФ та РБВ не слід використовувати у пацієнтів, інфікованих ВГС генотипу 1. У випадку, коли жоден запропонований варіант недоступний, подвійна комбінація Пег-ІФН-α та РБВ або потрійна комбінація Пег-ІФН-α, РБВ, а також ТЛП чи БЦП, залишаються прийнятними для окремих пацієнтів. Імовірно, ці схеми будуть працювати, доки нові ПППД не стануть доступними та дешевими; дивіться попередні Клінічні настанови EASL [5, 24].
Інтерфероновмісні схеми
Генотип 1, інтерфероновмісний варіант 1
• Пацієнтів, інфікованих ВГС генотипом 1, можна лікувати щотижневою комбінацією Пег-ІФН-α, щоденною дозою РБВ залежно від маси тіла пацієнта (1000 мг чи 1200 мг у пацієнтів з масою тіла < 75 мг чи ≥ 75 кг відповідно) та щоденно СОФ (400 мг) впродовж 12 тижнів (А1).
Генотип 1, інтерфероновмісний варіант 2
• Пацієнтів, інфікованих ВГС генотипом 1, можна лікувати щотижневою комбінацією Пег-ІФН-α, щоденною дозою РБВ залежно від маси тіла пацієнта (1000 мг чи 1200 мг у пацієнтів з масою тіла < 75 мг чи ≥ 75 кг відповідно) і щоденною дозою СИМ (150 мг) (А1).
• Ця комбінація не рекомендується для пацієнтів, інфікованих підтипом 1а, які мають визначене заміщення Q80K у послідовностях протеази NS3 на вихідному рівні, за оцінкою популяційного секвенування (аналіз прямого секвенування) (А1).
• СИМ слід приймати впродовж 12 тижнів у поєднанні з Пег-ІФН-α та РБВ. Пег-ІФН-α та РБВ необхідно призначати окремо ще 12 тижнів (загальна тривалість лікування 24 тижні) пацієнтам, які попередньо не отримували лікування, і пацієнтам із попереднім рецидивом, у тому числі хворих на цироз печінки, а також ще 36 тижнів (загальна тривалість лікування 48 тижнів) пацієнтам з попередньою частковою та нульовою відповіддю, в тому числі хворих на цироз печінки (В1).
• Рівні РНК ВГС необхідно контролювати щодо реакції на лікування. Лікування слід припинити, якщо рівень РНК ВГС досягає 25 МО/мл і більше на 4, 12 чи 24-й тиждень (А2).
Безінтерферонові варіанти
Генотип 1, безінтерфероновий варіант 1
• Пацієнтів, інфікованих ВГС генотипу 1, можна лікувати безінтерфероновою комбінацією з фіксованою дозою СОФ (400 мг) та ЛЕД (90 мг) по одній таблетці один раз на день (А1).
• Пацієнтів без цирозу, в тому числі тих, які попередньо не отримували лікування, і тих, які пройшли лікування, необхідно лікувати цією комбінацією фіксованих доз впродовж 12 тижнів без РБВ (А1).
• Лікування може бути скорочено до 8 тижнів у пацієнтів, які попередньо не отримували лікування, без цирозу, якщо їхній вихідний рівень РНК ВГС нижче 6 млн (6,8 log10) МО/мл. При цьому необхідно дотримуватися обережності, особливо у пацієнтів з фіброзом F3, з урахуванням очікування майбутніх даних щодо точності рівнів РНК ВГС, детермінованих цим діапазоном значень, та практичного підтвердження того, що 8 тижнів лікування достатньо для досягнення високої СВВ (В1).
• Пацієнтів із компенсованим цирозом, у тому числі тих, які не отримували попереднього лікування, і тих, які отримували лікування, необхідно лікувати цією комбінацією фіксованих доз РБВ залежно від маси тіла (1000 або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) щоденно впродовж 12 тижнів (А1).
• Пацієнтам із компенсованим цирозом печінки з протипоказаннями чи поганою переносимістю РБВ слід вводити комбінацію з фіксованою дозою СОФ та ЛЕД впродовж 24 тижнів без РБВ (В1).
• Лікування комбінацією фіксованих доз СОФ та ЛЕД з РБВ може бути продовжено до 24 тижнів у тих із компенсованим цирозом, хто пройшов лікування і має негативний прогноз щодо відповіді, наприклад, кількість тромбоцитів < 75× 103/мкл (В2).
Генотип 1, безінтерфероновий варіант 2
• Пацієнтів, інфікованих ВГС генотипу 1, можна лікувати за допомогою безінтерферонової схеми, що включає комбінацію фіксованих доз ОМБ (75 мг), ПАР (12,5 мг) та РТВ (50 мг) в одній таблетці (дві таблетки один раз на день під час їди) та дасабувіра (250 мг) (одна таблетка два рази на день) (А1).
• Пацієнти, інфіковані підтипом 1b, без цирозу повинні отримувати цю комбінацію без РБВ впродовж 12 тижнів (А1).
• Пацієнти, інфіковані підтипом 1b, з цирозом повинні отримувати цю комбінацію впродовж 12 тижнів щоденно з РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (А1).
• Пацієнти, інфіковані підтипом 1а, без цирозу повинні отримувати цю комбінацію впродовж 12 тижнів щоденно з РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (А1).
• Пацієнти, інфіковані підтипом 1а, з цирозом повинні отримувати цю комбінацію впродовж 24 тижнів щоденно з РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (А1).
Генотип 1, безінтерфероновий варіант 3
• Пацієнтів, інфікованих ВГС генотипу 1, можна лікувати за допомогою безінтерферонової комбінації щоденною дозою СОФ (400 мг) та щоденною дозою СИМ (150 мг) впродовж 12 тижнів (А1).
• На основі даних інших безінтерферонових комбінацій, додавання щоденної дози РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) рекомендується пацієнтам з цирозом печінки (В1).
• Для пацієнтів із цирозом печінки та протипоказаннями до використання РБВ необхідно розглядати продовження лікування до 24 тижнів (В1).
Генотип 1, безінтерфероновий варіант 4
• Пацієнтів, інфікованих ВГС генотипом 1, можно лікувати за допомогою безінтерферонової комбінації щоденної дози СОФ (400 мг) та щоденної дози ДАК (60 мг) впродовж 12 тижнів (А1).
• На підставі даних інших безінтерферонових комбінацій додавання щоденної дози РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) рекомендується пацієнтам із цирозом печінки (В1).
• Для пацієнтів із цирозом печінки та протипоказаннями до використання РБВ необхідно розглянути продовження лікування до 24 тижнів (В1).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.2.3. ГЕНОТИП 2 І 3 І ТРИВАЛІСТЬ ЛІКУВАННЯ
Оптимальним лікуванням пацієнтів з інфекцією генотипу 2 і 3 є Пег-ІФН і РБВ з урахуванням маси [7, 119, 120]. Як первинний результат один метааналіз порівнював показники СВВ у пацієнтів з інфекцією генотипу 2 або 3. Через 24 тижні терапії показники СВВ становили 74 % і 69 % відповідно, з СШ 1,49 (95% ДІ від 1,23 до 1,80), проте відсоткова різниця не була значущою (р = 0,90). У пацієнтів із вищим вірусним навантаженням показники ШВВ з інфекцією генотипу 2 (75 %) відрізнялися від показників генотипу 3 (58 %) з СШ 2,36 (95% ДІ 1,80 до 3,09). Різниця у відсотках в 24,9 % (95% ДІ від 12,8 до 37,0; р = 0,07) не була значущою. У пацієнтів із низьким вірусним навантаженням відповідні показники були 79 і 75 % з СШ 1,50 (95% ДІ від 1,08 до 2,09), знову ж таки з незначною різницею (р = 0,84). Як вторинний результат аналізували скорочений строк терапії у пацієнтів із ШВВ, які отримували лікування впродовж 12–16 або 24 тижнів. ШВВ у пацієнтів з інфекцією генотипу 2 була 83 % і 84 % відповідно, а у пацієнтів з інфекцією генотипу 3 становила 84 % і 86 %. У пацієнтів без ШВВ, які отримували лікування впродовж 24 тижнів, ШВВ була вище у пацієнтів з інфекцією генотипу 2, з 17,8 % зваженою різницею (95% ДІ від 8,7 до 27,0) та загальним СШ 2,06 (95% ДІ від 1,40 до 3,02). Автори дійшли висновку, що лікування впродовж 24 тижнів повинно залишатися стандартним строком для пацієнтів з інфекціями генотипу 2 або 3. Проте серед пацієнтів, які досягають ШВВ, пацієнти з ВГС генотипу 3 відповіли на скорочене лікування, а також пацієнти з генотипом 2, незалежно від початкової віремії [139]. 1+
Метою другого метааналізу було визначення оптимальної тривалості лікування у хворих із генотипами 2 і 3. Результати цих двох генотипів об’єднували. Об’єднані дані СВВ були вищими при стандартному лікуванні в РКД, які рандомізовані на початку дослідження з СШ 0,88 (95% ДІ від 0,76 до 1,01) на користь стандартної терапії порівняно зі скороченою терапією. Об’єднана пропорція показників СВВ РКД, рандомізованих при ШВВ, була аналогічною в групі скороченого лікування (82 %) і в групі стандартного лікування (83 %) із загальним ефектом з ВР 1,00 (95% ДІ від 0,92 до 1,09). До висновків авторів слід ставитися з обережністю, враховуючи відсутність деталей методології і високий рівень гетерогенності включених досліджень. Автори роблять висновок, що на основі вихідних характеристик всі пацієнти повинні отримувати подвійну терапію впродовж 1+
24 тижнів. Проте у пацієнтів, які досягнуть ШВВ через чотири тижні, їх лікування може бути скорочено до 12–16 тижнів подвійної терапії Пег-ІФН і РБВ з урахуванням маси. Вони не виявили жодної різниці між лікуванням 12 або 16 тижнів, але кількість була невеликою. Кількість пацієнтів із цирозом була надто невеликою, щоб можна було зробити будь-який висновок щодо цієї групи. Рибавірин з урахуванням маси досяг вищих показників СВВ, ніж РБВ у низьких фіксованих дозах [140].
Дані з двох досліджень показують, що у пацієнтів з інфекцією генотипа 2 або 3, які досягли ШВВ (ВГС РНК-негативна) через чотири тижні, можуть отримувати Пег-ІФН і РБВ з урахуванням маси впродовж 12 або 16 тижнів з аналогічними результатами, що і лікування впродовж 24 тижнів [141, 142]. 1+
A У пацієнтів із генотипом 2 або 3 стандартним лікуванням має бути Пег-ІФН і РБВ з урахуванням маси впродовж 24 тижнів.
В Пацієнти без цирозу печінки з генотипом 2 або 3, які досягли ШВВ через 4 тижні терапії, можуть бути розглянуті на скорочену терапію від 12 до 16 тижнів.
An update on the management of chronic hepatitis C:Consensus guidelines from the Canadian Association for the Study of the Liver (2012)
Скорочення строків лікування не слід розглядати у пацієнтів з кофакторами, що знижують імовірність успіху лікування (наприклад, виражений фіброз, негроїдна раса, ожиріння, метаболічний синдром/інсулінорезистентність), навіть якщо ШВВ досягнута. Якщо у пацієнта після скороченого курсу лікування виник рецидив, слід розглянути можливість повторного 24-тижневого курсу лікування (клас 1, рівень А).
У пацієнтів, інфікованих генотипом 3, які не досягли ШВВ, але досягли РВВ, лікування повинно бути продовжено до 36–48 тижнів, особливо в умовах кофакторів, що знижують імовірність успішності лікування (клас 2а, рівень С).
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
ПАЦІЄНТИ З ВГС ГЕНОТИПУ 2 (ТАБЛ. 6)
СОФ та РБВ
У фазі 3 випробування FISSION [5] СОФ (400 мг на добу) застосовувався в комбінації з РБВ, дозу якого розраховано на підставі маси тіла, протягом 12 тижнів на пацієнтах із ВГС генотипу 2, які раніше не отримували лікування. Пацієнтів рандомізовано розподілили до контрольної групи для отримання 24-тижневого курсу Пег-ІФН та РБВ (800 мг на добу). Пацієнти з цирозом печінки становили приблизно 20 % популяції дослідження. Показник СВВ12 у групах застосування СОФ/РБВ та Пег-ІФН/РБВ становив 97 % (68 з 70) і 78 % (52 з 67) відповідно. Частота появи небажаних явищ була значно нижчою серед пацієнтів, які отримували СОФ/РБВ, особливо грипоподібних симптомів та депресії, які притаманні терапії, що базується на ІФН. У фазі 3 випробування VALENCE [12] 32 пацієнти з ВГС генотипу 2, які раніше не отримували лікування, отримали 12 тижнів застосування комбінації СОФ та РБВ, дозу якого розраховано на підставі маси тіла. Як спостерігалося в дослідженні FISSION [5], всі ці пацієнти досягли показника СВВ12, окрім одного (97 %). Показник відповіді не розрізнявся між пацієнтами з цирозом печінки (100 % (два з двох)) та без цирозу печінки (97 % (29 з 30)). У фазі 3 POSITRON випробування [11] 143 пацієнтам із ВГС генотипу 2, які не є кандидатами на отримання ІФН, було рандомізовано призначене отримання СОФ та РБВ, дозу якого розраховано на підставі маси тіла, протягом 12 тижнів або плацебо. Більшість пацієнтів у цьому випробуванні мали протипоказання до ІФН або відмовились від його прийому; тільки 7 % попередньо не дали відповідь на лікування, що базувалося на ІФН. Серед 109 пацієнтів із генотипом 2, які отримували СОФ/РБВ протягом 12 тижнів, 101 пацієнтів (93 %) досягли показника СВВ12, який був схожий на результат, що спостерігався у випробуваннях FISSION і VALENCE [5, 12]. Показник СВВ12 не розрізнявся між пацієнтами з цирозом печінки та без такого (94 % (16 з 17) проти 92 % (85 з 92)).
Застосування СОФ (400 мг на добу) та РБВ, дозу якого розраховано на підставі маси тіла, також досліджувалося у пацієнтів із ВГС генотипу 2, які отримували лікування, у фазі 3 випробувань VALENCE [12] і FUSION [11]. У випробуванні VALENCE [12] 37 з 41 (90 %) пацієнтів, які раніше отримували лікування, досягли СВВ12 після 12-тижневого курсу СОФ/РБВ. У випробуванні FUSION [11] 68 пацієнтів, які попередньо не дали відповідь на схему, що містила ІФН (приблизно 75 % через виникнення рецидиву), були рандомізовано обрані для отримання СОФ/РБВ протягом як 12, так і 16 тижнів. Загалом досягнення СВВ12 спостерігалося у 86 % (31 з 36) пацієнтів, які отримували лікування протягом 12 тижнів, проти 94 % (30 з 32) тих, хто отримував лікування протягом 16 тижнів, хоча ця різниця не була статистично значущою. У пацієнтів без цирозу печінки високий показник СВВ12 спостерігався незалежно від тривалості лікування (12 проти 16 тижнів: 96 % (25 з 26) проти 100 % (23 з 23)). Однак нижчий показник відповіді спостерігався серед пацієнтів із цирозом печінки (12 проти 16 тижнів: 60 % (6 з 10) проти 78 % (7 з 9)). Хоча ця різниця не була статистично значущою, поганий показник відповіді серед пацієнтів, яких лікували протягом 12 тижнів, дає можливість припустити, що застосування 16-тижневої схеми є переважним, якщо комбінація СОФ/РБВ призначається цій підгрупі пацієнтів, особливо у піддослідних, які не є кандидатами на отримання ІФН. Переносимість комбінації СОФ/РБВ була схожою з тією, що спостерігалася в дослідженнях FISSION і POSITRON [5, 11].
СОФ, Пег-ІФН та РБВ
Застосування комбінації СОФ, Пег-ІФН та РБВ, дозу якого розраховано на підставі маси тіла, протягом 12 тижнів досліджувалося у пацієнтів із ВГС генотипу 2, які не дали відповіді на попередню терапію, у відкритій фазі 2 дослідження [86]. Серед 23 пацієнтів із ВГС генотипу 2 (14 з цирозом печінки) спостерігався показник СВВ12, що дорівнював 96 % (22 з 23). Високий показник відповіді спостерігався серед пацієнтів із цирозом печінки (93 % (13 з 14)) та без цирозу печінки (100 % (9 з 9)). Серед усієї популяції дослідження (n = 47), яка також включала 24 пацієнтів із генотипом 3, троє пацієнтів припинили застосування РБВ через анемію, а один пацієнт припинив увесь курс лікування через біль. Серйозні небажані явища виникли у чотирьох пацієнтів (9 %); більшість через застосування Пег-ІФН або РБВ і жодне через застосування СОФ.
Рекомендації:
35. Пацієнтам із ВГС генотипу 2, які раніше не отримували лікування, слід призначати СОФ (400 мг на добу) разом із РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень A).
36. Пацієнтам із генотипом 2 без цирозу печінки, які отримували лікування, слід призначати СОФ (400 мг на добу) разом із РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень A).
37. Пацієнтам із генотипом 2 та цирозом печінки, які отримували лікування і яким можна призначати ІФН, слід призначати СОФ (400 мг на добу) разом із Пег-ІФН та РБВ у дозі, залежній від маси тіла, протягом 12 тижнів. Пацієнтам, яким не можна призначити ІФН, слід призначати СОФ (400 мг на добу) разом із РБВ у дозі, залежній від маси тіла, протягом 16 тижнів (клас 1, рівень B).
ПАЦІЄНТИ З ВГС ГЕНОТИПУ 3 (ТАБЛ. 7)
СОФ та РБВ
У фазі 3 випробування FISSION [5] СОФ (400 мг на добу) в комбінації з РБВ, дозу якого розраховано на підставі маси тіла, протягом 12 тижнів або з Пег-ІФН/РБВ (800 мг на добу) протягом 24 тижнів застосовувався у 359 пацієнтів із ВГС генотипу 3, які раніше не отримували лікування. Загалом досягнення СВВ12 спостерігалося у 56 % (102 з 183) пацієнтів, які були рандомізовано обрані для отримання СОФ/РБВ, порівняно з 63 % (110 з 176) тих, які отримували Пег-ІФН/РБВ. Ця різниця не була статистично значущою. У світлі субоптимальних відповідей, отриманих при 12-тижневому застосуванні схеми СОФ/РБВ у цьому випробуванні, випробування VALENCE вивчало 24-тижневий курс у пацієнтів із ВГС генотипу 3 [12]. Серед пацієнтів, які раніше не отримували лікування, 94 % (99 з 105) досягли СВВ12, при цьому відповіді не розрізнялися між пацієнтами з цирозом (92 % (12 з 13)) та без цирозу печінки (95 % (87 з 92)).
Застосування комбінації СОФ/РБВ також досліджувалося у пацієнтів із ВГС генотипу 3, які отримували лікування. У фазі 3 випробування FUSION [11] 127 пацієнтам, які не дали відповіді на попереднє лікування, було рандомізовано призначено 12 чи 16 тижнів застосування СОФ та РБВ, дозу якого розраховано на підставі маси тіла. Загалом показник СВВ12 дорівнював 30 % (19 з 64) та 62 % (39 з 63) у групі 12 та 16 тижнів відповідно. Наявність цирозу печінки була міцним негативним предиктором відповіді у пацієнтів, які отримували лікування протягом 12 тижнів; при застосуванні цієї схеми тільки 19 % (5 із 26) пацієнтів з цирозом печінки та 37 % (14 із 38) пацієнтів без цирозу печінки досягли СВВ12. В групі 16-тижневого лікування показник СВВ12 становив 61 % (14 з 23) серед пацієнтів із цирозом печінки і 63 % (25 з 40) у тих, хто без цирозу печінки. В цьому випробуванні головною причиною невдачі лікування був рецидив, що спостерігався серед 66 % (42 з 64) пацієнтів, які отримували лікування протягом 12 тижнів, та серед 38 % (24 з 63) тих, хто отримував лікування протягом 16 тижнів. Отже, випробування VALENCE вивчало подовжений курс (24 тижнів) застосування СОФ/РБВ на 145 пацієнтах із ВГС генотипу 3, які раніше отримували лікування [12]. Серед 98 пацієнтів без цирозу печінки в цьому випробуванні СВВ12 спостерігався у 85 (87 %). Однак тільки 62 % (29 з 47) пацієнтів із цирозом печінки досягли СВВ12. Ці дані обґрунтовують необхідність альтернативних варіантів терапії пацієнтів із ВГС генотипу 3 з цирозом печінки, які отримували лікування.
СОФ, Пег-ІФН та РБВ
Застосування комбінації СОФ, Пег-ІФН та РБВ у дозі, залежній від маси тіла, протягом 12 тижнів досліджувалося у невеликій відкритій фазі 2 дослідження на пацієнтах із ВГС генотипу 3, які не дали відповідь на попередню терапію [86]. Серед 24 пацієнтів, 12 з яких мали цироз печінки, спостерігався показник СВВ12, що дорівнював 83 % (20 з 24). Не було відзначено різниці у відповіді між пацієнтами з цирозом та пацієнтами без цирозу печінки (83 % (10 з 12) в обох групах).
СОФ/ЛЕД + РБВ
Схема із застосуванням однієї таблетки СОФ/ЛЕД досліджувалася у пацієнтів із ВГС генотипу 3 у відкритій фазі 2 випробування ELECTRON-2, яке проводилося у двох центрах у Новій Зеландії [87]. В цьому дослідженні 51 пацієнту, які раніше не отримували лікування (16 % з цирозом печінки), було рандомізовано призначено 12 тижнів застосування СОФ/ЛЕД з РБВ чи без нього, дозу якого розраховано на підставі маси тіла. П’ятдесят пацієнтів, які раніше отримували лікування (44 % з цирозом печінки), отримали СОФ/ЛЕД + РБВ. Серед пацієнтів, які раніше не отримували лікування, показник СВВ12 дорівнював 64 % (16 з 25) в групі застосування СОФ/ЛЕД та 100 % (26 з 26) у тих, хто отримував СОФ/ЛЕД + РБВ. Серед пацієнтів, які раніше отримували лікування, що отримували СОФ/ЛЕД/РБВ протягом 12 тижнів, пацієнти без цирозу печінки мали вищий показник СВВ12, ніж ті, хто з цирозом печінки (89 % (25 з 28) проти 73 % (16 з 22)). ЛЕД мав обмежену активність проти генотипу 3 ВГС in vitro [88]; отже, хоча СОФ/ЛЕД є потенційним варіантом лікування у таких пацієнтів, до того, як рекомендувати цю схему як терапію першої лінії, надаючи їй перевагу перед іншими схемами, що містять СОФ, необхідно отримати додаткові дані в різних популяціях.
Рекомендації:
38. Пацієнтам із ВГС генотипу 3, які раніше не отримували лікування, та тим, які раніше отримували лікування і не мають цирозу печінки, слід призначати СОФ (400 мг на добу) разом із РБВ у дозі, залежній від маси тіла, протягом 24 тижнів (клас 1, рівень B).
39. Пацієнтам із ВГС генотипу 3 з цирозом печінки, які отримували лікування, слід призначати СОФ (400 мг на добу) разом із Пег-ІФН та РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень B).
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Лікування інфекції ВГС генотипу 2
Найкращий варіант лікування першої лінії для пацієнтів, інфікованих генотипом 2, — це безінтерферонове поєднання СОФ із РБВ. Інші варіанти можуть бути корисні для невеликої кількості пацієнтів, які не переносять цю схему лікування. У випадку, коли ці варіанти не доступні, комбінація Пег-ІФН-α з РБВ залишається прийнятним варіантом у відповідності з опублікованими раніше Клінічними настановами EASL [5].
Генотип 2, варіант 1
• Пацієнтів, інфікованих ВГС генотипу 2, потрібно лікувати щоденною дозою РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) та щоденною дозою СОФ (400 мг) впродовж 12 тижнів (А1).
• Лікування слід продовжити до 16 чи 20 тижнів у пацієнтів із цирозом печінки, особливо, якщо вони вже отримували лікування (В1).
Генотип 2, варіант 2
• Пацієнтів із цирозом печінки та/чи тих, хто раніше отримував лікування, можна лікувати щотижневою комбінацією Пег-ІФН-α, щоденною дозою РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) та щоденною дозою СОФ (400 мг) впродовж 12 тижнів (В1).
Генотип 2, варіант 3
• Пацієнтів із цирозом печінки та/чи тих, хто пройшов лікування, можна лікувати за допомогою безінтерферонової комбінації щоденної дози СОФ (400 мг) та щоденної дози ДАК (60 мг) впродовж 12 тижнів (В1).
Лікування інфекції ВГС генотипу 3
Існує три варіанти лікування пацієнтів, інфікованих ВГС генотипу 3. Комбінація СОФ та РБВ не є оптимальною, зокрема для пацієнтів із цирозом, у яких попереднє лікування ІФН та РБВ було невдалим. Спираючись на дані з інших генотипів та невелику групу пацієнтів із генотипом 3, потрійна комбінація Пег-ІФН, РБВ та СОФ виявляється корисною. Безінтерферонові комбінації СОФ та ДАК з чи РБВ без нього виявляються ще одним привабливим варіантом для пацієнтів, інфікованих ВГС генотипу 3.
ЛЕД є значно менш потужним проти генотипу 3, ніж ДАК in vitro; в клінічних дослідженнях ЛЕД, щодо ролі ЛЕД та РБВ у комбінації з СОФ не можуть бути визначені через відсутність контрольної групи тільки для СОФ та РБВ. Таким чином, хоча була використана ця комбінація, в очікуванні подальших досліджень більшої кількості пацієнтів, включаючи більші контрольні групи, комбінація СОФ + ЛЕД не рекомендується для лікування пацієнтів, інфікованих ВГС генотипу 3.
У випадку, коли жоден варіант недоступний, комбінація Пег-ІФН-α з РБВ залишається прийнятним варіантом, у відповідності з раніше опублікованими Клінічними настановами EASL [5].
Генотип 3, варіант 1
• Пацієнтів, інфікованих ВГС генотипу 3, можна лікувати щотижневою комбінацією Пег-ІФН-α, щоденною дозою РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) та щоденною дозою СОФ (400 мг) впродовж 12 тижнів (В1).
• Ця комбінація є відмінним варіантом для пацієнтів, які не змогли досягти СВВ після лікування СОФ + РБВ (В1).
Генотип 3, варіант 2
• Пацієнтів, інфікованих ВГС генотипом 3, можна лікувати щоденною дозою РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) та щоденною дозою СОФ (400 мг) впродовж 24 тижнів (А1).
• Ця терапія не є оптимальною для тих із цирозом, хто пройшов лікування, і тих, які не змогли досягти СВВ після лікування СОФ + РБВ. Для таких пацієнтів слід запропонувати можливість альтернативного лікування (В1).
Генотип 3, варіант 3
• Пацієнтів, інфікованих ВГС генотипом 3, без цирозу можна лікувати за допомогою безінтерферонової комбінації щоденної дози СОФ (400 мг) та щоденної дози ДАК (60 мг) впродовж 12 тижнів (А1).
• Ті, хто попередньо не отримував лікування, та пацієнти, які пройшли лікування, інфіковані ВГС генотипу 3, з цирозом, повинні отримувати цю комбінацію РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) щоденно впродовж 24 тижнів, в очікуванні подальших даних порівняння 12-тижневого лікування РБВ та 24-тижневого лікування з РБВ чи без нього в цій групі (В1).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.2.4. ГЕНОТИП 4, 5, 6 І ТРИВАЛІСТЬ ЛІКУВАННЯ
Оптимальна тривалість лікування пацієнтів із генотипом 4 гепатиту С становить 48 тижнів [7, 119, 120]. 1++
Метааналіз двох великих РКД третьої/четвертої фаз, проведених у Бельгії у пацієнтів із ХГС (n = 1073), порівнює відповіді на противірусну терапію пацієнтів із вірусом генотипу 5 з відповіддю у пацієнтів з іншими генотипами ВГС. Дослідження показало, що інфекція генотипу 5 відповідає на терапію аналогічно генотипу 1, проте популяція з генотипом 5 старша за віком, більш імовірно, має набуту інфекцію при переливанні крові та частіше має цироз печінки. У метааналізі рекомендували лікування пацієнтів з інфекцією генотипу 5 впродовж 48 тижнів подвійною терапією [143]. 1+
Систематичний огляд знайшов дуже мало досліджень з лікування хворих з інфекцією генотипу 6. Лікування Пег-ІФН і РБВ з урахуванням маси є ефективним з показниками СВВ близько 70 % після 48 тижнів терапії. Показники СВВ аналогічні у пацієнтів з інфекцією генотипу 6, які отримують Пег-ІФН і РБВ з урахуванням маси 24 тижні, хоча необхідні додаткові дослідження, перш ніж рекомендувати 24 тижні як оптимальну тривалість лікування цих пацієнтів [144]. 1+
А Для пацієнтів з інфекцією генотипу 4, 5 або 6 стандартне лікування повинно тривати 48 тижнів Пег-ІФН і РБВ з урахуванням маси.
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
ПАЦІЄНТИ З ВГС ГЕНОТИПІВ 4, 5 І 6 (ТАБЛ. 8)
Дані, які б могли скерувати лікаря у процесі прийняття рішення щодо терапії пацієнтів із ВГС генотипів 4, 5 чи 6, є обмеженими через невелику кількість пацієнтів, включених у клінічні дослідження 3-ї фази. В Канаді ці генотипи виявляють у < 1 % випадків [22]. Хоча ІП першого покоління, БЦП та ТЛП не мають клінічно значущої активності проти генотипів 4, 5 чи 6, СОФ [5] та СИМ [89] мають активність проти всіх цих генотипів. Однак через брак опублікованих даних Міністерство охорони здоров’я Канади і FDA США затвердили для лікування з ВГС генотипу 4 тільки СОФ.
Схеми без Пег-ІФН
ПАРР/ОМБ ± РБВ: Комбінована лікарська форма, що містить підсилений РТВ ІП NS3/4A паритапревір ПАРР та інгібітор NS5A ОМБ, вивчалася у пацієнтів із ВГС генотипу 4 в дослідженні PEARL-I [90]. Пацієнти, які раніше не отримували лікування, були рандомізовані в групи призначення ПАРР/ ОМБ з РБВ (у дозі, залежній від маси тіла) або без нього протягом 12 тижнів; всі пацієнти, які раніше отримували лікування, отримували РБВ. Майже всі пацієнти (93 %) в цьому дослідженні мали помірно виражений фіброз (від F0 до F2) і жоден не мав цирозу печінки. Серед суб’єктів, які отримували ПАРР/ОМБ + РБВ, всі пацієнти, які раніше не отримували лікування (42 з 42), та пацієнти, які отримували лікування (41 з 41), досягли СВВ12. Однак частота досягнення СВВ12 була нижчою (91 % [40 з 44]) серед пацієнтів, які раніше не отримували лікування, та яких було рандомізовано в групу застосування схеми без РБВ, що дозволяє припустити, що РБВ є необхідним при застосуванні цієї комбінації препаратів. Профіль безпеки комбінації ПАРР/ОМБ + РБВ був схожим з таким, що спостерігався у пацієнтів із ВГС генотипу 1, які додатково отримували ДАС [14, 15].
СОФ/ЛЕД: Застосування схеми з однією таблеткою СОФ/ЛЕД оцінювалося у пацієнтів із ВГС генотипу 4 в одноцентровому відкритому дослідженні фази IIa SYNERGY, що проводилося в одному центрі (Національний інститут вивчення алергії та інфекційних захворювань) [91]. 21 пацієнт (38 % тих, хто раніше отримував лікування; 40 % з цирозом печінки) отримував СОФ/ЛЕД протягом 12 тижнів. Серед 20 пацієнтів, які пройшли контрольний період після лікування, 19 (95 %) досягли СВВ12. Жоден пацієнт не припинив лікування через небажане явище. В подібному відкритому дослідженні, яке проводилося серед 25 пацієнтів із ВГС генотипу 6 (92 % пацієнтів, які раніше не отримували лікування; 8 % з цирозом печінки; 80 % з CC-генотипом IL28B) у двох центрах (ELECTRON-2) [87], 12-тижнева схема застосування СОФ/ЛЕД показала частоту досягнення СВВ12, що дорівнювала 96 % (24 з 25). Хоча дані in vitro дозволяють припустити, що застосування СОФ/ЛЕД має бути ефективним для пацієнтів із ВГС генотипу 5 [88], наразі воно не може бути рекомендоване в цій підгрупі пацієнтів, доки не будуть отримані дані клінічного випробування.
СОФ та РБВ: Застосування пероральної комбінації СОФ (400 мг на добу) та РБВ у дозі, залежній від маси тіла, протягом 12 або 24 тижнів досліджувалося в рандомізованому дослідженні, яке проводилося серед 103 пацієнтів з Єгипту з ВГС генотипу 4 (52 % тих, хто раніше отримував лікування; 17 % з компенсованим цирозом печінки) [92]. Серед піддослідних, які раніше не отримували лікування, показник СВВ12 в групах 12 та 24 тижнів лікування був схожим (84 % (21 з 25) проти 92 % (22 з 24)). У той час як пацієнти без цирозу печінки мали схожі відповіді в групах 12 та 24 тижнів лікування (86 % (19 з 22) проти 90 % (19 з 21)), пацієнти з цирозом печінки продемонстрували користь від більш тривалої терапії (СВВ12 у 12-тижневій порівняно з 24-тижневою групою: 67 % (2 з 3) проти 100 % (3 з 3)); однак розмір вибірки був обмежений. Серед пацієнтів, які раніше отримували лікування (41 % тих, хто не дав відповідь), 24-тижнева схема продемонструвала загальну перевагу (СВВ12 у 12-тижневій порівняно з 24-тижневою групою: 70 % (19 з 27) проти 89 % (24 з 27)) та у пацієнтів без цирозу печінки (73 % (16 з 22) проти 95 % (20 з 21)). У пацієнтів із цирозом печінки показник СВВ12 в групах 12 та 24 тижнів лікування становив 60 % (3 з 5) та 67 % (4 з 6) відповідно [92]. Ці результати були підтверджені невеликим випробуванням серед осіб єгипетського походження, що мешкали у Сполучених Штатах, які отримували лікування із застосуванням СОФ та РБВ у дозі, залежній від маси тіла, протягом 12 або 24 тижнів [93]. Серед пацієнтів, які раніше не отримували лікування, показник СВВ12 становив 79 % (11 з 14) у пацієнтів, які отримували лікування протягом 12 тижнів, та 100 % (14 з 14) у тих, хто отримував лікування протягом 24 тижнів. У пацієнтів, які раніше отримували лікування, відповідний показник СВВ12 становив 59 % (10 з 17) та 87 % (13 з 15).
Схеми, що містять Пег-ІФН
СОФ, Пег-ІФН та РБВ: У дослідженні 2-ї фази ATOMIC [94] невелика кількість пацієнтів із ВГС генотипів 4 і 6 приймала СОФ (400 мг раз на добу) протягом 24 тижнів в комбінації з Пег-ІФН/РБВ. У пацієнтів із генотипом 4 спостерігалась частота досягнення СВВ12 82 % (9 з 11), а у пацієнтів із генотипом 6 — 100 % (5 з 5), підтверджуючи противірусну активність цієї схеми. У дослідженні 3-ї фази NEUTRINO [5] невелика підгрупа пацієнтів з ВГС генотипів 4 (n = 28), 5 (n = 1) і 6 (n = 5) отримувала цю схему протягом короткого 12-тижневого періоду лікування, в якому спостерігалась частота досягнення СВВ12, що дорівнювала 96 % (27 з 28) у пацієнтів із генотипом 4, та 100 % (шість з шести) у пацієнтів із генотипами 5 і 6. Один пацієнт із генотипом 4, який не досягнув СВВ12, мав цироз печінки, і в нього виник рецидив після завершення терапії. Переносимість було схожою з такою, що в минулому спостерігалася серед пацієнтів, які раніше отримували лікування із застосуванням Пег-ІФН та РБВ.
СИМ, Пег-ІФН та РБВ: Дослідження RESTORE являло собою відкрите дослідження 3-ї фази в одній групі, яке оцінювало застосування СИМ разом із Пег-ІФН/РБВ серед 35 пацієнтів, які раніше не отримували лікування, та 72 пацієнтів із ВГС генотипу 4, які раніше отримували лікування [95]. Всі пацієнти отримали 12 тижнів потрійної терапії з наступними 12 або 36 тижнями застосування подвійної терапії Пег-ІФН та РБВ. Пацієнти, які раніше не отримували лікування, та пацієнти, в яких стався рецидив, отримували терапію, що модификується залежно від вираженості відповіді (додаткові 12 тижнів застосування подвійної терапії Пег-ІФН та РБВ за умови досягнення рівня РНК ВГС < 25 МО/мл на 4-му тижні та невиявлюваного рівня на 12-му тижні; в іншому випадку — додаткових 36 тижнів), у той час як пацієнти з частковою або нуль-відповіддю на попереднє лікування отримували 36 тижнів подвійної терапії (всього 48 тижнів). Загалом 65 % (70 з 107) пацієнтів досягли СВВ12 (83 % (29 з 35) пацієнтів, які раніше не отримували лікування, 86 % (19 з 22) пацієнтів з рецидивом, 60 % (6 з 10) пацієнтів із частковою відповіддю та 40 % (16 з 40) пацієнтів із нуль-відповіддю на попереднє лікування). Більшість пацієнтів (89 % пацієнтів, які раніше не отримували лікування, та 91 % з тих, в кого стався рецидив) відповідала критеріям застосування скороченої терапії, і в цих групах частота досягнення СВВ12 становила 94 і 95 % відповідно. Профіль безпеки був схожим із таким, що спостерігався в інших дослідженнях 3-ї фази терапії СИМ/Пег-ІФН/РБВ [6, 7].
Рекомендації:
40. Пацієнти з ВГС генотипу 4 мають отримувати лікування із застосуванням комбінації ПАРР/ОМБ + РБВ у дозі, залежній від маси тіла, або СОФ/ЛЕД без РБВ протягом 12 тижнів (клас 1, рівень B).
41. Пацієнти з ВГС генотипу 5 мають отримувати лікування із застосуванням СОФ (400 мг на добу) та Пег-ІФН + РБВ у дозі, залежній від маси тіла, протягом 12 тижнів (клас 1, рівень B).
42. Пацієнти з ВГС генотипу 6 мають отримувати лікування із застосуванням СОФ/ЛЕД протягом 12 тижнів (клас 1, рівень B).
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Лікування інфекції ВГС генотипу 4
У 2015 році пацієнтам, інфікованим ВГС генотипу 4, доступні шість варіантів лікування, включаючи два варіанти інтерфероновмісних та чотири безінтерферонових варіанти. У випадках, коли жоден варіант недоступний, залишається прийнятною комбінація Пег-ІФн-α та РБВ (попередні настанови EASL) [5].
Інтерфероновмісні варіанти
Генотип 4, інтерфероновмісний варіант 1
• Пацієнтів, інфікованих ВГС генотипу 4, можна лікувати за допомогою щотижневої комбінації Пег-ІФН-α, щоденного РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) та щоденного СОФ (400 мг) впродовж 12 тижнів (В1).
Генотип 4, інтерфероновмісний варіант 2
• Пацієнтів, інфікованих ВГС генотипом 1, можна лікувати за допомогою комбінації щотижневого Пег-ІФН-α, щоденного РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) та щоденного СИМ (150 мг) (В1).
• СИМ слід вводити впродовж 12 тижнів у комбінації з Пег-ІФН-α та РБВ. У подальшому Пег-ІФН-α та РБВ слід призначати додатково ще впродовж 12 тижнів (загальний строк лікування — 24 тижні) пацієнтам, які до того не отримували лікування, та пацієнтам із рецидивом, включаючи пацієнтів із цирозом; додатково ще впродовж 36 тижнів (загальний строк лікування 48 тижнів) пацієнтам із частковою або нульовою відповіддю, включаючи пацієнтів із цирозом (В1).
• Рівні РНК ВГС необхідно контролювати щодо реакції на лікування. Лікування слід припинити, якщо рівень РНК ВГС досягає 25 МО/мл чи більше на 4, 12 та 24-й тиждень (А2).
Безінтерферонові варіанти
Генотип 4, безінтерфероновий варіант 1
• Пацієнти, інфіковані ВГС генотипу 4, підлягають лікуванню безінтерфероновою схемою фіксованих доз СОФ (400 мг) та ЛЕД (90 мг) в одній таблетці раз на день (А1).
• Пацієнтів без цирозу, в тому числі тих, хто не отримував лікування, і тих, хто пройшов лікування, необхідно лікувати цією комбінацією фіксованих доз впродовж 12 тижнів без РБВ (А1).
• На основі даних від пацієнтів, інфікованих генотипом 1, пацієнтам із компенсованим цирозом печінки, включаючи тих, хто раніше отримував лікування, і тих, хто не отримував лікування, слід вводити цю комбінацію з фіксованим дозуванням впродовж 12 тижнів із РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (В1).
• Пацієнтам із компенсованим цирозом печінки з протипоказаннями чи поганою переносимістю РБВ слід вводити комбінацію з фіксованою дозою СОФ та ЛЕД впродовж 24 тижнів без РБВ (В1).
• На основі даних від пацієнтів, інфікованих генотипом 1, лікування комбінацією з фіксованим дозуванням СОФ та ЛЕД з РБВ може бути продовжено до 24 тижнів у пацієнтів із компенсованим цирозом печінки, які раніше отримували лікування, і тих, хто має негативні прогностичні фактори відповіді, наприклад, показник тромбоцитів < 75 × 103/мкл (В1).
Генотип 4, безінтерфероновий варіант 2
• Пацієнтів без цирозу печінки, інфікованих генотипом 4, можна лікувати безінтерфероновою схемою, що включає фіксовані дози ОМБ (75 мг), ПАР (12,5 мг) та РТВ (50 мг) в одній таблетці (дві таблетки раз на день під час їди) впродовж 12 тижнів із дозуванням РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) щоденно без дасабувіру (В1).
• Пацієнтів із цирозом печінки, інфікованих генотипом 4, слід лікувати фіксованою дозою ОМБ (75 мг), ПАР (12,5 мг) та РТВ (50 мг) в одній таблетці (дві таблетки раз у день під час їди) впродовж 24 тижнів із дозуванням РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) щоденно без дасабувіру, в очікуванні подальших даних (В6).
Генотип 4, безінтерфероновий варіант 3
• Пацієнтів, інфікованих генотипом 4, можна лікувати безінтерфероновою комбінацією СОФ (400 мг) та СИМ (150 мг) щоденно впродовж 12 тижнів (В2).
• На основі даних про інші комбінації пацієнтам із цирозом рекомендовано додавання щоденної дози РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (В2).
• У випадках протипоказань до РБВ при цирозі печінки слід розглядати можливість продовження лікування до 24 тижнів (В2).
Генотип 4, безінтерфероновий варіант 4
• Пацієнтів, інфікованих генотипом 4, можна лікувати безінтерфероновою комбінацією СОФ (400 мг) та ДАК (60 мг) щоденно впродовж 12 тижнів (В2).
• На основі даних про інші комбінації пацієнтам із цирозом рекомендовано додавання щоденної дози РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (В2).
• У випадку протипоказань до РБВ при цирозі печінки слід розглянути можливість продовження лікування до 24 тижнів (В2).
Лікування інфекції ВГС генотипів 5 чи 6
Існує три варіанти лікування пацієнтів з генотипом 5 чи 6 ВГС: потрійна комбінація Пег-ІФН-α, РБВ та СОФ; безінтерферонова комбінація СОФ та ЛЕД; безінтерферонова комбінація СОФ та ДАК. У випадках, коли жоден варіант недоступний, залишається прийнятною комбінація Пег-ІФН-α та РБВ [5].
Генотип 5 чи 6, варіант 1
• Пацієнти, інфіковані генотипом 5 або 6, можуть підлягати лікуванню комбінацією Пег-ІФН-α щотижнево, РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) щоденно та СОФ (400 мг) щоденно впродовж 12-ти тижнів (В1).
Генотип 5 чи 6, варіант 2
• Пацієнти, інфіковані генотипом 5 чи 6, можуть підлягати лікування безінтерфероновою схемою з фіксованими дозами СОФ (400 мг) та ЛЕД (90 мг) в одній таблетці раз на день (А1).
• Пацієнтам без цирозу, включаючи пацієнтів, які раніше отримували лікування, слід вводити цю комбінацію з фіксованим дозуванням впродовж 12 тижнів без РБВ (В1).
• На основі даних від пацієнтів, інфікованих генотипом 1 ВГС, пацієнтам із компенсованим цирозом печінки, включаючи тих, хто раніше не отримував лікування, слід вводити цю комбінацію з фіксованим дозуванням впродовж 12 тижнів із дозуванням РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (В1).
• Пацієнтам із компенсованим цирозом печінки з протипоказаннями чи поганою переносимістю РБВ слід вводити комбінацію з фіксованою дозою СОФ та ЛЕД впродовж 24 тижнів без РБВ (В1).
• На основі даних від пацієнтів, інфікованих генотипом 1, лікування комбінацією з фіксованим до–зуванням СОФ та ЛЕД із РБВ може бути продовжено до 24 тижнів у пацієнтів із компенсованим цирозом печінки, які раніше отримували лікування, та з негативними прогностичними факторами відповіді, наприклад, показник тромбоцитів < 75 × 103/мкл (В1).
Генотип 5 чи 6, варіант 3
• Пацієнтів, інфікованих генотипом 5 або 6 ВГС, можна лікувати безінтерфероновою комбінацією СОФ (400 мг) та ДАК (60 мг) щоденно впродовж 12 тижнів (В1).
• На основі даних щодо інших комбінацій пацієнтам із цирозом рекомендовано додавання щоденної дози РБВ залежно від маси тіла (1000 мг або 1200 мг у хворих < 75 мг або ≥ 75 кг відповідно) (В1).
• У випадках протипоказань до РБВ при цирозі печінки слід розглядати можливість продовження лікування до 24 тижнів (В1).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.3. ПІДГРУПИ ПАЦІЄНТІВ
10.3.1. ПАЦІЄНТИ З ЛЕГКОЮ ФОРМОЮ ХРОНІЧНОГО ГЕПАТИТУ
У пацієнтів із легкою формою ХГС ефективність і безпека комбінованої терапії Пег-ІФН і РБВ аналогічна ефективності і безпеці в інших пацієнтів із гепатитом С. Таким чином, біопсія печінки, щоб виключити пацієнтів із легкою формою захворювання, не потрібна перед розглядом питання про противірусне лікування [145]. 1++
А Пацієнти з легкою формою ХГС повинні розглядатися на отримання лікування.
10.3.2. ПАЦІЄНТИ З ЦИРОЗОМ
Див. розділ 11.1.1 щодо інформації про пацієнтів із цирозом.
10.3.3. ПАЦІЄНТИ З НОРМАЛЬНОЮ АКТИВНІСТЮ АЛТ
Ефективність та безпека комбінованої терапії Пег-ІФН та РБВ у пацієнтів із ХГС з нормальними рівнями активності АЛТ аналогічна ефективності і безпеці у пацієнтів із підвищеним рівнем активності АЛТ (розділ 9.5) [146]. 1+
А Пацієнти з ХГС і нормальним рівнем активності АЛТ повинні розглядатися на лікування.
10.3.4. ПАЦІЄНТИ З КОІНФЕКЦІЄЮ ВІЛ
Пегільований ІФН і РБВ впродовж 48 тижнів ефективні в лікуванні пацієнтів із ВГС і супутньою ВІЛ-інфекцією. Їх застосування призвело до СВВ у 60 % пацієнтів із генотипом 2 і 3 та у 14–29 % пацієнтів з генотипом 1. У пацієнтів із генотипом 1 і низьким вірусним навантаженням (< 800 000 МО/мл) показник СВВ становив близько 60 % [147–149].
98 % пацієнтів із супутніми ВІЛ/ВГС, які не мали РВВ на 12-му тижні, не досягли СВВ на 48-му тижні [149]. 1+
Пацієнти з коінфекцією ВІЛ і ВГС генотипу 2 і 3, у яких не визначається РНК ВГС на 4-му тижні, не отримають користі від терапії тривалістю понад 24 тижнів [150]. 1+
Пегільований ІФН + РБВ з урахуванням маси для лікування ВГС був більш ефективним, ніж стандартний ІФН п+ РБВ з урахуванням маси в досягненні СВВ у пацієнтів з коінфекцією ВІЛ: 55 % проти 26 % в цілому, 46 % проти 18 % при генотипі 1 і 4, і 71 % проти 43 % при генотипі 2 і 3. Різниця між когортами залежала від генотипу ВГС у перші 12 тижнів терапії Пег-ІФН, незалежно від статусу ВІЛ. Серед пацієнтів із генотипом вірусу 2 або 3 дослідження показало значно більш різке зменшення рівня РНК ВГС у пацієнтів з моноінфекцією ВГС порівняно з ВГС ВІЛ-інфікованими пацієнтами тільки на 4-му тижні, в той час як значні відмінності серед пацієнтів із ВГС генотипу 1 спостерігалися тільки після 12 тижнів лікування. В цілому, більш тривале лікування (48–72 тижнів) показало кращі відповіді на лікування, незалежно від генотипу, ніж більш коротка тривалість лікування (24–48 тижнів) [150–152]. 1+
Думка експертів групи з розробки настанови полягала в тому, що можливо зробити рекомендації стосовно лікування хворих з коінфекцією ВІЛ і ВГС генотипу 1 шляхом екстраполяції схем лікування пацієнтів з моноінфекцією ВГС генотипу 1, які включають ІП.
А Усі пацієнти з коінфекцією ВІЛ і ВГС повинні бути розглянуті на лікування гепатиту.
А У пацієнтів із 1-м генотипом ВГС і ВІЛ-інфекцією, які не досягають РВВ, лікування необхідно припинити.
А Пацієнтам з коінфекцією не 1-го генотипу, які вважаються придатними для лікування, пропонується лікування Пег-ІФН і РБВ з урахуванням маси впродовж 48 тижнів.
- Пацієнти з коінфекцією генотипу 2 або 3, які досягли ШВВ, можуть розглядатися на лікування впродовж 24 тижнів.
С Всі пацієнти з коінфекцією ВІЛ і ВГС генотипу 1 повинні бути розглянуті на лікування за схемою, яка включає ІП ВГС.
В Неліковані пацієнти з коінфекцією ВІЛ і ВГС генотипу 1, яким не підходить лікування за схемою, що включає ІП ВГС, повинні бути розглянуті на лікування Пег-ІФН і РБВ з урахуванням маси впродовж 48–72 тижнів залежно від вірусологічної відповіді.
- Пацієнти з коінфекцією генотипу 1, не вилікувані від гепатиту, повинні контролюватися щодо прогресування захворювання.
10.3.5. ПАЦІЄНТИ З КОІНФЕКЦІЄЮ ГЕПАТИТУ В
Результати лікування комбінацією непегільованого ІФН і РБВ у пацієнтів із коінфекцією хронічного гепатиту В і С аналогічні результатам, досягнутим у пацієнтів з моноінфекцією ВГС [153, 154]. Жодного дослідження не було знайдено, яке б вивчило взаємодію Пег-ІФН і РБВ у пацієнтів із коінфекцією хронічного гепатиту В і С. 2++
Не знайдено ніяких доказів, щоб зробити рекомендації з лікування ІП пацієнтів з генотипом 1 і з коінфекцією гепатиту В, оскільки ці пацієнти були виключені з клінічних досліджень.
С Пацієнти з коінфекцією хронічного гепатиту В та С повинні розглядатися на отримання комбінованої терапії Пег-ІФН і РБВ з урахуванням маси.
- Пацієнти з хронічним гепатитом В і коінфекцією ВГС генотипу 1 можуть бути розглянуті на комбіноване лікування Пег-ІФН і РБВ з урахуванням маси з додаванням ІП на індивідуальній основі в центрах, які мають досвід в лікуванні гепатиту В.
10.3.6. ПАЦІЄНТИ В ПРОГРАМАХ ЛІКУВАННЯ НАРКОЗАЛЕЖНОСТІ
У пацієнтів із ХГС, які беруть участь у стабільній програмі лікування наркозалежності, лікування комбінацією Пег-ІФН і РБВ є ефективним і призводить до високого рівня СВВ. У той же час показник відмов від лікування вищий, ніж в інших когортах, відмови трапляються раніше, зазвичай протягом перших восьми тижнів. Після восьми тижнів прийому препаратів дотримання лікування аналогічне дотриманню лікування в інших групах [44, 155]. 2++
Останні дослідження показали, що пацієнти, які активно вживають наркотики, мають аналогічні результати лікування, як і ті, хто не вживає наркотиків [156–158].
С Пацієнти з ХГС, які беруть участь у програмі лікування наркозалежності, можуть розглядатися для лікування.
- Активні споживачі наркотиків мають залучатися до заходів щодо забезпечення медичної допомоги та зниження шкоди здоров’ю.
- Активні споживачі наркотиків повинні мати комплексну оцінку їх психологічних потреб та ймовірність дотримання противірусного лікування.
An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver (2012):
Рішення лікувати споживачів ін’єкційних наркотиків, які хворі ВГС, з недавнім або активним вживанням наркотиків, має прийматися в індивідуальному порядку досвідченими докторами, в ідеалі — в умовах міждисциплінарного консенсусу. Навчання застосування на практиці стратегій зменшення шкоди є незамінним компонентом світової практики лікування цих пацієнтів (клас 1, рівень С).
«EASL Recommendations on Treatment of Hepatitis C 2015»:
Лікування пацієнтів із тяжкою хворобою печінки
Пацієнти з декомпенсованим цирозом печінки без показань для трансплантації печінки
Основна мета противірусного лікування пацієнтів із декомпенсованим цирозом печінки, які відсутні в списку очікування на трансплантацію, — досягнення покращення функції печінки та виживаності. 48-тижневий режим лікування СОФ та РБВ оцінюється у пацієнтів із цирозом печінки та портальною гіпертензією [88]. Попередні результати показали відмінну відповідь на лікування та незначне покращення тестів печінкової функції. Довгострокові клінічні переваги та ефект від цього лікування на портальний тиск не спостерігались.
Дослідження оцінило безпечність та ефективність комбінації фіксованих доз СОФ та ЛЕД з РБВ впродовж 12 чи 24 тижнів у пацієнтів із декомпенсованим цирозом (оцінка за Чайлдом — П’ю до 12), інфікованих ВГС генотипу 1 чи 4 [89]. Частота СВВ становила 87 % (45/52) та 89 % (42/47) після 12 та 24 тижнів лікування відповідно; лікування було однаково ефективним у пацієнтів із цирозом печінки класу В та класу С. Був наявний ефект вірусного кліренсу на функції печінки зі значним покращенням рівнів білірубіну, альбуміну та міжнародного нормалізованого відношення і, як наслідок, у шкалах MELD та Чайлда — П’ю. Покращення функції печінки було виявлено на четвертому тижні після переривання лікування. Таким чином, воно буде мати важливе значення для оцінки вигоди від ліквідації ВГС на функцію печінки і подальшої виживаності в більш пізні моменти часу. Ці попередні результати показують, що пацієнти із декомпенсованим цирозом печінки отримують користь від цієї схеми лікування. При призначенні лікування слід брати до уваги наявність супутньої патології, що може впливати на виживаність. Дані щодо пацієнтів із більш пізніми стадіями хвороби печінки (> 12 за Чайлдом — П’ю) обмежені.
Рекомендації
• Пацієнтів із декомпенсованим цирозом печінки (клас В і клас С, до 12 балів), які не знаходяться в списку очікування на трансплантацію печінки і без супутньої патології, що може впливати на виживаність, можно лікувати за допомогою комбінації СОФ та РБВ впродовж 16–20 тижнів (генотип 2), комбінації з фіксованою дозою СОФ та ЛЕД (генотипи 1, 4, 5, 6), чи поєднання СОФ та ДАК (всі генотипи), з дозою РБВ залежно від маси тіла впродовж 12 тижнів (В1).
• Пацієнтам із декомпенсованим цирозом печінки з протипоказаннями чи поганою переносимістю РБВ слід вводити комбінацію з фіксованою дозою СОФ та ЛЕД (генотипи 1, 4, 5, 6), чи комбінацію СОФ та ДАК (всі генотипи) впродовж 24 тижнів без РБВ (В1).
Пацієнти з ГЦК без показань до трансплантації печінки
ВГС є провідною причиною ГЦК у всьому світі, захворюваність та летальність від ВГС-асоційованої ГЦК зростає, особливо в регіонах з високим рівнем доходів. ГЦК щороку трапляється у 1–7 % пацієнтів із цирозом печінки. Ризик пов’язаний з тяжкістю фіброзу серед інших факторів. Було з’ясовано, що СВВ асоційована з загальним зменшенням летальності, летальності від хвороб печінки, зі зменшенням ризику ГЦК. За допомогою декількох метааналізів дослідили взаємозв’язок між досягненням СВВ та зниженням ризику ГЦК, що передбачає, що СВВ пов’язана зі сниженням ГЦК [90, 91]. Проте більшість з цих досліджень мають обсерваційний та ретроспективний дизайн; були засновані на СВВ, досягнутої завдяки лікуванню ІФН.
Так, було з’ясовано, що ІФН призводить до покращення результатів після абляції чи резекції ВГС, цілком можливо, що високі темпи СВВ, досягнуті з новими безінтерфероновими схемами, можуть знизити ризик рецидиву після резекції чи абляції ГЦК [92]. Якщо частота рецидивів ГЦК може бути знижена за допомогою даної стратегії, більш високі темпи резекції чи абляції плюс СВВ із противірусним лікуванням можуть допомогти скоротити подальшу необхідність у трансплантації для ВГС-асоційованої ГЦК. Потрібно більше даних, щоб оцінити вплив високоефективних безінтерферонових схем на ризик рецидиву після резекції ГЦК чи абляції.
Рекомендації
• Хоча довгострокові вигоди противірусного лікування для зниження ризику ГЦК у пацієнтів, які перенесли резекцію чи абляцію ГЦК при ВГС-асоційованій ГЦК, невідомі, ці пацієнти часто страждають від фіброзу та повинні отримувати відповідне противірусне лікування при хворобах печінки, дотримуючись описаних вище правил (В2).
Пацієнти з показаннями для трансплантації печінки
Трансплантація печінки є найкращим варіантом для пацієнтів із термінальною стадією хвороби печінки. Однак, як правило, після трансплантації за відсутності профілактики виникає рецидив інфекції гепатиту С [93]; строк служби трансплантата зменшений у пацієнтів із рецидивуючим гепатитом С.
Лікування інфекції ВГС у пацієнтів, які очікують на трансплантацію, має дві головні мети: профілактика інфікування трансплантата після трансплантації (у всіх випадках) і покращення печінкових функцій перед трансплантацією (у пацієнтів з декомпенсованою хворобою печінки). Можна стверджувати, що, оскільки виліковування інфекції ВГС може бути досягнуто в переважній більшості випадків після трансплантації, немає необхідності лікування ВГС-інфекції до трансплантації, особливо тому, що тривалість противірусного лікування не може бути передбачена для пацієнтів, які знаходяться в списку очікування на трансплантацію. Проте профілактика інфікування трансплантата печінки суттєво полегшує лікування після трансплантації. Окрім того, покращення печінкових функцій передбачає виключення із списку деяких пацієнтів [94], що є доцільним у контексті нестачі органів [89]. Окрім того, ризик рецидиву ГЦК теоретично може бути зменшений при противірусному лікуванні після резекції; таким чином, більшій кількості пацієнтів може бути запропонована резекція.
У нещодавно опублікованому дослідженні [95] 61 пацієнта, які були інфіковані генотипами 1 чи 4 з цирозом класу А за шкалою Чайлда — П’ю, лікували СОФ та РБВ до 48 тижнів перед трансплантацією; 46 з них підпали під трансплантацію. Ефективність у відповідності з протоколом становила 43 пацієнти з рівнем РНК ВГС < 25 МО/мл у момент трансплантації. Серед них 30 (70 %) досягли СВВ на 12-му тижні після трансплантації, що означає відсутність повторення інфікування. Час без виявлення РНК ВГС перед трансплантацією був кращим прогнозом відповіді (РНК ВГС не виявлялось впродовж ≥ 30 днів поспіль). Ці концептуальні дослідження показали, що безінтерферонове лікування впродовж декількох тижнів перед трансплантацією дозволяє попередити ВГС-інфікування трансплантата у більшості пацієнтів. У пацієнтів, інфікованих генотипом 2, поєднання СОФ та РБВ є оптимальним, із досить високим рівнем СВВ. Для інших генотипів цю комбінацію слід уводити до трансплантації печінки тільки якщо немає іншого вибору лікування.
Лікування Пег-ІФН-α, РБВ та СОФ впродовж 12 тижнів є прийнятним у пацієнтів з компенсованим (клас А) цирозом, які знаходяться в списку очікування на трансплантацію печінки, якщо безінтерферонові поєднання недоступні, як показує дослідження, що проводилось на 164 пацієнтах, інфікованих генотипом 1, половина з яких вже отримували лікування, та третина з цирозом, які досягли СВВ на 4-му тижні у 85 % випадків [13].
Поєднання СОФ та ЛЕД із РБВ упродовж 12 чи 24 тижнів оцінювалося у пацієнтів із генотипами 1 та 4 з компенсованим (клас А) чи декомпенсованим (клас В і клас С, до 12 балів) цирозом [89]. У пацієнтів класу А за шкалою Чайлда — П’ю дані цього та інших досліджень показали досягнення СВВ на 12-му тижні у більше ніж 95 % досліджуваних, як у тих, хто попередньо не отримував лікування, так і у тих, хто вже отримував лікування, незалежно від строків лікування. У пацієнтів із декомпенсованим цирозом печінки попередній аналіз показав рівень СВВ на 12-му тижні 88 % (50/57) та 88 % (37/42) у пацієнтів класу В та класу С відповідно, незалежно від тривалості лікування [89]. На 4-му тижні після лікування результати MELD покращились з 1 до 8 балів у 64 % (34/53) випадках у пацієнтів із тяжкістю хвороби класу В та у 70 % (28/40) пацієнтів класу С. Бал за шкалою Чайлда — П’ю покращився з 1 до 3 балів приблизно у двох третин пацієнтів. У цієї комбінації хороший профіль безпеки; найбільш серйозні побічні реакції, включаючи смерть, не були пов’язані з досліджуваними препаратами. Хоча дослідження не було спеціально сплановане для оцінки впливу противірусного лікування у пацієнтів із компенсованим та декомпенсованим цирозом печінки в списку очікування на трансплантацію.
Було опубліковано дані щодо ефективності та безпеки комбінації РТВ, ПАР, ОМБ та дасабувіру з РБВ у пацієнтів із компенсованим цирозом печінки, інфікованих генотипом 1 [45]. Пацієнти з цирозом печінки, які очікують на трансплантацію, як правило, мають більш пізні стадії хвороби та портальної гіпертензії, ніж ті, які були включені в це дослідження; однак були включені пацієнти з низьким рівнем альбуміну (< 35 г/дл у 43 пацієнтів) і тромбоцитів (< 100 000 клітин/мл, 78 пацієнтів). У пацієнтів із концентрацією тромбоцитів < 100 000/мл рівень СВВ становив 89 та 97 % на 12-му та 24-му тижні лікування відповідно. Частота СВВ у пацієнтів із рівнем альбуміну < 35 г/дл становила 84 % та 89 % відповідно. Таким чином, ця комбінація може розглядатися у пацієнтів із компенсованим цирозом та ГЦК, які знаходяться в списку на трансплантацію печінки.
Поєднання СОФ та СИМ з РБВ чи без нього було оцінено у великих групах у практичних дослідженнях, у тому числі у значної кількості пацієнтів із цирозом [13]. У пацієнтів із генотипом 1 та компенсованим цирозом печінки рівень СВВ на 4-му тижні був близько 90 %. Попередні дані у 81 пацієнта з генотипом 1 та декомпенсованим цирозом печінки показали досягнення СВВ на 4-му тижні у 75 % випадків та хороший профіль безпеки. Проте СИМ не показаний у пацієнтів із декомпенсованим цирозом через більш високі концентрації препарату.
Рекомендації
• Пацієнтам, які очікують на трансплантацію, показане противірусне лікування, оскільки вона попереджає інфікування трансплантата (А1).
• Лікування повинно бути розпочато якомога скоріше для того, щоб завершити повний курс лікування до трансплантації та оцінки впливу кліренсу вірусу на печінкові функції, оскільки в окремих випадках значне покращення функції печінки може призвести до виключення зі списку на трансплантацію (В1).
• Пацієнтів, які очікують на трансплантацію, необхідно лікувати безінтерфероновою схемою впродовж 12 чи 24 тижнів, практично до самої трансплантації, з РБВ (А1).
• Пацієнтів зі збереженими печінковими функціями (клас А), у яких показаннями для трансплантації печінки є ГЦК, можно лікувати за допомогою комбінації СОФ та РБВ впродовж 16–20 тижнів (генотип 2), з фіксованою дозою комбінації СОФ та ЛЕД з РБВ впродовж 12 тижнів (генотипи 1, 4, 5 чи 6), комбінацією посилених РТВ ПАР, ОМБ та дасабувіру з РБВ впродовж 12 тижнів (генотип 1b) чи 24 тижнів (генотип 1а), поєднанням посилених РТВ ПАР та ОМБ з РБВ впродовж 12 тижнів (генотип 4), поєднанням СОФ та СИМ з РБВ впродовж 12 тижнів (генотипи 1 та 4) або комбінацією СОФ та ДАК з РБВ впродовж 12 тижнів (всі генотипи) (В1).
• Лікування Пег-ІФН-α, РБВ та СОФ і РБВ впродовж 12 тижнів є прийнятним у пацієнтів із компенсованим (клас А) цирозом печінки, які очікують на трансплантацію печінки, якщо безінтерферонові схеми недоступні (В2).
• Пацієнтів із декомпенсованим цирозом печінки (клас В або клас С) в очікуванні на трансплантацію печінки можно лікувати за допомогою комбінації СОФ та РБВ впродовж 12 тижнів (генотип 2), з фіксованою дозою комбінації СОФ та ЛЕД з РБВ впродовж 12 тижнів (генотипи 1, 4, 5 та 6), або комбінацією СОФ та ДАК з РБВ впродовж 12 тижнів (всі генотипи), однак дані щодо пацієнтів із цирозом за шкалою Чайлда — П’ю > 12 або з балом MELD > 20 (А1) обмежені.
• Оптимальний час лікування (тобто до трансплантації чи після неїї) для максимізації виживаності залишається суперечливим і потребує індивідуальної оцінки (В2).
• Через обмежену кількість даних щодо безпеки серед пацієнтів із декомпенсованим цирозом печінки, які очікують на трансплантацію печінки, необхідні часті клінічні та лабораторні оцінки (В2).
Рецидиви після трансплантації печінки
Рецидив ВГС, як правило, трапляється у пацієнтів із виявленою на момент трансплантації печінки РНК ВГС [93]. Перебіг ВГС, пов’язаний із хворобою печінки, прискорюється у реципієнтів після трансплантації печінки, приблизно в однієї третини з них розвивається цироз печінки впродовж 5 років після трансплантації [96, 97]. Пацієнти з гострим холестатичним гепатитом і пацієнти з помірним та поширеним фіброзом чи портальною гіпертензією в перший рік після трансплантації мають високий ризик втрати трансплантата і потребують невідкладного противірусного лікування [98, 99].
Лікування Пег-ІФН-α та РБВ призводить до низького рівня СВВ та погано переноситься реципієнтами печінки. Додавання ТЛП чи БЦП збільшує частоту СВВ до 60–70 % у пацієнтів, інфікованих генотипом 1, але також спричиняє часті тяжкі побічні реакції. Окрім того, необхідно корегувати дози блокаторів кальциневрину, щоб уникнути токсичності через взаємодії ліків. Проте було з’ясовано, що кліренс ВГС справляє позитивний вплив як на трансплантат, так і на виживаність пацієнтів [100, 101].
В першому дослідженні, що проводилось для оцінки безпеки та ефективності безінтерферонової терапії у ВГС-позитивних реципієнтів печінки, використовувалася комбінація СОФ та РБВ впродовж 24 тижнів [102]. Група включала 40 пацієнтів, з яких 40 % мали цироз та 88 % не реагували на ІФН-терапію. Ця схема викликала СВВ на 12-му тижні в 70 % випадків, з відмінним профілем безпеки (тяжкі побічні реакції у 15 % пацієнтів, анемія у 20 % і припинення лікування в 5 %). Корекція дози блокатора кальциневрину не знадобилась через відсутність суттєвих взаємодій СОФ з такролімусом чи циклоспорином. Позитивний вплив кліренсу ВГС на печінкові функції та виживаність після трансплантації печінки підтверджується даними застосування СОФ в індивідуальному порядку, що включали пацієнтів із тяжким рецидивом гепатиту С чи очікуваної тривалості життя без противірусного лікування менше 12 місяців [103]. Пацієнти отримували СОФ та РБВ до 48 тижнів з Пег-ІФН-α чи без нього. Рівень СВВ на 12-му тижні становив 59 %. П’ятдесять сім відсотків пацієнтів мали значне клінічне покращення при останньому обстеженні, в той час як 22 % залишалися без змін, 3 % погіршили клінічний стан та 13 % вмерли. Ці результати дозволяють припустити, що кліренс ВГС впливає на виживаність у цих найбільш тяжких випадках, особливо з раннім рецидивом. У реальному житті в пацієнтів, інфікованих генотипом 2, поєднання СОФ та РБВ після трансплантації печінки дали досить високий рівень СВВ у дослідженні TARGET [13].
Були представлені попередні дані щодо клінічних досліджень, що тривають, присвячених оцінці ефективності та безпеки комбінації фіксованих доз СОФ та ЛЕД з РБВ впродовж 12 чи 24 тижнів [104]. Ці пацієнти включали тих, хто попередньо не отримував лікування, та в переважній кількості тих, хто отримував лікування з генотипами 1 та 4, які мали фіброз на всіх стадіях (F0–F4), та пацієнтів із декомпенсованим цирозом печінки класу В та класу С. Частота СВВ була 97 % (108/111) у F0–F3 пацієнтів, 96 % (49/51) у пацієнтів із хворобою класу А та 84 % (37/44) у пацієнтів із класом В. Доступні дані тільки про 8 пацієнтів класу С, 5 з яких (62 %) досягли СВВ. Не було ніяких відмінностей в ефективності між 12 та 24 тижнями лікування, а профіль безпеки комбінації був відмінним. Як і у пацієнтів із нормальним імунітетом, результати MELD на 4-му тижні після лікування покращилися у більшості пацієнтів класу А та класу В за шкалою Чайлда — П’ю, які досягли елімінації вірусу [104].
Противірусна ефективність та безпечність комбінації посилених РТВ ПАР, ОМБ та дасабувіру з РБВ упродовж 24 тижнів були протестовані у 34 реципієнтів печінки, інфікованих ВГС генотипу 1 [105]. Всі вони не отримували лікування після трансплантації та мали фіброз F0–F2. Всі, окрім одного, досягли СВВ на 12-му тижні, в той час як тільки 6 % пацієнтів повідомили про тяжкі побічні ефекти, 17 % — про анемію, в 1-го пацієнта лікування було припинено. Через взаємодії РТВ з ПАР, такролімусом та циклоспорином була необхідність в корекції дози впродовж лікування. Дані пацієнтів без рецидивів після трансплантації слід екстраполювати на пацієнтів із більш пізніми стадіями хвороби.
Наводилися дані про реальні групи, де лікування проводилось комбінацією СОФ та СИМ з РБВ чи без нього впродовж 12 тижнів. СВВ на 12-му тижні була досягнута у 91 % (60/66) пацієнтів, інфікованих генотипом 1, більшість з яких раніше не отримували лікування, третина з яких мали фіброз чи компенсований цироз. Частота СВВ була дещо нижчою у пацієнтів із генотипом 1а з фіброзом [28]. У когортному дослідженні з дизайном для реальної клінічної практики TARGET, в якому більшість пацієнтів раніше отримували лікування та більше половини мали цироз, поєднання СОФ та СИМ дало 90 % (61/68) частоту СВВ на 4-му тижні [106].
Існує мало даних щодо комбінації СОФ та диклатасвіру після трансплантації, в основному це дані від невеликих когорт у реальній клінічній практиці. Взагалі з цією легкопереносимою схемою СВВ досягається в більше ніж 90 % випадків, у тому числі в пацієнтів із фіброзуючим холестатичним гепатитом [107].
Рекомендації
• Всі пацієнти з післятрансплантаційним рецидивом ВГС повинні розглядатися на лікування (А1).
• Гострий холестатичний гепатит або наявність фіброзу ступеня від помірного до поширеного чи портальної гіпертензії через рік після трансплантації є предиктором гострого прогресування хвороби та втрати трансплантата; це вказує на потребу в невідкладній противірусній терапії (А1).
• Пацієнті з рецидивом ВГС після трансплантації слід лікувати безінтерфероновими схемами з РБВ впродовж 12 чи 24 тижнів (А1).
• Пацієнтів без цирозу чи з компенсованим (клас А) цирозом печінки після трансплантації можна лікувати комбінацією посилених РТВ ПАР, ОМБ та дасабувіром з РБВ впродовж 12 тижнів (генотип 1b) чи 24 тижнів (генотип 1а з цирозом), комбінацією посилених РТВ ПАР та ОМБ з РБВ впродовж 12 чи 24 тижнів (генотип 4 без цирозу печінки чи з таким відповідно), чи комбінацією СОФ та СИМ з РБВ впродовж 12 тижнів (генотипи 1 і 4), з потребою в корекції доз імуносупресантів чи, у випадку комбінації СОФ з СИМ, необхідність уникати циклоспорину А (В1).
• Пацієнтів із декомпенсованим цирозом (клас В чи клас С) можна лікувати за допомогою комбінації СОФ та РБВ впродовж 12 тижнів (генотип 2), комбінацією фіксованих доз СОФ та ЛЕД з РБВ впродовж 12 тижнів (генотипи 1, 4, 5 чи 6) або комбінацією СОФ та ДАК з РБВ впродовж 12 тижнів (всі генотипи). У цих пацієнтів прийом РБВ може розпочатися в дозі 600 мг щоденно; доза в подальшому корегується залежно від переносимості (В1).
• Корекція дози такролімусу чи циклоспорину не потрібна в комбінаціях СОФ-РБВ, СОФ-ЛЕД чи СОФ-ДАК (А2).
• Через значне збільшення концентрації СИМ у плазмі одночасний прийом СИМ та циклоспорину А не рекомендується реципієнтам печінки. Ніяких змін дози СИМ не потрібно з такролімусом та сиролімусом, але слід проводити регулярний моніторинг їх конценрації в крові (А2).
• При використанні комбінації посилених РТВ ПАР, ОМБ та дасабувіру доза такролімусу повинна бути скоригована до 0,5 мг один раз у тиждень чи 0,2 мг кожні 3 дні, в той час як доза циклоспорину повинна бути скоригована до однієї п’ятої частини добової дози перед початком лікування гепатиту; використання преднізолону в дозі ≤ 5 мг/день дозволяється, але використання mTOR-блокаторів не рекомендується (А2).
Лікування особливих груп
Коінфекція ВГВ
У пацієнтів із коінфекцією ВГС + ВГВ рівень ДНК ВГВ часто низький чи такий, що не визначається тест-системами, хоча він може змінюватися в широких діапазонах, і, як правило, основним фактором хронічного гепатиту є ВГС. У пацієнтів повинен бути ретельно проаналізований реплікативний статус як ВГВ, так і ВГС, також слід перевіряти на наявність інфекції вірусу гепатиту дельта. При реплікації ВГС, що спричинює хворобу печінки, лікування слід проводити за тими ж правилами, що стосуються і моноінфекції ВГС. Існує потенційний ризик реактивації ВГС під час чи після кліренсу вірусу гепатиту С [108]. В цьому випадку чи якщо виявляється значна реплікація ВГВ показане лікування конкуруючими препаратами нуклеозидів/неклеотидів ВГВ. СИМ посилює вплив тенофовіру. Таким чином, у пацієнтів, які отримують тенофовір як лікування ВГВ, слід часто перевіряти розрахункову швидкість клубочкової фільтрації, функцію канальців і відповідним чином регулювати дозування.
Рекомендації
• Пацієнтів слід лікувати за тими самими схемами і дотримуватися тих же правил, що і при лікуванні пацієнтів із моноінфекцією ВГС (В1).
• Якщо вірус ВГВ реплікується в значній кількості до, під час чи після кліренсу ВГС, показана терапія аналогами конкуруючих неклеозидів/нуклеотидів ВГВ (В1).
Імунокомплексні прояви ХГС
Було описано декілька імунокомплексних проявів хронічної інфекції ВГС. Змішана кріоглобулінемія, в основі якої лежить експансія В-лімфоцитів, може призводити до системного васкуліту, при якому багато органів уражені в результаті внутрішньосудинного осадження імунних комплексів. Лікування змішаної кріоглобулінемії засновано на етіологічній (противірусній терапії) та/чи імуносупресивній терапії. Ритуксимаб, анти-CD20 моноклональні антитіла були використані для уражень як шкіри, так і для уражень внутрішніх органів.
Існує значна асоціація між вірусним гепатитом С та В-клітин неходжкінської лімфоми. Дифузна В-великоклітинна лімфома є найбільш поширеною. Хвороба лікується за стандартним режимом R-CHOP; дія ритуксимабу явно посилюється, незважаючи на те, що може також підвищитися вірусна реплікація. Із застосуванням ритуксимабу може бути пов’язана гепатотоксичність і підвищення трансаміназ, хоча ризик невеликий.
Зв’язок хронічної інфекції ВГС і хронічної ниркової недостатності достовірно встановлений. Було виявлено ряд гістологічних уражень, але більш частим був мембранозно-проліферативний гломерулонефрит І типу, як правило, на фоні змішаної кріоглобулінемії ІІ типу. Також можуть виникати вогнищевий сегментарний гломерулосклероз та інтерстиційний гломерулонефрит. Підходи до лікування ВГС-асоційованих хвороб нирок включають противірусне лікування, кортикостероїди та циклофосфамід; лікування, спрямоване на виснаження В-клітин з метою попередження утворення імунних комплексів; плазмаферез. Імовірно, але не доведено, що більш ефективна та швидка вірусологічна відповідь, що спостерігається при нових безінтерферонових противірусних схемах, покращить результати. Існують деякі дані щодо використання ритуксимабу в лікуванні хвороб нирок, індукованих інфекцією ВГС. Проте існують питання, що стосуються його безпечного та оптимального використання разом із швидкодіючими ПППД, на які слід звернути увагу. Рекомендується мультидисциплінарний підхід.
Рекомендації
• За необхідності в лікуванні ВГС-асоційованої лімфоми повинні використовуватися нові безінтерферонові схеми, але вплив СВВ на загальний прогноз поки не з’ясований. Ефект нових противірусних схем лікування разом із виснаженням В-клітин потребує подальшого вивчення. Міждисциплінарний підхід при ретельному моніторингу функцій печінки не потрібен (В1).
• Слід розглядати відповідне противірусне лікування для лікування змішаної кріоглобулінемії та ниркових хвороб, що пов’язані з хронічною інфекцією ВГС. Роль ритуксимабу у пов’язаних із ВГС ниркових хворобах потребує оцінки. Більш швидке гальмування реплікації вірусу гепатиту та високий темп СВВ потребують кореляції з відповіддю ураженої печінки та кріоглобулінемією. Ретельний моніторинг побічних реакцій є обов’язковим (В1).
Пацієнти із супутніми хворобами
Пацієнти на гемодіалізі
Інфекція ВГС поширена серед пацієнтів, які перебувають на гемодіалізі, та асоційована з підвищеною загальною летальністю та летальністю від хвороб печінки. Однак серцево-судинні хвороби залишаються головними причинами смерті у діалізних пацієнтів незалежно від статусу ВГС. Як і у будь-яких випадках, кандидатура на діаліз для противірусного лікування потребує спеціального розгляду супутніх хвороб, оскільки хвороба печінки може мати незначний вплив на прогнозовану захворюваність та летальність даного пацієнта. Імуносупресія може прискорити ураження печінки, що пов’язане з інфекцією ВГС. З цієї причини слід розглядати противірусне лікування для всіх пацієнтів на гемодіалізі, які є кандидатами на трансплантацію нирок.
Використання РБВ у цій ситуації проблематично. Після гемодіалізу рекомендуєтся індивідуальна доза РБВ 200 мг/день, чи по 200 мг через день, чи по 200 мг тричі на тиждень, також необхідна гемопоетична підтримка. Наразі немає опублікованих даних, які описують фармакокінетику, дозування, безпечність та ефективність поточних режимів безінтерферонової терапии ВГС у пацієнтів, які перебувають на гемодіалізі. Ці дані вкрай необхідні.
Рекомендації
• При лікуванні пацієнтів на гемодіалізі, особливо потенційних кандидатів на трансплантацію нирок, необхідно розглянути питання щодо застосування противірусної терапії (B1).
• Пацієнти на гемодіалізі повинні отримувати лікування за безінтерфероновою схемою, а якщо є можливість, то і без РБВ, 12 тижнів — пацієнти без цирозу, 24 тижні — пацієнти з цирозом печінки (В1).
• СИМ, ДАК та комбінація посилених РТВ ПАР, ОМБ и дасабувіру виводяться метаболізмом печінки та можуть бути використані у пацієнтів із тяжкими нирковими хворобами (А1).
• СОФ не слід призначати пацієнтам зі швидкістю клубочкової фільтрації < 30 мл/хв/1,73 м2 чи з термінальною стадією ниркової недостатності, доки не буде доступно більше даних (B2).
• Невідомо, чи потрібна корекція дози затвер-джених для лікування ВГС ПППД у хворих на діалізі. Даних щодо безпеки дозування та ефективності в цій когорті немає. Таким чином, ці препарати повинні бути використані з особливою обережністю у хворих із тяжкими нирковими хворобами, і тільки у крайніх випадках, при загрозі життю пацієнтів на діалізі (В1).
Реципієнти трансплантації інших паренхіматозних органів
Вірус гепатиту С у нирках реципієнтів може бути пов’язаний зі збільшенням швидкості прогресування фіброзу печінки. Більшість досліджень груп із трансплантатом нирок вказують, що у ВГС-позитивних пацієнтів зменшена ниркова функція трансплантата та виживаність. Погіршення виживаності трансплантата частково впливає на підвищення летальності пацієнтів. Окрім того певні фактори, пов’язані з ВГС, наприклад, гломерулонефрит та збільшений ризик розвитку діабету, впливають на трансплантат. ВГС-позитивність пов’язана зі збільшенням загальної летальності та летальності через хвороби печінки, хоча основною причиною смерті пацієнтів є серцево-судинні хвороби [109]. Оскільки цироз є важливим індикатором низької виживаності після трансплантації нирки, бажано оцінити стадію фіброзу печінки у всіх ВГС-позитивних кандидатів на трансплантацію нирки [94]. Для пацієнтів зі встановленим діагнозом цирозу печінки та портальної гіпертензії, яким не допомогла (або якщо вони не придатні) противірусна терапія ВГС, ізольовані трансплантації нирок можуть бути протипоказані, при цьому слід розглядати одночасну трансплантацію печінки та нирок [110]. Оскільки лікування на основі ІФН може призвести до відторгнення трансплантату, необхідно запропонувати таким пацієнтам безінтерферонові схеми лікування. Ще належить визначити, чи краще призначати (щоб покращити результат) пацієнтам із ХГС без цирозу печінки трансплантацію нирок, з надією на те, що їхній ВГС можна буде вилікувати після трансплантації.
Дані щодо ВГС після трансплантації серця обмежені та суперечливі, дослідження показують незмінну чи зменшену виживаність у пацієнтів, інфікованих ВГС. Ніякі дослідження ризиків та вигід противірусного лікування не проводились на цих пацієнтах; ризик відторгнення трансплантата при ІФН-терапії лишається нез’ясованим. У цьому контексті лікування ХГС у реципієнтів серця повинно ґрунтуватися на безінтерферонових схемах і показання слід розглядати індивідуально в кожному конкретному випадку, якщо ВГС являє загрозу для життя.
Міжнародні настанови визначають хронічну інфекцію ВГС як протипоказання до трансплантації легень [111]. Кандидатам на трансплантацію легень деякі автори рекомендують лікування перед трансплантацією, але досвід із цим підходом обмежений. Відсутні дані щодо впливу інфекції ВГС і її лікування після трансплантації підшлункової залози чи тонкого кишечника.
Рекомендації
• Лікування гепатиту до трансплантації нирки допоможе уникнути летальності після трансплантації та може попередити ВГС-специфічні причини дисфункції ниркового трансплантата. За можливості, противірусне лікування повинно бути надано потенційним реципієнтам до занесення в список на трансплантацію нирки. Ці пацієнти повинні отримувати лікування за безінтерфероновою схемою, а якщо можливо, то і без РБВ, 12 тижнів для пацієнтів без цирозу, 24 тижні — для пацієнтів з компенсованим (клас А) цирозом печінки у відповідності з вищезазначеними рекомендаціями. Однак дані щодо безпеки та ефективності в цій групі недоступні; потреба в корекції доз для нових ПППД невідома. Таким чином, ці препарати слід використовувати з великою обережністю, а пацієнтам із рШКФ < 30 мл/хв/1,73 м2 чи термінальною стадією хвороби нирок не слід вводити СОФ, доки не буде отримано більше даних (В1).
• Реципієнти паренхіматозних органів (окрім печінки) з показаннями для лікування ВГС повинні отримувати безінтерферонове лікування, дотримуючись наведених вище рекомендацій щодо режиму лікування та управління лікарськими взаємодіями циклоспорину та такролімусу за необхідності (В2).
Активні наркозалежні та пацієнти на стабільній замісній підтримуючій терапії
Групи старіючих людей, які споживають ін’єкційні наркотики (СІН), з ХГС та низьким рівнем лікування вносять значний вклад у популяцію з прогресуючою хворобою печінки і в летальність від хвороб печінки [112, 113]. Поширеність ВГС серед СІН приблизно 65 % [114–116] та > 80 % серед СІН у віддаленій перспективі [114].
При лікуванні СІН противірусну терапію слід розглядати за умови, що вони бажають отримати лікування та у них є можливість та бажання проводити регулярні зустрічі. Існують настанови для оцінки ВГС-інфікованих перед початком лікування ВГС [5, 117]. Моделюючі дослідження показують, що лікування ВГС-інфікованих СІН може знизити передачу інфекції [118, 119]. Рішення впродовж лікування повинні прийматися індивідуально в кожному випадку. У СІН із тривалими соціальними проблемами та/чи з психіатричними хворобами в анамнезі чи з більш частим споживанням наркотиків під час лікування існує ризик зниження дотримання лікування та зниження ймовірного досягнення СВВ; вони потребують уважного моніторингу під час лікування та більше підтримуючих заходів.
Лікування гепатиту успішно проводилось серед СІН за допомогою різних клінічних моделей, у тому числі в рамках многопрофільних лікарень, що спеціалізуються на хворобах печінки, та в клініках, що спеціалізуються на вірусних гепатитах, в клініках ОЗТ, наркологічних клініках, в’язницях та муніципальних клініках. Стратегії підвищення дотримання призначеного лікування розглядалися вище.
Клінічні програми розвитку ПППД виключили осіб з активним споживанням ін’єкційних наркотиків, але багато досліджень включали тих, хто знаходився на замісній терапії. Дані щодо безпеки та наслідків лікування ПППД не були представлені клінічними дослідженнями субпопуляцій осіб на ОЗТ. Дослідження взаємодії препаратів були представлені СОФ та СИМ в одній групі та метадоном [120] і бупренорфіном [121] в другій групі без спостереження клінічно значущих взаємодій. Проводяться дослідження взаємодій ДАК та метадону/бупренорфіну.
На додаток до ОЗТ, у пацієнтів із наркозалежністю часто використовуються антидепресанти, нейролептики та седативні лікарські засоби. Суттєвої взаємодії препаратів із СОФ не виявлено. СИМ збільшує концентрацію в крові перорального мідазоламу і, потенційно, триазоламу. Таким чином, рекомендується обережність при поєднаному введенні пероральним шляхом цих препаратів із вузьким терапевтичним індексом. Мало існує даних щодо ДАК. Фармакокінетичні дослідження легких та заборонених наркотиків не проводились.
Рекомендації
• Слід регулярно та добровільно перевіряти СІН на антитіла до ВГС кожні 6–12 місяців при негативному результаті (В1).
• СІН повинні бути забезпечені чистими ін’єкційними засобами та доступом до ОЗТ у рамках значно поширених комплексних програм щодо зниження шкоди, в тому числі у в’язницях (В1).
• Претерапевтична освіта повинна включати в себе обговорення передачі ВГС, факторів ризику прогресування фіброзу, лікування, ризик повторного інфікування та стратегії зниження шкоди (В1).
• СІН слід рекомендувати помірне споживання алкоголю чи утримання від нього, якщо є ознаки прогресуючої хвороби печінки (А1).
• СІН слід рекомендувати помірне споживання канабісу чи утримуватися від нього, якщо є ознаки прогресуючої хвороби печінки (В2).
• Лікування гепатиту у СІН повинно розглядатися індивідуально і здійснюватися многопрофільною командою (А1).
• Перетерапевтичне обстеження повинно включати оцінку стану житла, освіти, культури, соціальних функцій та підтримки, фінансів, харчування та споживання наркотиків і алкоголю. СІН повинні бути прив’язані до служби соціальної підтримки і групи взаємної підтримки, якщо такі існують (А1).
• Внутрішньовенне споживання наркотиків в анамнезі на початку лікування не пов’язане зі зниженою СВВ; рішення щодо лікування необхідно приймати індивідуально в кожному випадку (В1).
• Пацієнти, які отримують наркотики та алкоголь, чи будь-які інші пацієнти із соціальними проблемами та/чи психіатричними хворобами в анамнезі і пацієнти з більш частим споживанням наркотиків під час лікування можуть менше дотримуватися лікування та мати більш низьку ймовірність досягнення СВВ. Вони повинні бути під особливим спостереженням впродовж лікування та потребують більш інтенсивної міждисциплінарної підтримки (В1).
• Необхідна оцінка безпеки та ефективності нових інтерфероновмісних та безінтерферонових схем у СІН (С1).
• СІН, які перебувають на ОЗТ, повинні отримувати лікування за безінтерфероновою схемою (В1).
• Схеми лікування ВГС, які можуть бути використані у СІН, такі самі, як і у незалежних. Спеціальна корекція дози метадону та бупренорфіну не потрібна, але потрібен контроль ознак опіоїдної токсичності; в іншому випадку повинна бути відміна. Є потреба в більших даних щодо ДАК (В1).
• Слід роз’яснити, що трансплантація печінки є методом лікування у пацієнтів з анамнезом внутрішньовенного споживання наркотиків (В1).
• Замісна терапія не є протипоказанням для трансплантації печінки; особам з ОЗТ не слід рекомендувати зменшення чи припинення лікування (В1).
Гемоглобінопатії
Найбільш частою гемоглобінопатією, асоційованою з ХГС, є велика таласемія, що потребує частих переливань крові і поширена в країнах із низьким рівнем скринінгу крові. Хронічна інфекція ВГС також часто зустрічається в осіб із серпоподібно-клітинною анемією. Лікування цим пацієнтам часто не надається, оскільки Пег-ІФН-α та РБВ можуть спричиняти анемію. Дослідження противірусного лікування в цій когорті населення ще не були опубліковані, але тривають. За відсутності опублікованих досліджень щодо вивчення безпеки безінтерферонових схем лікування у пацієнтів із гемоглобінопатіями немає ніяких схем підстав вважати, що ці препарати специфічно протипоказані. Таким чином, у цих пацієнтів слід використовувати схеми, що не містять ІФН та РБВ. Їх перевагою є те, що вони не погіршують анемію.
Рекомендації
• Показання для лікування ВГС у пацієнтів із гемоглобінопатією такі самі, як і у пацієнтів без неї (А1).
• Пацієнтів із гемоглобінопатією слід лікувати за безінтерфероновою схемою та без РБВ (В1).
• Схеми противірусного лікування ВГС пацієнтів із гемоглобінопатіями такі самі, як і пацієнтів без гемоглобінопатій (В1).
• Коли використання РБВ необхідне, рекомендується ретельний контроль; також може знадобитися переливання крові (В2).
Порушення згортання крові
Гемофілія є спадковим порушенням згортання крові, що спричинюється дефіцитом факторів VII чи IX при гемофілії А чи В відповідно. Пацієнти страждають від спонтанних та травматичних кровотеч. Лікування ґрунтується на внутрішньовенному заміщенні цих факторів, які до недавнього виділялися з донорської плазми. Концентрати факторів згортання отримують з пулов плазми, що включає близько 30 000 донорів, та до 1985 року вводилась без будь-якої вірусної інактивації. Хворі на гемофілію, які отримували неактивовані концентрати до 1985 року, мали майже 100% шанс інфікуватися ВГС після першого контакту з концентратом. Існує рід інших спадкових порушень згортання крові, що підлягають лікуванню концентратами, в тому числі хвороба Віллебранда та дефіцит фібриногену і факторів II, VII, X, XI, XIII.
Прогресування до кінцевої стадії хвороби печінки у пацієнтів із гемофілієй схожа на таку, як у ВГС-позитивних осіб у загальній популяції. Дослідження хронічної хвороби печінки при гемофілії таке саме, як і для осіб без гемофілії. Трансюгулярна біопсія печінки підвищує безпеку процедури. Для моніторингу прогресування хвороби можуть бути використані неінвазивні методи. Смерть від печінкової недостатності ВГС-позитивних людей є однією з основних причин смерті у пацієнтів зі спадковими порушеннями згортання крові. За винятком гістологічного дослідження печінки лікування ХГС при гемофілії схоже на лікування ХГС у пацієнтів без гемофілії. В лікуванні пацієнтів з гемофілією також використовуються сучасні ПППД для лікування ВГС.
У світі було зроблено понад 100 трансплантацій печінки пацієнтам із гемофілією. Концентрат фактора VIII/IX вводять безпосередньо перед операцією, чи за допомогою болюсної ін’єкції, чи безперервної інфузії, чи впродовж післяопераційного періоду (12–48 год), після чого введення концентрату не потрібне. Коінфекція ВІЛ/ВГС не є протипоказанням до трансплантації печінки при гемофілії. Показання для трансплантації печінки у пацієнтів із гемофілією такі самі, як і у не хворих на гемофілію, але процедура має переваги, створюючі фенотипові ліки від гемофілії внаслідок синтезу фактора VIII пересадженою печінкою.
Рекомендаціії
• Показання для терапії ВГС у пацієнтів із порушеннями згортання крові такі самі, як і у пацієнтів без даної патології (А1).
• Через потенційні взаємодії препаратів у пацієнтів із коінфекцією ВГС/ВІЛ, які отримують антиретровірусні препарати, потрібен ретельний відбір агентів (А1).
Подальші заходи для пацієнтів, які не отримували лікування, та пацієнтів із невдачею лікування
Пацієнтів, які не отримували лікування, з ХГС та тих, хто не відреагував на попереднє лікування, слід регулярно обстежувати. Причина(и) недотримання та неефективності лікування повинна(і) бути чітко задокументована(і). Ті пацієнти, які не отримували лікування, повинні бути обстежені з інтервалом від 1 до 2 років неінвазивним методом. Пацієнти з цирозом печінки повинні проходити спеціальний контроль ГЦК кожні 6 місяців.
Рекомендації
• Пацієнтів, які не отримували лікування, з хронічним ВГС та тих, хто не відреагував на попереднє лікування, слід регулярно обстежувати (А1).
• Неінвазивні методи визначення фіброзу краще підходять для подальшої періодичної оцінки (А1).
• Спостерігати за ГЦК у пацієнтів із цирозом печінки необхідно продовжувати невизначений час (А1).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.4. ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА ЕФЕКТИВНІСТЬ
10.4.1. ВІК, СТАТЬ, ЕТНІЧНА ПРИНАЛЕЖНІСТЬ
Противірусна терапія менш ефективна у пацієнтів віком понад 40 років; чоловіки рідше, ніж жінки, досягають СВВ [7, 119, 120]. У пацієнтів різних рас спостерігалися певні розбіжності у відповіді на противірусну терапію. Метааналіз різних етнічних груп показав, що пацієнти афроамериканського чи латиноамериканського походження мали нижчий показник СВВ порівняно з білими або азіатськими групами (16 і 24 % проти 32 і 59 % з генотипом 1 досягли СВВ) [159]. 1+
А Пацієнти мають знати, що старший вік на початку лікування знижує ймовірність СВВ.
В Пацієнти мають знати про ймовірність СВВ відповідно до їх етнічної групи.
10.4.2. МАСА ТІЛА
Три систематичних огляди повідомляють, що у пацієнтів із ХГС, маса тіла яких понад 75 кг, лікування комбінацією Пег-ІФН і РБВ призводить до нижчої СВВ, ніж у пацієнтів з масою 1+
тіла до 75 кг [7, 119, 120]. Дозування Пег-ІФН і РБВ у цих дослідженнях було визначено для маси 75 кг і не пов’язувалося зі справжньою вагою, тому слід проявляти обережність при екстраполяції результатів. Питання маси та дієти обговорюються в розд. 12.
10.4.3. АЛКОГОЛЬ
Дослідження з лікування пацієнтів, які продовжують вживати алкоголь, обмежені. Два когортних дослідження показали, що відповідь на стандартне лікування ІФН була обернено пропорційна кількості вжитого алкоголю [160, 161]. Утримання від алкоголю протягом 6 місяців не змінило показники від колишнього вживання алкоголю [162]. 2+
- Пацієнти мають знати, що вживання алкоголю (навіть помірне) може знизити відповідь на лікування Пег-ІФН і РБВ.
«An update on the management of chronic hepatitis C: 2015 Consensus guidelines from the Canadian Association for Stady of Liver»:
РЕЗИСТЕНТНІСТЬ ДО ПРОТИВІРУСНИХ ПРЕПАРАТІВ
При застосуванні ПППД необхідно враховувати можливість виникнення РАШ. Через високу швидкість реплікації ВГС і низьку точність його РНК-залежної РНК-полімерази нові варіанти виникають безперервно [96–98]. ВГС циркулює у вигляді великої популяції пов’язаних вірусів, відомих як квазівиди. Варіанти з мутаціями, які призводять до резистентності до ПППД, з’являються випадково і з низькою частотою присутні до експозиції ПППД. Після експозиції ПППД ці резистентні варіанти мають селективну перевагу над вірусом дикого типу і виступають як домінуючі штами в квазівидах. Імовірність того, що резистентність з’явиться при застосуванні певних ПППД, залежить від їхнього генетичного бар’єра до резистентності. Цей бар’єр, як правило, відображає кількість нуклеотидних замін, які повинні виникнути для того, щоб з’явився високий рівень резистентності. Наприклад, часта ІП-асоційована мутація R155K потребує двох замін у вірусі генотипу 1b та всього однієї заміни у вірусі генотипу 1a, отже, цей варіант набагато частіше зустрічається у пацієнтів з генотипом 1a [99]. На додаток до генетичного бар’єра важливе значення має пристосованість РАШ. РАШ, який дуже погано реплікується, навряд чи з’явиться при застосуванні терапії і буде швидко пригнічений вірусом дикого типу після видалення селективного тиску препарату [97, 98]. Наприклад, варіант S282T, що дає резистентність до СОФ, має вкрай низьку реплікативну здатність і, як наслідок, виявляється лише в рідкісних випадках у пацієнтів при застосуванні СОФ і швидко зникає після припинення лікування [100]. І навпаки, багато варіантів, резистентних до інгібіторів NS5A, дуже пристосовані і добре конкурують з вірусом дикого типу [88, 101]. В результаті NS5A-резистентні варіанти виявляються у 10–15 % пацієнтів з генотипом 1 до експозиції препарату і довго персистують після припинення терапії у пацієнтів, які не дали відповіді на схеми, що містять інгібітор NS5A [8, 9].
Стратегії подолання резистентності включають уникання застосування ПППД у вигляді монотерапії або у низьких дозах, збільшення комплаєнтності, комбінування ПППД з профілями резистентності, які не перекриваються, вибір ПППД із високими бар’єрами до резистентності та комбінування ПППД з Пег-ІФН та РБВ [96]. Інгібітори NS5A (наприклад, ЛЕД, ОМБ), ненуклеозидні інгібітори полімерази (наприклад, ДАС) та ІП NS3/4A (наприклад, ТЛП, БЦП, СИМ) мають низькі бар’єри до резистентності [88]. Однак при комбінуванні потужних агентів декількох класів вірусологічна невдача в процесі лікування спостерігається надзвичайно рідко (наприклад, в одного пацієнта серед 473, які отримували лікування із застосуванням ПАРР/ОМБ/ДАС + РБВ у випробуванні SAPPHIRE-I), а рецидив після лікування є дуже непоширеним (наприклад, в 7 з 463 пацієнтів в цьому випробуванні) [15]. Проте резистентність до двох або всіх трьох класів лікарських засобів була визначена майже в усіх пацієнтів з вірусологічною невдачею на цій комбінації. ЛЕД-резистентні варіанти також непоширені, але наявні під час рецидиву в більшості пацієнтів, які не дали відповіді на комбінацію СОФ/ЛЕД [8, 9].
Дані щодо підтримки тестування на резистентність до початку лікування відсутні. У пацієнтів, які не дали відповіді на схему, що містить ПППД, розумно припустити, що резистентність до цього ПППД буде наявною і під час повторного лікування. Тому в цій ситуації слід обирати схему, що містить ПППД без резистентності, що перекривається. Наприклад, у пацієнтів, які не дали відповіді на ТЛП чи БЦП, застосування комбінаційної терапії СОФ/ЛЕД дуже ефективне. У випробуванні ION-2 [9] 159 з 163 пацієнтів (98 %) з персистуючою резистентністю до ІП на початку лікування досягли СВВ12 при застосуванні цієї схеми. Хоча й по закінченні тривалого періоду від припинення лікування РАШ можуть повернутися на рівні, що спостерігались до початку терапії, немає даних щодо лікування пацієнтів з резистентністю до ІП із застосуванням схеми, що містить ІП (наприклад, ПАРР/ОМБ/ ДАС). Таким чином, цей підхід не має бути прийнятним, особливо враховуючи наявність інших перевірених альтернатив (тобто СОФ/ЛЕД).
Резистентність NS5A є дещо більшою проблемою, оскільки інгібітори NS5A є компонентом більшості пероральних схем лікування [88]. У випробуваннях ION-1 [8] і ION-3 [10] серед пацієнтів із базовою NS5A-резистентністю 90 % досягли СВВ12 при застосуванні СОФ/ЛЕД. Хоча такий показник СВВ був дещо нижчим порівняно з пацієнтами без базової резистентності, відмінності не були статистично значущими, отже, виявлення резистентності до лікування не вплинуло б на тактику лікування. Детальне секвенування перед початком лікування не проводилось у жодного пацієнта, які отримали лікування із застосуванням схеми ПАРР/ОМБ/ДАС у дослідженнях 3-ї фази [13–15, 75, 83], однак показник вірусологічної невдачі був низьким, що дозволяє припустити, що базовий рівень NS5A-резистентності навряд чи є серйозною проблемою. Залишається визначити, чи буде ефективним повторне лікування пацієнтів з NS5A-резистентністю, яка виникла, із застосуванням схеми, що містить інгібітор NS5A.
Рекомендації:
43. ПППД не мають застосовуватись у вигляді монотерапії (клас 1, рівень B).
44. Зниження дози ПППД не повинне застосовуватися з метою ведення побічних ефектів, пов’язаних із лікуванням (клас 2a, рівень C).
45. Слід максимізувати прихильність до ПППД з метою зменшення ймовірності виникнення резистентності (клас 2a, рівень C).
46. Пацієнтів, які в минулому зазнали невдачі терапії із застосуванням ІП, слід лікувати із застосуванням схем, що не містять ІП (клас 1, рівень B).
47. За винятком тестування на Q80K у пацієнтів, для яких розглядається можливість застосування СИМ, Пег-ІФН + РБВ, немає необхідності у тестуванні базової резистентності при застосуванні сучасних ПППД (клас 1, рівень A).
Взаємодія між лікарськими засобами
Перед початком застосування будь-якого ПППД слід розглянути можливість виникнення взаємодій між лікарськими засобами, включаючи ті, що пов’язані з рецептурними та безрецептурними лікарськими засобами і рослинними препаратами. Виявлення потенційних взаємодій потребує знання метаболізму цих агентів. Усі наявні в даний час ІП ВГС (ТЛП, БОЦ, СИМ, ПАР) є інгібіторами і субстратами цитохрому Р450 3А4 (CYP3A4). РТВ, який використовується для збільшення експозиції і робить можливим прийом ПАР раз на добу, також є інгібітором і субстратом CYP3A4. Таким чином, застосування ІП протипоказане разом із ліками, що є потужними індукторами CYP3A4/5, які знижують плазмові концентрації і терапевтичний ефект ІП, і для тих, кліренс яких сильно залежить від CYP3A4/5, а підвищені плазмові концентрації пов’язані з серйозними та/або загрозливими для життя явищами (тобто вузький терапевтичний діапазон). Інші шляхи метаболізму препаратів також беруть участь у переробці окремих ІП, що може вплинути на взаємодії між лікарськими засобами. Інгібіторі NS5A і нуклеотидні інгібітори полімерази мають менше відомих взаємодій між лікарськими засобами, ніж ІП, однак перед початком терапії слід розглянути всі супутні лікарські засоби щодо можливості виникнення взаємодій між лікарськими засобами. Перед початком терапії рекомендується звернутися до онлайн-бази даних взаємодії між лікарськими засобами, які постійно оновлюється (наприклад, http://www.hep-druginteractions.org).
Рекомендація:
48. Перед початком терапії із застосуванням ПППД слід розглянути можливість виникнення взаємодії з рецептурними, безрецептурними лікарськими засобами і препаратами рослинного походження (клас 1, рівень C).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.5. ПРОТИПОКАЗАННЯ
10.5.1. ВАГІТНІСТЬ ТА РИЗИК ВАГІТНОСТІ
Немає досліджень про вплив противірусної терапії на вагітність жінки. Дослідження на тваринах показали, що РБВ у набагато нижчій від рекомендованої дози, порівняно з людиною, викликає вади розвитку плода. Частота і тяжкість тератогенного ефекту збільшуються з підвищенням дози РБВ. Виживання плода і потомства знижується [163]. Подальші дослідження на тваринах показали відхилення в спермі [163].
Даних про застосування Пег-ІФН у вагітних жінок немає, і невідомо, чи виводяться Пег-ІФН або РБВ з організму через жіноче молоко.
- Пег-ІФН і РБВ не повинні призначатися вагітним жінкам.
- Лікування Пег-ІФН і РБВ не повинно починатися до моменту виключення ймовірності наявної вагітності.
- Пари, в яких один з партнерів отримує Пег-ІФН і РБВ, повинні використовувати дві форми контрацепції впродовж лікування і ще 6 місяців після завершення терапії.
10.5.2. ПАЦІЄНТИ З НИРКОВОЮ НЕДОСТАТНІСТЮ
Рибавірин викликає залежну від дози гемолітичну анемію, а ступінь гемолізу залежить від тяжкості ниркової недостатності [164]. Може розглядатися лікування Пег-ІФН як монотерапія в дозі 135 мкг підшкірно на тиждень у пацієнтів, які перебувають на гемодіалізі, але такі пацієнти потребують ретельного спостереження [165].
D Пацієнти з ХГС та нирковою недостатністю можуть отримувати лікування ІФН як монотерапію з ретельним моніторингом.
10.5.3. ПАЦІЄНТИ З ПСИХІЧНИМИ РОЗЛАДАМИ
Пацієнти з проблемами психічного здоров’я мають хорошу відповідь на терапію ІФН і РБВ, але необхідно ретельно спостерігати за їх психічними симптомами, особливо у перші чотири тижні лікування [166, 167].
В У пацієнтів зі стійкими психічними проблемами не повинно виключатися лікування ХГС.
В У пацієнтів із психічними розладами необхідно забезпечити моніторинг їх психічних симптомів до початку і під час лікування ІФН.
- При необхідності слід розглядати проведення офіційної психіатричної оцінки.
10.5.4. ПАЦІЄНТИ, ЯКІ ПРИЙМАЮТЬ ІНШІ ЛІКИ
ІП (ТЛП і БЦП) є як інгібіторами, так і субстратами метаболізуючого ферменту цитохрому Р450 (CYP) 3А4. Одночасне введення ТЛП або БЦП з ліками, які метаболізуються цим ферментом, може призвести до клінічно значущих і, можливо, небезпечних для життя лікарських взаємодій. У зв’язку з потенційною можливістю токсичності та/або субоптимального лікування особливу увагу слід приділяти вивченню повної історії застосування ліків у всіх пацієнтів (включаючи призначені ліки, засоби, що відпускаються без рецепта, трав’яні та/або заборонені препарати) [134, 168]. Необхідно здійснити оцінку, щоб гарантувати, що одночасне введення не призведе до будь-яких клінічно значущих змін у метаболізмі ліків. Як до основних джерел інформації слід звертатися до довідкових матеріалів, таких як короткі характеристики препарату і вебсайт Університету гепатиту С Ліверпуля щодо взаємодії препаратів [169]. Проте всі можливі джерела достовірної інформації повинні бути використані для запобігання проблем з лікарських взаємодій. У пацієнтів зі складними схемами лікування слід розглянути направлення до спеціаліста-фармацевта, щоб урахувати всі складні взаємодії адекватно. Провайдери первинної медичної допомоги повинні бути попереджені про можливість взаємодії, повідомляючи результати оглядів лікарських засобів. У пацієнтів, у яких призначені та заборонені препарати протипоказані одночасно з ІП, лікування із застосуванням Пег-ІФН і РБВ повинно проводитися тільки після консультації з місцевою мультидисциплінарною командою [134].
Слід дотримуватися обережності при одночасному призначенні ІП з препаратами, які пролонгують інтервал QT. Інформація з призначення окремих препаратів забезпечує інструкцію з моніторингу електрокардіограми. Можуть бути залучені інші механізми метаболізму ліків, але ще не визначені, і консультантам слід бути пильними. При одночасному призначенні інших ліків необхідно дотримуватися обережності і здійснювати ретельний моніторинг.
D У пацієнтів слід взяти повну історію застосування лікарських засобів, у тому числі призначених, тих, що відпускаються без рецепта, і заборонених препаратів.
D Одночасне введення будь-яких ліків повинно бути оцінене для забезпечення відсутності неприйнятної потенційної токсичності або субоптимальної ефективності кожного засобу.
- Пацієнти зі складною поліпрагмазією можуть отримати користь від консультації зі спеціалістом-фармацевтом.
- Пацієнти повинні бути поінформовані про потенційно небезпечні взаємодії між ліками, які відпускаються без рецепта, забороненими препаратами і лікуванням гепатиту С, навіть якщо не відомо, що вони вживають заборонені препарати.
An update on the management of chronic hepatitis C: Consensus guidelines from the Canadian Association for the Study of the Liver (2012):
/173.jpg)
10.6. ВЕДЕННЯ ПОБІЧНИХ ЕФЕКТІВ
10.6.1. ГРИПОПОДІБНІ СИМПТОМИ
Практично всі пацієнти, які приймають Пег-ІФН і РБВ, мають грипоподібні симптоми, такі як лихоманка, м’язові болі, озноб, біль у суглобах і головний біль. Ці симптоми, як правило, полегшуються після першого місяця лікування [170]. Прості втручання, такі як застосування парацетамолу, більше споживання рідини та відпочинок, можуть мінімізувати ці ефекти [170, 171]. 4
D Пацієнти, у яких спостерігаються грипоподібні побічні ефекти внаслідок прийому Пег-ІФН і РБВ, можуть приймати парацетамол відповідно до інструкцій виробника.
D Пацієнтам необхідно рекомендувати підтримувати відповідний рівень споживання рідини впродовж лікування Пег-ІФН і РБВ.
D Пацієнтам необхідно рекомендувати узгодити свої ін’єкції Пег-ІФН і РБВ з періодами зниженої активності, наприклад, вихідні або свята.
10.6.2. АНЕМІЯ ТА НЕЙТРОПЕНІЯ
У клінічних випробуваннях застосування еритропоетину у пацієнтів, у яких розвинулася анемія (рівень гемоглобіну < 120 г/л) впродовж прийому Пег-ІФН і РБВ, поліпшили показники анемії і зменшили необхідність зниження дози РБВ. Окрім того, поліпшилася якість життя [172, 173]. Немає прямих доказів того, що це призводить до збільшення СВВ. Жоден еритропоетин у даний час не ліцензований для такого призначення. 1+
Рівень гемоглобіну повинен підтримуватися на рівні, що не допускає необхідності зниження дози або припинення застосування Пег-ІФН і РБВ, оскільки це може призвести до зниження СВВ [174]. Майже у третини пацієнтів, які отримували комбіновану терапію, розвивається анемія, і в 13 % зниження гемоглобіну менше ніж до 100 г/л. З додаванням ІП до лікування Пег-ІФН і РБВ анемія може бути частіше і серйозніше, що спостерігається в перші кілька тижнів лікування [174]. РКД порівнювало застосування еритропоетину як терапії першої лінії для підтримки гемоглобіну зі зниженням дози РБВ у пацієнтів, які отримують БЦП. Воно показало, що зниження дози РБВ підтримувало рівень гемоглобіну і забезпечувало аналогічну СВВ (71 %) у пацієнтів, лікування яких було доповнено еритропоетином. Цей висновок був підтверджений у пацієнтів із цирозом [175] і в третій фазі випробування із застосуванням ТЛП у схемах потрійної терапії [176].
Гранулоцитарний колонієстимулюючий фактор може полегшити медикаментозну нейтропенію у пацієнтів, які отримували Пег-ІФН і РБВ. Найчастіше він необхідний пацієнтам, які отримують противірусну терапію після трансплантації печінки [177]. 3
В Необхідно розглядати можливість призначення еритропоетину у пацієнтів із ХГС, які приймають Пег-ІФН і РБВ, і в яких розвинулася анемія, щоб запобігти відміні або зниженню дози РБВ.
В У пацієнтів, які отримували ІП поєднано з Пег-ІФН і РБВ, слід розглянути зниження дози РБВ як альтернативи до додавання EП для контролю анемії.
D Гранулоцитарний колонієстимулюючий фактор має розглядатися окремо у кожного пацієнта, в якого розвинулася значна нейтропенія впродовж лікування ХГС Пег-ІФН та РБВ, щоб запобігти відміні або зниженню дози Пег-ІФН.
10.6.3. ДЕПРЕСІЯ
Депресія є частим побічним ефектом Пег-ІФН і РБВ як у пацієнтів із попередньою депресією, так і у пацієнтів без такої [178]. Антидепресанти можуть успішно застосовуватися при депресії, пов’язаній з лікуванням, як превентивний захід перед початком противірусного лікування [166, 179].
В Всі пацієнти, які отримують Пег-ІФН та РБВ, мають проходити моніторинг на ознаки депресії перед курсом лікування, впродовж його та одразу після нього.
В Пацієнти, які отримували лікування Пег-ІФН і РБВ, з депресією в анамнезі, повинні розглядатися на лікування антидепресантами та направлятися до спеціаліста, якщо в цьому є потреба.
- Для моніторингу стану депресії слід використовувати затверджений інструмент оцінки (наприклад, шкала госпітальної депресії та неспокою).
10.6.4. ШКІРНІ РЕАКЦІЇ
Тяжкі шкірні реакції впродовж прийому Пег-ІФН або РБВ зустрічаються рідко, але сухість шкіри, свербіж і дифузні екзематозні ураження зустрічаються приблизно у 20 % пацієнтів [170]. Може також посилюватися псоріаз. Реакції в місці ін’єкції виникають у більше ніж 50 % пролікованих пацієнтів [171]. Ураження шкіри з’являються найчастіше на кінцівках і ділянці голови та шиї, що свідчить про попереднє сонячне опромінення відкритих сонцю частин тіла [180]. Пацієнти добре відповідають на антигістамінні препарати, пом’якшуючі препарати та стероїди місцевої дії, що дозволяє продовжити лікування [180]. Показник припинення лікування через дерматологічні побічні ефекти становить приблизно 34 % [181]. 4
Три РКД повідомили про потенційно смертельний висип, один із головних побічних ефектів лікування ТЛП. Він призводить до припинення ТЛП у 5–7 % пацієнтів. Як тільки ліки припиняються, висип зникає (хоча це може зайняти кілька тижнів). Висип переважно екзематозний і сверблячий. У п’ятдесяти відсотків пацієнтів розвивається висип впродовж перших чотирьох тижнів лікування, хоча він може виникнути в будь-який час. Раннє втручання із застосуванням стероїдів місцевої дії зменшує вираженість висипів. Рідко ТЛП асоціювався з реакцією на препарати з еозинофілією і системними симптомами або синдромом тяжких шкірних побічних реакцій на препарати, які включають синдром Стівенса — Джонсона і токсичний епідермальний некроліз, які повинні виявлятися і, якщо виявлені, терапію слід припинити [182–184].
D Всі пацієнти, які отримують Пег-ІФН і РБВ, мають отримати рекомендації щодо відповідної гігієни шкіри та її зволоження.
D Пацієнтам необхідно рекомендувати утримуватися від перебування на сонці.
D Пацієнтам необхідно рекомендувати чергувати місця ін’єкцій препаратів.
D Використання пом’якшуючих засобів та відповідних кортикостероїдів може розглядатися як варіант при неспецифічних висипаннях.
А Пацієнти, які приймають ТЛП, повинні ретельно стежити за висипами, і лікувальні центри повинні мати план ведення висипів.
- Застосування антигістамінних препаратів можна розглядати при свербежу.
- Пацієнти з тяжкими дерматологічними реакціями і ті, хто не відповів на лікування першої лінії, повинні направлятися до спеціаліста для дерматологічної оцінки.
- Пацієнти, які приймають ТЛП, повинні негайно оцінюватися на тяжкість відповідно до відсотка ураженої площі поверхні тіла і наявності системних симптомів.
- Пацієнтів з висипами або з проблемами шкіри в анамнезі слід розглядати на лікування БЦП, а не ТЛП.
10.6.5. ДИСФУНКЦІЯ ЩИТОПОДІБНОЇ ЗАЛОЗИ
У шести відсотків пацієнтів впродовж лікування ІФН розвиваються дисфункції щитоподібної залози (як гіпотиреоз, так і гіпертиреоз) [150]. Жінки мають вищий ризик, особливо ті, хто має автоантитіла перед початком лікування [185]. ІФН-терапія пов’язана з індукцією та підвищенням автоімунних процесів у щитоподібній залозі [186, 187]. Автоантитіла перед початком лікування не є універсальним прогнозом дисфункції щитоподібної залози впродовж лікування [170].
D Базовий моніторинг функції щитоподібної залози має проводитися перед початком терапії ІФН, на 12-му тижні лікування та у будь-який момент, коли виникає підозра щодо дисфункції щитоподібної залози.
- Пацієнтів, у яких розвивається дисфункція щитоподібної залози, слід направляти на консультацію до ендокринолога.
10.6.6. ВТРАТА МАСИ
ХГС призводить до прискорення основного метаболізму у пацієнтів без цирозу [188]. Втрата маси, зазвичай, спостерігається у пацієнтів на противірусному лікуванні [170, 171, 189]. Дієтотерапія у пацієнтів з ВГС обговорюється в розд. 12.1.
10.6.7. ДИСПНОЕ
Диспное рідко спостерігається як побічний ефект лікування Пег-ІФН і РБВ. Диспное може статися в результаті лікування анемії, але також може бути викликано більш серйозними серцево-судинними і респіраторними захворюваннями [170, 171, 190].
D Пацієнти, які лікуються Пег-ІФН та РБВ, у яких спостерігається диспное, не пов’язане з анемією, мають негайно пройти медичне обстеження на виявлення серцево-легеневих захворювань.
10.6.8. РЕТИНОПАТІЯ
Ретинопатія в період лікування ІФН є поширеним явищем, але, як правило, має м’яку форму і швидко минає. Зникає спонтанно після припинення лікування ІФН, рідко потребує лікування. Довгострокові наслідки невідомі [191]. Пацієнти з гіпертонією або діабетом схильні до більшого ризику розвитку ретинопатії [171]. Інші наслідки з офтальмологічної сторони є рідкістю.
D Пацієнти з ХГС і гіпертонією або діабетом повинні пройти офтальмологічне обстеження до початку лікування, звертаючи особливу увагу на схожі на вату плями і крововилив у сітківку.
D Будь-який пацієнт, який скаржиться на порушення зору впродовж лікування, має бути оглянутий офтальмологом.
D Прийом ІФН необхідно припинити, поки у пацієнта з порушенням зору не зникнуть ці порушення або поки офтальмолог не підтвердить відсутність ураження сітківки.
10.6.9. АЛОПЕЦІЯ
Алопеція — це доволі поширене побічне явище впродовж прийому ІФН та РБВ. Після припинення лікування волосся відростає знову [170, 171].
D Пацієнтам необхідно повідомити, що після припинення лікування волосся відросте знову.
10.6.10. ІНШІ ПОБІЧНІ ЕФЕКТИ
Інші побічні ефекти включають безсоння, зниження концентрації, захворювання порожнини рота, анальний/ректальний дискомфорт, шлунково-кишкові проблеми, зміни смаку, нудоту, симптоми абстиненції після лікування. Не виявлено доказів щодо ефективного їх усунення.
Втома є одним із найбільш частих побічних ефектів лікування ІФН або РБВ і може бути багатофакторною в зв’язку з анемією, гіпотиреозом, порушенням сну і депресією, що впливають на неї [170, 171]. 4
WHO Guidelines for the screening, care and treatment of persons with hepatitis C infection (2014):
Спостереження за пацієнтами з інфекцією ВГС
Спектр хвороби в осіб, інфікованих вірусом гепатиту С, простягається від м’якого фіброзу до цирозу і ГЦК. Компенсований цироз печінки може прогресувати з часом до декомпенсованого цирозу, що асоціюється з асцитом, варикозним розширенням вен стравоходу і шлунка, і в результаті до печінкової недостатності, ниркової недостатності і сепсису (всі з них є небезпечними для життя). ГЦК також може траплятися серед 2–4 % осіб із цирозом на рік. Діагноз декомпенсованої хвороби печінки ґрунтується на даних як клінічного обстеження, так і лабораторного моніторингу; отже, до початку терапії повинно бути зроблено ретельне медичне обстеження пацієнтів. Стадія хвороби може бути оцінена за допомогою біопсії печінки або за допомогою різних неінвазивних методів. Вони обговорюються в подальших розділах.
Важливо визначити стадію ВГС, оскільки це призводить до ідентифікації пацієнтів з прогресуючою хворобою, групи, яка вимагає посиленого моніторингу та пріоритетів щодо лікування до настання декомпенсованого цирозу печінки. У багатьох країнах з високим середнім рівнем доходу всі особи з хронічною інфекцією ВГС, які не мають протипоказань до лікування, розглядаються придатними для лікування (хоча багато осіб з легкою — помірною хворобою можуть приймати рішення чекати нових, менш токсичних і більш ефективних ліків). У країнах із низьким і середнім рівнем доходів, де доступ до лікування обмежений, стадія фіброзу може бути використана для пріоритетного лікування пацієнтів із більш пізніми стадіями хвороби (наприклад, пацієнти з цирозом печінки або з фіброзом ≥ F2).
У пацієнтів, інфікованих вірусом гепатиту С, часто існує інша супутня патологія, така як гепатит В, ВІЛ, туберкульоз та вживання психоактивних речовин. Пов’язана настанова ВООЗ для СІН і для ВІЛ-інфікованих. Надмірне споживання алкоголю, що поширено в деяких інфікованих ВГС-популяціях, може прискорити перебіг хвороби. Настанова ВООЗ щодо зниження споживання алкоголю детально обговорюється в іншій главі.
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
10.7. РЕЦИДИВ ЧИ НЕВДАЛЕ ЛІКУВАННЯ
10.7.1. ІНТЕРФЕРОН ТА РИБАВІРИН
Повторне лікування комбінацією Пег-ІФН і РБВ ефективне у пацієнтів з ХГС, у яких було невдалим лікування непегільованим ІФН з РБВ або без нього, і призводить до СВВ у певної частини пацієнтів. СВВ є найвищою у пацієнтів, які раніше отримували монотерапію непегільованим ІФН, у інфікованих генотипами 2 або 3, у пацієнтів із рецидивами, а не у пацієнтів із відсутністю відповіді на попереднє лікування, і у пацієнтів без цирозу впродовж повторного лікування [192]. 3
Два випробування, які досліджували повторне лікування пацієнтів із генотипом 1 ВГС, у яких лікування було раніше невдалим, показали, що існує значна користь від повторного лікування Пег-ІФН і РБВ з додаванням ІП [134]. При потрійній терапії з ТЛП загальна СВВ була 64 % (без підготовки), 66 % (з чотиритижневою підготовкою) і 17 % у контрольній групі подвійної терапії, різниця в 47 % (95% ДІ від 37 до 57, р < 0,001) і 50 % (95% ДІ від 40 до 60, р < 0,001) між потрійною терапією та контрольною групою була значущою [193]. Для потрійної терапії БЦП загальна СВВ була 59 % (32 тижні потрійної терапії), 66 % (44 тижні потрійної терапії ) і 21 % у контрольній групі. Різниця на 38 % (95% ДІ від 25,7 до 49,1, р < 0,001) і 45 % (95% ДІ від 33,7 до 56,8, р = 0,001) між потрійною терапією та контрольною групою була значущою [194]. 1+
D Пацієнти з ХГС, у кого було неуспішне лікування непегільованим ІФН та РБВ, мають розглядатися на повторне лікування Пег-ІФН та РБВ.
А Пацієнти з ХГС генотипу 1, у яких було невдале будь-яке лікування, повинні розглядатися на застосування основної схеми ІП.
- Пацієнти з генотипом 2 або 3 ХГС, яким застосовували субоптимальну терапію, можуть розглядатися на повторне лікування Пег-ІФН і РБВ впродовж 48 тижнів.
An Update on Treatment of Genotype 1 Chronic Hepatitis C Virus Infection: 2011 Practice Guideline by the American Association for the Study of Liver Diseases (AASLD):
Для раніше лікованих хворих:
1. Повторне лікування БЦП або ТЛП разом із Пег-ІФН-α і РБВ на основі маси може бути рекомендоване для хворих із вірусологічним рецидивом або частковою відповіддю після попереднього курсу лікування зі стандартним ІФН-альфа чи Пег-ІФН-α і/або РБВ (клас 1, рівень А).
2. Повторне лікування ТЛП разом із Пег-ІФН-α і РБВ на основі маси може розглядатися для пацієнтів із відсутньою відповіддю на курс стандартного ІФН альфа чи Пег-ІФН-α та/або РБВ на основі маси (клас 2b, рівень В).
3. Терапія на основі відповіді раніше лікованих пацієнтів з використанням режимів на основі БЦП або ТЛП може розглядатися для пацієнтів з рецидивом (клас 2a, рівень B для БЦП; клас 2b, рівень С для ТЛП), може розглядатися для пацієнтів із частковою відповіддю (клас 2b, рівень B для БЦП клас 3, рівень С для ТЛП), але не може бути рекомендована для пацієнтів без відповіді на лікування (клас 3, рівень С).
4. Пацієнти, в яких після повторного лікування БЦП + Пег-ІФН-α і РБВ продовжує утримуватися РНК ВГС > 100 МО на 12-му тижні, повинні припинити лікування через високу ймовірність розвитку стійкості до противірусних препаратів (клас 1, рівень В).
5. Пацієнти, в яких після повторного лікування ТЛП + Пег-ІФН-α і РБВ продовжує утримуватися РНК ВГС > 1000 МО на 4-му або 12-му тижні, повинні припинити лікування через високу ймовірність розвитку стійкості до противірусних препаратів (клас 1, рівень В).
10.8. МОНІТОРИНГ ЗА ПАЦІЄНТАМИ, ЯКІ НЕ ОТРИМУЮТЬ ЛІКУВАННЯ
10.8.1. КЛІНІЧНИЙ ОГЛЯД
Жодних доказів не було виявлено щодо ефективної практики моніторингу та консультування пацієнтів, які не є кандидатами на лікування або які пройшли неуспішне лікування.
- Необхідно заохочувати пацієнтів продовжувати спостереження в клініках з метою моніторингу стану здоров’я, обговорення нових схем лікування, якщо вони з’являються.
- Пацієнтам необхідно мати доступ до консультування та послуг спеціалізованої медсестри для надання підтримки з питань, що стосуються життя з гепатитом С.
10.8.2. РОЛЬ БІОПСІЇ ПЕЧІНКИ
Рутинна біопсія печінки протягом або після противірусного лікування не призначається, якщо не потрібна певна конкретна інформація щодо окремих пацієнтів [101]. 1–
ХІ. ЛІКУВАННЯ ІНФЕКЦІЇ, ЩО ПРОГРЕСУЄ
11.1. ПРОТИВІРУСНА ТЕРАПІЯ
11.1.1. ПАЦІЄНТИ З ЦИРОЗОМ
Пацієнти з цирозом поділяються на пацієнтів із компенсованим та декомпенсованим цирозом. Пацієнти з декомпенсацією мають погіршення з розвитком одного або більше ускладнень: жовтяниця, асцит, варикозні кровотечі або енцефалопатія.
Є кілька великих добре проведених РКД з ІФН і РБВ, Пег-ІФН з РБВ, монотерапії Пег-ІФН у пацієнтів із ХГС, які мають високу ймовірність прогресування до термінальної стадії хвороби печінки [122, 123, 195, 196]. Підгрупи в рамках цих досліджень мали цироз або запущений фіброз. Рандомізація розподілила їх рівномірно між інтервенціями, так що аналіз підгруп був можливий. Виявилося, що терапія не була більш токсичною для пацієнтів із цирозом печінки порівняно з пацієнтами без цирозу печінки, але була менш ефективною. СВВ були досягнуті у 50–70 % для генотипу 2 і 3 і у 20–30 % для генотипу 1. Подальший систематичний огляд пацієнтів із цирозом підтвердив зниження ризику ГЦК у тих, хто досягнув СВВ (ВР 0,25, 95% ДІ від 0,14 до 0,46, р = 0,00001) [97]. 1+
Хоча і покращені порівняно з попереднім лікуванням показники СВВ скоріше за все залишаться низькими у пацієнтів із цирозом печінки, які раніше не відповіли, особливо в контексті поганої відповіді, на початкове лікування Пег-ІФН і РБВ. Лікування цих пацієнтів з ІП, імовірно, також збільшить розвиток медикаментозно резистентних мутантів, що потенційно ставить під загрозу майбутнє використання противірусних препаратів прямої дії. Таким чином, необхідно приділити серйозну увагу найкращому варіанту лікування для цієї групи. У хворих із вираженим фіброзом або цирозом є незначні тенденції до поліпшення показників СВВ із терапією фіксованої тривалості, але в даний час недостатньо доказів для використання терапії залежно від відповіді у пацієнтів із цирозом [134]. Подальші дослідження ефективності ІП у хворих із цирозом принесли б користь, оскільки основні випробування ТЛП виключають пацієнтів з кількістю тромбоцитів < 90 000/мм3 [133].
Прямих порівняльних досліджень різних Пег-ІФН виявлено не було. Довготривала терапія для пацієнтів із цирозом у даний момент досліджується, але наразі результати не опубліковано.
A Пацієнти з компенсованим цирозом мають розглядатися як кандидати на терапію, якщо не мають протипоказань.
Лікування щотижневими низькими дозами Пег-ІФН у пацієнтів із цирозом печінки не показало суттєвої різниці в уповільненні прогресування захворювання або зменшенні клінічних результатів порівняно з пацієнтами, які не отримували лікування. Не було ніяких відмінностей у розвитку ГЦК, декомпенсації або трансплантації [198, 199]. 1++
Одне РКД показало зниження загальної смертності і неонкологічної захворюваності впродовж 48 тижнів ескалації монотерапії Пег-ІФН у переважно лікованих раніше пацієнтів із цирозом печінки, проте це дослідження було недостатньо підтримане і поки що не відтворюється іншими дослідниками [200].Проспективний заданий субаналіз в іншому РКД пацієнтів із портальною гіпертензією показав, що Пег-ІФН затримує суттєві випадки портальної гіпертензії, такі як варикозна кровотеча [201].
A Пацієнти з компенсованим цирозом ВГС можуть отримати перевагу від лікування ІФН у зниженні ризику розвитку ХГС. Тривалість терапії для досягнення такого ефекту не визначена.
Для надання рекомендацій з лікування пацієнтів із ВГС та декомпенсованим цирозом недостатньо доказового матеріалу.
11.1.2. ПАЦІЄНТИ, ЯКІ НАПРАВЛЯЮТЬСЯ НА ТРАНСПЛАНТАЦІЮ ПЕЧІНКИ
Кілька досліджень вже окреслювали переваги противірусної терапії в період до або після ортотопічної трансплантації печінки [177, 202–205]. У період перед трансплантацією багатьох пацієнтів знімають з лікування через протипоказання. Показники СВВ низькі. Існує мало доказів для лікування в перитрансплантатному періоді (період безпосередньо до, впродовж і після трансплантації). Після трансплантації терапія переноситься погано, що обумовлено анемією і лейкопенією, але здається безпечною з точки зору відторгнення трансплантата. У тих пацієнтів, які можуть витримати повну дозу терапії, досягається високий показник СВВ.
D Пацієнти, яким планується трансплантація, не повинні отримувати противірусну терапію у передтрансплантаційний або перитрансплантаційний періоди, окрім випадків клінічних випробувань.
D Для досягнення кліренсу ВГС у випадках повторного захворювання печінки, що пов’язане з ВГС, необхідно розглядати призначення пацієнтам противірусної терапії у посттрансплантаційному періоді.
11.2. ТРАНСПЛАНТАЦІЯ ПЕЧІНКИ
У ранніх дослідженнях серед пацієнтів, яким було трансплантовано печінку через ВГС, цироз, 5- і 10-річний показник виживання був еквівалентний пацієнтам, які перенесли ортотопічну трансплантацію печінки через причини, не пов’язані з ВГС (68 і 60 %) [205]. У нещодавньо-му аналізі Об’єднаної мережі з обміну органами було проведено дослідження баз даних щодо ВГС-позитивних (n = 5640, 43 %) і ВГС-негативних реципієнтів (n = 7386, 56,7 %). У ВГС-негативних і ВГС-позитивних реципієнтів п’ятирічні показники виживання пацієнтів становили 83,5 % проти 74,6 % (p < 0,00001), а п’ятирічні показники життєздатності трансплантата — 80,6 проти 69,9 % (р < 0,00001) відповідно. ВГС-інфекція знижує результати після трансплантації, але цей ефект не є достатнім, щоб відмовити окремому пацієнту у трансплантації [206].
Пацієнти з ВГС та ГЦК, що дозволяє трансплантацію (один осередок < 5 см або менше трьох осередків < 3 см, на поперечному перерізі зображення), не мають зниження виживаності до 48 місяців після ортотопічної трансплантації печінки порівняно з пацієнтами, які мають лише ВГС [205, 207[. 2+
Якість життя пацієнтів після ортотопічної трансплантації печінки для ВГС є еквівалентним до пацієнтів, які не мають ВГС на етапі 3 років [208]. 3
C Пацієнтам із гепатитом С та одночасною операбельною ГЦК мають запропонувати трансплантацію печінки.
C Пацієнтам із ВГС-асоційованою хворобою печінки необхідно пропонувати трансплантацію печінки
Досліджень щодо ефективності ретрансплантації у пацієнтів із відторгненням через повторне виникнення ВГС не виявлено.
11.3. СКРИНІНГ НА ГЕПАТОЦЕЛЮЛЯРНУ КАРЦИНОМУ (ГЦК)
Результати досліджень з оцінки чутливості і специфічності сироватки α-фетопротеїну для виявлення ГЦК у пацієнтів із ВГС показують, що інтерпретація окремо взятого цього маркера має обмежену інформаційну цінність. 1+
Щорічне ультразвукове дослідження пацієнтів із цирозом і ВГС не виявляє пухлини на тій стадії, що дозволяє вірогідний лікувальний ефект [210]. Сканування раз на шість місяців може допомогти у виявленні пухлин на тій стадії, що дозволяє отримати лікувальний ефект від терапії [211]. 2+
Інші методи скринінгу та нагляду, окрім α-фетопротеїну та ультразвукового дослідження, залишаються експериментальними.
Показник розвитку ГЦК у пацієнтів із ВГС, які не мають цирозу, є дуже низьким (7,6 % проти 92,4 %) [212]. 2+
A Вимірювання α-фетопротеїну має проводитися ізольовано для скринінгу або нагляду за розвитком ГЦК у пацієнтів із гепатитом С.
D Нагляд із використання УЗД має проводитися з інтервалами у 6 місяців.
C Нагляд має охоплювати пацієнтів із цирозом.
AASLD Practice Guideline. Management of Hepatocellular Carcinoma: An Update (2011):
Роль АФП у діагностиці
Альфа-фетопротеїн вже давно використовується для діагностики ГЦК. Окрім того, він був частиною алгоритмів спостереження. Однак, як описано вище, АФП недостатньо чутливий або специфічний для використання як спостережний аналіз. Останні дані також показують, що його використання як діагностичного тесту менш специфічне, ніж колись вважалось. АФП може бути підвищений при внутрішньопечінковій холангіокарциномі (ВХК) і при деяких метастазах раку товстої кишки [167, 168].
Таким чином, наявність вогнищевого утворення в печінці у пацієнтів із підвищеним АФП не свідчить про ГЦК. ВХК також більш поширена при цирозі печінки, ніж у пацієнтів без цирозу.
Хоча поширеність ВХК значно нижча, ніж ГЦК, той факт, що обидві злоякісні пухлини є більш поширеними при цирозі, означає, що необхідно з обережністю розрізняти їх, аби врахувати відмінності у лікуванні та результати. Оскільки АФП може бути підвищений при обох станах, рекомендується, щоб він більше не використовувався. Таким чином, діагноз ГЦК має спиратися на радіологічні ознаки та гістологію.
Рекомендація EASL-EORTC для клінічної практики: лікування гепатоцелюлярної карциноми (2011):
Епідеміологія
Онкологічна захворюваність зростає в усьому світі. Щорічно реєструється 10,9 млн нових випадків раку та 6,7 млн зумовлених ним смертей. Найчастіше діагностують рак легені, молочної залози і товстої кишки, серед причин онкологічної смерті лідирує рак легенів, шлунка та печінки [3, 4]. Рак печінки посідає 6-те місце у структурі онкологічної захворюваності (749 000 нових випадків) і 3-тє місце у структурі онкологічної смертності (692 000 випадків) і становить 7 % усіх випадків раку [4]. На ГЦК припадає понад 90 % первинних ракових пухлин печінки, що становить велику проблему охорони здоров’я в усьому світі.
Захворюваність на ГЦК зростає з віком у всіх країнах, досягаючи піку до 70 років [5]. У Китаї та серед чорношкірого населення Африки середній вік хворих значно менший. У Японії, навпаки, найбільша захворюваність відзначається серед чоловіків віком 70–79 років [6]. Захворюваність на ГЦК істотно вища в чоловіків (за оцінками, у 2,4 раза вища, ніж у жінок) [4].
Захворюваність на ГЦК має чіткі географічні особливості: вона є найвищою в Східній Азії, країнах Африки південніше Сахари і Меланезії, на які припадає близько 85 % всіх випадків ГЦК [3, 4]. У розвинених регіонах захворюваність низька, окрім Південної Європи, де у чоловіків захворюваність істотно вища, ніж в інших розвинених регіонах (стандартизована за віком захворюваність 10,5 випадка на 100 000 населення) [7].
У світі спостерігається зростання захворюваності на ГЦК. Зокрема, у 2008 р. захворюваність і смертність у Європі становили 65 000 і 60 240 випадків, а у США — 21 000 і 18 400 випадків відповідно. За оцінками, у 2020 році ці показники досягнуть 78 000 і 27 000 відповідно [4]. Поточне зростання захворюваності зумовлене розвитком ГЦК у людей, які інфікувалися ВГС в 1940–1960-ті роки в Європі і десятиліттям пізніше у США. У країнах Європи захворюваність і смертність неоднорідні. Останніми десятиліттями спостерігається зростання смертності від ГЦК у чоловіків у більшості країн (Австрії, Данії, Німеччині, Греції, Ірландії, Португалії, Норвегії, Іспанії, Швейцарії, Великій Британії), але в деяких — знижується (Фінляндії, Франції, Італії, Нідерландах, Швеції) [7]. У США число смертей від ГЦК за 1990–2004 рр. збільшилося приблизно на 40 %, при тому що загальна смертність від раку за той же період знизилася приблизно на 18 % [8]. Це пов’язано не тільки з ВГС, але й зі зростанням частоти ГЦК на фоні ВГВ, особливо серед іммігрантів з ендемічних країн. В Японії, в якій зв’язок ГЦК із ВГС вперше було відзначено після Другої світової війни, з 1990 р. спостерігається помітне зниження захворюваності на ГЦК [6]. В ендемічних країнах частота випадків ГЦК, пов’язаних із ВГВ, знижується після введення обов’язкової вакцинації дітей проти ВГВ. Така картина спостерігається серед тайванських дітей, очікується, що вона стане ще більш явною, коли вакциновані діти досягнуть дорослого віку [9].
Скринінг
Скринінг передбачає періодичне обстеження осіб із групи ризику щодо певного захворювання. Користь і здійсненність скринінгу залежать від кількох чинників, включно із захворюваністю в обстежуваній популяції, доступністю ефективних діагностичних тестів за прийнятною ціною та його придатністю в цільової популяції, а також доступністю та ефективністю лікування [46]. Мета скринінгу — знизити пов’язану із захворюванням смертність. Зазвичай це досягається за рахунок ранньої діагностики, що дозволяє застосувати радикальні й економічно ефективні методи лікування. Однак основною метою і, відповідно, основним оцінюваним показником повинно бути збільшення виживання, а не такий сурогатний показник, як стадія хвороби.
ГЦК належить до захворювань, яким скринінг показаний самою їхньою природою, тому що групи ризику — пацієнти з вірусним гепатитом або іншими захворюваннями печінки — легко виявляються. Насправді в західних країнах майже в 90 % випадків ГЦК розвивається на фоні цирозу печінки [47], а цироз сам по собі є прогресуючим захворюванням, що скорочує тривалість життя. Цироз впливає на вибір і результати протипухлинного лікування, тому рання діагностика ГЦК набуває ще більшого значення. Окрім того, багато методів лікування можуть викликати ускладнення цирозу, тому в деяких випадках не можна точно встановити причину смерті: ГЦК або первинне захворювання печінки. У зв’язку з цим зниження загальної смертності — більш правильний показник для оцінки ефективності скринінгу.
• Упровадження програм скринінгу ГЦК для груп ризику і виявлення біомаркерів ранньої стадії захворювання — важливі завдання суспільної охорони здоров’я у зниженні пов’язаної з ГЦК смертності (результати 1D; рекомендація 1B). Ці завдання повинні бути в центрі уваги державних органів охорони здоров’я та дослідницьких центрів.
• Пацієнтів з високим ризиком ГЦК слід включати до програм скринінгу. Групи ризику вказано в табл. 3 (результати 1B/3A; рекомендація 1A/B).
• Скринінг повинен проводитися в усіх групах ризику досвідченими фахівцями за допомогою абдомінального УЗД кожні 6 міс. (результати 2D; рекомендація 1B).
Виняток: у таких випадках рекомендується менший інтервал між обстеженнями (3–4 міс.): 1) виявлено вузол діаметром менш ніж 1 см (див. обстеження в динаміці); 2) проведено резекцію або локорегіональну терапію (результати 3D; рекомендація 2B).
• Необхідно знайти точні біомаркери для виявлення ранньої стадії ГЦК. За наявними результатами, вивчені біомаркери [такі як α-фетопротеїн (АФП, АФП-L3) і дез-γ-карбоксипротромбін (ДКП)] для клінічної практики недостатньо інформативні (результати 2D; рекомендація 2B).
• Скринінг на ГЦК обов’язковий для пацієнтів, які очікують трансплантації печінки, щоб виявити і контролювати прогресування пухлини і допомогти у виборі пріоритетів для трансплантації (результати 3D; рекомендація 1B).
Цільові групи
Пацієнти із цирозом печінки
Аналіз моделей економічної ефективності та прийняття рішень показав, що втручання вважається економічно ефективним, якщо дозволяє продовжити очікувану тривалість життя не менш ніж на 3 міс. при витратах менш ніж 50 000 доларів США на рік на 1 рік збереженого життя [48]. Дослідження економічної ефективності показали, що при захворюваності 1,5 % на рік і вище періодичне обстеження пацієнтів із цирозом печінки на ГЦК економічно ефективне [49] незалежно від причини цирозу [10, 17, 50, 51]. Якщо виявити пацієнтів із цирозом, у яких ризик ГЦК низький [52–54], і виключити їх зі скринінгу, можна скоротити витрати, проте виправданість такого підходу поки що не доведено. З іншого боку, при тяжкому цирозі (клас С за Чайлдом — П’ю) курабельні методи лікування практично не застосовані, тому скринінг у таких пацієнтів економічно неефективний [1, 55]. Виняток складають пацієнти, включені до списку очікування трансплантації печінки, у яких скринінг ГЦК повинен проводитися незалежно від функції печінки, щоб виявити пухлину, що виходить за рамки допустимих критеріїв, і визначити пріоритети для трансплантації. Нарешті, хоча інтуїтивно можна припустити, що скринінг після деякого вікового порогу перестає бути економічно ефективним, будь-яких рекомендацій на цей рахунок дати не можна через відсутність результатів.
Пацієнти без цирозу печінки
Хронічний гепатит В підвищує ризик ГЦК навіть за відсутності цирозу. До таких пацієнтів рекомендований поріг захворюваності, після якого скринінг буде доцільним, не застосований. Поріг захворюваності в таких пацієнтів погано визначений, хоча, на думку експертів, скринінг показаний за частоти ГЦК не менше ніж 0,2 % на рік [56, 57]. Для такого сценарію необхідно побудувати модель відношення витрат і користі. Частота ГЦК у дорослих носіїв вірусу гепатиту В з Азії та Африки та осіб із сімейним анамнезом ГЦК є вищою від цих величин, а в західних країнах у пацієнтів із хронічним гепатитом В становить 0,1–0,4 % на рік [58, 59]. Ризик розвитку ГЦК також залежить від вірусного навантаження. В азійських пацієнтів сироватковий рівень ДНК HBV > 10 000 копій/мл пов’язаний із ризиком ГЦК більше ніж 0,2 % на рік [18].
На жаль, інформація щодо частоти ГЦК у хворих на ХГС мізерна і часом суперечлива. За результатами з Японії, у пацієнтів з легким фіброзом захворюваність на ГЦК становить 0,5 % на рік [51]. У нещодавньому дослідженні у США було відзначено, що у хворих на ХГС ГЦК розвивається при мостоподібному фіброзі за відсутності цирозу (Метавір F3) [12]. Оскільки перехід від вираженого фіброзу до цирозу точно визначити не можна, EASL рекомендує проводити скринінг і в пацієнтів із мостоподібним фіброзом [1]. Наша група експертів підтримує таку політику. Щодо цього ультразвукова еластографія є перспективним методом для виділення груп пацієнтів із різним ризиком ГЦК [14, 60].
Відомості щодо частоти ГЦК у пацієнтів із хронічними захворюваннями печінки невірусної етіології без цирозу, такими як неалкогольний і алкогольний стеатогепатит, автоімунний гепатит, спадковий гемохроматоз, дефіцит α1-антитрипсину і хвороба Вільсона, є обмеженими [23–25, 61]. Однак доступні результати говорять про те, що при цих захворюваннях ГЦК зазвичай виникає після розвитку цирозу [1]. Таким чином, у пацієнтів із метаболічним синдромом або з неалкогольним стеатогепатитом, у яких розвивається цироз, повинен проводитися скринінг ГЦК [62], тоді як у хворих без цирозу ризик розвитку ГЦК поки що не встановлений.
Лікований хронічний вірусний гепатит
Останні досягнення противірусної терапії забезпечили відносно високу частоту супресії вірусу у хворих на хронічні гепатити В і С. Успішне лікування, за якого досягається СВВ при ХГС і сероконверсія за HBeAg або стійка супресія ДНК HBV, знижує ризик ГЦК, але не усуває його [63–66]. Скринінг рекомендований пацієнтам із ХГВ, у яких ризик ГЦК зберігається у зв’язку з вихідними чинниками, а також у хворих на ВГС із вираженим фіброзом або цирозом, навіть після досягнення СВВ.
Методи обстеження
Для скринінгу ГЦК застосовують серологічні тести і методи візуалізації. З останніх найбільш широко використовується УЗД, що характеризується прийнятною діагностичною точністю (чутливість 58–89 %, специфічність понад 90 %) [67, 68]. Нещодавній метааналіз 19 досліджень показав, що планове обстеження за допомогою УЗД виявляє більшість ГЦК на доклінічній стадії з середньою чутливістю 94 %. Однак на ранній стадії ГЦК чутливість УЗД становить всього 63 % [69]. Проте в нещодавньому японському когортному дослідженні за участю 1432 пацієнтів ретельне обстеження за допомогою УЗД, виконаного досвідченим фахівцем, виявляло пухлини з середнім розміром 1,6 ± 0,6 см, при цьому пухлини діаметром більше ніж 3 см становили менше 2 % випадків [70].
Широкому застосуванню УЗД також сприяє відсутність ускладнень, неінвазивність, добра переносимість пацієнтами і відносно невисока вартість. Однак в умовах цирозу виявлення ГЦК за допомогою УЗД утруднюється. Цироз печінки характеризується наявністю фіброзних перетинок і регенеративних вузлів. Це створює плямисту картину при УЗД, що утруднює виявлення малих пухлин. Окрім того, успіх УЗД у ранній діагностиці ГЦК значно залежить від досвіду спеціаліста, який його виконує, та якості обладнання. Тому рекомендується спеціальна підготовка фахівців для УЗД печінки. Нещодавно з’явилося УЗД із контрастуванням, однак його вищі діагностичні можливості щодо ГЦК малого розміру не доведені [71].
Результатів на користь застосування для скринінгу мультидетекторної КТ або динамічної МРТ немає. Практичний досвід говорить про те, що через високу частоту хибнопозитивних результатів необхідно багато уточнювальних обстежень, що спричинить великі витрати і буде економічно неефективним. Ці методи виправдані в пацієнтів, які очікують трансплантації печінки, в яких вони можуть бути альтернативою УЗД. Окрім того, їх використання можливе при ожирінні, скупченні газів у кишечнику і деформаціях грудної клітки, що ускладнюють УЗД. Навіть у таких випадках застосування цих методів для довгострокового спостереження ставиться під питання через ризик, пов’язаний із повторним опроміненням при КТ і високою вартістю МРТ. Серологічні тести для ранньої діагностики ГЦК, які проходили дослідження або проходять їх у теперішній час, включають визначення АФП, ДКП, також відомого як протромбін II, індукований відсутністю вітаміну K (PIVKA II), відношення глікованого АФП (фракція L3) до загального АФП, α-фукозидази та гліпікану 3 [12, 72]. АФП — біомаркер ГЦК, який найбільш широко визначається. Відомо, що стабільно високий рівень АФП — фактор ризику ГЦК [73]. Примітно, що АФП в основному визначають у діагностичних цілях, а не для скринінгу. Це важливо, оскільки цінність методу діагностики не дорівнює цінності у скринінгу. Зокрема, як скринінговий метод визначення АФП недостатньо показове. В одному рандомізованому дослідженні [74] і одному популяційному спостережному дослідженні [75] отримано протилежні результати. В останньому наводяться результати на користь визначення АФП у деяких групах або умовах, коли УЗД не завжди доступне [75]. Однак у комбінації з УЗД визначення рівня АФП дозволило додатково виявити всього 6–8 % випадків ГЦК, не помічених при УЗД. Недостатня цінність визначення АФП як скринінгового методу має дві причини. По-перше, коливання рівня АФП у пацієнтів із цирозом можуть бути наслідком активації гепатиту B або С, загострення основного захворювання печінки, а також розвитку ГЦК [76]. По-друге, лише невелика частина пухлин (10–20 %) на ранній стадії супроводжується підвищеним сироватковим рівнем АФП; нещодавно було встановлено зв’язок цього факту з молекулярним підкласом агресивної ГЦК (клас S2, EpCAM+) [77–79]. При визначенні АФП як діагностичного тесту рівень 20 нг/мл показує добру чутливість при низькій специфічності, а рівень 200 нг/мл — високу специфічність при низькій (22 %) чутливості [80].
Усі інші сироваткові маркери, окремо або в комбінації, вивчалися в основному в діагностичних, а не скринінгових цілях. Окрім того, їх діагностична цінність нерідко оцінювалася в умовах, у яких поширеність ГЦК істотно вища за очікувану при скринінгу [81]. Під час скринінгу вимірювання ДКП методами першого покоління не дає значущих переваг порівняно з АФП [82]. Окрім того, рівень ДКП пов’язаний з інвазією пухлини в портальну вену і пізньою стадією пухлини, що перешкоджає його застосуванню як маркера для раннього виявлення ГЦК [82]. Схожа ситуація спостерігається і щодо рівня L3-фракції АФП [83]. У теперішній час будь-який із цих маркерів не можна рекомендувати для скринінгу ГЦК у пацієнтів із групи ризику. Сьогодні проводяться дослідження кількох інших маркерів, зокрема фукозильованих білків [84].
Підводячи підсумок, відзначимо, що УЗД — найбільш підходящий метод скринінгу. Додаткове вимірювання АФП не рекомендується, тому що підвищення числа виявлених пухлин на 6–8 % нівелюється зростанням хибнопозитивних результатів, що підвищує витрати на кожну діагностовану ГЦК малого розміру приблизно на 80 % [69, 85].
/180.jpg)
Ефективність скринінгу
Опубліковано 2 РКД, присвячені скринінгу ГЦК. В одному з них проводилася кластерна рандомізація (рандомізовано цілі села) на групу скринінгу (УЗД і АФП кожні 6 міс.) і групу без скринінгу; у дослідженні брали участь китайські пацієнти з хронічним гепатитом В незалежно від наявності цирозу [86]. Незважаючи на недостатньо високу схильність до скринінгу (55 %), у результаті більшої частоти резектабельності виявлених пухлин смертність від ГЦК у групі скринінгу знизилася на 37 %. Інше дослідження, в якому проводився скринінг ГЦК шляхом визначення рівня АФП у пацієнтів з групи високого ризику (чоловіки, HBsAg+) у Цидуні (Китай), не виявило відмінностей у загальній виживаності [74].
Інші результати було отримано в популяційних і непопуляційних когортних дослідженнях і аналізах економічної ефективності; здебільшого ці результати свідчать на користь регулярного проведення УЗД [55, 69, 87–93]. Однак ці дослідження були неоднорідними як за стадією й етіологією ураження печінки, так і за протоколами скринінгу. Окрім того, майже у всіх були методологічні недоліки і пов’язані з ними помилки, зокрема пов’язана зі вступним періодом (уявне збільшення виживання через очікуваний діагноз) і з тривалим спостереженням (гіпероблік повільнорослих пухлин). Хоча остання помилка для цього типу досліджень неминуча, помилки вступного періоду можна скоротити за допомогою поправкових формул. Після такої поправки користь планового обстеження зберігалася [94].
Інтервал між обстеженнями
Ідеальний інтервал між обстеженнями на предмет ГЦК диктується двома основними чинниками: швидкістю росту пухлини до розміру, що виявляється, і частотою ГЦК в обстежуваній популяції. За наявними результатами щодо середнього часу подвоєння обсягу ГЦК [87–89], прийнятний інтервал між обстеженнями становить 6 міс. Однак з урахуванням великих індивідуальних відмінностей у Японії рекомендовано більш часте обстеження з інтервалом 3 міс. [90, 95]. Проте рандомізоване дослідження не виявило яких-небудь відмінностей між обстеженнями кожні 3 міс. і кожні 6 міс. [91]. З іншого боку, подібні результати дало і когортне порівняння схем з інтервалом 6 і 12 міс. [52, 92], хоча ретроспективні дослідження показали перевагу 6-місячного інтервалу у виявленні більш ранньої стадії ГЦК (малі, потенційно курабельні пухлини) [96] і у виживаності [97]. Метааналіз проспективних досліджень показав, що узагальнена чутливість скринінгу за допомогою УЗД знижувалася з 70 % за 6-місячного інтервалу до 50 % за обстеження 1 раз на рік [69].
Нарешті, дослідження економічної ефективності показали, що обстеження за допомогою УЗД 2 рази на рік збільшує очікувану тривалість життя з урахуванням її якості за прийнятних витрат [98]. З урахуванням доступної інформації 6-місячний період між обстеженнями можна вважати найкращим. Провести подальші дослідження в цій сфері важко.
Обстеження в динаміці
• У пацієнтів із цирозом печінки, у яких при УЗД виявлено вузли менш ніж 1 см у діаметрі, упродовж першого року обстеження рекомендується повторювати кожні 4 міс., а в подальші роки — кожні 6 міс. (результати 3D; рекомендація 2B).
• У пацієнтів із цирозом діагностика ГЦК за вузлів 1–2 см у діаметрі має бути заснована на неінвазивних критеріях або результатах біопсії. Рекомендується, щоб біопсія проводилась досвідченим фахівцем із патоморфології печінки. За невизначених результатів, або виявленому при подальших обстеженнях зростанні вузла, або зміні характеру його контрастування рекомендується повторна біопсія (результати 2D; рекомендація 1B).
• У пацієнтів із цирозом і вузлами діаметром понад 2 см діагноз ГЦК можна встановити за типовою картиною одного методу візуалізації. За невизначених або нетипових результатів діагноз слід підтвердити біопсією (результати 2D; рекомендація 1A).
Спостереження в динаміці має велике значення для успіху скринінгу. Воно включає певний алгоритм дій у разі виявлення патології. Цей алгоритм повинен враховувати ідеальну мішень для скринінгу, тобто виявлення ГЦК на дуже ранній стадії (≤ 2 см), коли можливе радикальне лікування з найбільшою ймовірністю довготермінового лікування [99]. У разі ГЦК патологічною знахідкою при УЗД вважається вперше виявлений вогнищевий утвір або виявлений раніше утвір, який збільшився в розмірі або змінив ехоструктуру [100]. Патоморфологічні дослідження показали, що більшість вузлів, менших від 1 см у діаметрі, які можна виявити в ураженій цирозом печінки, не є ГЦК [101]. Такі вузли повинні бути предметом пильного спостереження в динаміці (рис. 2). Діє правило: вважати аномальним результатом скринінгу, що вимагає подальшого обстеження, будь-який вузол діаметром більш ніж 1 см [56]. Такі нові вузли вимагають дослідження в динаміці з використанням неінвазивних або інвазивних (біопсія) методів, описаних у розд. «Діагностика». Якщо неінвазивні критерії не дозволяють встановити діагноз через атипову картину візуалізації, рекомендується провести біопсію. Якщо і біопсія дає нечіткі результати, рекомендовано ретельне спостереження з повторним обстеженням 1 раз на 4 міс. Повторна біопсія може розглядатися в разі зростання вогнища або зміни його контрастування. При виявленні підозрілого вогнища рекомендується обстежити пацієнта в спеціалізованому центрі з відповідними кадровими і технічними ресурсами [56].
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
ХІІ. ХАРЧУВАННЯ, ПІДТРИМУЮЧА ТЕРАПІЯ І ДОДАТКОВІ МЕТОДИ ЛІКУВАННЯ
12.1. ЗАХОДИ ЩОДО ХАРЧУВАННЯ
12.1.1. ДІЄТА
Недостатня кількість білка є поширеним явищем у всіх пацієнтів із хронічними захворюваннями печінки і може призвести до втрати маси. ХГС підвищує базовий метаболізм у пацієнтів із нецирозними захворюваннями [188]. Невідповідне харчування (мала або надмірна маса тіла) негативно впливає на нутритивний статус, якість життя і виживання. Оцінка харчування для виявлення пацієнтів із ризиком і забезпечення харчової підтримки (ентерально і парентерально) для поліпшення клінічних результатів повинні відігравати важливу роль у догляді за пацієнтами [213].
У пацієнтів впродовж отримання противірусної терапії зазвичай спостерігається втрата маси [170, 171, 189]. Ймовірно, це є наслідком інших побічних наслідків, таких як втома і депресія, що можуть мати негативний вплив на апетит [170, 171].
D • Лікувальне харчування осіб, які інфіковані гепатитом С, має включати пропаганду оптимального харчування та запобігання або лікування неправильного харчування або нестачі конкретних поживних речовин.
• Пацієнти мають проходити тест на дефіцит поживних речовин, а за необхідності — нутритивну оцінку з відповідними рекомендаціями дієтолога.
D Пацієнтам із розвиненою хворобою печінки слід приділяти увагу харчуванню, щоб уникнути випадків недостатнього харчування.
- Противірусна терапія являє високу загрозу для втрати маси, а тому необхідно ретельно проводити моніторинг серед пацієнтів і надавати їм нутритивну підтримку, коли необхідно, протягом лікування.
Систематичний огляд 11 РКД не виявив переконливих доказів на підтримку будь-якої переваги від амінокислот із розгалуженим ланцюгом у пацієнтів із цирозом печінки і печінковою енцефалопатією [214]. Було неясно, як багато пацієнтів, включених у дослідження, були ВГС-позитивними. Амінокислоти з розгалуженими боковими ланцюгами поліпшують рівні сироваткового альбуміну в компенсованій стадії цирозу печінки у пацієнтів із розгалуженим відношенням тирозину < 4 і рівнем альбуміну в сироватці між 35–39 г/л [215, 216]. Методологія, що використовувалася в цих дослідженнях, мало уваги приділяла до недостовірних змінних.
Кава може мати захисний ефект проти розвитку ГЦК у пацієнтів із захворюваннями печінки при споживанні в кількості трьох і більше чашок на день. Неясно, які саме складові у каві викликають такий ефект [217, 218]. 2+
12.1.2. ВІТАМІНИ ТА МІНЕРАЛИ
Існує мало доказів того, що прийом пацієнтами вітамінів та мінералів може вплинути на перебіг хвороби ХГС.
Додаткове вживання цинку в дозуванні 34 мг/день може мати позитивний ефект на СВВ у пацієнтів, які перебувають на терапії ІФН; з генотипом 1b; з вірусним навантаженням нижче 5 × 105 копій/мл [219].
Вітамін K [2] може мати позитивний вплив у запобіганні розвитку ГЦК у пацієнтів із гепатитом С [220].
Вітамін E не мав позитивного ефекту на пацієнтів, які приймали ІФН та РБВ. Не схоже, що він допомагає у запобіганні гемолізу РБВ або підвищує вірусологічний кліренс [221].
Прийом заліза, що обмежений до < 7 мг/день, поєднано з контрольованою кількістю спожитих калорій у 30 Ккал/кг, споживанням білків у 1,1–1,2 г/кг та жирів у 15 % від дієтологічного прийому, знижує рівні амінотрансферази [222].
Вітамін C у дозі 600 мг/день не має позитивного ефекту у запобіганні ретинопатії, що асоційована з терапією ІФН [191].
- Пацієнтів із ХГС необхідно заохочувати до досягнення рекомендованих Сполученим Королівством рівнів споживання поживних речовин, вітамінів та мінералів [223]. Необхідно мати на увазі, що не існує ніяких виявлених доказів на підтвердження кращої дії вказаних речовин у вищих дозах.
- Пацієнтам зі стабільно високими показниками феритину в сироватці необхідно рекомендувати знизити рівень споживання продуктів, що містять залізо.
12.1.3. НАДМІРНА ВАГА
Дослідження виявили, що ІМТ > 25 пов’язаний зі стеатозом печінки, призводить до більш тяжкої форми фіброзу [89, 224]. Фіброз печінки, стеатоз і зниження рівнів активності АЛТ із контрольованою втратою маси тіла пацієнтом у 3 дієтологічних програмах та завдяки регулярним фізичним вправам, що направлені на зниження маси на 0,5 кг щотижнево [225].
C Пацієнтам, які мають надлишкову вагу, слід рекомендувати схуднення у реалістичних рамках втрати маси, оскільки це може мати позитивний вплив на ступінь пошкодження печінки, що пов’язані з гепатитом С.
- Втрату маси слід розглядати тільки тоді, коли пацієнт є стабільним з точки зору ведення захворювання на гепатит С. Заходи, що спрямовані на зниження маси впродовж противірусного лікування, не рекомендуються, тому що побічні ефекти можуть призвести до надмірної незапланованої втрати маси.
- Пацієнти, які перебувають в програмах схуднення, мають регулярно отримувати підтримку та проходити контроль.
An update on the management of chronic hepatitis C:Consensus guidelines from the Canadian Association for the Study of the Liver (2012):
Деякі, але не всі дослідження також показують, що підвищена маса тіла має негативний вплив на ймовірність СВВ на подвійну терапію з Пег-ІФН і РБВ. При комбінованій терапії, включаючи ТЛП або БЦП, ожиріння не впливає суттєво на відповідь на лікування. У світлі цих висновків не можна зробити конкретних рекомендацій щодо втрати маси перед ІП-терапією з метою покращення рівня СВВ (як уже було повідомлено щодо подвійної терапії).
Адаптована клінічна настанова, заснована на доказах «Вірусний гепатит С» (2014):
12.2. СПЕЦІАЛІЗОВАНИЙ САНІТАРНИЙ ДОГЛЯД
Спеціальна підтримка і догляд є ключем для підтримання прихильності до лікування пацієнтів із нейропсихіатричними захворюваннями [226]. Спеціальний гепатологічний догляд має визначну роль у допомозі пацієнтам щодо досягнення та підтримування СВВ [227]. 2–
- Клінічні спеціалісти із санітарного догляду за пацієнтами мають бути невід’ємною частиною клінічної команди, яка піклується про пацієнтів із ХГС.
12.3. ПСИХОСОЦІАЛЬНІ ЗАХОДИ
Два дослідження щодо психологічних впливів на пацієнтів із гепатитом С не показали можливої користі від цього. Одне невелике нерандомізоване дослідження показало деяку користь, але інше РКД, що перевіряло індивідуально результати кожного заходу, не показало жодної різниці в результатах порівняно зі стандартним доглядом [228, 229]. 2– 1+
12.4. ФІЗИЧНІ ВПРАВИ
Пацієнтам, які отримують лікування від гепатиту, рекомендовано легкі та помірні фізичні вправи [170]. Невелике когортне дослідження показало, що пацієнти на противірусній терапії мають знижену переносимість до фізичних вправ [230].
D Пацієнтів із гепатитом С необхідно закликати до легких та помірних фізичних вправ. Пацієнтам, які перебувають на противірусній терапії, слід знати, що їх можливості до виконання фізичних вправ будуть знижені.
12.5. ДОДАТКОВІ МЕТОДИ ЛІКУВАННЯ
Два метааналізи дійшли висновку, що немає ніяких доказів, які підтримують використання додаткових або альтернативних лікарських засобів у лікуванні хворих із гепатитом C [231, 232].
Жодне дослідження не виявило (через обмеженість часу проведення досліджень) безпечність або шкоду від довготривалого прийому рослинних лікарських засобів.
- Пацієнти повинні знати, що існують певні загрози, пов’язані з деякими додатковими препаратами.
12.6. ПАЛІАТИВНИЙ ДОГЛЯД
Жодних доказів щодо надання паліативного догляду за пацієнтами з ВГС виявлено не було.
ХІІІ. НАДАННЯ ІНФОРМАЦІЇ
Аби дізнатися про основні інформаційні потреби пацієнтів, були проведені інтерв’ю та фокус-групи, впроваджено анкети для людей із гепатитом С по всій Великобританії через мережу центрів підтримки з питань гепатиту С у Шотландії та завдяки ресурсному центру Сполученого Королівства. Результати були переформатовані на запитання із запропонованими відповідями (розд. 13.2), що можуть бути використані для заохочення дискусій між пацієнтами та медичними працівниками. Деякі з організацій, наведених у розд. 13.1, розробляють якісні інструкції для пацієнтів.
13.1. ДЖЕРЕЛА ПОДАЛЬШОЇ ІНФОРМАЦІЇ
Коментар робочої групи: більш докладну інформацію про джерела подальшої інформації можна знайти за посиланням http://www.sign.ac.uk/pdf/sign133.pdf.
13.2. ІНФОРМАЦІЯ ПРО ГЕПАТИТ С ДЛЯ ПАЦІЄНТІВ ТА МЕДПЕРСОНАЛУ
Що таке гепатит С?
Гепатит С — це захворювання, що викликається вірусом, який може передаватися через кров від однієї людини до іншої. Захворювання, в основному, вражає печінку.
Коли ваша печінка вражається вірусом, вона може пошкоджуватися, і зрештою виникнуть труднощі з виконанням своїх різноманітних і життєво важливих функцій. Протягом тривалого періоду часу це може прогресувати до серйозного пошкодження печінки (наприклад, фіброзу і цирозу), або, в деяких випадках, до раку печінки (ГЦК).
Як хвороба впливає на людей?
Потенційно, це захворювання загрожує життю людини і може вплинути на вас фізично й емоційно. Захворювання може погіршити якість вашого життя. У багатьох випадках за умови відповідного лікування гепатит С можна вилікувати.
Які симптоми захворювання на гепатит С?
Деякі люди не мають жодних симптомів захворювання протягом багатьох років, у той час як інші можуть відчувати підвищену стомлюваність, пітливість (особливо вночі), ломоту та болі, втрату апетиту і концентрації уваги. Симптоми можуть з’являтися і зникати. На більш пізніх стадіях захворювання, коли печінка пошкоджена більш серйозно, можуть бути такі симптоми, як жовтяниця, свербіж, внутрішня кровотеча і запор.
Мені це загрожує?
Фактори ризику, коли кров інфікованої гепатитом С особи може потрапити в кровоток іншої особи, включають такі:
• переливання крові, хірургічне втручання за кордоном або у Сполученому Королівстві до 1991 року, продукти крові у Сполученому Королівстві до 1987 року (переливання та продукти крові у Сполученому Королівстві зараз безпечні з точки зору ВГС); та
• отримання медичної або стоматологічної допомоги в країнах, де гепатит є поширеним захворюванням, а інфекційний контроль є неякісним;
• спільне використанням будь-якого обладнання при споживанні ін’єкційних наркотиків або інгаляційних наркотиків;
• спільне використання таких речей, як леза для гоління, зубні щітки або речі, що можуть подряпати шкіру;
• пірсинг, татуювання або косметичні ін’єкційні процедури (наприклад, ботекс), якщо обладнання для цього використовується повторно;
• статеві відносини; хоча ризик дуже низький, якщо немає загрози кровотечі;
• контакт із кров’ю на роботі, наприклад, поранення голкою, порізи, прибирання крові, робота на місці жорстоких подій з наявністю крові;
• передача від матері до дитини в момент народження.
Мені треба здати аналізи?
Якщо ви вважаєте, що знаходитеся у групі ризику, необхідно пройти попередню консультацію з лікарем. Чим раніше почати лікування, тим більша вірогідність вилікування інфекції. Якщо ви знаєте, що маєте позитивний результат тесту на інфекцію, ви можете уникнути зараження інших.
Що мається на увазі «позитивний» чи «негативний»?
Є три типи тестів. Перший тип тесту (тест на антитіла до ВГС) визначає, чи ви коли-небудь мали вірус. Деякі люди позбавляються вірусу природним шляхом, без медичної допомоги. Другий тип (ПЛР) вказує, чи наявний вірус у даний момент у вашому організмі (тобто чи інфіковані ви гепатитом С). Якщо тест ПЛР позитивний, додаткове тстування покаже генотип (штам) вірусу. Генотип визначає лікування, яке ви отримуватимете.
Як щодо конфіденційності?
Конфіденційне тестування доступне у сімейних лікарів та інших місцях. Результати цього тесту є конфіденційними і не будуть передані третім особам без вашого дозволу. Сімейні лікарі лише передадуть інформацію про позитивні тести страховій компанії, якщо ви подали заяву на страхування і дали свою згоду на передачу медичної інформації. Негативні результати не будуть розголошуватися.
Ви можете знайти інформацію про служби гепатиту по всій Шотландії, відвідавши сайт Hepatitis Scotland (розд. 13.1).
Це загрожує моїй родині та друзям? Мені треба їм розповісти?
Підтримка родини і друзів має вирішальне значення, тому варто сказати їм про ваш діагноз і те, якими можуть бути результати і побічні ефекти лікування. Ви не можете заразити членів вашої сім’ї і друзів через повсякденну діяльність, таку як спільне використання посуду, обійми та поцілунки.
Аби не заразити інших:
— не використовуйте спільно такі предмети побуту, як зубні щітки або бритви;
— очищуйте будь-які плями крові слабким розчином хлорки;
— не використовуйте спільно будь-яке приладдя для вживання ліків (наприклад, трубки, голки та шприци, воду або посуд тощо).
Ризик передачі інфекції статевим шляхом є дуже низьким у відсутності інших ускладнюючих чинників, таких як:
— кров від менструації або анального сексу;
— виразки на геніталіях, тобто від інфекцій, що передаються статевим шляхом, таких як гонорея, герпес або генітальні бородавки.
Як це вплине на мою роботу і кар’єрні перспективи?
Багато людей із гепатитом С почуваються досить добре, щоб працювати, але вам, можливо, доведеться внести деякі корективи у вашу повсякденність, якщо у вас є надмірна втомлюваність або інші симптоми.
Як правило, ви не зобов’язані повідомляти своєму роботодавцю, що у вас ВГС (якщо ви не медичний працівник, який бере участь у процедурах, що можуть включати контакт з кров’ю, наприклад, деякі операції). Проте побічні ефекти від лікування можуть означати, що ви відчуваєте себе погано і не в змозі працювати протягом певного періоду часу. Може бути корисно розказати, що ви перебуваєте на лікуванні. Наприклад, вас можуть підтримати, змінивши робочі години або фізичну діяльність, що пов’язана з вашою роботою впродовж періоду лікування.
Як позитивний діагноз вплине на моє страхування життя?
Як і будь-яке серйозне захворювання, діагноз гепатиту С буде мати вплив на страхування життя. Є багато видів страхування життя, так що варто перевірити будь-які поліси, які у вас є, оскільки, можливо, вам доведеться сказати страховику, якщо є зміни у стані вашого здоров’я. Важливо пам’ятати, що будь-яка інформація, яку ви надаєте вашим страховикам, є складовою частиною правового договору. Якщо інформація є неточною або неправильною, угода може бути недійсною.
Якщо ви подаєте заяву на страхування та згоду на передачу медичної інформації, людина, яка проводила тестування, зобов’язана передати інформацію про позитивний результат тесту, якщо страхова компанія звернеться з таким проханням.
Ви повинні прочитати дрібний шрифт на поточних або нових договорах страхування, перш ніж підписувати.
Як вплине на моє страхування життя негативний діагноз?
Лікарі не повинні надавати страховикам жодної інформації про негативний діагноз. Страховики можуть тільки запитувати інформацію, чи має хтось позитивний результат або проходить курс лікування.
Що відбувається впродовж тестування?
Перед тестуванням лікар повинен з вами обговорити, що відбувається. Це допоможе вам зрозуміти процес тестування, результати тестування та конфіденційність.
Зразки крові будуть відправлені на лабораторне дослідження. Якщо ваш контакт із вірусом відбувся в останні шість місяців, вас можуть попросити повернутися для повторного тесту. Це відбувається через те, що існує «вікно» після контакту, поки тест не стає позитивним.
Якщо тест негативний, команда лікарів дасть вам поради про те, як не піддавати себе ризику в майбутньому. Якщо тест позитивний, вони будуть пояснювати, що це означає, і направлять вас у спеціалізовану клініку для оцінки.
Що відбувається далі?
Оцінка буде включати в себе аналізи крові, такі як тест на печінкові проби, тест на генотип (штам вірусу гепатиту С), клінічне обстеження, дискусії про спосіб життя, інші захворювання та ліки, що ви приймаєте, УЗД, еластографію і, в окремих випадках, біопсію печінки. Біопсія печінки означає забір невеликого шматка печінки для лабораторного аналізу. Це робиться під місцевою анестезією, але не обов’язково до початку лікування.
Після завершення оцінки ваш лікар буде говорити з вами про лікування. Лікування дуже ефективне, і побічних ефектів можна уникнути при доброму догляді та підтримці. Ваша клініка повинна допомогти вам знайти підтримку, що є частиною вашого лікування. Лікування не підходить для всіх і залежить від інших захворювань або ускладнень, які ви можете мати.
У той час як ви або ваш партнер знаходитесь на лікуванні, і протягом від 6 до 12 місяців після цього, ви повинні використовувати контрацепцію, щоб уникнути вагітності, оскільки ці препарати можуть бути шкідливі для майбутньої дитини.
Життя з гепатитом С?
Є багато речей, що стосуються способу життя, які можуть полегшити життя з гепатитом С.
• Не вживайте алкоголь. Алкоголь і гепатит С можуть призвести до пошкодження печінки, а їх поєднання робить цей процес набагато швидшим. Існує спеціальна професійна підтримка, щоб допомогти вам зменшити або припинити споживання алкоголю.
• Збалансована дієта є життєво важливою. Зменшіть споживання надмірно жирних та солодких продуктів. Втрата надмірної маси допоможе знизити навантаження на печінку. Проте втрата ваги може бути побічним ефектом лікування, тому можуть бути необхідні харчові добавки. Професійна допомога в плануванні здорової збалансованої дієти стане вам у нагоді.
• Якщо у вас поганий апетит, намагайтеся їсти малими порціями, але частіше.
• Регулярні помірні фізичні вправи зменшують стрес або депресію, тонізують, допомагають зміцнити імунну систему.
• Якщо у вас гепатит С, припиніть палити. Відмова від куріння знижує ризик захворіти на рак. Для припинення паління можна звернутися за допомогою.
Коментар робочої групи: вживання тютюну — основна причина передчасних смертей та хвороб в усьому світі, яким людство здатне запобігти. Куріння викликає широкий спектр хвороб і станів, що можуть призвести до передчасної смерті. За офіційною статистикою, в Україні щороку від хвороб, пов’язаних із курінням, помирає 120 тисяч чоловік.
Допомогти припинити палити вам допоможе сімейний лікар відповідно до «Стандартів первинної медичної допомоги при припиненні вживання тютюнових виробів» «http://www.dec.gov.ua/mtd/_pvtv.html».
• Поговоріть із вашим лікарем з приводу щеплень проти гепатиту А і В. Інші типи інфекції печінки, особливо якщо у вас вже є гепатит С, спричиняють набагато більше навантаження на печінку і можуть уповільнити або зупинити відновлення для всіх типів гепатиту. Ви також повинні переконатися, що ви отримуєте сезонне щеплення проти грипу як додаткову міру обережності, коли імунна система може бути ослаблена.
Існує дуже мало доказів користі застосування додаткових лікарських засобів, але багато пацієнтів вважають їх корисними у вирішенні багатьох різних симптомів, пов’язаних із цим захворюванням. Перш ніж почати їх вживання, необхідно отримати професійну консультацію.
Яку підтримку я можу отримати?
Існують різні спеціалізовані служби підтримки для людей із гепатитом С, такі як консультування, підтримка осіб із подібним діагнозом, адвокації для допомоги у прийнятті рішень.
Гепатит С може змусити людей відчувати себе ізольованими, а тому емоційна підтримка є дуже важливою. Пацієнти повинні сподіватися:
• на підтримку багатопрофільних служб, що забезпечують добру комунікацію з пацієнтом;
• якісні інформаційні послуги;
• залучення пацієнта на всіх стадіях допомоги та лікування;
• плавний перехід до паліативної допомоги, якщо це необхідно; та
• регулярну оцінку потреб.
ХІV. ВПРОВАДЖЕННЯ НАСТАНОВИ
14.1. СТРАТЕГІЯ ВПРОВАДЖЕННЯ
Впровадження національних настанов є обов’язком кожної Ради NHS і невід’ємною частиною клінічного управління. Повинні існувати механізми, що дозволяють переглядати медичну допомогу, що надається відповідно до рекомендацій настанови. Причини відмінності повинні розглядатися і, там де необхідно, переглядатися. Повинні бути здійснені місцеві механізми для впровадження національної настанови в окремих лікарнях, відділеннях тощо.
14.2. РЕСУРСИ ДЛЯ ВПРОВАДЖЕННЯ КЛЮЧОВИХ ПОЛОЖЕНЬ КЛІНІЧНОЇ НАСТАНОВИ
Не було виявлено жодного положення КН, що потребувало б значної бюджетної підтримки.
14.3. АУДИТ ПОТОЧНОЇ ПРАКТИКИ
Існують два механізми для аудиту практики щодо тестування, лікування, догляду та підтримки, які надаються службами з гепатиту С у Шотландії. Першим є індикатори якості з гепатиту С Healthcare Improvement Scotland, які самостійно підраховуються радами з питань охорони здоров’я. Іншим є індикатори діяльності, які містяться в «Blood Borne Virus and Sexual Health framework» і які підраховуються національним шотландським урядом.
14.4. ДОДАТКОВІ ПОРАДИ
Додаткові поради для NHS Scotland від Quality Improvement Scotland та Шотландського консорціуму лікарських засобів:
У вересні 2011 року Шотландський консорціум лікарських засобів повідомив, що БЦП був прийнятий для використання в межах NHSScotland для лікування ХГС генотипу 1 у поєднанні з Пег-ІФН і РБВ у дорослих пацієнтів із компенсованим захворюванням печінки, які зазнали невдачі попередньої терапії або які раніше не отримували лікування.
У вересні 2011 року Шотландський консорціум лікарських засобів повідомив, що ТЛП у поєднанні з Пег-ІФН і РБВ показаний для лікування ХГС генотипу 1 у дорослих пацієнтів із компенсованим захворюванням печінки (у тому числі цирозом печінки), які раніше лікувалися ІФН-альфа (Пег-ІФН або непегільованим ІФН) окремо або в комбінації з РБВ, включаючи пацієнтів із рецидивом, частковою відповіддю і відсутньою відповіддю, або пацієнтів, які раніше не отримували лікування.
ХV. ДОКАЗОВА БАЗА
15.1. СИСТЕМАТИЧНА ОЦІНКА ЛІТЕРАТУРИ
Доказова база для даної КН була створена у відповідності з методологією мережі SIGN. Систематичний огляд літератури проводили з використанням чіткої стратегії пошуку, що була розроблена працівником мережі з питань інформації у співпраці з членами групи розробки КН. Пошуки літератури проводилися в бібліотеках Medline, Embase, Cinahl, PsycINFO та Cochrane. Пошук охоплював період 2006–2012 рр. Пошук в Інтернеті проводився на різних сайтах, в тому числі на сайті координаційного центру настанов США. Основні пошуки були доповнені матеріалами, визначеними окремими членами групи з розробки. Кожен із обраних документів оцінювався одним членом групи і одним співробітником SIGN з використанням стандартних листів оцінки SIGN, перш ніж висновки були розглянуті як докази.
15.1.1. ПОШУК ЛІТЕРАТУРИ ЩОДО ПИТАНЬ, ПОВ’ЯЗАНИХ ІЗ ПАЦІЄНТАМИ
На початку процесу розробки настанови спеціалісти з пошуку доказів та інформації SIGN провели пошук літератури для якісних і кількісних досліджень, які охоплювали питання, пов’язані з пацієнтами, які мають відношення до раннього лікування пацієнтів з гепатитом С. Пошуки літератури проводилися в бібліотеках Medline, Embase, Cinahl і PsycINFO, і результати були узагальнені і представлені групі з розробки настанови.
15.2. РЕКОМЕНДАЦІЇ ДЛЯ ДОСЛІДЖЕННЯ
Група з розробки настанови не змогла визначити достатньо доказів, щоб відповісти на всі ключові питання в цій настанові (див. Додаток 1). Були визначені такі галузі для подальшого дослідження:
• лікування гепатиту С у дітей;
• лікування активних споживачів наркотиків;
• маршрути пацієнтів для лікування гепатиту С (пацієнти похилого віку, ув’язнені, пацієнти після трансплантації, хворі на декомпенсований цироз);
• тестування і скринінг.
15.3. ПЕРЕГЛЯД ТА ОНОВЛЕННЯ
Ця настанова була опублікована в 2013 році і буде розглядатися на предмет перегляду через 3 роки. Будь-які оновлення даної настанови в перехідний період будуть відзначені на сайті SIGN: www.sign.ac.uk.
ХVІ. РОЗРОБКА КЛІНІЧНОЇ НАСТАНОВИ
16.1. ВСТУП
SIGN — це спільна мережа лікарів, інших медичних працівників і організацій пацієнтів, що є частиною Національної служби з вдосконалення якості охорони здоров’я Шотландії. Настанови SIGN розробляються міждисциплінарними групами практикуючих лікарів із використанням стандартної методології, заснованої на систематичній оцінці доказів. Більш детальну інформацію про мережу і методологію розробки настанови ви можете знайти у довіднику «SIGN 50: Настанова для розробників настанов» на сайті www.sign.ac.uk.
Коментар робочої групи: більш докладну інформацію про склад групи з розробки настанови та рецензентів можна знайти за посиланням http://www.sign.ac.uk/pdf/sign133.pdf.
Протокол з ведення хворих на вірусний гепатит С буде представлений у журналі «Актуальна інфектологія» № 1(10), 2016
Список литературы
Список літератури знаходиться в редакції

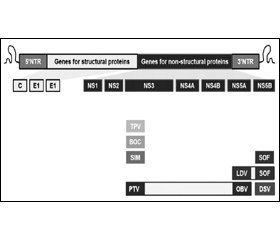
/117.jpg)
/126.jpg)
/142.jpg)
/143.jpg)
/147.jpg)
/149.jpg)
/152.jpg)
/153.jpg)
/156.jpg)
/157.jpg)
/160.jpg)