Журнал «Актуальная инфектология» 1 (10) 2016
Вернуться к номеру
Практические рекомендации по лечению синусита у взрослых (Американская академия отоларингологии — Общество хирургии головы и шеи, обновление 2015 г.)
Авторы: Richard M. Rosenfeld, MD, MPH(1), Jay F. Piccirillo, MD(2), Sujana S. Chandrasekhar, MD(3),
Itzhak Brook, MD, MSc(4), Kaparaboyna Ashok Kumar, MD, FRCS(5), Maggie Kramper, RN, FNP(6),
Richard R. Orlandi, MD(7), James N. Palmer, MD(8), Zara M. Patel, MD(9), Anju Peters, MD(10), Sandra A. Walsh(11), and Maureen D. Corrigan(12)
Рубрики: Инфекционные заболевания
Разделы: Руководства
Версия для печати
Статья опубликована на с. 71-99
Введение
Синуситом заболевает примерно 1 из 8 человек в Соединенных Штатах, в результате чего ежегодно устанавливается более 30 миллионов диагнозов [3, 4]. Прямые затраты на лечение острого и хронического синусита превышают 11 млрд долл. США в год [4, 5], дополнительно необходимо учитывать уменьшение продуктивности, снижение эффективности работы, а также нарушение качества жизни [6–8]. Чаще чем в 1 из 5 случаев синусита у взрослых назначаются антибиотики. Таким образом, это пятый по распространенности диагноз, при котором применяется антибактериальная терапия [5]. Несмотря на высокую распространенность и экономические затраты, сопряженные с лечением синусита, тактика лечения данного состояния значительно отличается как в рамках определенных специальностей, так и между специальностями, так или иначе связанными с лечением данного состояния, в целом [9, 10].
Данные рекомендации рассчитаны на пациентов 18 лет и старше с клиническим диагнозом неосложненного риносинусита.
Риносинусит определяется как симптоматическое воспаление придаточных пазух и полости носа. Предпочтительнее термин «риносинусит», поскольку синусит практически всегда сопровождается воспалением прилежащей слизистой оболочки носа [11–13]. Таким образом, термин «риносинусит» используется в остальной части рекомендаций.
Неосложненный риносинусит определяется как риносинусит без клинически определяемого распространения воспаления за пределы придаточных пазух носа и собственно полости носа на момент постановки диагноза (например, отсутствуют неврологические, офтальмологические осложнения или вовлечение мягких тканей).
По продолжительности риносинусит можно разделить на острый риносинусит (ОРС), если продолжительность составляет менее 4 недель, и хронический риносинусит (ХРС), если продолжительность составляет более 12 недель, с обострениями или без. ОРС можно также классифицировать согласно предполагаемой этиологии, основываясь на симптомах и динамике (ключевая рекомендация 1), на острый бактериальный риносинусит (ОБРС) и вирусный риносинусит (ВРС). Дифференциальная диагностика бактериальной или вирусной природы очень важна, так как в последнем случае антибактериальная терапия неприменима. Когда у пациента наблюдается 4 и более эпизода риносинусита в год без сохранения симптомов между ними, данное состояние называется рецидивирующим ОРС. Практически все организации согласны в том, что ХРС можно рассматривать при продолжительности заболевания более 12 недель, но мнения о продолжительности ОРС до сих пор различаются; некоторые специалисты считают, что ОРС может длиться до 12 недель [14]. Мы согласны с другими группами по разработке рекомендаций [15, 16], которые ограничивают длительность ОРС 4 неделями, но признаем, что данная граница основывается больше на консенсусе, нежели на доказательных данных. Кроме того, доступны очень ограниченные данные по риносинуситу длительностью 4–12 недель, иногда называемому подострым риносинуситом. Мы не выделяем риносинусит в рамках данного периода времени в качестве отдельной нозологической единицы в данных рекомендациях, и, следовательно, решение о том, относить ли пациентов к группе ОРС или ХРС, следует принимать в индивидуальном порядке.
Цель данного междисциплинарного руководства заключается в определении возможностей улучшения качества лечения риносинусита у взрослых, а также в создании четких и эффективных рекомендаций по реализации этих возможностей в клинической практике. В частности, целями являются повышение точности диагностики риносинусита у взрослых, содействие надлежащему применению вспомогательных исследований для подтверждения диагноза (рентгенография, эндоскопия носа, компьютерная томография, аллергологические и иммунологические исследования) и лечения, а также разумному применению системной и местной терапии. Акцент сделан также на выявлении некоторых хронических заболеваний, которые могут оказывать влияние на лечение риносинусита, а именно астмы, муковисцидоза, иммунодефицитных состояний и цилиарной дискинезии.
Бремя риносинусита
У двенадцати процентов населения США (практически каждый 8-й житель) был установлен диагноз риносинусита в течение предшествующих 12 месяцев согласно данным национального опроса по состоянию здоровья за 2012 год [4]. Диагноз риносинусита опередил по распространенности поллиноз (7 %), бронхит (4 %) и хроническую обструктивную болезнь легких (4 %), при этом вероятность постановки диагноза риносинусита зависела от наличия астмы (13 %).
Категория риносинусита включает ОРС и ХРС. Большинство ОРС начинается при распространении вирусной инфекции верхних дыхательных путей (ИВДП) на околоносовые пазухи с последующим возможным присоединением бактериальной инфекции. Ежегодно в Соединенных Штатах регистрируется около 20 миллионов случаев предположительно бактериального ОРС (ОБРС) [5], что делает его одним из наиболее распространенных состояний, с которыми сталкиваются врачи в своей практике. Значение ОБРС заключается не только в его распространенности, но также и в потенциальном развитии необычных, однако серьезных осложнений, включающих менингит, абсцесс головного мозга, флегмону или абсцесс орбиты [17, 18].
Национальные данные по амбулаторной помощи за период с 2006 по 2010 год показали, что на риносинусит приходилось больше выписанных амбулаторных рецептов на антибиотики, чем при любом другом диагнозе. Несмотря на имеющиеся рекомендации, поощряющие разумное применение антибактериальных препаратов при ОРС [16, 19], антибиотики назначаются в 82 % случаев обращений за медицинской помощью [20]. С 2006 по 2010 год на риносинуситы приходилось 11 % всех обращений к врачам первичного звена с последующим назначением антибиотиков: для ОРС данный показатель составил 3,9 %, а для ХРС — 7,1 % [20]. На ОРС и ХРС приходилось больше обращений к врачам первичного звена с последующим назначением антибиотиков, чем при любом другом диагнозе или группе диагнозов.
С ОРС связаны значительные экономические затраты. В Соединенных Штатах Америки затраты в области здравоохранения при неэффективной антибактериальной терапии ОРС, включая дополнительные назначения, амбулаторные обращения, проведение исследований и процедур [21], составляют более 3 млрд долл. США в год [5]. В среднем прямые расходы пациента с рецидивирующим ОРС составляют около 1100 долл. США в год [22]. Помимо прямых затрат на лечение, такие последствия, как снижение производительности труда и потеря рабочих дней, вносят вклад в еще большие косвенные затраты в области здравоохранения, связанные с ОБРС и рецидивирующим ОРС.
ХРС также имеет значительные социально-экономические последствия. В 2001 году количество обращений по поводу ХРС составило 18,3 млн, в большинстве из них имело место назначение лечения [23]. Пациенты с ХРС посещают врачей первичного звена в два раза чаще, чем пациенты без данного состояния, при этом они получают назначения в 5 раз чаще [24]. Исследование, проведенное в 2007 году, показало, что ежегодно на ХРС тратится примерно 8,3 млрд долл. США, прежде всего на отпускаемые по рецепту лекарственные средства и амбулаторную помощь [25]. Средняя стоимость оперативного вмешательства по поводу ХРС, которое в Соединенных Штатах Америки выполняется почти 250 000 раз в год, составляет 7700 долл. США на одного пациента. Среднегодовые расходы на пациента составляют 770 долл. США, которые увеличиваются до 2450 долл. США в год при выполнении оперативного вмешательства [26].
Непрямые затраты, связанные с ХРС, значительны, что делает их, возможно, более важными, чем прямые затраты. ХРС ведет в среднем к потере 1–2 рабочих дней на пациента в год и 73 млн дней ограниченной активности [24, 27]. А у пациентов с рефрактерным к лечению ХРС количество невыходов по нетрудоспособности составляет 18 дней [6]. Потери рабочего времени у пациентов с ХРС составляют 6,5 %, снижение рабочей эффективности — 36 %, снижение продуктивности — 38 % [7]. По сравнению с пациентами без ХРС у пациентов с ХРС наблюдаются большие ограничения активности, работоспособности, а также социальных взаимодействий [22]. Общий годовой убыток, связанный со снижением продуктивности по причине рефрактерного к лечению ХРС, составляет около 10 077 долл. США на одного пациента [6].
ХРС может также оказывать существенное влияние на качество жизни, связанное со здоровьем. Пациенты с ХРС, обращающиеся к отоларингологу, отмечают значительно худшие показатели, оценивающие физическую боль и социальное функционирование, нежели пациенты с тонзиллитом, болью в спине, застойной сердечной недостаточностью и хронической обструктивной болезнью легких [8]. Точно так же пациенты с ХРС демонстрируют худшие показатели оценки состояния здоровья, чем при многих других хронических заболеваниях, в том числе сердечной недостаточности, ишемической болезни сердца и хронической обструктивной болезни легких [28]. Лечение ХРС может улучшить показатели оценки состояния здоровья и существенно снизить усталость и физическую боль [28–31].
Классификация доказательных рекомендаций
Цель рекомендаций заключается в стандартизации оказания медицинской помощи, разработке оптимальных критериев оценки результатов лечения, а также минимизации возможного вреда. Ориентированный на доказательные данные подход к разработке рекомендаций предусматривает определение, оценку, а также обобщенный анализ поддерживающих тактику ведения пациента данных, а также определение очевидной связи между доказательными данными и сделанными на их основе рекомендациями. Основанные на доказательных данных рекомендации отражают как качество доказательных данных, так и соотношение пользы и вреда, прогнозируемых при создании рекомендации. Определения доказательных рекомендаций [35] приведены в табл. 1, 2.
Рекомендации не заменяют клиническое суждение; скорее, они призваны служить определенными направляющими рамками при принятии врачом индивидуальных решений в конкретных клинических условиях. Более строгие ограничения содержатся в сильных рекомендациях, тогда как в рекомендациях они менее строги. Возможные варианты тактики лечения в наименьшей степени ограничивают выбор [36]. Врачу всегда следует на первое место ставить интересы и потребности своих пациентов независимо от рекомендаций. Рекомендации представляют собой лучшие возможные варианты ведения пациентов, по общему согласованному мнению опытных врачей и методистов, изучивших доказательные данные по соответствующей тематике [35].
Разработка рекомендаций по лечебной тактике предусматривает и субъективную оценку намерения достичь того или иного результата/исхода благодаря применению той или иной тактики лечения. Намерения ГОР заключались в попытке минимизировать потенциальный риск, ограничить применение нецелесообразных и ненужных методов лечения и диагностики, а также ограничить нецелесообразное применение системной антибактериальной терапии. На первое место группа вынесла прозрачность процедуры определения ценностей и документирование процесса разработки рекомендаций.
Доказательные рекомендации по лечению риносинусита
Каждая рекомендация на основе доказательных данных организована следующим образом: ключевая рекомендация на основе доказательных данных выделена жирным шрифтом, за ней следует указание силы рекомендации курсивом. За каждой ключевой рекомендацией следует «профиль рекомендации», в котором указывается возможность улучшения качества, качество совокупной доказательной базы, уровень достоверности доказательных данных (высокий, средний, низкий), польза, вред, риски, расходы и оценка соотношения польза — риск. Кроме того, представлены ценности, роль предпочтений пациента (или лица, осуществляющего уход), объяснение любой преднамеренной неопределенности по тому или иному вопросу группы, разрабатывавшей рекомендации, исключения, любые разногласия и повторное указание силы рекомендации. В нескольких последующих абзацах обсуждается доказательная база. Обзор каждой доказательной рекомендации данного руководства отражен в табл. 3, а связь между рекомендациями представлена на рис. 1.
Роль предпочтения пациента в принятии решений требует дальнейшего разъяснения. Для некоторых рекомендаций, где доказательная база демонстрирует очевидную пользу и роль предпочтений пациента для возможных вариантов лечения не играет особой роли, следует обеспечить пациентов доступной и понятной информацией о пользе для более легкого понимания пациентом сути вмешательства в рамках совместного принятия решений, что позволяет достичь лучшей приверженности к лечению и, соответственно, лучших результатов самого лечения. В тех случаях, когда доказательная база недостаточно сильна или же польза неясна, очень полезна практика совместного принятия решений на основе сотрудничества надлежащим образом информированного пациента и врача. Факторы, связанные с предпочтениями пациента, включают в том числе абсолютную пользу (количество пролеченных пациентов на одного излеченного), побочные эффекты (индекс потенциального вреда), стоимость препаратов или процедур, а также частоту и продолжительность лечения.
Рекомендация 1А. Дифференциальная диагностика острого риносинусита: следует проводить дифференциальную диагностику предполагаемого острого бактериального риносинусита (ОБРС) и острого риносинусита, вызванного вирусной инфекцией верхних дыхательных путей или неинфекционными заболеваниями. Диагностировать ОБРС следует в случаях, когда (а) симптомы или признаки острого риносинусита (гнойные выделения из носа, сопровождающиеся заложенностью носа, наличием ощущения боли/давления/заполненности в области лица или и того и другого) сохраняются без признаков улучшения в течение по крайней мере 10 дней после появления симптомов со стороны верхних дыхательных путей или (б) симптомы или признаки острого риносинусита ухудшаются в течение 10 дней после первоначального улучшения (повторное ухудшение).
Обоснование
Цель данных рекомендаций заключается в необходимости подчеркнуть важность дифференциальной диагностики острого бактериального риносинусита (ОБРС) и острого риносинусита (ОРС), вызванного вирусными инфекциями верхних дыхательных путей, для предотвращения ненужного лечения антибиотиками. Это также помогает избежать ненужных диагностических исследований и таким образом оптимизировать расходы и повысить качество медицинской помощи. В отличие от версии этой рекомендации в оригинальном руководстве по ринусинуситу [1], мы изменили диагностические критерии, включив не только сохранение признаков и симптомов в течение более 10 дней, но также и отсутствие улучшения в течение 10 дней для большей специфичности в различении предполагаемой бактериальной инфекции и персистирующей, но разрешающейся вирусной инфекции.
Основные симптомы острого риносинусита
Острый риносинусит диагностируется при наблюдении у пациента гнойных (непрозрачных) выделений из носа, которые сопровождаются его заложенностью, ощущениями боли/давления/заполненности в области лица или же и того и другого (табл. 4).
Заложенность носа без гнойных выделений не согласуется с ОРС и выходит за рамки данных рекомендаций. Точно так же боль в области лица без гнойных выделений из носа не согласуется с ОРС, несмотря на то что многие пациенты обращаются с собственным анамнезом или установленным врачом диагнозом головной боли на фоне синусита, которая часто связана с мигренью и отвечает на терапию мигрени [45, 46].
При соответствии критериям ОРС в табл. 4 следует проводить дифференциальную диагностику вирусного риносинусита (ВРС) и предполагаемого ОБРС [5, 13, 47, 48]. Дифференциальная диагностика основана на характере заболевания и его продолжительности (табл. 4), поскольку гнойные выделения из носа не позволяют различить вирусную и бактериальную инфекцию [49]. Хотя доказательные данные высокого уровня, которые бы указывали на то, что продолжительность симптомов и гнойные выделения позволяют надежно различать бактериальный и вирусный ОРС, отсутствуют [50], критерии, представленные в табл. 4, считаются ГОР наилучшим подходом для решения данной задачи, исходя из данных фундаментальных экспериментальных исследований, вспомогательных доказательных данных, а также консенсуса экспертов, как описано в оставшейся части данного раздела.
Обоснование выбора трех основных симптомов основано на их высокой чувствительности и относительно высокой специфичности для ОБРС, особенно при рассмотрении временного интервала персистенции в 10 и более дней [51–53]. Гнойные (инфицированные, окрашенные или просачивающиеся) выделения указывают на повышенную вероятность выявления бактерий в пазухах при аспирации содержимого, когда пациенты жалуются на гнойную ринорею, когда выявляются признаки постназального затека или гнойное отделяемое на задней стенке глотки, а также в носовой полости или вблизи устья пазухи [54, 55]. Гнойная ринорея также указывает на повышенную вероятность наличия рентгенографических признаков ОБРС [56, 57]. Боль в области лица и зубная боль также позволяют заподозрить ОБРС [53, 55], но локализация боли обычно не позволяет определить, какие пазухи поражены [58]. Также отметим, что жалобы пациента на заложенность носа коррелируют с объективными измерениями, такими как риноманометрия или пиковая скорость воздушного потока в носовой полости [59].
Поскольку обычно существует клиническая дилемма в дифференцировании ОБРС и ВРС, в данном контексте была изучена специфичность симптомов ОБРС. Анамнез вирусной ИВДП вносит определенный вклад в специфичность симптомов для ОБРС, однако насколько это в действительности так, пока что не установлено. Аналогичным образом, хотя дифференциальная диагностика изолированной обструкции носовой полости или лицевой боли является широким вопросом (и выходит за рамки данных рекомендаций), специфичность для ОБРС возрастает при наличии одновременных гнойных выделений из носа (табл. 4). Например, мигрень, головная боль напряжения и зубной абсцесс могут имитировать боль при риносинусите, но отсутствие гнойных выделений из носа исключает данный диагноз на основе нашего определения.
Дополнительные признаки и симптомы ОБРС включают повышение температуры, кашель, усталость (недомогание), снижение обоняния (гипосмия), отсутствие обоняния (аносмия), верхнечелюстную зубную боль, а также ощущение заложенности или давления в ушах [60]. Хотя в большинстве ранних консенсусных отчетов для определения ОРС применялись комбинации основных и второстепенных симптомов [60], последние отчеты [13, 61] отклонили эту систему и вместо этого сосредоточились на трех основных симптомах, описанных выше.
Начальная диагностическая оценка при ОРС должна включать измерение показателей жизненно важных функций (температура, пульс, артериальное давление, частота дыхания) и физикальное обследование головы и шеи. Особое внимание следует уделять наличию или отсутствию следующих признаков: изменение (гнусавость) речи, которое указывает на заложенность носа; отек; покраснение кожи вследствие перегрузки капилляров (эритема) либо отек, локализованный в области скул или периорбитальной области; чувствительность кожи области щек или чувствительность при перкуссии верхних зубов; гнойное отделяемое в носу или по задней стенке глотки; признаки вовлечения тканей за пределами пазух (флегмона лица или периорбитальных тканей, орбитальная протрузия, нарушения движения глаз, скованность движений шеи). Тем не менее из всех физикальных признаков важное диагностическое значение имеет только наличие гнойного отделяемого в носовой полости или по задней стенке глотки, что было описано выше.
Результаты культуральных исследований выделений из носовой полости или носоглотки не позволяют различить ОБРС и ВРС, поскольку результаты посевов выделений из носовой полости плохо коррелируют с посевами выделений из пазух верхней челюсти, полученных путем прямой аспирации [62]. Посев секрета из среднего носового хода, полученного с помощью эндоскопии, имеет лучшую корреляцию, но его роль в рутинном лечении неосложненного ОБРС установлена не была [63].
Переход от вирусной инфекции к бактериальной
Только около 0,5–2,0 % случаев ВРС осложняются бактериальной инфекцией [64]. Предшествующая вирусная инфекция может способствовать развитию ОБРС путем обструкции дренажа пазух, осуществляемого при дыхании через нос [65], способствуя росту болезнетворных бактерий, которые колонизируют полость носа и носоглотку [64], и оседанию бактерий из полости носа в пазухах во время попыток интенсивного продувания носовой полости. Хотя ОБРС часто рассматривается в качестве переходного состояния от предшествующей вирусной ИВДП [51], бактериальная инфекция может развиться в любой момент заболевания. Понятие перехода, однако, является полезным для принятия решений относительно лечения [53], особенно с учетом динамики ВРС и вариантов болезни, которые наиболее вероятно могут быть связаны с бактериальной инфекцией.
В первые 3–4 дня заболевания ВРС невозможно отличить от ранних стадий ОБРС; поэтому только в отношении пациентов с тяжелыми симптомами и проявлениями инфекции за пределами пазух имеются соответствующие подозрения на бактериальную инфекцию. Точно так же сохраняющиеся симптомы в период между 5-м и 10-м днем сопоставимы с ВРС, но в то же время могут представлять и начальные стадии ОБРС. В этот период времени, однако, вариант первоначального улучшения с последующим ухудшением («повторное ухудшение») сопоставим с ОБРС [13, 56, 57]. Спустя 10 дней остаточная увеличенная толщина слизистой оболочки пазухи, пораженной вирусом, может сохраняться обычно в отсутствие активной вирусной инфекции, но вероятность подтверждения бактериальной инфекции при аспирации содержимого пазухи составляет около 60 % [66].
Gwaltney с коллегами [6] изучали динамику симптомов и признаков спонтанной риновирусной инфекции (рис. 2).
/79.jpg)
Пик типичных симптомов приходится на 2-й и 3-й день с последующим ослаблением, однако симптомы могут сохраняться на протяжении 14 и более дней. Симптомы ВРС могут сохраняться более 10 дней, но их тяжесть постепенно уменьшается. Таким образом, ГОР было принято решение изменить рекомендацию «ОБРС следует диагностировать в случаях, когда а) симптомы или признаки острого риносинусита присутствуют в течение 10 или более дней после появления симптомов со стороны верхних дыхательных путей» на «ОБРС следует диагностировать в случаях, когда а) симптомы или признаки острого риносинусита сохраняются без признаков улучшения в течение по крайней мере 10 дней после появления симптомов со стороны верхних дыхательных путей».
Повышенная температура присутствует у некоторых пациентов с ВРС в первые дни болезни (рис. 2), но не является предиктором бактериальной инфекции в качестве изолированного диагностического критерия. Чувствительность и специфичность повышенной температуры составляет только около 50 % для ОБРС [52, 53], а систематический обзор привел к выводу, что доказательных данных в поддержку применения повышенной температуры тела и лицевой/зубной боли как критериев, позволяющих точно отличить ОБРС от ВРС, недостаточно [68]. По этой причине мы не включали повышенную температуру тела в качестве основного признака/симптома в диагностику ОБРС.
Хотя наша ГОР пришла к выводу, что доказательных данных недостаточно, чтобы выступить в поддержку варианта тяжелого проявления ОБРС, другие специалисты однозначно выделяют данную подгруппу пациентов. Meltzer и соавт. [13] выделяют особые варианты ОБРС, когда гнойные выделения из носа в течение 3–4 дней сопровождаются значительным повышением температуры. Определение термина «высокая температура» дано не было, но данный критерий применялся только к тяжелому течению заболевания при более короткой продолжительности. В рекомендациях по синуситу у детей, разработанных Американской академией педиатрии [69], одновременное наличие в течение 3 или более дней высокой температуры тела и гнойных выделений из носа рассматривалось как тяжелое течение ОБРС, требующее назначения антибактериальной терапии. Точно так же в руководстве по ОБРС Американского общества по инфекционным болезням [15] рекомендуется рассматривать диагноз ОБРС, если у пациента с начала заболевания наблюдается тяжелая симптоматика или высокая температура (> 39 °C) наряду с гнойными выделениями или лицевой болью продолжительностью не менее 3–4 дней подряд от начала заболевания.
Мы рекомендуем объяснять пациентам причины ОРС, а также то, почему важно отличить предполагаемый ВРС от ОБРС. В табл. 5 представлен информационный листок пациента, который можно использовать в обучении.
Рекомендация 1В. Проведение рентгенографии у пациентов, отвечающих критериям ОРС, не рекомендуется, за исключением случаев подозрения на наличие осложнений или альтернативного диагноза. Рекомендация (против проведения рентгенографии) основана на диагностических исследованиях с незначительными ограничениями и преобладанием пользы над возможным вредом при непроведении процедуры.
Обоснование
Цель данной рекомендации — подчеркнуть отсутствие необходимости выполнять рентгенографию у пациентов с неосложненным ОРС для дифференциации ОБРС и ВРС, за исключением случаев подозрения на наличие осложнений или альтернативного диагноза.
Рентгенография придаточных пазух не нужна у пациентов, которые отвечают клиническим диагностическим критериям (табл. 4) ОБРС [33, 70–72]. Для оценки придаточных пазух носа могут использоваться такие методы визуализирующей диагностики, как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Американская коллегия радиологов (АКР) заявляет, что обзорная рентгенограмма придаточных пазух является неинформативной в большом проценте случаев и требует дополнительного проведения КТ [70]. Метаанализ 6 исследований показал, что рентгенография пазух обладает умеренной чувствительностью (76 %) и специфичностью (79 %) по сравнению с пункцией пазух в диагностике ОБРС [73]. Вовлечение пазух часто сопровождает подтвержденные вирусные ИВДП [74], что делает невозможной дифференциацию ОБРС и ВРС исключительно на основании результатов визуализирующих исследований. Кроме того, клинические критерии могут иметь сопоставимую диагностическую точность с рентгенографией пазух, при этом проведение рентгенографии не является экономически эффективным независимо от распространенности синусита [73].
При подозрении на наличие осложнений ОБРС или альтернативного диагноза можно провести визуализирующие исследования [33]. Осложнения ОБРС включают вовлечение орбитальных, внутричерепных или мягких тканей. Альтернативные диагнозы включают злокачественные процессы и другие неинфекционные причины лицевой боли. Также можно провести рентгенографию при наличии у пациента модифицирующих факторов или сопутствующих заболеваний, которые предрасполагают к развитию осложнений, таких как сахарный диабет, состояния иммуносупрессии, а также анамнез травмы/хирургического вмешательства в области лица.
КТ пазух целесообразна в случаях, когда имеются подозрения на наличие осложнений ОБРС: сильная головная боль, отек лица, паралич черепных нервов, выпячивание глаз (проптоз); результаты КТ, которые указывают на ОБРС, включают затемнение, определение уровня воздуха над жидкостью, а также утолщение слизистой оболочки от умеренной до значительной степени. Осложнения ОБРС лучше исследовать с помощью КТ с контрастированием йодосодержащими препаратами или МРТ с гадолинием, которые позволяют выявить распространение процесса за пределы синуса [33, 75–77]. Подозрение на наличие осложнений является единственным показанием к выполнению МРТ придаточных пазух в условиях ОБРС.
Ограничения к выполнению КТ включают высокую стоимость и лучевую нагрузку процедуры. Доза облучения зависит от техники выполнения и при использовании несоответствующего подхода может превышать в 10 раз дозу облучения при обычной рентгенографии. Однако при тщательном выборе техники исполнения КТ дозу облучения можно снизить до уровня, который лишь в два раза превышает уровень облучения при обычной рентгенографии. Другие ограничения КТ включают отсутствие специфичности для бактериальной инфекции, относительный дефицит корреляции между локализацией симптомов и поражением пазух на КТ, а также высокую частоту случайных патологических находок у бессимптомных лиц [74, 78–80].
Альтернативой традиционной КТ является конусно-лучевая КТ, выполняемая в амбулаторном порядке, которая имеет преимущества с точки зрения места оказания медицинской помощи и возможного снижения дозы облучения. Показания для КТ, выполняемой в амбулаторном порядке, такие же, как и для традиционной томографии, и ее не следует использовать для диагностики и лечения неосложненных форм ОБРС.
Рекомендация 2. Симптоматическое лечение вирусного риносинусита (ВРС): для облегчения симптомов ВРС можно рекомендовать анальгетики, применение местных интраназальных стероидов и/или орошение носовой полости солевыми растворами. Возможный вариант, основанный на данных рандомизированных контролируемых исследований с ограничениями и когортных исследований с неопределенным соотношением пользы и вреда, которое может различаться у разных пациентов.
Обоснование
ВРС — это заболевание, которое проходит самостоятельно, без лечения, характеризуется наличием кашля, чихания, ринореи, боли в горле и заложенностью носа [67]. Заболеваемость острым ВРС достаточно высока, в среднем развивается, согласно оценкам, от 2 до 5 раз в год у среднестатистического взрослого человека. Только от 0,5 до 2,0 % этих случаев осложняются присоединением вторичной бактериальной инфекции [19]. В то время как проявления вирусной и бактериальной инфекции могут быть очень схожими, акцент на продолжительности, особенностях течения заболевания и тяжести симптомов помогает отличить вирусную инфекцию от бактериальной (табл. 4). Симптомы острого ВРС обычно достигают пика в пределах 3 дней от начала заболевания, после чего постепенно уменьшаются с последующим разрешением в период с 10-го по 14-й день.
Наличие гнойных выделений из носа само по себе не указывает на наличие бактериальной инфекции; изменение цвета выделений из носа указывает на наличие воспаления и не является специфическим для инфекции. Окрашивание выделений из носа связано с нейтрофилами, а не бактериями [49, 81–83]. Нормальный транспорт слизи требует слаженной работы ресничек. ВРС способствует развитию сильной воспалительной реакции, вызывая разрушение ресничек, возникновение отека и чрезмерную продукцию слизи, которая дополнительно ослабляет работу ресничек [84].
Лечение ВРС прежде всего направлено на облегчение симптомов. Использование антибиотиков для лечения ВРС не рекомендуется, поскольку антибиотики неэффективны при вирусной инфекции и не обеспечивают прямого облегчения симптомов [85]. Таким образом, для облегчения симптомов могут использоваться такие паллиативные средства, как анальгетики, противовоспалительные препараты, солевые растворы для орошения носовой полости, деконгестанты, антигистаминные, муколитические, противокашлевые препараты, а также стероиды для местного интраназального применения, по отдельности или в различных комбинациях [16].
Анальгетики или жаропонижающие препараты (парацетамол, ибупрофен или другие нестероидные противовоспалительные средства) можно применять для купирования болевого симптома или лихорадки. Орошение носовой полости солевыми растворами является паллиативным и очищающим методом с низким риском возникновения побочных реакций [15]. Результаты кохрановского обзора [86] свидетельствуют о незначительных улучшениях показателей симптомов со стороны носовой полости при использовании солевого раствора для орошений носовой полости как в физиологической, так и в гипертонической концентрации.
Пероральный прием деконгестантов может облегчить симптомы и рекомендуется к рассмотрению при отсутствии каких-либо медицинских противопоказаний, например гипертензии или приступов тревоги. Местное применение деконгестантов, вероятно, является паллиативным методом лечения, при этом рекомендуется, чтобы непрерывная продолжительность применения не превышала 3–5 дней в соответствии с рекомендациями производителей во избежание эффекта рикошета в виде заложенности носа или развития медикаментозного ринита [87]. Клинический опыт показывает, что пероральный прием антигистаминных препаратов позволяет облегчить симптомы чрезмерных выделений из носа и чихания, хотя какие-либо данные клинических исследований, которые бы поддерживали применение антигистаминных препаратов при остром ВРС, отсутствуют. Для облегчения симптомов ВРС часто используются гвайфенезин (отхаркивающий препарат) и декстрометорфан (противокашлевый препарат), но доказательных данных, свидетельствующих в пользу их клинической эффективности, недостаточно. Соответственно, принятие решения об их применении, как правило, основывается на предпочтениях пациента и врача.
Определенную роль в лечении ВРС может иметь местное применение интраназальных стероидов, хотя они и не утверждены по данному показанию Управлением по контролю пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA). В ходе систематического обзора [88] было обнаружено, что интраназальные стероиды позволяли облегчить болевой симптом в области лица и заложенность носа у пациентов с ринитом и острым синуситом, несмотря на то что у большинства пациентов, вероятно, имела место вирусная инфекция. Выраженность эффекта, однако, была небольшой: 66 % пациентов отметили улучшение при применении плацебо по состоянию на 14–21-й день, при терапии стероидами показатель составил 73 %. Нежелательные явления наблюдались редко, так что решение о том, оправдан ли возможный умеренный клинический эффект при соответствующей стоимости, следует принимать, главным образом исходя из предпочтений пациента.
Рекомендация 3. Симптоматическое лечение острого бактериального риносинусита (ОБРС): для облегчения симптомов ОБРС можно рекомендовать анальгетики, применение местных интраназальных стероидов и/или орошение носовой полости солевыми растворами. Возможный вариант основан на данных рандомизированных контролируемых исследований с включением гетерогенных выборок пациентов, диагностическими критериями и критериями соотношения пользы и вреда.
Обезболивающая терапия
Купирование боли является основной целью лечения ОБРС и часто именно это является причиной обращения пациентов за медицинской помощью [52, 53]. Боль в области лица является кардинальным симптомом для диагностики ОБРС (табл. 4) и может вовлекать переднюю часть лица, периорбитальную область либо проявляться диффузной или локализованной головной болью. Применения безрецептурных анальгетиков, таких как нестероидные противовоспалительные препараты или ацетаминофен, обычно достаточно для купирования лицевой боли, связанной с ОБРС. Применение наркотических анальгетиков требуется редко и не рекомендуется ввиду возможных побочных эффектов.
Кортикостероиды для местного и перорального применения
Местные интраназальные кортикостероиды используются отдельно или в комбинации с пероральными антибиотиками для симптоматического лечения ОБРС. Рецептурные препараты, изучавшиеся в этих испытаниях, включают мометазон [89–91], флутиказон [92], флунисолид [93] и будесонид [94]. Также доступен безрецептурный стероид для интраназального применения, триамцинолона ацетонид, однако он не изучался непосредственно при ОБРС.
Кохрановский обзор [95], включивший 4 РКИ местного интраназального кортикостероида по сравнению с плацебо или отсутствием лечения ОБРС, показал, что стероиды увеличивали частоту купирования симптомов с 66 до 73 % через 15–21 день (отношение рисков 1,10; 95% ДИ 1,02–1,18). Исследования имели низкий риск систематической ошибки, также были отмечены только незначительные нежелательные явления, которые включали носовое кровотечение, головную боль и зуд в области носа. Авторы пришли к выводу о необходимости взвешивать умеренную (количество пролеченных пациентов на одного излеченного), но клинически значимую пользу применения интраназальной стероидной терапии с соответствующей стоимостью и незначительными нежелательными явлениями.
Хотя интраназальные стероиды используются в качестве дополнения к пероральной антибактериальной терапии в лечении ОБРС, результаты нельзя применять к пациентам со спорадическим ОБРС, как определено в данных рекомендациях. Dolor с коллегами [92] удалось увеличить частоту успешного лечения ОБРС в течение 3 недель с 74 до 93 % при добавлении флутиказона в форме назального спрея к пероральному цефуроксиму, однако у всех пациентов определялся анамнез ХРС или рецидивирующего ОРС. Наоборот, Williamson с коллегами [94] изучали пациентов с нерецидивирующим ОРС и не обнаружили каких-либо преимуществ применения амоксициллина в качестве монотерапии или местного применения будесонида по сравнению с плацебо. В это исследование, однако, могло быть включено большое количество лиц с ВРС, поскольку у большинства пациентов симптомы наблюдались менее 10 дней (медиана составила 7 дней), что не соответствует нашим диагностическим критериям для ОБРС (табл. 4).
Кохрановский обзор [96] применения системных кортикостероидов при ОБРС не выявил какого-либо преимущества по сравнению с плацебо при применении пероральных стероидов в качестве монотерапии. Исходя из ограниченных данных, полученных в 5 исследованиях, было установлено, что пероральное применение стероидов в сочетании с антибиотиками может оказывать умеренный краткосрочный положительный эффект в виде купирования симптомов (количество пролеченных пациентов на одного излеченного = 7), однако достоверность результатов была ограничена значительным риском систематической ошибки, связанной с отсутствующими данными. Нежелательные явления были достаточно легкими (тошнота, рвота, жалобы на дискомфорт в желудке), но авторы считают, что необходимы дополнительные исследования для надлежащего подтверждения истинных эффектов системных стероидов.
Орошение носовой полости солевыми растворами, деконгестанты, антигистаминные препараты, гвайфенезин
Орошение носовой полости солевыми растворами, отдельно или в сочетании с другими вспомогательными мерами, может улучшить качество жизни, облегчить симптомы и уменьшить использование лекарственных средств при ОБРС, особенно у пациентов с частыми синуситами. Орошение буферизованным гипертоническим (3–5%) солевым раствором продемонстрировало умеренную пользу при ОРС в 2 клинических испытаниях [97, 98]. По сравнению с изотоническим солевым раствором гипертонический раствор может обладать большим противовоспалительным эффектом и лучшей способностью уменьшать количество слизи, а также временно улучшать мукоцилиарный клиренс [99–101]. Одно рандомизированное контролируемое исследование с участием пациентов с ОРВИ и ОРС не продемонстрировало какой-либо разницы в результатах при использовании гипертонического раствора, изотонического раствора и отсутствии орошений [102]. Систематические обзоры для оценки орошения носовой полости солевыми растворами при ОБРС у взрослых отсутствуют.
Местные и системные деконгестанты (симпатомиметики) используются для лечения заложенности носа, связанной с простудой, в течение многих лет [103–107]. РКИ, которые бы специально изучали эффективность деконгестантов при ОБРС, отсутствуют; однако 2 небольших исследования показали, что ксилометазолин в виде назального спрея уменьшает отечность слизистой оболочки носа и пазух, согласно данным визуализирующих исследований [65, 108], и превосходит однократное пероральное применение псевдоэфедрина [108]. Еще одно небольшое нерандомизированное исследование продемонстрировало улучшение результатов при добавлении ксилометазолина в виде спрея к антибиотикам при ОБРС [97]. Местные деконгестанты не следует применять более 3–5 дней подряд без достаточно длительного периода перерыва ввиду возможного симптома рикошета в виде заложенности носа и медикаментозного ринита [87].
Антигистаминные препараты не играют роли в симптоматическом лечении при ОБРС у пациентов с неатопическими состояниями [47, 59, 109]. Исследования, которые бы поддерживали их применение при инфекционных заболеваниях, отсутствуют, кроме того, антигистаминные препараты могут усилить заложенность носа вследствие высушивания слизистой оболочки. Наоборот, 1 рандомизированное контролируемое исследование среди пациентов с аллергией и ОБРС продемонстрировало снижение чихания и заложенности носа при применении лоратадина по сравнению с плацебо при их добавлении к антибиотикам и пероральным кортикостероидам [110]. Таким образом, антигистаминная терапия может быть рассмотрена у пациентов с ОБРС, симптомы которых свидетельствуют об аллергическом компоненте. В этом отношении антагонисты H1-рецепторов второго поколения в меньшей степени вызывают седативный эффект и антихолинергические побочные эффекты, чем антагонисты H1-рецепторов первого поколения [111].
Гвайфенезин является водо- и спирторастворимым средством, которое используется в качестве отхаркивающего; гвайфенезин снижает вязкость мокроты и бронхиальную секрецию. Препарат отпускается без рецепта и иногда рекомендуется для улучшения отхождения выделений из носа, однако доказательные данные о его влиянии, если таковое имеется, на симптоматическое улучшение при ОБРС отсутствуют.
Рекомендация 4. Начальное лечение острого бактериального риносинусита (ОБРС): у взрослых пациентов с неосложненными формами ОБРС следует предлагать либо выжидательную тактику (без применения антибиотиков), либо назначение начальной антибактериальной терапии. Выжидательную тактику следует предлагать только в том случае, когда есть возможность обеспечить надлежащее наблюдение с последующим назначением антибактериальной терапии в случае отсутствия улучшения в течение 7 дней после постановки диагноза ОБРС или при ухудшении в любое время.
Рекомендация основана на систематических обзорах двойных слепых рандомизированных контролируемых исследований с некоторой гетерогенностью диагностических критериев и тяжести заболевания и относительным равновесием пользы и риска.
Сравнение плацебо и антибактериальной терапии
Во всех четырех систематических обзорах РКИ, опубликованных с момента выхода предыдущей версии рекомендаций [1], изучали применение антибиотиков в сравнении с плацебо при ОБРС [112–115]. Все обзоры включали РКИ, в которых диагноз устанавливался только на основании клинической симптоматики. В некоторых из включенных РКИ также применялись рентгенологические, серологические или микробиологические исследования для подтверждения диагноза. В совокупности результаты систематического обзора можно подытожить следующим образом.
Уровни выздоровления или улучшения состояния спустя 7–15 дней свидетельствовали в пользу антибактериальной терапии, однако клиническая польза была незначительной: 91 % для антибактериальной терапии против 86 % для плацебо. Количество пациентов, которых необходимо было пролечить для достижения клинической пользы, составляло от 11 до 15, а отношение шансов для общего эффекта лечения — от 1,25 до 1,87.
Продолжительность болевого симптома или болезненного состояния, связанных с ОБРС, не продемонстрировала устойчивой взаимосвязи с первоначальным лечением [113].
Нежелательные явления наблюдались чаще у пациентов, получавших антибактериальную терапию (отношение шансов от 1,87 до 2,10; индекс потенциального вреда 8,1), однако уровень выбывания из исследования в связи с нежелательными явлениями был незначительным (1–1,5 %) и аналогичным в обеих группах.
Осложнения были аналогичны независимо от первоначального лечения.
Хотя в РКИ, включенных в данный метаанализ, из рандомизации, как правило, исключались пациенты с тяжелой степенью заболевания, что именно подразумевалось под термином «тяжелая степень», не указывалось. Таким образом, доказательные данные, которые бы поддерживали или опровергали утверждение о том, что пациентам с более тяжелым течением ОБРС всегда следует изначально назначать антибактериальную терапию, отсутствуют. Одно исследование показало, что пациенты с ОРС и гнойными выделениями в глотке имеют большую вероятность извлечь пользу от антибактериальной терапии [114]. К сожалению, данные о том, какие пациенты могут получить большую или меньшую пользу от антибактериальной терапии, отсутствуют. Кроме того, убедительные доказательства того, что более старший возраст или наличие аллергического ринита могут являться прогностическим фактором большей продолжительности или хронизации ОБРС, отсутствуют [116, 117], так же как и какие-либо доказательства того, что пожилые пациенты получают больше пользы от антибактериальной терапии [114].
Данные рекомендации отличаются от предыдущей версии [1] тем, что в них применение выжидательной тактики больше не ограничивается пациентами с ОБРС легкой и средней степени тяжести, поскольку данные, которые бы свидетельствовали о дополнительной пользе антибактериальной терапии в случаях более тяжелого заболевания, отсутствуют. Данный подход также отличается от других рекомендаций и консенсусных положений, которые рекомендуют применение антибактериальной терапии у пациентов с тяжелым ОБРС, проявляющимся высокой температурой и сильной или усиливающейся болью в области лица [15, 19, 69].
Принятие совместных решений с пациентами
Применение антибактериальной терапии в лечении ОБРС следует обсуждать с пациентом, учитывая его предпочтения и применимость доступных на момент принятия решения доказательных данных к конкретным условиям врачебной практики и группе пациентов. Некоторые пациенты предпочтут по возможности избежать антибактериальной терапии, в то время как другие могут потребовать назначения антибиотиков в качестве начальной терапии, поскольку для них важно небольшое, но статистически значимое улучшение клинического состояния, которое могут обеспечить антибиотики. Независимо от используемой начальной стратегии следует предоставить пациенту четкую информацию о возможных вариантах лечения, в том числе и о симптоматическом лечении (табл. 6). Также может быть полезным анализ уже имеющихся у пациента знаний об антибактериальной терапии и его отношения к ней и ОБРС, поскольку они могут оказывать влияние на предпочтения пациента.
У некоторых пациентов выжидательная тактика может не принести результатов, тогда как назначение антибиотиков может оказаться эффективным. Во избежание расходов и неудобств, связанных с повторными амбулаторными обращениями, врач, возможно, пожелает применить тактику WASP/SNAP. Такая тактика, с указанием того, в каких случаях и когда приобрести потенциально назначенный препарат и начать лечение, позволит пациенту, который соглашается на выжидательную тактику и выражает ту или иную обеспокоенность по поводу возможности повторного посещения врача для получения рецепта на антибиотик, чувствовать себя в безопасности. Пациенты информируются о том, что приобрести назначенный препарат и начать антибактериальную терапию следует в том случае, если их состояние не улучшится в течение 7 дней или же ухудшится в любое время. Пациенту также следует связаться с врачом или медперсоналом и сообщить о начале антибактериальной терапии.
Рекомендация 5. Выбор антибактериальной терапии при остром бактериальном риносинусите (ОБРС): если принято решение о лечении ОБРС с помощью антибактериальной терапии, для большинства взрослых в качестве терапии первой линии следует назначать амоксициллин с клавуланатом или без него на 5–10 дней.
Рекомендация основана на рандомизированных контролируемых исследованиях с определенной гетерогенностью и дизайном, предусматривающим подтверждение отсутствия меньшей эффективности исследуемого препарата по сравнению с активным препаратом контроля, с преобладанием пользы над возможным вредом.
Выбор стартового антибиотика для лечения ОБРС
По клиническим исходам ОБРС значительных различий между разными антибактериальными препаратами не наблюдается. Систематический обзор [112], а также 2 РКИ [118, 119] среди пациентов, страдающих синуситами, с радиологическим или бактериологическим подтверждением диагноза значительного различия в частоте регрессии клинических проявлений у пациентов, принимавших амоксициллин или амоксициллин-клавуланат, в сравнении с пациентами, принимавшими цефалоспорины или макролиды, не обнаружили. В другом обзоре [48] 11 сравнительных метаанализов различий обнаружено не было, однако было установлено незначительное снижение частоты неэффективного лечения для амоксициллина-клавуланата в сравнении с цефалоспоринами (число пролеченных больных на одного излеченного составило 30).
Обоснование использования амоксициллина в качестве терапии первой линии для большинства пациентов с ОБРС заключается в его безопасности, эффективности, экономичности, а также узком спектре микробиологической активности [5, 11, 112, 120–122]. Рассматривать назначение амоксициллина-клавуланата для лечения ОБРС у пациентов зрелого возраста следует в случае высокого риска инфицирования микроорганизмами, резистентными к амоксициллину. Факторы, способные склонить врачей к рассмотрению назначения амоксициллина-клавуланата вместо амоксициллина, приведены в табл. 7 [123, 124].
Использование высоких доз амоксициллина-клавуланата (2 г в сутки перорально в два приема или 90 мг/кг/сутки перорально в два приема) рекомендовано [15] взрослым пациентам с ОБРС и высоким риском инфицирования резистентными к амоксициллину микроорганизмами. Высокие дозы амоксициллина являются предпочтительными по сравнению со стандартными дозами амоксициллина, главным образом в связи с необходимостью охвата нечувствительного к пенициллинам (НЧП) Streptococcus pneumoniae. Данному риску подвержены жители географических регионов с высокими эндемическими показателями (> 10 %) инвазии НЧП S.рneumoniae, пациенты с тяжелым течением инфекции (например, наличие доказательств системной токсичности, температуры 39 °С или выше, а также гнойных осложнений), в возрасте старше 65 лет, с недавним пребыванием в стационаре, принимающие антибиотики в течение последнего месяца, а также пациенты с иммунодефицитными состояниями [125].
Пациенты с аллергией на пенициллины
Пациентам с аллергией на пенициллины рекомендовано назначение доксициклина или респираторных фторхинолонов (левофлоксацина или моксифлоксацина) в качестве альтернативных препаратов для эмпирической антибактериальной терапии. Несмотря на это, фторхинолоны не рекомендованы для терапии первой линии при ОБРС у пациентов без аллергии на пенициллины, ввиду того что исходы сопоставимы с таковыми при использовании амоксициллина-клавуланата, а нежелательные явления возникают чаще, по данным некоторых исследований [126]. Комбинация клиндамицина и перорального цефалоспорина третьего поколения (цефиксима или цефподоксима) рекомендована для лечения взрослых пациентов с анамнезом отличной от I типа гиперчувствительности к пенициллинам.
Макролиды и триметоприм/сульфаметоксазол не рекомендованы для начального лечения ОБРС. Высокая распространенность резистентного к макролидам S.рneumoniae в Соединенных Штатах (> 40 %) [124], а также высокая частота резистентных к триметоприм/сульфаметоксазолу как S.рneumoniae (50 %), так и Haemophilus influenzae (27 %) могут привести к неэффективности лечения [127], однако это не было подтверждено данными сравнительных РКИ.
Длительность лечения и нежелательные явления
В большинстве исследований ОБРС антибиотики назначались на 10 дней. В систематическом обзоре 12 рандомизированных контролируемых исследований с подтвержденным посредством радиологического метода диагнозом ОБРС не было обнаружено различий в результатах эффективности антибактериальной терапии курсом от 3 до 7 дней в сравнении с курсом лечения от 6 до 10 дней [128]. Схожие результаты были получены и в других исследованиях с аналогичными показателями частоты разрешения симптомов в течение 3 недель после начала лечения, несмотря на длительность терапии [48, 129–131]. При сравнении 5-дневного и 10-дневного курса антибактериальной терапии также наблюдаются аналогичные показатели эффективности [128]. Нежелательные явления распространены при антибактериальной терапии, однако разнообразие отчетов об исследованиях исключает возможность конструктивного сравнения частоты развития нежелательных явлений при использовании разных классов антибиотиков [48]. Средний показатель частоты нежелательных явлений составляет от 15 до 40 %, а наиболее частыми жалобами являются тошнота, рвота, диарея, боль в животе, головная боль, высыпания на коже, фотосенсибилизация и вагинальный кандидоз. Нежелательные явления редко имеют такое тяжелое течение, чтобы быть причиной изменения тактики лечения, но при этом следует иметь в виду влияние антибиотиков на бактериальную резистентность.
Нежелательные явления чаще развиваются при антибактериальной терапии в сравнении с выжидательной тактикой, а также являются более распространенными при 10-дневном курсе лечения в сравнении с более короткими курсами. Использование антибактериальной терапии повышает частоту нежелательных явлений в среднем на 10–12 % в сравнении с плацебо [112, 113], с отношением шансов 1,8–2,1 [113, 115]. С другой стороны, частота нежелательных явлений ниже в случае приема антибиотиков в течение 5 дней в сравнении с 10-дневным курсом (отношение шансов 0,79) [128], таким образом, у пациентов с менее тяжелым течением заболевания следует рассматривать назначение более короткого курса антибактериальной терапии.
Бактериология ОБРС
Наиболее распространенными видами бактерий, выделяемых из верхнечелюстных пазух пациентов с начальными проявлениями ОБРС, являются S.pneumoniae, H.influenzae и Moraxella catarrhalis [5, 132], последний вид распространен преимущественно среди пациентов детского возраста. Обзор исследований по аспирации содержимого околоносовых пазух, проведенных среди взрослых пациентов с ОБРС, предполагает, что S.pneumoniae выделяется в 20–43 % случаев, H.influenzae — в 22–35 %, M.сatarrhalis — в 2–10 % и Staphylococcus aureus — в 10 % случаев [66, 133–136].
В случае назначения антибиотиков для лечения ОБРС следует принимать во внимание данные о локальной резистентности: это позволит избежать применения антибиотика, действие которого может оказаться неэффективным в связи с устойчивостью бактерий. К примеру, распространенность продуцирующих β-лактамазу штаммов H.influenzae в Соединенных Штатах составляет от 27 до 43 % [137], и в случае назначения амоксициллина без клавуланата данный штамм может оказаться устойчивым к лечению. Таким же образом распространенность резистентного к пенициллинам S.pneumoniae изменяется в зависимости от географического региона: наиболее распространен данный вид на юго-востоке (около 25 %), а менее всего — на северо-западе (около 9 %). И наконец, S.aureus, который определяется в 10 % случаев ОБРС, практически всегда продуцирует β-лактамазу [136, 138], что делает его резистентным к амоксициллину, но не к амоксициллину-клавуланату.
С тех пор как в 2000 году начали проводить иммунизацию детей при помощи пневмококковой конъюгированной вакцины (ПКВ), бактериология ОБРС изменилась. Соответственно, частота выявления S.рneumoniae при посеве содержимого среднего носового хода у пациентов с ОБРС снизились (35 % после вакцинации в сравнении с 45 % до вакцинации), но в то же время возросла частота выявления H.influenzae (36 % до вакцинации в сравнении с 43 % после вакцинации) [123]. В дополнение к изменению распространенности микроорганизмов применение ПКВ снизило распространенность инвазивных культур S.pneumoniae, резистентных к пенициллинам, до 8–11 % [127, 138, 139]. Внедрение 13-валентной ПКВ с 2010 года может способствовать дальнейшему снижению распространенности инвазивных пневмококковых инфекций [140], что упростит лечение пневмококков как возбудителей ОБРС.
Рекомендация 6. Неэффективное лечение острого бактериального риносинусита (ОБРС): если состояние пациента ухудшается, или отсутствует улучшение на фоне изначально выбранной тактики лечения спустя 7 дней после постановки диагноза ОБРС, или наблюдается ухудшение во время начальной терапии, следует повторно обследовать пациента для подтверждения диагноза ОБРС, исключения других возможных причин неудовлетворительного состояния и выявления осложнений. Если у пациента, для которого изначально было принято решение о выжидательной тактике, подтверждается ОБРС, следует начать антибактериальную терапию. Если пациенту изначально была назначена антибактериальная терапия, следует заменить антибиотик.
Рекомендация основана на ограниченных в разных отношениях рандомизированных контролируемых исследованиях, поддерживающих предельный срок в 7 дней для определения отсутствия улучшения состояния пациента, а также на экспертном мнении и данных фундаментальных экспериментальных исследований по изменению лечения с преобладанием пользы над возможным вредом.
Неэффективность начальной тактики лечения при предполагаемом ОБРС
О неэффективности начальной тактики лечения при предполагаемом ОБРС можно говорить в том случае, если на фоне начальной тактики лечения состояние пациента ухудшается или отсутствует его улучшение в течение 7 дней после постановки диагноза. Повторное обследование пациентов с неэффективной начальной тактикой лечения необходимо для подтверждения диагноза (табл. 4), выявления осложнений, исключения других причин неудовлетворительного состояния, а также изменения, при необходимости, тактики лечения. Ухудшение состояния определяется прогрессированием имеющихся признаков или симптомов ОБРС или появлением новых признаков или симптомов. Отсутствие улучшения определяется отсутствием уменьшения имеющихся признаков или симптомов ОБРС в течение 7 дней после постановки диагноза; данное определение неприменимо в случае, если у пациента наблюдаются постепенно уменьшающиеся персистирующие симптомы.
Обоснованием для установленного предельного периода в 7 дней после постановки диагноза для оценки эффективности лечения ОБРС являются данные РКИ по клиническим исходам. Систематический обзор данных по ОБРС, проведенный Rosenfeld и коллегами [1], показал, что улучшение клинической картины в период между 7-м и 12-м днем после включения в исследование наблюдалось у 73 % пациентов, рандомизированных на прием плацебо, показатель которого увеличивался до 85 % при приеме антибиотика. В последующем кохрановском обзоре [112] были установлены аналогичные результаты: 86 % пациентов выздоровели или же их состояние улучшилось в период между 7-м и 15-м днем после начала приема плацебо, этот же показатель для антибактериальной терапии составил 91 %.
Определение неэффективности тактики лечения как отсутствия улучшения клинической картины в течение 7 дней обеспечит приемлемые в процентном отношении показатели неблагоприятных исходов. Показатели улучшения состояния на 3-и — 5-е сутки составляют лишь 30 % в случае приема плацебо и незначительно выше (41 %) в случае приема антибиотиков [1]. Следовательно, пограничный 5-дневный период будет причиной гипердиагностики неэффективности тактики лечения, ввиду того что приблизительно у двух третей пациентов к тому времени еще не будет наблюдаться улучшение клинической картины независимо от выбранной тактики лечения. Использование более строгого критерия клинического выздоровления (вместо улучшения клинической картины) приведет к тому, что показатель неэффективности тактики лечения составит более 50 % на 7–12-й день. Таким образом, врачам и пациентам следует понимать, что для улучшения клинической картины при ОБРС может понадобиться до 7 дней, персистенция или незначительное ухудшение состояния до 7-го дня не обязательно указывает на неэффективность выбранной тактики, а полное выздоровление (исчезновение всех признаков и симптомов заболевания) может потребовать 14 и более дней.
У пациентов, включенных в РКИ, факторы риска или тяжесть заболевания могут не соответствовать таковым у лиц, не участвовавших в РКИ (или исключенных). Следовательно, предельный 7-дневный период для улучшения клинической картины может быть неприменим для пациентов с тяжелым течением заболевания, осложненными синуситами, иммунодефицитом, предшествующей синусостомией или сопутствующими бактериальными инфекциями; при определении надлежащего пограничного периода оценки эффективности лечения следует принимать во внимание возраст пациента, общее состояние, состояние сердечно-сосудистой и дыхательной систем, а также сопутствующие заболевания.
Обследование пациентов с ОБРС с неэффективностью начальной тактики лечения
Подтверждать диагноз ОБРС следует с помощью диагностических критериев, приведенных в табл. 4. В случае, если у пациента отсутствует симптомокомплекс «гнойные выделения из носа до 4 недель… сопровождающиеся обструкцией носовых ходов и наличием в области лица ощущения боли/давления/заполненности или и тем и другим», однако вместо этого присутствуют индивидуальные симптомы, следует рассматривать альтернативный диагноз. Распространенными причинами боли в области лица, которую ошибочно принимают за симптом ОБРС, являются мигрень, головная боль напряжения, кластерная головная боль и височно-нижнечелюстной синдром. Таким же образом выделения из носа или заложенность носа могут быть вызваны распространенными неинфекционными заболеваниями, в том числе аллергическим ринитом, вазомоторным ринитом, искривлением носовой перегородки, а также коллапсом носового клапана. Визуализирующие исследования не показаны в случае неосложненного ОБРС, однако могут помочь при исключении ОБРС (в случае, к примеру, неверного предыдущего диагноза), если пациент не отвечает на лечение.
Пациентов с повторно подтвержденным диагнозом ОБРС, однако неэффективным лечением, особенно пациентов с ухудшением течения заболевания, рекомендуется обследовать на предмет возможных осложнений, включающих орбитальное и интракраниальное распространение инфекции. Полученные при физикальном обследовании данные, которые могут натолкнуть на мысль об осложнении, включают проптоз глазного яблока, нарушения зрения, сильную головную боль, патологические движения глазных яблок, нарушения психического статуса, а также периорбитальное воспаление, отек или эритему. Острый фронтит является типичной причиной сильной головной боли, локализированной в лобной области над орбитами, с болезненной чувствительностью от оказываемого давления на дно лобной пазухи. Сфеноидит обычно является причиной тупой боли в затылке, в частности над затылочным бугром с иррадиацией в лобную и ретроорбитальную области.
Культуральное исследование микрофлоры выделений из носа может помочь в последующем выборе антибактериальной терапии, а образцы для посева лучше получать путем прямой аспирации содержимого синусов, нежели взятием мазка из носоглотки. Альтернативным методом у взрослых пациентов является эндоскопическое взятие образцов для посева из среднего носового хода. Систематический обзор, проведенный Benninger и коллегами [63], продемонстрировал, что чувствительность метода эндоскопического взятия для посева из среднего носового хода составляет 81 %, специфичность — 91 %, прогностическая ценность положительного результата — 83 %, прогностическая ценность отрицательного результата — 89 %, а общая точность метода составляет 87 % (95% ДИ 81–93 %) в сравнении с прямой аспирацией содержимого пазух.
Антибактериальная терапия ОБРС в случае неэффективности начальной тактики лечения
В случае подтвержденного диагноза ОБРС и неэффективности начальной выжидательной тактики следует назначить лечение амоксициллином с клавуланатом или без, что рассматривалось в предыдущем разделе. Пациентам с аллергией на пенициллин рекомендовано назначать доксициклин или респираторный фторхинолон (левофлоксацин или моксифлоксацин). Комбинация клиндамицина и перорального цефалоспорина третьего поколения (цефиксима или цефподоксима) рекомендована взрослым пациентам с отличной от I типа гиперчувствительностью к пенициллину в анамнезе.
Пациентам, начальная тактика лечения которых заключалась в приеме амоксициллина без клавуланата, можно назначать высокие дозы амоксициллина с клавуланатом, доксициклин, респираторные фторхинолоны (левофлоксацин или моксифлоксацин) или комбинацию клиндамицина и перорального цефалоспорина третьего поколения (цефиксима или цефподоксима).
В случае, если во время антибактериальной терапии состояние пациента ухудшается или же не улучшается в течение 7 дней, следует подумать о возможном инфицировании микроорганизмом, резистентным к данному препарату, и необходимости перехода на альтернативную антибактериальную терапию и повторного обследования пациента. При изменении антибиотика следует учитывать ограничения спектра активности предыдущего препарата [5]. Например, у пациентов, принимающих амоксициллин, обычно определяется продуцирующий β-лактамазу штамм H.influenzae или M.сatarrhalis. Также часто выявляется S.pneumoniae с пониженной чувствительностью к β-лактамам, макролидам, тетрациклинам и триметоприму/сульфаметоксазолу, а частота выявления в значительной степени коррелирует с предыдущей антибактериальной терапией.
Лишь в немногих исследованиях рассматривались результаты микробиологических исследований неэффективного лечения ОБРС; тем не менее в тех исследованиях, в которых проводились посевы материала из пазух, было установлено наличие высокого процентного показателя бактерий с пониженной чувствительностью к первоначальному антибиотику [125, 141–145]. Brook и Gober [125] провели последовательные посевы назофарингеальных образцов 20 пациентов детского возраста с ОБРС, у которых наблюдалась неэффективность начальной эмпирической терапии. Повышенные уровни резистентности, показателем которых является минимальная ингибирующая концентрация (МИК), минимум в два раза превышающая таковую для соответствующих штаммов до лечения, наблюдались у 49 % пациентов.
Выбор антибиотиков в случае неэффективности лечения ОБРС обусловлен надлежащим перекрытием спектра предполагаемых бактерий или их чувствительностью к антибактериальным препаратам, если проводился посев. Применение антибиотика повышает вероятность наличия резистентных организмов, например резистентных к β-лактамам и доксициклину S.pneumoniae, а также H.influenzae или M.сatarrhalis, продуцирующих β-лактамазу [141, 146–148]. Прогнозирование вероятности надлежащего покрытия спектра резистентных организмов осуществляется с помощью фармакокинетических исследований, тестов чувствительности in vitro, а также определения минимальной ингибирующей концентрации [149–154]. Экспериментальные и клинические исследования позволяют предположить наличие взаимосвязи между исходами лечения и фармакодинамическими характеристиками, однако при этом нужно отметить, что данные в первую очередь касаются острого среднего отита и негоспитальной пневмонии.
Оптимальное лечение инфекции, вызванной мультирезистентными штаммами S.pneumoniae, а также H.influenzae и M.сatarrhalis, продуцирующих β-лактамазу, заключается в применении высоких доз амоксициллина-клавуланата (4 г в сутки в амоксициллиновом эквиваленте) или респираторного фторхинолона (левофлоксацина, моксифлоксацина). Данные препараты также будут воздействовать на менее распространенных возбудителей, таких как S.aureus и анаэробные бактерии. И наоборот, пероральные цефалоспорины и макролиды, как предполагается, не смогут надлежащим образом обеспечить воздействие на S.pneumoniae или H.influenzae.
Рекомендация 7А. Диагностика хронического риносинусита (ХРС) или острого риносинусита (ОРС): следует отличать ХРС и рецидивирующий ОРС от изолированных эпизодов ОБРС и других причин синоназальных симптомов.
Рекомендация основана на когортных и обсервационных исследованиях с преобладанием пользы над возможным вредом.
ХРС с полипами или без них, а также рецидивирующий ОРС определяются (табл. 8) на основе длительности и частоты рецидивов заболевания и отличаются от изолированных эпизодов ОБРС [13, 60, 155]. В случаях обоих диагнозов клиническая картина, влияние заболевания на качество жизни, диагностика, а также лечение значительно отличаются от таковых при ОБРС. Более того, ввиду хронического течения и разнообразия симптомов, свойственных полипозному и неполипозному ХРС, а также рецидивирующему ОРС, следует отличать их от других причин симптомов, зачастую связанных с заболеваниями носа и пазух.
Полипозный и неполипозный ХРС
Симптоматика ХРС различается по степени тяжести и распространенности. Обструкция носовых ходов является наиболее распространенным симптомом (81–95 %), за чем следует ощущение боли/давления/заполненности в области лица (70–85 %), окрашенные выделения из носа (51–83 %) и гипосмия (61–69 %). Наличие двух или более признаков или симптомов, сохраняющихся на протяжении более 12 недель, является высокочувствительным для ХРС, однако критерии, основанные лишь на симптоматике, являются относительно неспецифичными [78, 156–158].
Для постановки диагноза ХРС в дополнение к персистирующим симптомам необходимы данные, подтверждающие воспаление (полипы, отек или гнойные выделения) [155, 156, 159]. Можно провести обследование полости носа при помощи эндоскопа или налобного осветителя и расширителя для носовой полости, при этом обращая особое внимание на среднюю носовую раковину и средний носовой ход (рис. 3); также можно использовать отоскоп, однако он недостаточно удобен. Для отека обычно является характерной мягкая припухлость слизистой оболочки, а также ее бледно-розовый или белый цвет (рис. 4). Воспаление также может проявляться полипами носовой полости или среднего носового хода (рис. 5). В редких случаях ХРС можно заподозрить, основываясь главным образом на объективных данных (к примеру, полипы носовой полости или данные КТ), в случае исключения другой патологии.
Отличить ХРС от состояний со схожими симптомами может быть затруднительно. Согласно данным КТ как стандартного критерия, истинная распространенность ХРС среди пациентов, направляемых на обследование с подозрением по сипмтомам на ХРС, составляет от 65 до 80 %. Данный показатель распространенности может быть ниже в условиях первичного звена оказания медицинской помощи. ХРС может сопровождаться головной болью, жаром, кашлем, неприятным запахом изо рта, усталостью, зубной болью, а также другими неспецифичными признаками или симптомами. Таким образом, дифференциальная диагностика ХРС включает аллергический ринит, неаллергический ринит, вазомоторный ринит, неаллергический эозинофильный ринит, искривление носовой перегородки, а также нериногенные причины боли в области лица. Последние охватывают неврологические заболевания, такие как сосудистая головная боль, мигрень, кластерная головная боль, невралгия тройничного нерва и другие болевые синдромы в области лица [45, 161, 162].
/91.jpg)
ХРС главным образом является воспалительным заболеванием с периодическими обострениями (ОБРС), связанными с инфекцией. Лечение исключительно эпизодических случаев инфекции оставляет основное заболевание нелеченым, что, вероятно, способствует учащению обострений. В данном отношении ХРС в значительной мере подобен хроническому бронхиту. ХРС связан с отеком околоносовых пазух и нарушенным мукоцилиарным клиренсом. Бактериальной инфекции гораздо легче развиться при обструкции носовых ходов, связанной с отеком и застоем слизи. Следовательно, в случае наличия ХРС медикаментозную терапию и другие методы лечения следует направлять на основную причину воспалительного процесса.
Рецидивирующий острый риносинусит
Диагноз рецидивирующего острого риносинусита следует устанавливать в случае, если в течение последних 12 месяцев наблюдалось 4 и больше эпизода ОБРС, при этом в периоды между эпизодами признаки или симптомы риносинусита отсутствовали [60]. Несмотря на то что рецидивирующий острый риносинусит определяется как отдельная форма риносинусита, характеристики и клиническое влияние данного заболевания были установлены лишь в нескольких когортных исследованиях. Предельная частота минимального количества эпизодов, при которой следует рассматривать диагноз рецидивирующего острого риносинусита, была повторно подтверждена мультидисциплинарной командой экспертов и составляет 4 и более эпизода ОБРС в год [155]. Корректный диагноз рецидивирующего ОРС требует, чтобы каждый эпизод соответствовал критериям ОБРС (табл. 4). Подтверждение истинного бактериального эпизода риносинусита является желательным, однако не первостепенным для верификации основного диагноза рецидивирующего ОРС. В таких случаях обследование пациента во время эпизода ОБРС является необходимым условием для подтверждения диагноза [163]. Обследование среднего носового хода на предмет гнойного содержимого позволяет с большой уверенностью предположить ОБРС, а также получить с помощью эндоскопии образцы для посева [164].
ОРС следует отличать от изолированного эпизода ОБРС в связи с тяжелым бременем болезни, иным подходом к диагностике и лечению ОРС. Симптоматика, а также ее влияние на состояние пациента при рецидивирующем ОРС аналогичны таковым при ХРС, однако антибиотики применяются чаще [163]. Пациенты с обоими заболеваниями могут получить пользу от посева образцов их носовой полости, а также визуализирующих исследований. Ни длительная антибактериальная терапия [165], ни назначение назальных стероидов [166] не продемонстрировали пользы в снижении частоты эпизодов рецидивирующего острого синусита. Можно провести оценку аллергологического и иммунологического статуса для определения сопутствующего аллергического ринита или фонового иммунодефицита. У пациентов с рецидивирующим ОРС можно рассматривать проведение синусотомии [167].
Рекомендация 7В. Объективное подтверждение диагноза хронического риносинусита (ХРС): следует подтвердить клинический диагноз ХРС объективным документированием признаков синоназального воспаления с помощью передней риноскопии, эндоскопии носа или компьютерной томографии.
Сильная рекомендация основана на результатах кросс-секционного исследования с преобладанием пользы над возможным вредом.
Обоснование
Цель данной рекомендации заключается в акцентировании внимания на том, что диагноз ХРС не может основываться исключительно на признаках или симптомах, а требует также объективных подтверждающих данных, свидетельствующих о синоназальном воспалении (табл. 8). Предусмотренная необходимость объективных признаков воспаления повышает диагностическую достоверность ХРС и ограничивает возможность гипердиагностики. Более того, объективное подтверждение воспаления позволит избежать проведения нецелесообразных исследований и вмешательств у самостоятельно обратившихся пациентов с синоназальными симптомами, например вызванными хроническим аллергическим ринитом, которые можно запросто перепутать с ХРС.
Синоназальное воспаление может быть объективно подтверждено посредством прямой визуализации или КТ. Прямую визуализацию лучше всего осуществлять с помощью назальной эндоскопии, однако у некоторых пациентов будет достаточно провести переднюю риноскопию посредством отоскопа или расширителя для полости носа. Важной частью прямой визуализации является определение полипов носовой полости, что может потребовать исключения новообразования при одностороннем расположении полипов, равно как и предложить несколько иные ухищрения в случае лечения двусторонних полипов.
Предпочтения пациента не влияют на выбор подтверждающего метода исследования. Передняя риноскопия является наиболее экономически доступной и имеет наименьший процедурный риск, однако в то же время является менее чувствительной, чем эндоскопия, что увеличивает возможность постановки ошибочного диагноза. Как эндоскопия полости носа, так и КТ имеют значительно более высокую диагностическую точность, но при этом КТ сопровождается незначительным риском облучения, в то время как эндоскопия полости носа предусматривает дополнительные расходы. Данные различия кратко изложены в табл. 9 и рассмотрены ниже.
Прямая визуализация посредством эндоскопии или передней риноскопии
Прямая визуализация слизистой оболочки носа и околоносовых пазух наиболее информативна при проведении назальной эндоскопии [168]. Эндоскопическая визуализация обычно выполняется амбулаторно и позволяет оценить воспаление слизистой оболочки носа и околоносовых пазух, выделения из носа, а также патологические изменения и образования, замеченные при физикальном обследовании [169]. Назальную эндоскопию можно проводить с помощью гибкого или жесткого эндоскопа, обычно после местного нанесения деконгестанта и анестетика на слизистую оболочку носа. Области, доступные для осмотра во время эндоскопии, включают полость носа, нижнюю носовую раковину, нижний носовой ход, средний носовой ход, крючковидный отросток, полулунную расщелину, выводные отверстия верхнечелюстной пазухи, передний решетчатый пузырек, носолобное углубление, клиновидно-решетчатое углубление, выводное отверстие пазухи клиновидной кости, а также носоглотку.
Данные назальной эндоскопии, подтверждающие диагноз ХРС, включают гнойную слизь или отек в среднем носовом ходе или в этмоидальной области или полипы носовой полости или среднего носового хода [13, 61, 155]. Примерами могут служить патологии, напрямую связанные с ХРС или рецидивирующим острым риносинуситом, такие как назальные полипы, гнойные выделения из носа и искривление носовой перегородки. Альтернативные данные, благодаря которым можно заподозрить более сложные причины и механизмы заболевания или наличие иного патологического процесса, включают новообразования, мягкотканные образования, инородные тела, некроз тканей, а также данные, соответствующие аутоиммунным или гранулематозным заболеваниям.
В систематическом обзоре [168] была проведена оценка диагностической ценности назальной эндоскопии у взрослых пациентов с подозрением на ХРС с сопоставлением результатов с результатами КТ как золотого стандарта диагностики. В сравнении с исходным риском ХРС положительные результаты назальной эндоскопии (наличие гноя или полипов) имели дополнительную ценность 25–28 % в подтверждении ХРС, в то время как отрицательные результаты назальной эндоскопии имели дополнительную ценность 5–30 % в исключении ХРС. Авторами данного обзора было сделано заключение, что назальную эндоскопию следует проводить в качестве подтверждающего исследования первой линии в случае ХРС, отложив КТ для пациентов с длительным или осложненным течением заболевания.
Проведение передней риноскопии позволяет визуализировать переднюю треть носовой полости под прямым освещением и с использованием расширителя для носовой полости или другого инструмента для расширения преддверия носа. В условиях первичного звена медицинской помощи для обследования носовой полости часто используется отоскоп. В случае крупных полипов или обильных гнойных выделений достаточно провести переднюю риноскопию; тем не менее лучшим методом является назальная эндоскопия, которая также позволяет визуализировать заднюю стенку полости носа, носоглотку, а также зачастую и дренажные пути пазух в среднем и верхнем носовых ходах. Преимущества назальной эндоскопии в сравнении с передней риноскопией заключаются в возможности установить искривление задней части носовой перегородки, полипы или выделения в заднем отделе носовой полости, полипы или выделения в среднем носовом ходе или в клиновидно-решетчатом углублении. Более того, назальная эндоскопия позволяет провести целенаправленную аспирацию патологического содержимого для анализов и посева.
Визуализация при помощи КТ
Подтвердить диагноз также можно посредством КТ или магнитно-резонансной томографии (МРТ). МРТ не рекомендуется использовать для верификации диагноза ввиду дороговизны данного метода и его гиперчувствительности (гипердиагностика) в сравнении с КТ без контрастирования.
КТ позволяет определить степень и распространенность воспалительного процесса, основываясь на затемнении околоносовых пазух [169], также данный метод повышает диагностическую достоверность, поскольку его результаты коррелируют с наличием или отсутствием ХРС у пациентов с соответствующими диагнозу клиническими симптомами [163, 170]. Несмотря на то что данные КТ не всегда коррелируют с тяжестью симптомов, они являются объективным методом для мониторинга рецидивирующего или хронического течения заболевания [78, 171]. Патологические изменения слизистой оболочки, обструкция отверстий пазух, разные варианты анатомического строения, а также синоназальный полипоз наилучшим образом визуализируются при помощи КТ. Состояние слизистой оболочки, однако, является неспецифичным параметром, и утолщение слизистой оболочки следует интерпретировать в контексте результатов клинического обследования, назальной эндоскопии или того и другого [172].
В случае полипозного или неполипозного ХРС КТ выделяется важная роль в исключении агрессивных инфекций или новообразований, которые могут имитировать ХРС или ОРС. Разрушение кости, распространение процесса за границы околоносовых пазух, а также локальная инвазия позволяют заподозрить неопластический процесс. В случае обнаружения данных признаков следует провести МРТ для дифференциации доброкачественной обструкции и накопления секрета от опухоли, а также для оценки распространения процесса за пределы носовой полости и околоносовых пазух [76].
КТ околоносовых пазух следует проводить в случае рассмотрения или планирования эндоскопической синусотомии у пациентов с ХРС или рецидивирующим ОРС [173]. В дополнение к визуализации патологических изменений слизистой оболочки и затемнений пазух исследование предоставит подробные данные об анатомическом строении, необходимые в проведении хирургического вмешательства [76, 174]. Визуализация околоносовых пазух при помощи КТ обычно включает прямую аксиальную и фронтальную проекции, для того чтобы в полной мере визуализировать остиомеатальный комплекс. Более новой технологией, имеющей преимущества перед односпиральной КТ околоносовых пазух за счет того, что сканирование пациента проводится однократно, а все остальные проекции (например, фронтальная, сагиттальная) воссоздаются из первичного объема данных, является мультиспиральная КТ. Использование мультиспиральной КТ может снизить общую дозу ионизирующего излучения, а в случае оценки неопухолевого процесса допустимо проводить данное исследование не только для диагностики, но и для хирургического вмешательства.
Рекомендация 8. Факторы, влияющие на лечение: следует оценить пациента с ХРС или рецидивирующим ОРС на предмет хронических заболеваний, таких как астма, муковисцидоз, иммунодефицитные состояния, а также цилиарная дискинезия, которые могут влиять на лечение. Рекомендация основана на одном систематическом обзоре и нескольких наблюдательных исследованиях с преобладанием пользы над возможным вредом.
Обоснование
Цель данной рекомендации заключается в осведомлении практикующих врачей о пользе диагностирования и лечения основного заболевания, связанного с ХРС, для улучшения клинических исходов. В отличие от ОБРС, при ХРС и рецидивирующем ОРС наблюдаются потенциальные предрасполагающие факторы, способствующие персистированию заболевания и/или его рецидивам [60]. Астма [175, 176], муковисцидоз [177], иммунодефицитные состояния [178], цилиарная дискинезия [179] и разные варианты анатомического строения [180] являются некоторыми из тех факторов, которые были изучены в рамках данного вопроса. В идеальном случае раннее распознание факторов, способных привести к рецидивированию или персистированию риносинусита, может иметь ключевое значение в выборе наиболее оптимальной тактики лечения для отдельных пациентов.
Обследование пациента на предмет наличия астмы, муковисцидоза, иммунодефицитного состояния, а также цилиарной дискинезии заключается во внесении в медицинскую документацию информации о том, что данные состояния были рассмотрены в процессе дифференциальной диагностики ХРС или рецидивирующего ОРС. Дальнейшая оценка может включать анамнез, физикальное обследование или диагностические исследования на усмотрение врача. Группа по разработке рекомендаций отмечает, что данные состояния, за исключением астмы, являются редкими, и не рекомендует тщательные неизбирательные обследования всех пациентов подряд. Дополнительное обследование должно осуществляться в индивидуальном порядке, исходя из анамнеза пациента и результатов физикального обследования.
Астма и риносинусит
Связь между риносинуситом и астмой подтверждается высокой распространенностью ХРС и рецидивирующего ОРС среди пациентов, страдающих астмой [181, 182], и является особо заметной в случае тяжелой степени астмы [176, 183]. Степень тяжести астмы напрямую коррелирует с тяжестью рентгенологической картины заболевания пазух [183], а у 84–100 % пациентов с астмой тяжелой степени определяются патологические изменения пазух при КТ [175]. Более того, при лечении ХРС (консервативно или хирургически) симптомы астмы регрессируют и потребность в противоастматических препаратах снижается [184–186].
В ходе систематического обзора [187] было установлено, что проведение эндоскопической синусотомии улучшает контроль астмы, снижая при этом частоту ее обострений, госпитализации пациентов и применения системных и ингаляционных кортикостероидов; однако при этом функция легких остается неизменной [187]. Приведенные данные говорят в пользу лечения ХРС у пациентов, страдающих астмой, в случае, если риносинусит рассматривается в качестве возможной причины неудовлетворительного контроля астмы. Таким же образом пациентов с неудовлетворительным контролем заболевания рекомендуется обследовать на предмет незаподозренного риносинусита с помощью КТ или назальной эндоскопии, поскольку признаки и симптомы ХРС могут быть слабовыраженными и их можно пропустить, если не искать целенаправленно.
Муковисцидоз и риносинусит
Уже давно была установлена связь между муковисцидозом и ХРС, при этом ХРС наблюдается у 30–67 % пациентов с муковисцидозом всех возрастных групп [188–191]. Симптомы ХРС наблюдаются у 36 % облигатных носителей генетической мутации, обусловливающей муковисцидоз [157], в сравнении с предварительной фоновой распространенностью ХРС, составляющей от 13 до 14 % [192, 193].
Связь мутации, обусловливающей муковисцидоз, и ХРС была исследована разными методами и среди разных популяций, при этом результаты исследований порой являлись противоречивыми. В Финляндии, где зарегистрированная частота носительства мутации составляет около 1 : 80, только у 1 из 127 пациентов с ХРС, обследованных на наличие мутаций ΔF508 и 394delTT, была обнаружена мутация, связанная с муковисцидозом [194]. Хорошо установлено соответствие между микроорганизмами верхних и нижних дыхательных путей у пациентов с муковисцидозом и ХРС, а колонизация микроорганизмами верхних дыхательных путей может предшествовать распространению данных бактерий в нижние дыхательные пути [195–198].
Многочисленные обсервационные исследования демонстрируют, что применение более агрессивной схемы лечения пациентов с муковисцидозом и ХРС (это касается как максимального увеличения объема хирургического вмешательства, так и постоперационного медикаментозного лечения) может иметь положительный эффект на течение заболевания пазух [199–202]. Поскольку ХРС или рецидивирующий ОРС, в особенности в сочетании с назальными полипами, могут быть первыми проявлениями муковисцидоза, пациентов с полипозом, проявившимся до 18-летнего возраста, или с рефрактерным к лечению риносинуситом следует обследовать на предмет скрытого муковисцидоза.
Иммунодефицитные состояния и риносинусит
Среди пациентов с ХРС или рецидивирующим острым риносинуситом наблюдаются определенные иммунодефицитные состояния [203–205], что говорит в пользу иммунологического исследования при оценке пациентов с рефрактерным к лечению или рецидивирующим течением заболевания [203]. Установленные распространенные иммунодефицитные состояния включают снижение уровня сывороточных IgA и IgG, а также патологический функциональный ответ IgG на полисахаридные вакцины [203–206]. Для получения более подробной информации относительно надлежащих исследований для оценки данной небольшой, однако важной группы пациентов, обратитесь к ключевой рекомендации 9 данного руководства.
Цилиарная дискинезия и риносинусит
Цилиарная дискинезия наблюдается у небольшого процента пациентов с ХРС и сниженным мукоцилиарным клиренсом [207–210]. Даже у пациентов без фонового генетического нарушения, обусловливающего цилиарную дискинезию, нормальное время мукоцилиарного клиренса (ВМК), составляющее от 10 до 14 минут, значительно увеличивается при наличии ХРС [209]. Повышение ВМК определяется у все возрастающего числа пациентов с вирусом иммунодефицита человека, а также подразумевает повышенный риск рецидивирования риносинусита у данной популяции пациентов [210].
Однако не все исследования выступают в поддержку роли сниженной мукоцилиарной функции в патогенезе ХРС. Частота движений ресничек слизистой оболочки придаточных пазух и полости носа у пациентов с ХРС не отличалась от таковой у здоровых пациентов контрольной группы, повышенная частота движений наблюдалась у пациентов с назальным полипозом [208]. Аналогично муковисцидозу и иммунологическому исследованию, исследование цилиарной дискинезии может быть показано пациентам с устойчивым к лечению риносинуситом, особенно если он сопровождается частыми или длительными инфекционными заболеваниями нижних дыхательных путей. Пациенты с муковисцидозом и ХРС могут извлечь пользу из эндоскопической синусотомии, в особенности при наличии назальных полипов, которые создают обструкцию, однако случаются рецидивы и часто требуется ревизионное хирургическое вмешательство.
Другие заключения
В раннем исследовании патогенеза ХРС и рецидивирующего ОРС акцентировалось внимание на различных патологических вариантах анатомического строения [211–214], которые могут привести к обструкции придаточных пазух носа и спровоцировать развитие инфекции [215, 216]. Основываясь на данных предположениях, описания анатомических взаимосвязей, разные варианты анатомического строения, связи с граничащими анатомическими областями, а также важность точных рентгенографических данных для планирования и проведения хирургических вмешательств успешно наполняли раннюю литературу по эндоскопии [174, 217–221]. Тем не менее в отношении причинно-следственной связи между разными патологическими вариантами анатомического строения и хроническими заболеваниями доказательных данных недостаточно. В одном исследовании [180] была установлена корреляция между рецидивирующим ОРС и патологическими вариантами анатомического строения передних ячеек решетчатого лабиринта.
Взаимосвязь между гастроэзофагеальной рефлюксной болезнью (ГЭРБ) и ринусинуситом остается неясной, несмотря на постоянное увеличение количества данных, указывающих на прямую или непрямую связь. Однако при этом достоверные доказательные данные, подтверждающие эту взаимосвязь, отсутствуют. Большинство исследований, поддерживающих данную связь, являются исследованиями небольших серий случаев [222–224]. Например, в одном небольшом исследовании [225] у 95 % пациентов с риносинуситом, рефрактерным к медикаментозному и хирургическому лечению, наблюдались позитивные результаты pH-метрии глотки, однако значение рН в носоглотке не коррелировало со значением рН в глотке. Единственным механизмом, посредством которого ГЭРБ может привести к развитию синоназальных симптомов, является назоэзофагеальный рефлюкс. Wong с коллегами [226] вводили соляную кислоту и солевой раствор в гастроэзофагеальное соединение и описали вагальный рефлюкс, приводящий к увеличению выработки назальной слизи и баллов оценки симптомов.
Vaezi с коллегами [227] установили, что применение ингибиторов протонной помпы значительно снижает проявления симптомов постназального затека у пациентов с ринитом в сравнении в плацебо. Несмотря на то, что плацебо-контролируемые исследования, которые бы демонстрировали пользу лечения ГЭРБ при риносинусите, отсутствуют, данные состояния часто сосуществуют и имеют аналогичные симптомы. Пациентам с клинически значимой ГЭРБ следует проводить соответствующее лечение, однако влияет ли лечение легкой или субклинической ГЭРБ на риносинусит, остается неизвестным.
Рекомендация 9. Аллергологические и иммунологические исследования: пациентам с ХРС или рецидивирующим ОРС можно назначить аллергологические и иммунологические исследования.
Возможный вариант основан на результатах наблюдательных исследований с сомнительным балансом пользы и возможного вреда.
Аллергологические исследования
Распространенность аллергических ринитов (АР) составляет от 40 до 84 % среди взрослых пациентов с ХРС [228–230] и от 25 до 31 % среди пациентов молодого возраста с острым гайморитом [231, 232]. По сравнению со здоровыми лицами патологические находки на КТ у пациентов с аллергическим ринитом определяются в два раза чаще [233]. Значимые заболевания пазух, установленные посредством КТ, связаны с аллергией у 78 % пациентов и с астмой — у 71 % [234, 235]. У пациентов с аллергией и ХРС симптоматика более выражена в сравнении с пациентами без аллергии при сопоставимых результатах КТ [236, 237]. В одном исследовании 200 пациентов с ХРС более чем у половины имел место аллергический ринит, который расценивался как основная причина развития синусита [238].
Отек, обусловленный аллергическим ринитом, может привести к обструкции придаточных пазух носа [212], подтверждением данной теории является более высокая распространенность заболеваний мукопериостального слоя, определяемых с помощью КТ, у пациентов с аллергией в сравнении с пациентами без аллергии [235, 236]. Кроме того, состояние гиперчувствительности, связанное с аллергическим ринитом, может повысить восприимчивость придаточных пазух и полости носа к воспалению, таким образом, предрасполагая к развитию риносинусита [239]. В недавнем ретроспективном когортном исследовании ХРС было установлено, что АР является преморбидным фактором в случае свежедиагностированного ХРС [240]. Необходимо отметить, что большинство вышеприведенных исследований являются исследованиями серий случаев с гетерогенными критериями включения, результаты которых предполагают наличие связи между аллергией и риносинуситом, однако они не подразумевают непосредственно причинно-следственную связь.
В систематическом обзоре, проведенном Wilson и коллегами [241], было установлено, что аллергологическое исследование может применяться у пациентов с ХРС или рецидивирующим ОРС. Предпочтительным методом для определения чувствительности, обусловленной IgE, является аллергологическая кожная проба. Для большинства аллергенов в ходе аллерген-специфического иммунологического анализа in vitro в сыворотке крови большинства, однако не всех пациентов, клинически реагирующих на данные аллергены, определяются специфические антитела к IgE. Чувствительность иммунологического анализа в сравнении со скарификационной пробой и прик-тестом составляет от 50 до 90 % со средним значением 70–75 % в большинстве исследований [242]. Установить прямую связь клинического проявления болезни на основе данных, полученных при помощи аллергологических кожных проб или аллерген-специфического иммунологического анализа in vitro, возможно только в том случае, если результаты интерпретируются квалифицированным специалистом с учетом анамнеза и данных физикального обследования, полученных в ходе непосредственного контакта с пациентом.
В случае, если аллергологические исследования демонстрируют положительный результат и являются клинически значимыми, исходя из индивидуальной оценки, лечение может включать меры по контролю воздействия факторов окружающей среды, медикаментозную терапию, а также иммунотерапию в качестве иммуномодулирующего подхода. Несмотря на это, данные, поддерживающие предположение о том, что предотвращение воздействия аллергенов и/или иммунотерапия улучшают течение ХРС или рецидивирующего ОРС [19, 47], ограниченны, а уровень доказательности существующих исследований низок [241]. Несмотря на то, что аллергический ринит может продлить течение ОБРС, клиническое значение его невелико (повышение риска на 6–8 %) и не влияет на выбор лечения у пациентов с ОБРС с аллергией или без нее [117].
Иммунологические исследования
Возможность наличия иммунодефицитного состояния следует рассматривать у пациентов с ХРС или рецидивирующим ОРС в случае неэффективности агрессивной терапии или в случае, если синусит ассоциирован с отитом среднего уха, бронхоэктазами или пневмонией [203, 205]. Синусит являлся одним из самых распространенных инфекционных заболеваний во французском национальном исследовании первичной гипогаммаглобулинемии, и у 36 % пациентов с вариабельным неклассифицируемым иммунодефицитом (ВНИ) присутствовал синусит [243]. В другом исследовании среди пациентов с диагностированным с помощью рентгенографии синуситом, рефрактерным к консервативному и хирургическому лечению, было продемонстрировано, что у 10 % пациентов имел место ВНИ, а у 6 % — дефицит IgA [203]. У пациентов с неэффективным консервативным лечением и показанной синусотомией было отмечено (11 %) наличие дефицита специфических антител [206]. ХРС или рецидивирующий ОРС могут поражать от 30 до 68 % пациентов с вирусом иммунодефицита человека (ВИЧ) [244].
Наиболее распространенными первичными иммунодефицитами, связанными с ХРС или рецидивирующим ОРС, являются гуморальные иммунодефицитные состояния, такие как селективная недостаточность IgA, вариабельный неклассифицируемый иммунодефицит, а также недостаточность специфических антител, для которой характерными являются нормальные уровни IgG, однако при этом наблюдается патологическая реакция на полисахаридные вакцины [245]. Лабораторные исследования у пациентов с ХРС или рецидивирующим ОРС могут включать количественные иммунологические исследования (IgG, IgA и IgM), оценку реакции специфических антител на противостолбнячную и пневмококковую полисахаридные вакцины до и после иммунизации, CH50, а также измерения количества Т-лимфоцитов и оценку их функции (кожные пробы на гиперчувствительность замедленного типа и проточная цитометрия Т-лимфоцитов). При стандартной оценке иммунодефицитного состояния не следует проводить исследование подклассов IgG, так как связь между недостаточностью подклассов IgG и рецидивирующим ОРС или ХРС является спорной, а клиническая значимость патологических изменений подклассов IgG у пациентов с рецидивирующими инфекционными заболеваниями является недостоверной [246].
Рекомендация 10. Полипозный хронический риносинусит (ХРС): у пациентов с ХРС следует подтвердить или исключить наличие носовых полипов.
Рекомендация основана на обсервационных исследованиях с преобладанием пользы над возможным вредом.
Обоснование
Цель данной рекомендации заключается в поощрении проведения обследований пациентов на предмет наличия назальных полипов, поскольку полипы с большой вероятностью влияют на практическую ценность дополнительных диагностических исследований и тактику лечения.
Точная распространенность назальных полипов при риносинусите на данный момент неизвестна, однако примерно у 4 % пациентов с ХРС имеется сопутствующий полипоз [247]. Связь между астмой, назальными полипами и чувствительностью к аспирину была установлена давно [248, 249], однако назальный полипоз, похоже, не связан с аллергическим ринитом [250–252]. Распространенность назального полипоза колеблется в зависимости от географического региона и окружающей среды, однако обширные исследования распространенности полипоза в разных географических регионах не проводились.
Определение назального полипоза требует тщательного обследования носовых дыхательных путей. Увидеть большие полипы, способствующие обструкции носовой полости, при помощи расширителя для полости носа или карманного отоскопа не составляет труда. Однако небольшие полипы в среднем носовом ходе или на задней стенке носовой полости можно увидеть только с помощью назальной эндоскопии [253]. Специалисту, заподозрившему назальный полипоз у пациента с ХРС и не имеющему возможности провести назальную эндоскопию, следует направить пациента к специалисту, который сможет полноценно обследовать носовую полость.
Визуализация пазух с помощью КТ зачастую полезна в оценке ХРС с назальным полипозом, особенно в случае односторонних полипов, распространения полипов за пределы носовой полости или других атипичных проявлений [256]. КТ позволяет определить распространенность назальных полипов в носовой полости, состояние костных ориентиров (например, орбитальной пластинки решетчатой кости), а также целостность орбит и свода черепа. У пациентов с длительным анамнезом назальных полипов и предыдущими хирургическими вмешательствами, скорее всего, будут присутствовать значительные изменения анатомического строения придаточных пазух носа.
Односторонние полипы могут являться признаком ХРС, однако они менее распространены, чем двусторонние полипы, и их наличие должно натолкнуть врача на мысль о других возможных состояниях, имитирующих ХРС, в том числе о карциноме, инвертированной папилломе, антрохоанальном полипе или аллергическом грибковом синусите. Данные заболевания требуют более тщательной диагностической оценки и лечения, чем при двусторонних полипах, связанных с ХРС. Для постановки диагноза назального полипоза и исключения других патологий необходима биопсия; выскабливание назальных полипов не рекомендовано. В случае ХРС возможно проведение аллергологических или иммунологических исследований, результаты которых не зависят от наличия или отсутствия полипов; дополнительную информацию можно найти в предшествующей ключевой рекомендации (ключевая рекомендация 9).
Длительная местная или парентеральная антибактериальная терапия полипозного ХРС не рекомендуется, однако прием определенных пероральных антибиотиков, в особенности класса макролидов, может быть полезным в связи с их противовоспалительным действием [19, 255]. В отличие от антибиотиков, местное применение назальных стероидных спреев показано в качестве долгосрочной терапии назального полипоза при ХРС [256–258]. В случае отсутствия ответа на лечение в течение 3 месяцев целесообразно попробовать короткий курс пероральных кортикостероидов [254, 259–261]. Местные кортикостероиды по незарегистрированным показаниям для заболеваний носовой полости, в том числе будесонид, также могут иметь положительный эффект [262, 263].
Рекомендация 11. Местная интраназальная терапия при хроническом риносинусите (ХРС): для облегчения симптомов ОБРС следует рекомендовать орошения носовой полости солевыми растворами, местное применение интраназальных стероидов или и то и другое.
Рекомендация основана на преобладании пользы над возможным вредом.
Инструкции для пациентов по оптимальному использованию местных назальных стероидов [272]
1. Хорошо встряхните флакон.
2. Посмотрите вниз, наклонив голову и опустив взгляд в пол.
3. Поместите насадку в нос, используя правую руку для левой ноздри и левую руку для правой ноздри.
4. Направив отверстие насадки на внешнюю стенку ноздри, сделайте одно или два нажатия на поршень; не направляйте насадку в сторону перегородки носа (перегородка расположена посередине носа и разделяет носовую полость на две части) — это позволит избежать излишнего раздражения и кровотечения.
5. Смените руку и повторите действие для другой ноздри.
6. Не делайте слишком сильный вдох.
Орошение полости носа солевым раствором при ХРС
Благоприятные эффекты применения солевого раствора в улучшении симптоматики и качества жизни опосредованы улучшением мукоцилиарного клиренса, увеличением активности ресничек, разрушением и элиминацией антигенов, биопленки и медиаторов воспаления, а также прямым защитным эффектом на слизистую оболочку придаточных пазух и полости носа. Назальные орошения солевым раствором рекомендуются практикующими врачами как в качестве дополнительной терапии хронических синоназальных симптомов, так и в постоперационном периоде для увлажнения и очищения придаточных пазух и полости носа от сгустков и слущенного эпителия, а также для стимуляции заживления слизистой оболочки.
Благоприятный эффект орошения назальной полости в рамках симптоматического лечения ХРС был продемонстрирован в кохрановском обзоре [264], а также в других систематических обзорах [258, 265]. Орошение носовой полости солевым раствором является эффективным в качестве монотерапии при ХРС или в качестве дополнительной терапии к местным назальным стероидам, однако в сравнении непосредственно с местными назальными стероидами эффекты орошения носовой полости менее выражены [264]. Тем не менее безопасность и минимальные побочные эффекты орошения делают его привлекательным в качестве монотерапии ХРС. Распространенным побочным эффектом орошения носовой полости является вытекание жидкости из носа.
Ставить знак равенства между опрыскиванием и орошением солевым раствором не стоит, поскольку орошение является более эффективным в удалении выделений и улучшении качества жизни [265, 266]. Орошение можно проводить с помощью изотонического или гипертонического солевого раствора, однако доказательные данные, подтверждающие преимущества одного раствора перед другим, отсутствуют [265]. В дополнение к этому отметим, что оптимальная частота и метод орошения на сегодня не установлены [264]. Данная неопределенность в сочетании с затратами времени, необходимыми для регулярного орошения солевым раствором, могут служить причиной нежелания и/или нерегулярного соблюдения данной процедуры, имеющей, однако, достоверно установленную эффективность в облегчении симптомов.
Имеющиеся приспособления для орошения, а также приготовленные, не требующие рецепта растворы облегчают данную процедуру. Однако коммерческие растворы дороже приготовленного самостоятельно. Затраты на орошение носовой полости варьируют, но в основном являются низкими, особенно в случае самостоятельного приготовления растворов по предоставленным врачом инструкциям [267]. Варианты самостоятельного приготовления растворов и методы орошения достаточно разнообразны (различные сосуды для орошения, метод пульсирующего орошения, аэрозольный ингалятор, груша/шприц, мягкий флакон-пульверизатор, орошение под низким давлением [сосуд «Нети-пот»]).
Местные интраназальные кортикостероиды
Воспаление считается патологической основой ХРС, в связи с чем широко рекомендуется использование кортикостероидов [268]. Кортикостероиды являются эффективным противовоспалительным средством благодаря угнетению транскрипции провоспалительных и активации транскрипции противовоспалительных генов, снижению инфильтрации дыхательных путей воспалительными клетками, а также угнетению медиаторов воспаления, хемотаксических факторов и молекул адгезии [269].
Эффективность местного стероидного лечения в купировании симптомов ХРС подтверждена систематическими кохрановскими [270], а также другими [256–258, 271] обзорами рандомизированных контролируемых исследований, которые демонстрируют пользу при отличной безопасности и наличии минимальных нежелательных явлений. Несмотря на это, в некоторых обзорах подгрупповой анализ демонстрирует пользу местных стероидов в случае полипозного ХРС, однако в случае неполипозного ХРС эффективность отсутствует либо не установлена [256, 258]. Классы местных стероидов включают интраназальные стероиды первого поколения, такие как беклометазона дипропионат, триамцинолона ацетонид, флунисолид и будесонид, а также более новые препараты, такие как флутиказона пропионат, мометазона фуроат, циклесонид и флутиказона фуроат.
Местные назальные кортикостероиды наиболее эффективны при условии их надлежащего применения. Учитывая то, что пациенты, скорее всего, не будут иметь представления об оптимальном методе применения препарата, мы рекомендуем врачам инструктировать их и/или демонстрировать методику применения назальных стероидов.
Нежелательные явления местных назальных стероидов в целом незначительны (носовое кровотечение, головная боль, носовой зуд), однако в случае долгосрочного применения для контроля ХРС появляются дополнительные проблемы, связанные с системной абсорбцией и офтальмологическими проявлениями. Несмотря на это, долгосрочное использование стероидов не оказывает влияния на общий уровень кортизола [273], а также не повышает риск помутнения хрусталика, повышения внутриглазного давления или появления других офтальмологических симптомов [274]. У пациентов, получающих/планирующих получать долгосрочное лечение местными назальными стероидами, следует определить необходимость регулярного офтальмологического наблюдения.
ГОР пришла к соглашению, основанному на консенсусе экспертов, что местные назальные стероиды следует использовать не менее 8–12 недель в связи со временем, необходимым для купирования симптомов и оценки пользы для пациента. Более того, группа также пришла к однозначному соглашению о том, что пациенты, скорее всего, не будут иметь представления об оптимальном методе введения препарата в носовую полость, поэтому им следует предоставить простые и понятные инструкции. ГОР также пришла к выводу о невозможности рекомендовать конкретную длительность лечения, и о том, что решение о длительности терапии следует принимать в индивидуальном порядке на основе степени уменьшения симптомов, предпочтений пациента и клинического опыта.
Рекомендация 12. Противогрибковая терапия при хроническом риносинусите (ХРС): не следует назначать местную или системную противогрибковую терапию пациентам с ХРС. Рекомендация (против лечения) основана на систематическом обзоре РКИ с преобладанием пользы над возможным вредом (при неназначении лечения).
Обоснование
Цель данной рекомендации заключается в акцентировании внимания на том, что назначать системное или местное противогрибковое лечение пациентам с ХРС не следует ввиду возможных нежелательных явлений, которые не компенсируются устойчивой значительной пользой, по данным систематических кохрановских обзоров [275] или других исследований [255, 258, 271, 276].
Несмотря на недостаточную эффективность, противогрибковая терапия при ХРС широко используется некоторыми врачами в зависимости от региона. По этой причине нашим главным намерением в данной ключевой рекомендации является информирование пациентов и врачей, а также попытка предотвратить возможную противогрибковую терапию при ХРС. Данная рекомендация, однако, не применима к противогрибковым препаратам, используемым в лечении инвазивного грибкового синусита или аллергического грибкового синусита, в случае которых необходимо больше доказательных данных для каких-либо окончательных выводов.
Роль грибов при ХРС
Ponikau с коллегами [277] были первыми, кто описал эозинофильные инфильтраты в слизистой оболочке пациентов с ХРС, предположив возможную роль грибов при данном заболевании. Данное предположение подтверждалось предыдущими исследованиями, в которых демонстрировалось наличие грибов в операционных образцах пациентов с ХРС [278–280], что привело к гипотезе о том, что у пациентов с ХРС существует специфический иммунный ответ на широко распространенные виды грибов (в сравнении с пациентами контрольной группы), связанный с неинвазивным, неаллергическим, опосредованным интерлейкином-5 ответом, а также эозинофильным воспалением [281, 282]. Это послужило началом продолжительной дискуссии относительно применимости данной теории к общей популяции пациентов с ХРС и влияния противогрибковой терапии на данную популяцию.
В каждом систематическом обзоре, ограниченном РКИ [255, 258, 275], было сделано заключение об отсутствии благоприятного эффекта как при пероральной, так и при местной противогрибковой терапии при ХРС. Единственный случай наличия благоприятных эффектов при пероральной противогрибковой терапии был обнаружен в систематическом обзоре обсервационных исследований с несогласующимися критериями эффективности [283], что подразумевает риск системной ошибки, который лишает возможности сделать однозначное заключение. В кохрановском обзоре [275], который включал использование как пероральных, так и местных противогрибковых препаратов, а также предусматривал строгие критерии включения, доказательные данные о наличии пользы местного применения противогрибковых препаратов отсутствовали. Лишь в 1 из 5 исследований было установлено наличие пользы по рентгенологической и эндоскопической шкалам оценки (но не по шкале симптомов) и отсутствие превосходства системной противогрибковой терапии над плацебо по аналогичным исходам.
Были зарегистрированы побочные эффекты данных методов лечения, включавшие повышенные показатели печеночных проб при приеме пероральных противогрибковых препаратов, зуд в носу, снижение качества жизни, связанное с заболеванием придаточных пазух и полости носа, снижение активности ресничек при более высоких дозировках, а также значительные затраты на местные противогрибковые препараты [275, 283, 284]. Также существует риск индуцирования грибковой резистент–ности ввиду низких концентраций, используемых в составах для местного применения. Во многих исследованиях используемая концентрация амфотерицина В составила 100 мкг/мл; согласно данным, эта концентрация не подавляет рост грибов in vitro в сравнении с концентрациями 200 и 300 мкг/мл, обеспечивающими истинное подавление роста грибов [285]. Помимо этого, пациент, который может позволить себе данное лечение, может понести определенные потери, связанные с неназначением других, альтернативных методов лечения с установленной эффективностью.
Печатается в сокращении.
Полная оригинальная версия доступна на http://oto.sagepub.com/
Перевод с англ. Е. Куща
Место работы авторов
1 Department of Otolaryngology, SUNY Downstate Medical Center, Brooklyn, New York, USA
2 Department of Otolaryngology — Head and Neck Surgery, Washington University in St Louis, School of Medicine, St Louis, Missouri, USA
3 New York Otology, New York Head and Neck Institute, New York, New York, USA
4 Department of Pediatrics, Georgetown University, Washington, DC, USA
5 Department of Family Medicine, University of Texas Health Sciences Center at San Antonio, San Antonio, Texas, USA
6 Department of Otolaryngology, Washington University in St Louis School of Medicine, St Louis, Missouri, USA
7 Division of Otolaryngology, University of Utah School of Medicine, Salt Lake City, Utah, USA
8 Department Otolaryngology, University of Pennsylvania Hospital, Philadelphia, Pennsylvania, USA
9 Department of Otolaryngology Head & Neck Surgery, Emory University, Atlanta, Georgia, USA
10 Department of Internal Medicine, Northwestern University Allergy Division, Chicago, Illinois, USA
11 Consumers United for Evidence-Based Healthcare, Davis, California, USA
12 AAO-HNS, Alexandria, Virginia, USA
Список литературы
Список литературы находится в редакции

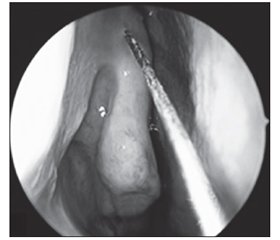
/73.jpg)
/74.jpg)
/75.jpg)
/76.jpg)
/77.jpg)
/80.jpg)
/86.jpg)
/85.jpg)
/90.jpg)
/90_2.jpg)
/91_2.jpg)
/92.jpg)