Статтю опубліковано на с. 79-83
Вступ
Біль, що відчувала дитина в ранньому післяопераційному періоді, змінює розвиток системи ноцицепції й призводить до необоротних функціональних і структурних змін у центральній нервовій системі, чим змінює програму відповіді на біль у майбутньому [1]. Больовий синдром у ранньому післяопераційному періоді є актуальною проблемою клінічної хірургії, анестезіології. У літературі, присвяченій знеболюванню в післяопераційний період, існують дані, що від 33 до 75 % пацієнтів, які перенесли планові та екстрені хірургічні втручання, страждають від післяопераційного болю. Пошкодження тканин при хірургічній інвазії запускає каскад патофізіологічних змін у периферичній і центральній нервовій системі, що призводять до формування післяопераційного хронічного больового синдрому. Незважаючи на широкий вибір медикаментозних препаратів і методик аналгезії, більшість хворих відчувають біль різної інтенсивності в післяопераційному періоді [1, 2]. Неадекватна аналгезія в ранньому післяопераційному періоді погіршує перебіг і прогноз цього періоду в дітей і збільшує рівень післяопераційних ускладнень, а також сприяє розвитку гіпералгезії. Гіпералгезія — це стан підвищеної чутливості до болю, що виникає внаслідок інтенсивної ноцицептивної стимуляції або може бути індукований опіоїдними аналгетиками [4, 7, 9]. Гіпералгезія реалізується переважно на рівні спинного мозку й асоціюється зі збільшенням інтенсивності болю та, відповідно, розвитком стрес-відповіді на біль, підвищенням ризику хронізації болю, розвитком толерантності до опіоїдів та потребою в підвищенні доз [3, 5, 8, 10, 11]. Для діагностики гіпералгезії стандартно виконують визначення больового порогу за допомогою монофіламентів фон Фрея в зоні післяопераційної рани, використовуючи монофіламенти в порядку зростання до найменшої сили тиску, що сприймається досліджуваним як больове відчуття [4, 6, 9]. Анестезія поперечного простору живота (transversus abdominis plane block — ТАР-блок) є новим підходом у блокуванні аферентних нервів передньої черевної стінки за допомогою введення місцевого анестетика в ділянку трикутника Petit. Для виконання цієї процедури зазвичай використовують анатомічні орієнтири й тактильні відчуття. На сьогодні доведено, що застосування ультразвукової підтримки збільшує відсоток успіху блокади й практично виключає можливість пункції черевної порожнини.
Метою нашого дослідження було встановити морфологічні зміни в ділянці шкіри в післяопераційній рані після застосування в ранньому післяопераційному періоді інфузії розчину фентанілу, його вплив на виникнення стану гіпералгезії в дітей з онкологічною патологією та оцінити ефективність ТАР-блоку після операції на органах черевної порожнини в дітей.
Об’єкт та методи дослідження
Дослідження проведені у 22 дітей (14,7 ± 2,4 року), прооперованих із приводу пухлин черевної порожнини (14 дітей, 63,6 %), пухлин заочеревинного простору (8 дітей, 37,4 %).
Залежно від методики знеболювання пацієнти були розподілені на дві групи: перша група — 10 пацієнтів (використовувалась мультимодальна аналгезія, ТАР-блок), друга група — 12 дітей (призначалась лише внутрішньовенна безперервна інфузія фентанілу) [2–4]. Усім хворим проводилось комплексне інтенсивне лікування: інфузійна та трансфузійна терапія, респіраторна підтримка апаратом Hamillton C2, режим ASV за параметрами (FiO2 30 %, PEEP 2 см H2О, PIP 15–20 см H2О), антибактеріальне лікування, посиндромна терапія. Пацієнту в ранньому післяопераційному періоді визначали периметр мінімального порогу болю навколо післяопераційної рани. Проекція лінії післяопераційної рани умовно розділялась на два рівні відрізки трьома точками, через які в 16 векторних напрямках, з кутом між ними в 45°, за допомогою набору з 10 каліброваних монофіламентів фон Фрея здійснювали тиск на шкіру зі зростаючою силою від 4 г (39,216 mN) до 300 г (2941,176 mN) (Touch-Test Sensory Evaluator, North Coast Medical Inc., CA, USA), притискаючи монофіламенти в порядку зростання до поверхні шкіри під кутом 90°, доки останній не зігнеться, на 1–1,5 с. Між дослідженнями витримували адаптаційний інтервал у 10 с. Механічний больовий поріг визначали як найменшу силу тиску, що спричинювала больову реакцію пацієнта (4 бали або більше за поведінковою шкалою оцінки болю Behavioral Pain Scale). Больовий поріг вимірювали на поверхні навколо післяопераційної рани. На 3-тю, 7-му та 14-ту добу хворим виконувалась біопсія ран — брали фрагменти шкіри з підлеглими тканинами в ділянці рани, відступаючи від її меж на 0,5 см. Забраний матеріал фіксувався 10% водним розчином нейтрального формаліну протягом 48 годин, потім він промивався проточною водою, надалі проводилось його зневоднення в системі багатоатомних спиртів і заливка в парафін за стандартною схемою. Приготовані напівтонкі зрізи товщиною 7–8 мкм забарвлювались гематоксиліном і еозином (основний метод забарвлення гістологічних препаратів) для оцінки патологічних змін та реакцій тканин у процесі виникнення та загоєння ран (оцінка стану та склад тканин у краях та дні рани, наявність та характер патологічних і репаративних змін у ній), характеру порушень мікрогемоциркуляції. Також гістологічні препарати, виготовлені зі шматочків тканин, взятих на 14-ту добу експерименту, окрім традиційного метода забарвлення гематоксиліном та еозином, сріблились за методом Фута для визначення розвитку в тканинах у процесі загоєння ран дрібних нервових закінчень та патологічних їх змін. Мікроскопію гістологічних препаратів проводили за допомогою світлового мікроскопа OLIMPUS BX 41 із застосуванням збільшення в 40, 100, 200 та 400 разів.
Результати та їх обговорення
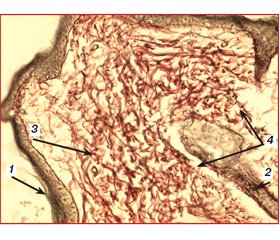
Перша група — 10 пацієнтів, яким знеболювання проводилося методом ТАР-блоку бупівакаїном 0,375% (Лонгокаїн, «Юрія-Фарм»), 12 дітям другої групи знеболювання проводилося безперервною внутрішньовенною інфузією фентанілу в дозі 10–20 мкг/кг/год (середня доза 14,7 ± 1,4 мкг/кг/год) [2–4]. У групі ТAP-блоку після введеного наркозу 10–20 мл 0,375% бупівакаїну було введено в нейрон-фасціальний простір поперечного м’яза живота в ділянці трикутника Petit з обох сторін. Пункція виконувалась голкою для спінальної анестезії G 22 (B. Braun). Для візуалізації структур і контролю просування голки використовувався конвексний датчик 4–6 МГц (Logiq 100, GE, USA) [10, 11]. У пацієнтів групи постійної інфузії фентанілу через 3 доби після введення фентанілу спостерігались такі морфологічні зміни в тканинах. Зона пошкодження була дуже поширеною, без чітких меж, із розвитком у центрі її некрозу (товщина шару некротизованих тканин становила до 5 мм) з вираженими перифокальними реактивними змінами у вигляді значного запалення (зона реактивних змін товщиною до 7 мм), мали місце суттєві порушення мікроциркуляції. Судини в дермі в зоні ураження навколо ранового каналу були паретично розширені, з вираженими дистрофічними змінами ендотелію, повнокровні, з крайовим стоянням лейкоцитів у них. Навколо придатків шкіри та периваскулярно визначались невеликі скупчення одноядерних клітин — лімфоцитів та клітин моноцитарного ряду з наявністю поодиноких лейкоцитів. Структура підлеглої гіподерми була порушена через вогнища некрозу та значну запальноклітинну інфільтрацію. У дермі та гіподермі спостерігалось накопичення набрякової рідини як один із проявів розладів мікрогемоциркуляції з розволокненням колагенових і еластичних волокон власне дерми. У набряковій рідині також зустрічались одноядерні клітини типу моноцитів крові, лімфоцитів, сегментоядерні лейкоцити у великій кількості (рис. 1, 2).
/81-1.jpg)
Отже, через 3 доби після введення фентанілу в уражених тканинах спостерігаються ранні стадії запального процесу у вигляді виражених ознак альтерації та визначаються значні прояви процесів ек–судації. На 7-му добу після інфузії фентанілу в дітей мали місце запальні зміни тканин шкіри. Серед запальних клітин визначались і молоді форми фібробластів. У гіподермі мала місце реактивна запальна інфільтрація. Клітинний склад інфільтрату був представлений сегментоядерними нейтрофілами, серед яких визначалась невелика кількість лімфоцитів та клітини моноцитарного ряду (макрофаги, гігантські багатоядерні клітини сторонніх тіл). Відзначалась судинна реакція у вигляді помірного повнокров’я, набряку гіподерми та сітчастого шару дерми в зоні запалення. Також визначались поодинокі пучки колагенових волокон щільної волокнистої оформленої сполучної тканини дерми з ознаками набряку, розшарування, фрагментації волокон (рис. 3).
Також на 14-ту добу в пацієнтів другої групи в зоні формування рубцевої тканини відбувалось утворення дрібних нервових волокон, але в невеликій кількості. Мав місце виражений фіброз дерми з утворенням великої кількості колагенових волокон з набряком, розшаруванням їх. Визначався значний периневральний набряк, фрагментація окремих нервових волокон (рис. 4).
Щодо використання методики аналгезії на основі ТАР-блоку бупівакаїном 0,375% (Лонгокаїн, «Юрія-Фарм») слід зазначити, що на 3-тю добу експерименту в дітей даної групи у тканинах визначались такі патологічні зміни. Зона пошкодження була тонкою, без чітких меж, із розвитком у центрі її некрозу з перифокальними реактивними змінами у вигляді помірного запалення та незначних порушень мікроциркуляції. Товщина зони некрозу становила лише 0,1 мм, зона реактивних змін — до 2 мм. Епідерміс у зоні ураження також був з незначними дистрофічними змінами у вигляді нерівномірного забарвлення ядер, балонної дистрофії окремих ядер, деякі епітеліоцити по самому краю перебували в стані некробіозу. Розлади мікроциркуляції були мало виражені порівняно з такими у хворих другої експериментальної групи (введення фентанілу). Судини в дермі в зоні ураження були дещо розширені, з незначними дистрофічними змінами ендотелію, помірно повнокровні, з крайовим стоянням лейкоцитів у деяких з них. Навколо придатків шкіри та периваскулярно визначались поодинокі одноядерні клітини — лімфоцити та клітини моноцитарного ряду з домішкою поодиноких лейкоцитів. Це пояснюється впливом бупівакаїну на мікроциркуляторне русло, що сприяло покращенню мікроциркуляції. Завдяки цьому в дермі та гіподермі спостерігалось незначне накопичення набрякової рідини (на відміну від дітей другої групи) з незначним розволокненням колагенових і еластичних волокон власне дерми. У набряковій рідині також зустрічались одноядерні клітини типу моноцитів крові, лімфоцитів, поодинокі сегментоядерні лейкоцити (рис. 5).
/82-1.jpg)
На 7-му добу від початку експерименту в дітей групи ТАР-блоку бупівакаїном також визначалась зона запалення тканин глибиною на всю товщу дерми до гіподерми, однак вона була значно меншою, ніж у дітей другої групи (введення фентанілу). Також у більш ранні терміни спостерігались процеси проліферації, а саме розвиток грануляційної тканини з подальшим утворенням рубцевої тканини. Зона некротизованих тканин майже не визначалась. Молода грануляційна тканина також вже утворилась до даного терміну. Вона практично не містила колагенових волокон, була інфільтрована невеликою кількістю сегментоядерних лейкоцитів та помірною кількістю лімфогістіоцитарних елементів, містила незначну кількість молодих фібробластів. У ній спостерігалось утворення великої кількості нових дрібних судин з розмноженням ендотеліальних клітин капілярів, так званих ангіобластів, що спочатку утворювали клітинні тяжі, а потім з них формувалися судинні трубки, до яких поступала кров. В оточуючі тканини з молодих новоутворених судин виходили форменні елементи крові та набрякова рідина в незначній кількості. У гіподермі мала місце реактивна запальна інфільтрація. Клітинний склад інфільтрату був представлений сегментоядерними нейтрофілами, серед яких визначалась невелика кількість лімфоцитів та клітини моноцитарного ряду (макрофаги, гігантські багатоядерні клітини сторонніх тіл). Мала місце судинна реакція у вигляді помірного повнокров’я, набряку гіподерми та сітчастого шару дерми в зоні запалення. Також визначались поодинокі пучки колагенових волокон щільної волокнистої оформленої сполучної тканини дерми з незначними дистрофічними змінами (рис. 6).
/82-2.jpg)
Також на 14-ту добу в дітей групи ТАР-блоку бупівакаїном у зоні формування рубцевої тканини відбувалось утворення дрібних нервових волокон у великій кількості. Мав місце виражений фіброз дерми з утворенням великої кількості колагенових волокон з незначним набряком, розшаруванням їх. Визначався незначний периневральний набряк, фрагментації нервових волокон не спостерігалось (рис. 7).
Дані зміни свідчать про повне завершення запалення та загоєння рани з формуванням сполучно–тканинного рубця, у якому спостерігаються процеси його ремоделювання. У групі дітей, у яких для знеболювання використовувався фентаніл в дозах 10–20 мкг/кг/годину, в зоні формування рубцевої тканини відбувалось утворення дрібних нервових волокон, але в невеликій кількості. Мав місце виражений фіброз дерми з утворенням великої кількості колагенових волокон з набряком, розшаруванням їх. Визначався значний периневральний набряк, фрагментація окремих нервових волокон. Також у дітей при застосуванні інфузії фентанілу в тканинах у ділянці рани визначались найбільш виражені альтеративні та запальні зміни зі значними розладами мікрогемоциркуляції. Ефективність використання ТАP-блоку ґрунтується на можливості впливу на периферичний механізм [9], про що свідчить значно менша зона запалення на відміну від такої в дітей другої групи (введення фентанілу), судинна реакція у вигляді помірного повнокров’я, набряку гіподерми та сітчастого шару дерми в зоні запалення. Також визначались поодинокі пучки колагенових волокон щільної волокнистої оформленої сполучної тканини дерми з незначними дистрофічними змінами, утворенням дрібних нервових волокон у великій кількості. Визначався незначний периневральний набряк, фрагментації нервових волокон не спостерігалось.
Висновки
1. Використання високих доз фентанілу (10–20 мкг/кг/добу) методом постійної інфузії для знеболювання в ранньому післяопераційному періоді в дітей може призводити до опіоїд-індукованої гіпер–алгезії, що супроводжується морфологічними змінами в шкірі навколо післяопераційної рани.
2. На 3-тю та 7-му добу після ведення фентанілу спостерігались такі морфологічні зміни в тканинах. Зона пошкодження була дуже поширеною, без чітких меж, із розвитком у центрі її некрозу (товщина шару некротизованих тканин становила до 5 мм) з вираженими перифокальними реактивними змінами у вигляді значного запалення (зона реактивних змін товщиною до 7 мм), мали місце суттєві порушення мікроциркуляції. У свою чергу, використання ТАP-блоку з розчином бупівакаїну практично повністю нівелює дані зміни.
3. На 14-ту добу на фоні використання фентанілу в зоні формування рубцевої тканини відбувалось утворення дрібних нервових волокон. Мав місце виражений фіброз дерми з утворенням великої кількості колагенових волокон з набряком, розшаруванням їх. Визначався значний периневральний набряк, фрагментація окремих нервових волокон, а при використанні ТАP-блоку з розчином бупівакаїну визначався незначний периневральний набряк, фрагментації нервових волокон не спостерігалось, що свідчить про відсутність розвитку післяопераційної гіпералгезії.
Список литературы
1. Айзенберг В.Л., Ульрих Г.Э., Цыпин Л.Е., Заболотский Д.В. Региональная анестезия в педиатрии. — СПб.: Синтез Бук, 2012. — 304 с.
2. Кучин Ю.Л., Глумчер Ф.С., Бєлка К.Ю. Опіоїд-індукована гіпералгезія під час анальгоседації у пацієнтів з черепно-мозковою травмою // Біль, знеболювання та інтенсивна терапія. — 2012. — № 1Д. — С. 254-257.
3. Кучин Ю.Л. Стрес-індукована гіпералгезія у пацієнтів з множинною травмою // Біль, знеболювання та інтенсивна терапія. — 2013. — № 2Д. — С. 262-266.
4. Лесной И.И. Предупреждение развития хронического послеоперационного синдрома у хирургических больных / И.И. Лесной, В.И. Черний, К.Ю. Белка // Український журнал екстремальної медицини ім. Г.О. Можаєва. — 2012. — Т. 13, № 3. — С. 26-32.
5. Потапов А.Л. Обезболивание после объемных открытых абдоминальных операцій — опиаты или эпидуральная аналгезия? / А.Л. Потапов, Ю.Ю. Кобеляцкий // Біль, знеболювання і інтенсивна терапія. — 2011. — № 4. — С. 39-42.
6. Angst M.S., Clark J.D. Opioid-induced hyperalgesia // Anesthesiology. — 2006. — 104. — 570-87.
7. Wilder-Smith O.H., Arendt-Nielsen L. Postoperative hyperalgesia: its clinical importance and relevance // Anesthesiology. — 2006. — 104 (3). — Р. 601-7.
8. Lavand’homme P., De Kock M., Waterloos H. Intraoperative epidural analgesia combined with ketamine provides effective preventive analgesia in patients undergoing major digestive surgery // Anesthesiology. — 2005. — 103 (4). — Р. 813-20.
9. Lee M., Silverman S., Hansen H., Patel V., Manchikanti L. A comprehensive review of opioid-induced hyperalgesia // Pain Physician. — 2011. — 14 (2). — 145-161.

/81-1.jpg)
/82-1.jpg)
/82-2.jpg)