Статья опубликована на с. 35-45
Критические состояния часто сопровождаются развитием синдрома полиорганной недостаточности (СПОН), от успешного лечения которого зависит прогноз основного заболевания. Начальные признаки отклонения от функциональной нормы какой-либо из органных систем (т.е. дисфункции) указывают на то, что гомеостаз больного без интенсивного лечения поддерживаться самостоятельно уже не может. Поэтому своевременно начатое лечение на ранней стадии полиорганной дисфункции дает значительно лучшие результаты и способствует снижению госпитальной летальности [1].
Острые нарушения функции органов — достаточно частое явление в практике неотложной хирургии [2]. При тяжелой хирургической абдоминальной патологии частота развития и выраженность дисфункции/недостаточности печени и почек в послеоперационном периоде варьируют в зависимости от нозологии. При развитии печеночно-почечной недостаточности летальность в послеоперационном периоде достигает 23–90 % [3, 4]. Поэтому применение дифференцированной интенсивной терапии, основанной на патогенетических особенностях развития печеночно-почечной дисфункции, позволяет снизить прогрессирование заболевания и развитие его тяжелых форм с утратой функций этих органов.
По данным В.П. Шано, Е.А. Кучер (2011), несостоятельность метаболического гомеостаза вследствие печеночно-почечной недостаточности встречается так же часто, как и сердечно-легочная недостаточность. Однако клиническая картина нарушений метаболизма не проявляется так ярко, как нарушения дыхания и кровообращения, особенно на ранних этапах своего развития. Диагностика нарушенного метаболизма, как правило, запаздывает и часто происходит при далеко зашедших или уже необратимых изменениях, определяющих исход заболеваний [5].
Цель обзора — определить причины развития печеночной недостаточности у пациентов отделения интенсивной терапии, рассмотреть основные направления метаболической терапии, роль оригинального L-орнитина-L-аспартата в профилактике и лечении осложнений.
Печеночная недостаточность может развиваться [6]:
— как острая печеночная недостаточность (Acute liver failure, ALF) в отсутствие ранее существовавшего заболевания печени (ОПечН);
— острое ухудшение функции печени у пациентов с известным или неизвестным хроническим заболеванием печени (Acute-on-chronic liver failure, ACLF);
— острая декомпенсация хронического заболевания печени в терминальной стадии.
К общим причинам, определяющим развитие печеночной недостаточности у пациентов отделения интенсивной терапии, относятся:
1. Инфекционная этиология: гепатотропные и негепатотропные вирусы (уровень доказательности 1a, А); реактивация гепатита В или гепатита С (2b, В); другие инфекционные агенты, от которых страдает печень (5, D).
2. Неинфекционная этиология: алкоголь: активный прием спиртных напитков в течение последних 4 недель (1a, А); использование гепатотоксических препаратов, трав (2b, В); обострение аутоиммунного гепатита или болезни Вильсона (3b, В); хирургическое вмешательство (3b, В); кровотечение из варикозно расширенных вен пищевода (4, C).
3. Токсическое поражение печени неизвестной этиологии (5, D).
Наиболее четко определены причины, определяющие развитие печеночной недостаточности, консенсусом Азиатско-Тихоокеанской ассоциации по изучению печени (Asian Pacific Association for the Study of the Liver) (рис. 1) [7].
Хирургия относится к негепатотропным причинам возможного развития первичной печеночной недостаточности.
По данным Т.В. Ермоловой и соавт. (2009), к факторам развития острой печеночной недостаточности относятся: травматические хирургические операции и увеличение продолжительности оперативного лечения; употребление лекарственных средств, оказывающих гепатотоксическое и церебротоксическое действие (седативные препараты, антибиотики, анальгетики); проведение общего обезболивания; наличие желудочно-кишечного кровотечения, шока, инфекции [8]. Кроме этого, в последние годы наблюдается увеличение числа операций, выполняемых на фоне заболеваний печени, и количества пациентов с хроническими заболеваниями печени, у которых возрастает риск послеоперационных осложнений, обусловленных морфофункциональной недостаточностью печени.
Функциональная недостаточность печени у больных с хирургической патологией — состояние, когда орган не способен поддерживать обмен веществ и постоянство внутренней среды организма, а если поддерживает, то за счет напряжения своих компенсаторных возможностей. По данным И.Б. Щербак (2012), функциональная недостаточность печени может развиваться у больных с различной хирургической патологией: при перитоните (классическая модель синдрома эндогенной интоксикации), острой кишечной непроходимости, остром панкреатите, желудочно-кишечном кровотечении [9].
Основные патофизиологические аспекты развития ОПечН [10]:
— предполагается центральная роль воспаления и дисфункции нейтрофилов в развитии органной недостаточности (2a), дисбаланс врожденных и адаптивных иммунных реакций;
— синдром системного воспалительного ответа (ССВО) рассматривается как маркер при прогнозировании смертности;
— изменение концентрации аминокислот. Высокие концентрации ADMA (asymmetric dimethyl-L-arginine) и SDMA (stereoisomer symmetric dimethylarginine) являются маркерами неблагоприятного прогноза;
— цитокины (TNFa, sTNF-aR1, sTNF-aR2, –IL-2, IL-2R, IL-4, IL-6, IL-8, IL-10 и interferon-γ) влияют на развитие и течение ACLF (3b);
— трудно дифференцировать ССВО и ранний сепсис у больных с циррозом печени. Сепсис, протекающий у пациента с ОПечН, связан с высокой смертностью вследствие развивающейся полиорганной дисфункции (1а, А);
— уменьшение воспалительной реакции может обусловить снижение заболеваемости и смертности у пациентов с ОПечН (3b, С);
— циркулирующие токсины при ОПечН вызывают вторичное повреждение печени, нарушается регенерация печени, несмотря на циркулирующие факторы роста (2b);
— у больных с циррозом печени, госпитализированных с острой декомпенсацией, наличие дисфункции почек или почечной недостаточности (в качестве единственной органной недостаточности или в сочетании с недостаточностью других органов) является маркером неблагоприятного прогноза в течение 4 недель (1b, В);
— TNFa и IL-6, вероятно, имеют двойное действие. С одной стороны, вызывают гибель гепатоцитов, с другой — способствуют их пролиферации через дифференциальные взаимодействия с клетками Купфера (3b).
Возможность развития функциональной недостаточности печени у больных с желудочно-кишечным кровотечением обусловлена несоответствием между уменьшенной массой циркулирующей крови и объемом сосудистого русла, что приводит к снижению общего периферического сопротивления, ударного объема сердца, минутного объема кровообращения и снижению артериального давления. Возникают нарушения центральной гемодинамики, снижается скорость спланхнического кровотока, повышается вязкость крови и образование в ней агрегатов эритроцитов, нарушается микроциркуляция, изменяется транскапиллярный обмен. В результате действия повреждающих факторов в паренхиме печени развиваются глубокие микроциркуляторные расстройства, в гепатоцитах происходит активация митохондриальных факторов гибели клетки и индукция апоптоза печеночных клеток.
Еще одной из наиболее частых причин печеночной недостаточности у больных с хирургической патологией является наличие желчной гипертензии. При этом повышается давление в желчных протоках, нарушается секреция гепатоцитами, так как для выделения секрета в просвет желчных капилляров им приходится преодолевать большее сопротивление, нарушается крово- и лимфообращение в печени, изменяется микроциркуляция органа, развиваются дистрофические изменения в гепатоцитах при резкой декомпрессии протоков во время операции [11].
Лекарственно-индуцированная ОПечН развивается медленно, встречается чаще у женщин (70,7 %), редко восстанавливается, но пересадка печени обеспечивает хорошую выживаемость [12].
К признакам дисфункции печени у пациентов с острой хирургической патологией относятся:
— повышение уровня трансаминаз крови — АЛТ и АСТ (признаки цитолиза гепатоцитов), билирубина и щелочной фосфатазы сыворотки крови;
— нарушение белковосинтетической функции печени (проявляется снижением уровня общего белка плазмы крови и альбумина);
— лабораторные признаки гипокоагуляции, гипофибриногенемия, гипопротромбинемия;
— развитие желтухи и печеночной энцефалопатии (делирии различного генеза);
— нарушение репаративных процессов (снижение скорости заживления ран, появление пролежней).
На сегодня считается, что синдром печеночной недостаточности — это симптомокомплекс, характеризующийся нарушением одной или многих функций печени вследствие острого или хронического ее повреждения. Наиболее широко принятое определение печеночной недостаточности в мировой литературе включает развитие [13–16]:
— желтухи (повышение билирубина сыворотки крови ≥ 85 мкмоль/л);
— коагулопатии (увеличение международного нормализованного отношения ≥ 1,5 и/или уменьшение протромбинового индекса < 40 % являются обязательными);
— асцита и/или печеночной энцефалопатии (ПЭ) у пациентов без цирроза.
Развитие печеночной недостаточности сопровождается изменением ее функций [17]. Нарушение обмена белков характеризуется изменением синтеза белка и азотсодержащих веществ (холина, глутатиона, таурина), расщепления белков и аминокислот в реакциях дезаминирования, трансаминирования, декарбоксилирования. Уменьшение синтеза альбумина клинически проявляется снижением онкотического давления крови, возникновением интерстициальных отеков.
Увеличение количества продуктов распада белка приводит к увеличению нагрузки на гепатоцит как основное место утилизации аммиака. Значительно страдает функция детоксикации: образование мочевины из аммиака, обезвреживание эндогенных (индол, скатол, ароматические углеводороды, аммиак, образовавшийся из белков) и экзогенных токсинов; участие в метаболизме большинства лекарственных веществ. Признаком нарушения детоксикационных функций печени является развитие печеночной энцефалопатии.
Печеночная энцефалопатия присутствует примерно в 40–50 % случаев. Уменьшение соотношения в крови между аминокислотами с разветвленной углеродной цепью и ароматическими аминокислотами приводит к их преимущественному проникновению в мозг через гематоэнцефалический барьер. Печеночную энцефалопатию связывают с образованием «ложных нейромедиаторов» — октопамина, β-фенилэтаноламина и тирамина, которые вытесняют из синапсов ЦНС естественные медиаторы допамин и норадреналин, нарушая мозговые функции.
Вследствие снижения продукции факторов свертывания развивается склонность к возникновению кровотечений (чаще всего в ЖКТ). К факторам, способствующим развитию кровотечений, относятся: портальная гипертензия, эрозии слизистой оболочки, тромбоцитопения. Кровотечения усугубляют гипопротеинемию. Нарушение белковосинтетической функции печени может сопровождаться уменьшением концентрации в крови первичных антикоагулянтов, что обусловливает возможность возникновения тромбозов.
Развитие печеночной недостаточности сопровождается нарушением обмена углеводов и липидов; обмена билирубина (желчеобразование и желчеотделение). Нарушается гуморальная функция и иммунная реактивность, участие печени в гемопоэзе.
Прогрессирование ОПечН приводит к CПОН, развитию системного воспалительного ответа, печеночной энцефалопатии, церебральному отеку и повышению внутричерепного давления, которые являются непосредственными причинами смерти у этих пациентов [18, 19].
Нейропатологические исследования при острой печеночной недостаточности, проведенные R.F. Butterworth (2015), позволили выявить существенные изменения нейроглии, представляющие собой набухание астроцитов (это ведет к развитию цитотоксического отека мозга и внутричерепной гипертензии), а также активацию микроглии, свидетельствующую о наличии центрального нейровоспалительного (neuroinflammatory) ответа [20].
Интенсивная терапия у больного с ОПечН остается уникальной клинической проблемой для практикующего врача, при этом необходимо исходить из патогенетических механизмов развития патологического состояния [21].
Основные методы лечения ОПечН известны, однако доказательная база для них и для многих аспектов поддерживающей терапии формируется медленно [22].
К основным направлениям терапии острой печеночной недостаточности относятся [23]:
1. Терапия отека мозга и внутричерепной гипертензии.
При диагностике печеночной энцефалопатии I/II необходимо исключить другие причины снижения психического статуса. Для этого рекомендовано проведение КТ (МРТ) мозга. Рекомендовано по возможности избегать седации, проводить наблюдение и лечение инфекции, антибиотикопрофилактику.
При диагностике печеночной энцефалопатии III/IV степени вырабатывается стратегия интенсивной терапии. Рекомендовано положение пациента в кровати с приподнятым изголовьем. Показаниями к интубации трахеи является наличие дыхательной недостаточности (признаки гипоксемии, гиперкапнии), необходимость протекции дыхательных путей при нарастании энцефалопатии. При необходимости — интубация трахеи (седация), проведение респираторной терапии. Рекомендовано рассмотреть возможность мониторинга внутричерепного давления. Немедленное лечение судорог. Целесообразно использование маннитола при идентификации тяжелого отека мозга или первых признаках вклинения.
2. Профилактика и лечение инфекционных осложнений.
Выбор антибактериальной терапии должен основываться на типе, тяжести и происхождении инфекции (внебольничная, внутрибольничная), а также на данных эпидемиологического профиля ОИТ и знании локальной резистентности флоры к антибиотикам (2а, С).
3. Лечение коагулопатии.
Рекомендовано эмпирическое введение витамина K всем больным с ОПечН (10 мг внутривенно).
Назначение свежезамороженной плазмы рекомендовано при проведении инвазивных процедур или при наличии активного кровотечения. Введение тромбоцитов — при уровне последних 10 000/мм3 в сыворотке крови или при необходимости проведения инвазивных процедур. Введение криопреципитата рекомендуется пациентам, которые имеют выраженную гипофибриногенемию (< 100 мг/дл). При проведении инвазивных процедур возможно введение рекомбинантного активированного фактора VIIa (rFVIIa). При явлениях гиперфибринолиза (диффузная кровоточивость слизистых и мест уколов) — введение препаратов с антифибринолитической активностью.
Профилактика стрессовых язв: введение блокаторов H2-рецепторов или блокаторов протонной помпы.
4. Гемодинамика/почечная недостаточность.
Мониторинг центральной гемодинамики. Контроль инфузионной терапии. При необходимости поддержания адекватного среднего артериального давления — проведение вазопрессорной поддержки (допамин, адреналин, норадреналин). Избегать назначения нефротоксических препаратов. Проведение заместительной почечной терапии при необходимости.
5. Метаболическая терапия.
Тщательный мониторинг уровня глюкозы, калия, магния и фосфора сыворотки крови. С учетом выраженного катаболического состояния необходимо обеспечение нутритивной поддержки: рекомендовано проведение энтерального и/или парентерального питания.
Метаболический гомеостаз должен тщательно поддерживаться у пациентов с острой печеночной недостаточностью [24]. К основным задачам метаболического лечения относятся: устранение гиперметаболизма и минимизация гиперкатаболизма; профилактика и лечение СПОН; терапия синдрома кишечной недостаточности; поддержка функции скелетных и дыхательных мышц; полноценное обеспечение энергетических и пластических потребностей и раннее начало нутритивной поддержки [25].
Метаболизм белков и нуклеиновых кислот включает их синтез из структурных компонентов аминокислот и нуклеотидов, соответственно, и распад до конечных продуктов катаболизма — СО2, Н2О, NH3, мочевой кислоты и др. Катаболизм аминокислот в тканях происходит постоянно со скоростью 1 мг/кг/сут. За исключением аминокислот, имеющих разветвленный радикал (лейцин, изолейцин и валин), в печени подвергаются дезаминированию почти все аминокислоты, поступающие в организм с белками пищи. Аминокислоты с разветвленным радикалом подвергаются метаболизму преимущественно в скелетных мышцах.
Основным продуктом обмена белков и аминокислот становится аммиак, который обладает высокой цитотоксичностью. К некоторым путям образования аммиака относятся: неокислительное дезаминирование аминокислот в печени (серин, треонин, гистидин), окислительное дезаминирование глутаминовой кислоты в печени и почках, катаболизм биогенных аминов во всех тканях, распад глутамина в тонкой кишке. Аммиак вырабатывается под действием бактерий толстого кишечника и всасывается в кровь через стенку кишечника. Основным органом, в котором происходят процессы детоксикации аммиака, является печень. В ходе нескольких последовательных реакций, происходящих в печени под действием ферментов, к двум молекулам аммиака присоединяется одна молекула СО2, в результате чего образуется мочевина [26, 27]. Мочевина является конечным продуктом, в форме которого аминный азот выводится из организма. Образовавшаяся мочевина легко диффундирует из печени и затем выделяется через почки. В сутки образуется 20–30 г мочевины.
К причинам накопления и избытка аммиака относятся:
— трофический распад собственных белков организма и, соответственно, увеличение количества аммиака на фоне преобладания процессов катаболизма;
— недостаточный уровень орнитина, необходимый для утилизации повышенного количества аммиака;
— дефицит L-аргинина (около 15 % плазменного аргинина превращается в орнитин под действием аргиназы);
— генетические дефекты ферментов синтеза мочевины;
— нарушение синтеза мочевины в печени и выведения ее почками.
Пациенты с ОПечН, имеющие высокий уровень аммиака артериальной крови, имеют большую вероятность развития осложнений и неблагоприятного исхода, чем пациенты с его более низким уровнем [28].
Независимыми предикторами стойкой гипераммониемии являются инфекции, почечная недостаточность, снижение рН артериальной крови.
Существуют значительные клинические и экспериментальные доказательства того, что аммиак является основным фактором в патогенезе печеночной энцефалопатии. В работе M. Holecek (2014) показано, что методы лечения, ориентированные на кишечную флору, имеют лишь ограниченное влияние на уровень аммиака у пациентов с печеночной недостаточностью. Делается акцент на необходимости использования терапевтических стратегий, ориентированных на нормализацию метаболизма [29].
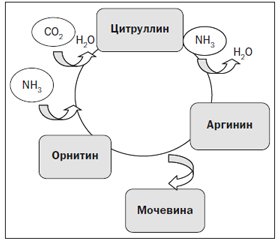
Улучшение основного биологического механизма элиминации аммиака — орнитинового цикла может дать значимый терапевтический эффект (рис. 2). Функции орнитинового цикла в печени — превращение азота аминокислот в мочевину и синтез аргинина.
В цикле принимают участие две аминокислоты, которые не входят в состав белков, — орнитин и цитруллин и две протеиновые аминокислоты — аргинин и аспарагиновая кислота. Орнитин усваивается митохондриями перипортальных гепатоцитов, где он служит метаболитом в образовании мочевины [30]. С орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата, который компенсирует затраты энергии на синтез мочевины. Аргинин является условно-незаменимой аминокислотой при стрессе, стимулирует секрецию гормона роста, инсулина, функциональную активность иммунных клеток, снижает стрессовый катаболизм белка, обеспечивает положительный азотистый баланс [31].
Возможность влияния на метаболические нарушения у пациентов с ОПечН обеспечивается применением лекарственных средств, в состав которых входят аминокислоты в различном качественном и количественном составе. Основными задачами этих препаратов являются снижение уровня метаболической нагрузки на клетки печени и повышение энергетического потенциала гепатоцитов в условиях метаболического стресса.
Патогенетически обоснованным препаратом для снижения метаболической нагрузки, которая возникает при увеличении распада собственных белков организма на фоне катаболизма и нарушения утилизации аммиака, является L-ornithine-L-aspartate (LoLa). Эффективность его определяется сбалансированной комбинацией аминокислот орнитина и аспартата, каждая из которых включается как в общие, так и в специфичные для каждой аминокислоты метаболические пути. Терапевтическая эффективность оригинального LoLa (Гепа-Мерц®) по уменьшению концентрации аммиака обусловливается двумя путями: периферическим (повышение синтеза мочевины и глутамина) и центральным (повышение синтеза глутамина) [32].
Молекула орнитина представляет собой ключевой субстрат в цепи последовательных ферментативных реакций орнитинового цикла синтеза мочевины (цикл Кребса — Хензелейта), протекающего в перипортальных гепатоцитах, в результате которого токсические азотсодержащие продукты распада, в первую очередь аммиак, преобразуются в нетоксическую водорастворимую мочевину — главный конечный продукт белкового обмена, которая, в свою очередь, выделяется почками.
Орнитин увеличивает активность и продукцию фермента карбамоилфосфатсинтетазы, под действием которого в присутствии N-ацетилглутаминовой кислоты аммиак превращается в карбамоилфосфат. Из последнего под действием орнитинтранскарбамоилсинтазы образуется аминокислота цитруллин, которая взаимодействует с аспартатом и трансформируется в аргинин — «полунезаменимую» аминокислоту, которая далее в присутствии аргиназы вновь образует орнитин. В результате орнитиновый цикл замыкается, а его продуктом является молекула мочевины, которая способна эффективно выводиться из организма. При этом одна из амидных групп мочевины формируется из неорганического аммиака, а вторая приносится аспартатом. Дополнительное введение LoLa приводит к усилению метаболизма в орнитиновом цикле и сопровождается выраженным увеличением детоксикации аммиака.
Кроме того, LoLa включается и в другие, неорнитиновые пути метаболизма. Так, орнитин повышает продукцию полиаминов — спермина и спермидина, способных регулировать биосинтез РНК, ДНК и белка, что в целом оказывает стимулирующий эффект на белковосинтетическую функцию печени. Орнитин участвует в биосинтезе глутамата, α-кетоглутарата и пролина, которые также играют существенную роль в биосинтезе белка. Аспартат, в свою очередь, под действием трансаминаз способен метаболизироваться в оксалоацетат, который вовлекается в цикл трикарбоновых кислот Кребса и, кроме того, подвергается последовательной трансформации в глюкозу, которая в виде гликогена способна депонироваться в печени (процесс глюконеогенеза). Кроме того, аспартат выполняет роль нейромедиатора в ЦНС и участвует в реакции переаминирования с глутамином, в результате чего повышает его концентрацию и трансформируется в аспарагин — аминокислоту, способную к ряду важных биохимических превращений. Как аспарагин, так и глутамин являются важными аминокислотами, участвующими в биосинтезе белка. Эти реакции протекают как в перивенозных гепатоцитах, так и в мышечной ткани, что играет немаловажную роль при хронических заболеваниях печени в условиях снижения ее функционального резерва [33].
Таким образом, вследствие применения LoLa возрастает пул многих аминокислот, участвующих в биосинтезе белка, — аспартата, аспарагина, глутамата, глутамина, пролина, аргинина, аланина и некоторых других. Кроме того, LoLa активирует биосинтез всех нуклеотидов и нуклеиновых кислот, а также оротовой кислоты, обладающей анаболическим эффектом. Это приводит к увеличению пула нуклеотидов и нуклеиновых кислот, сопровождается усилением биосинтеза белка и улучшением белковосинтетической функции печени как у пациентов с ХДЗП, так и у здоровых людей. Считается, что этот биохимический эффект в сочетании с увеличением продукции полиаминов является наиболее важным для объяснения анаболического действия LoLa.
Кроме того, внедрение дополнительных субстратов из LoLa в орнитиновый цикл приводит к росту биосинтеза макроэргических молекул, которые вырабатываются в сопряженном с LoLa цикле Кребса, который является основным источником энергии у человека. В первую очередь это связано с фумаратом. Сочетание этих факторов приводит к так называемому эргогенному эффекту — возрастанию энергетического потенциала организма вследствие усиления обменных процессов. Поэтому при увеличении содержания орнитина и аспартата в организме повышается продукция энергии в цикле Кребса. Аспартат приводит к уменьшению зависимости клеток от получения энергии в результате гликолиза и росту получения энергии из жирных кислот, проходящих через печень. Кроме того, снижается образование молочной кислоты и потребность организма в кислороде за счет усиления анаэробного окисления [34].
Эффективная нутритивная поддержка является одним из основных методов профилактики и лечения осложнений печеночной недостаточности.
С учетом участия печени в процессах энергетического обмена, поддержания гомеостаза организма и выработки биологически активных субстратов эффективное проведение нутритивной поддержки обеспечивает необходимый уровень жизнедеятельности органов и систем.
Использование метаболических (парентеральный, энтеральный способ применения препаратов; применение фармаконутриентов в комплексе терапии поддержки) способов коррекции нутритивного статуса у пациентов с функциональными нарушениями работы печени имеет свои особенности.
Согласно ESPEN Guidelines on Parenteral Nutrition: Hepatology (2009), у пациентов с патологией печени рекомендовано проводить прикроватный скрининг для выявления больных, имеющих высокий риск нутритивной недостаточности [35]. Рекомендовано начать проведение парентерального питания (ПП) у сильно истощенных пациентов с циррозом, которые не могут получать пероральное или энтеральное питание (ЭП) в достаточном количестве. Назначать глюкозу (2–3 г/кг в день), когда пациент имеет перерыв в питании более 12 ч. Скорость введения глюкозы необходимо уменьшить в случае развития гипергликемии с рассмотрением вопроса об использовании инсулина. Применение растворов глюкозы позволяет обеспечить 50–60 % небелковых энергетических потребностей.
При применении растворов аминокислот актуальным является повышение эффективности проводимой нутритивной поддержки. При развитии энцефалопатии рекомендовано использование растворов, богатых аминокислотами с разветвленной цепью и с низким содержанием ароматических аминокислот, метионина и триптофана.
У пациентов с ОПечН нутритивную поддержку рекомендовано начинать тогда, когда они не могут возобновить нормальное пероральное питание в течение 5–7 дней. Использовать ПП, когда не могут адекватно использоваться методы ЭП. При ОПечН расход энергии покоя увеличивается в 1,2–1,3 раза по сравнению со здоровыми лицами, поэтому энергетическая потребность должна быть измерена индивидуально с использованием непрямой калориметрии (C). Для профилактики и лечения гипогликемии обязательным является введение глюкозы (2–3 г/кг в день). Рассматривается возможность использования липидов (LCT/MCT) в дозе 0,8–1,2 г/кг в день, особенно при развитии инсулинорезистентности.
Независимо от причин, вызывающих печеночную недостаточность, в предыдущих руководствах пациентам рекомендовалась диета с ограничением белка. В обзоре Е.Ю. Плотниковой (2013) показано, что у пациентов с ПечН при чрезмерном ограничении поступления белка в результате активации мышечного катаболизма может повышаться уровень аммиака крови [36].
Ограничение потребления белка ухудшает нутритивный статус, поэтому для поддержания азотистого баланса и адекватного синтеза белка у пациентов с ОПечН при ПП доза аминокислот должна составлять 0,8–1,2 г/кг/сут, при ЭП количество потребляемого белка должено быть 0,8–1,2 г/кг/сут.
Данная дозировка аминокислот не всегда дает возможность в достаточной степени компенсировать распад белков при катаболизме у больных с органной дисфункцией. При проведении полного ПП также возможно развитие осложнений, связанных с метаболическими нарушениями:
— ранними, которые могут развиваться на фоне перегрузки субстрата из-за недостаточного его потребления, а также связанных с изменением осмотичности и неадекватной элиминацией питательных субстратов (углеводы, липиды, продукты неполного гидролиза белков), замедленным выведением из организма неметаболизируемых составляющих вливаемой среды;
— поздними и отдаленными реакциями при парентеральном питании могут быть различные электролитные нарушения (снижение уровня К, Са, Мg и фосфора);
— развитием синдрома инсулинорезистентности.
В связи с этим, во-первых, рекомендовано проведение адекватного метаболического мониторинга для обеспечения строгого контроля в плазме крови: уровня глюкозы (5–8 ммоль/л), лактата (< 2,0 ммоль/л), триглицеридов (< 3,0 ммоль/л) и аммиака (< 100 ммоль/л). Тяжелая гипофосфатемия приводит к дыхательной недостаточности, дисфункции нервной системы и эритроцитов. Во-вторых, коррекция метаболических нарушений с включением фармаконутриентов в программу парентерального питания.
Современная концепция клинического питания — включение фармаконутриентов в программу парентерального питания с целью улучшения эффективности лечения путем коррекции метаболических нарушений [37].
Актуальность проблемы повышения эффективности нутритивной поддержки и уменьшения риска осложнений потребовала поиска дополнительных возможностей применения препаратов, влияющих на механизмы обмена аминокислотных субстратов.
По данным C. Bémeur et al. (2010), в дополнение к удовлетворению энергетических и белковых потребностей назначение аминокислот, антиоксидантов, витаминов и пробиотиков может улучшить состояние питания, функцию печени и уменьшить печеночную энцефалопатию у больных с печеночной недостаточностью [38].
Tina Jafari et al. (2015) проведен компьютеризированный поиск в базах данных PubMed и Cochrane, ISI WEB of Science и Iran Medex рандомизированных контролируемых исследований, которые оценивали эффект парентерального питания с фармакоиммунонутриентами [39]. При проведении анализа показано, что внутривенное введение фармакоиммунонутриентов значительно снижало риск развития инфекционных осложнений (ОР = 0,59; 95% ДИ 0,39–0,88; р ≤ 0,05) и смертности (ОР = 0,26; 95% ДИ 0,11–0,59; р ≤ 0,001) у больных с острым панкреатитом, достоверно снижалась длительность госпитализации (MD = –2,93 дня; 95% ДИ –4,70–1,15; р ≤ 0,001). Сделан вывод, что включенные в комплекс парентерального питания фармакоиммунонутриенты, такие как глутамин и ω-3 ЖК, могут улучшить прогноз у больных с острым панкреатитом.
Оригинальный L-ornithine-L-aspartate (Гепа-Мерц®) внесен в стандарты лечения ПЭ у пациентов с заболеваниями печени Американской и Европейской ассоциаций по лечению заболеваний печени [40].
В.В. Никонов и соавт. (2011) провели сравнительный анализ клинических и биохимических показателей больных с печеночной недостаточностью, осложненной печеночной энцефалопатией, в лечение которых включен L-орнитин-L-аспартат и аргинина глутамат [41]. Динамика снижения показателей печеночной недостаточности (АЛТ, АСТ, ГГТП, уровень аммиака, мочевины) при использовании L-орнитина-L-аспартата была более быстрой, как и уменьшение признаков ПЭ. При длительном приеме L-орнитина-L-аспартата не регистрировали побочных или нежелательных эффектов, что свидетельствовало о безопасности этого препарата.
Кроме обезвреживания аммиака, орнитин-аспартатный комплекс оказывает анаболическое действие, блокирует мышечный катаболизм, стимулирует действие гормона роста, выделение инсулина и его действие как анаболического гормона [42].
Динамика показателей белкового обмена у больных в послеоперационный период изучалась В.Б. Зингеренко и соавт. (2007). Автор включил в схему полного парентерального питания оригинальный L-ornithine-L-aspartate (Гепа-Мерц®) (внутривенно в дозе 40 г/сут) с целью коррекции белкового обмена и азотистого баланса у пациентов (n = 48) с распространенным перитонитом различной этиологии. Актуальность этой работы заключается в том, что получена возможность оценить явления катаболизма-анаболизма по различным критериям и влияние на эти процессы LoLa (Гепа-Мерц®). Динамика уровня различных аминокислот дала возможность определить уровень распада белков и степень восстановления белковосинтетической функции печени. На катаболическую реакцию организма, снижение белковообразующей функции печени и увеличение потерь белка указывала прогрессирующая диспротеинемия — цифры уровня общего белка, альбумина, преальбумина, трансферрина, коэффициент А/Г. Интенсивность катаболизма с усиленным распадом смешанного мышечного белка отражала значительное повышение суточной экскреции азота с мочой. Одновременно происходило усиление синтеза белков острой фазы — С-реактивного белка.
Полученные результаты показали, что более выраженная положительная динамика показателей белкового обмена в послеоперационном периоде была у больных, которые применяли препарат LoLa (Гепа-Мерц®), чем в контрольной группе. Пациенты основной группы продемонстрировали быструю динамику восстановления уровня общего белка, альбумина, аргинина и орнитина сыворотки плазмы, что свидетельствовало об улучшении белковосинтетической функции печени. Динамика снижения уровня аланина и глутамина свидетельствовала об уменьшении катаболизма белков. Введение LoLa (Гепа-Мерц®) в схемы терапии пациентов с перитонитом позволило повысить эффективность проводимой нутритивной поддержки.
У пациентов с печеночной недостаточностью рекомендовано проведение динамического мониторинга уровня аммиака крови (Guidelines on Parenteral Nutrition, Hepatology, 2009). Влияние на уровень снижения концентрации аммиака при инфузии оригинального L-ornithine-L-aspartate (Гепа-Мерц®) представлено в клинических работах [43, 44].
Развитие явлений эндотоксикоза у пациентов хирургического профиля сопровождается повышением уровня метаболической нагрузки на печень. Это проявляется как нарушением сознания в виде делириев, так и признаками недостаточности гепатоцитов (изменения АЛТ, АСТ, мочевины, ГГТП, билирубина). Коррекция метаболических нарушений является одним из ключевых факторов эффективной терапии эндотоксикоза и делириозных состояний.
В клиническом мультицентровом сравнительном исследовании Ю.С. Винник и соавт. (2011) изучены эффективность и безопасность оригинального L-орнитина-L-аспартата (Гепа-Мерц®) как препарата, относящегося к группе гепатопротективных средств, влияющих на метаболические нарушения [45]. Оценивалось влияние LoLa (Гепа-Мерц®) на показатели тяжести состояния и динамику неврологических показателей у 232 пациентов с острым панкреатитом. Установлено, что при в/в введении LoLa (Гепа-Мерц®) (по 2 ампулы в день в течение 5 дней) отмечалось уменьшение выраженности неврологических расстройств по системе определения тяжести состояния SAPS2. У пациентов основной группы, получавших LoLa (Гепа-Мерц®), по сравнению с контрольной на 25 % быстрее восстанавливались показатели нервно-психической сферы, разница между тяжестью состояния пациентов по шкале СОФА составила 30 %. Также в пользу пациентов, получавших Гепа-Мерц®, свидетельствовала динамика разницы снижения АЛТ и АСТ, которая составила 20 %. Таким образом, был сделан вывод, что применение оригинального L-орнитина-L-аспартата оказывает влияние на механизмы коррекции эндотоксикоза и обеспечивает более эффективный механизм гепатопротекции при повышенной метаболической нагрузке на печень.
По данным А.В. Бутрова, А.Ю. Борисова (2006), у больных с острой абдоминальной патологией, осложненной алкогольным делирием, назначение оригинального L-орнитина-L-аспартата (Гепа-Мерц®) представляется патогенетически обоснованным. При назначении LoLa (Гепа-Мерц®) отмечалось более раннее купирование симптомов делирия (в среднем около 3–4 суток) и быстрое восстановление когнитивных функций (внимание, память, ориентация во времени, пространстве и личности), требовалось введение меньшего количества седативных препаратов по сравнению с пациентами контрольной группы, у которых продолжительность делирия составляла в среднем 5–6 суток. Авторы регистрировали нормализацию биохимических показателей крови, в том числе и белкового обмена; сокращение сроков лечения в ОИТ [46].
В.В. Лаптевым и соавт. (2008) проведено клиническое исследование у 51 больного с механической желтухой доброкачественного генеза (холедохолитиаз — 84,3 %, стеноз большого сосочка двенадцатиперстной кишки — 9,8 %, парапапиллярный дивертикул — 5,9 %). Разрешение холестаза проводили на 1-е — 3-и сутки госпитализации. Выявлено позитивное влияние препарата Гепа-Мерц® на улучшение биохимических показателей сыворотки крови (снижение уровня ЩФ, АлАТ, АсАТ и билирубина), нормализацию гемодинамики печени и коррекцию когнитивных функций. Разница основных показателей между группой, получавшей LoLa (Гепа-Мерц®), и контрольной группой без оригинального L-орнитина-L-аспартата (Гепа-Мерц®) составила по основным показателям около 30 %. Сделан вывод, что восстановление функционального состояния печени позволяет оптимизировать комплексное лечение механической желтухи неопухолевого генеза [47].
Возможность влиять на факторы повреждения гепатоцитов, связанные с хирургическим вмешательством, были изучены Т.В. Ермоловой и соавт. (2009) у пациентов с хроническими заболеваниями печени различного генеза [8]. При проведении полигепатографии на фоне терапии оригинальным L-орнитина-L-аспартатом (Гепа-Мерц®) у всех исследуемых основной группы независимо от типа нарушений портопеченочной гемодинамики, определяемой этиологией и стадией заболевания, отмечены признаки улучшения портопеченочной гемодинамики. Улучшение портопеченочной гемодинамики характеризовалось увеличением кровенаполнения печени, на фоне которого независимо от исходного типа реографических кривых наблюдалась тенденция к нормализации их формы. Это свидетельствовало об улучшении соотношения артериовенозного притока и венозного оттока, имеющего важное значение в печеночной гемодинамике. На основании полученных данных определено, что использование оригинального LoLa (Гепа-Мерц®) положительно влияет на портопеченочную гемодинамику, способствует нормализации биохимических показателей (уменьшение цитолитического, холестатического синдрома, усиление белковосинтетической функции печени), уменьшает проявления печеночной энцефалопатии. Авторы обосновали, что за счет патогенетических механизмов раннее включение препарата Гепа-Мерц® в схемы лечения у данной категории пациентов значительно уменьшает риск послеоперационных осложнений. Разница в развитии признаков печеночной недостаточности (ПЭ, изменения показателей биохимии крови) составила 60 % в пользу пациентов, получавших LoLa (Гепа-Мерц®) в энтеральной и инфузионной форме в дозе 10–15 г/сут в предоперационный период).
Таким образом, эффективная дозировка оригинального L-ornithine-L-aspartate (Гепа-Мерц®) составляет от 2 до 4 ампул в сутки. По данным многочисленных клинических исследований доказано, что данная дозировка обеспечивает эффект как детоксикации, так и гепатопротекции.
Выводы
1. Функциональное нарушение работы печени, связанное с развитием полиорганной недостаточности, повышает риск летального исхода у пациентов хирургического профиля на 23–90 %.
2. Лабораторными критериями нарушения работы печени являются изменения показателей биохимии крови (увеличение АЛТ, АСТ, ГГТП, билирубина и мочевины крови), белковосинтетической функции печени (снижение общего белка и альбумина крови, изменение А/Г коэффициента), развитие коагулопатии (нарушение синтеза белков свертывающей системы крови).
3. Развитие печеночной энцефалопатии различной степени тяжести относится к клиническим признакам нарушения работы печени. Это связано с нарушением механизмов детоксикации продуктов обмена, одним из которых является аммиак, концентрация которого увеличивается в результате распада белков при процессах катаболизма.
4. Использование метаболических способов коррекции нутритивного статуса у пациентов с функциональными нарушениями работы печени (парентеральный, энтеральный способ применения препаратов; применение фармаконутриентов в комплексе терапии поддержки) имеет свои особенности.
5. При ОПечН энергетическая потребность должна быть измерена индивидуально с использованием непрямой калориметрии. Для профилактики и лечения гипогликемии обязательным является введение глюкозы (2–3 г/кг в день). Рассматривается возможность использования липидов (LCT/MCT) в дозе 0,8–1,2 г/кг в день, особенно при развитии инсулинорезистентности.
6. У пациентов с ОПечН при чрезмерном ограничении поступления белка в результате активации мышечного катаболизма может повышаться уровень аммиака крови. Для поддержания азотистого баланса и адекватного синтеза белка у пациентов с ОПечН при ПП доза аминокислот должна составлять 0,8–1,2 г/кг/сут. При ЭП уровень потребляемого белка должен быть 0,8–1,2 г/кг/сут. При этом рекомендован динамический мониторинг уровня аммиака крови.
7. Терапевтические мероприятия, направленные на защиту печени, являются необходимым элементом эффективной интенсивной терапии пациентов хирургического профиля. Внутривенное введение оригинального L-ornithine-L-aspartate (Гепа-Мерц®) влияет на увеличение объема утилизации аммиака, что позволяет напрямую снизить токсическую нагрузку продуктов обмена белков на клетки головного мозга.
8. Гепатопротекция при применении оригинального L-ornithine-L-aspartate (Гепа-Мерц®) обусловлена снижением метаболической нагрузки на клетки печени. Аминокислота аспартат повышает энергетический потенциал гепатоцита, что также обеспечивает механизмы защиты гепатоцита в условиях развития эндотоксикоза.
9. Особенности биохимических трансформаций орнитина и аспартата в цикле трикарбоновых кислот позволяют оказывать плейотропные (дополнительные) эффекты при применении оригинального L-ornithine-L-aspartate (Гепа-Мерц®): белковосинтетическое действие, вазоактивное и нейропротективное, что связано с физиологическим увеличением аргинина в оринитиновом цикле мочевинообразования.
10.По данным многочисленных исследований, клинический опыт применения оригинального L-ornithine-L-aspartate (Гепа-Мерц®) показал возможность повышения эффективности нутритивной поддержки у пациентов с острой хирургической патологией, уменьшения риска развития осложнений при проведении энтерального и парентерального питания.
Список литературы
1. Зильбер А.П. Полиорганная недостаточность как новый вид патологии: клиническая физиология, интенсивная терапия, профилактика / А.П. Зильбер // Актуальные проблемы медицины критических состояний. — 2000. — № 7. — С. 71-91.
2. Ужва В.П. Ранняя диагностика острой послеоперационной печеночной недостаточности у хирургических больных / В.П. Ужва, Н.Ф. Мосинцев // Клиническая хирургия. — 1992. — № 12. — С. 49-53.
3. Гепаторенальный синдром и проблема коррекции белково-энергетического метаболизма в неотложной хирургии органов брюшной полости / Дибиров М.Д., Брискин Б.С., Костюченко М.В., Добрякова Э.А., Мхитарова Л.A. // Экспериментальная и клиническая гастроэнтерология. — 2009. — № 2. — С. 83-87.
4. Особенности профилактики и лечения дисфункции печени и почек при остром панкреатите / Дибиров М.Д., Костюченко М.В., Рамазанова Ю.И., Габибов Р.М., Нухов Р.Р., Ашимова А.А. // Український журнал хірургії. — 2011. — № 2 (11). — С. 40-44.
5. Синдром эндогенной интоксикации / Шано В.П., Кучер Е.А. // Острые и неотложные состояния в практике врача. — 2011. — № 1 (25). — С. 35-42.
6. Kim T.Y. Acute-on-chronic liver failure / T.Y. Kim, D.J. Kim // Clin. Mol. Hepatol. — 2013. — Vol. 19, № 4. — P. 349-359.
7. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL) 2014 / Sarin S.K., Kumar A., Almeida J.A., Chawla Y.K., Fan S.T., Garg H. et al. // Hepatol. Int. — 2014. — Vol. 8. — Р. 453-471.
8. Изучение эффективности L-орнитина-L-аспартата (Гепа-Мерц) в профилактике послеоперационных осложнений у больных хроническими заболеваниями печени / Т.В. Ермолова, А.В. Шабров, С.Ю. Ермолов, В.В. Олейник // Гастроэнтерология. — 2009. — № 5. — С. 26-32.
9. Щербак И.Б. Коррекция функциональных нарушений печени при острой хирургической патологии / И.Б. Щербак // Український медичний часопис. — 2012. — № 5 (91). — С. 71-77.
10. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL) // Sarin S.K., Kumar A., Almeida J.A., Chawla Y.K., Fan S.T., Garg H., et al. / Hepatol. Int. — 2009. — Vol. 3. — P. 269-282.
11. Гальперин Э.И., Семендяева М.И., Неклюдова Е.А. Недостаточность печени. — М.: Медицина, 1978. — 328 с.
12. Drug-induced acute liver failure: results of a U S multicenter, prospective study / Reuben A., Koch D.G., Lee W.M. // Hepatology. — 2010. — Vol. 52, № 6. — Р. 2065-2076.
13. AASLD Position Paper: The Management of Acute Liver Failure: Update 2011 / William M. Lee, Anne M. Larson, R. Todd Stravitz // Hepatology. — 2011. — Р. 1-18.
14. Wang Fu-S. Liver: How can acute-on-chronic liver failure be accurately identified? / Fu-S. Wang, Z. Zhang // Gastroenterology and Hepatology. — 2013. — Vol. 10. — P. 390-391.
15. Acute-on-chronic liver failure: concept, natural history, and prognosis / Olson J.C., Kamath P.S. // Curr. Opin. Crit. Care. — 2011. — Vol. 17. — P. 165-169.
16. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis / Moreau R., Jalan R., Gines P., Pavesi M., Angeli P., Cordoba J., et al. // Gastroenterology. — 2013. — Vol. 144. — P. 1426-1437.
17. Сорокіна О.Ю. Нутрітивна підтримка пацієнтів у критичному стані: Навчально-методичний посібник / Сорокіна О.Ю., Козинець Г.П. — К., Бізнес-інтелект, 2009. — 163 с.
18. Role of NMDA receptors in acute liver failure and ammonia toxicity: therapeutical implications / Rodrigo R., Cauli O., Boix J., ElMlili N., Agusti A., Felipo V. // Neurochem. Int. — 2009. — Vol. 55, № 1-3. — P. 113-118.
19. Mohsenin V. Assessment and management of cerebral edema and intracranial hypertension in acute liver failure / V. Mohsenin // J. Crit. Care. — 2013. — Vol. 28, № 5. — P. 783-791.
20. Butterworth R.F. Pathogenesis of hepatic encephalopathy and brain edema in acute liver failure / R.F. Butterworth // J. Clin. Exp. Hepatol. — 2015. — Vol. 5, № 1. — P. 96-103.
21. Intensive care management of acute liver failure / W. Bernal, G. Auzinger, E. Sizer, J. Wendon // Semin. Liver Dis. — 2008. — Vol. 28, № 2. — Р. 188-200.
22. Willars C. Update in intensive care medicine: acute liver fai–lure. Initial management, supportive treatment and who to transplant / C. Willars // Curr. Opin Crit. Care. — 2014. — Vol. 20, № 2. — Р. 202-209.
23. Intensive Care of Patients With Acute Liver Failure: Recom–mendations of the U.S. / R.T. Stravitz, A.H. Kramer, T. Davern, A.O.S. Shaikh, S.H. Caldwell, R.L. Mehta, A.T. Blei, R.J. Fontana, B.M. McGuire, L. Rossaro, A.D. Smith, W.M. Lee // Crit. Care Med. — 2007. — Vol. 35, № 11. — P. 2498-2508.
24. ASLD Position Paper: The Management of Acute Liver Fai–lure / J. Polson, W.M. Lee // Hepatology. — 2005. — Vol. 41, № 5. — P. 1129-1197.
25. Pathogenesis and management of alcoholic liver cirrhosis: a review / Huang Y.W., Yang S.S., Kao J.H. // Hepat. Med. — 2011. — Vol. 24, № 3. — P. 1-11.
26. The 2007 ESPEN Sir David Cuthbertson Lecture: Amino acid between and within organs. The glutamate-glutamine-citrulline-arginine pathway / Nicolaas E.P.Deuts // Clinical Nutr. — 2008. — Vol. 27. — P. 321-327.
27. Сitrulline as a biomarker of intestinal failure due to enterocyte mass redaction / P. Crenn, B. Messing, L. Cynober // Clinical Nutr. — 2008. — Vol. 27. — P. 328-339.
28. Persistent hyperammonemia is associated with complications and poor outcomes in patients with acute liver failure / Kumar R., Shalimar, Sharma H., Prakash S., Panda S.K., Khanal S., Acharya S.K. // Clin. Gastroenterol. Hepatol. — 2012. — Vol. 10, № 8. — P. 925-931.
29. Holecek M. Evidence of a vicious cycle in glutamine synthesis and breakdown in pathogenesis of hepatic encephalopathy-therapeutic perspectives / M. Holecek // Metab. Brain Dis. — 2014. — Vol. 29, № 1. — P. 9-17.
30. The purified and reconstituted ornithine/citrulline carrier from rat liver mitochondria catalyses a second transport mode: ornithine+/H+ exchange / C. Indiveri, A. Tonazzi, I. Stipani, F. Palmieri // Biochem. J. — 1999. — Vol. 341, № 3. — Р. 705-711.
31. Metabolism of ornithine, α-ketoglutarate and arginine in isolated perfused rat liver / De Bandt J.P., Cynober L.A., Coudray-Lucas C., Poupon R., Giboudeau J. // Br. J. Nutr. — 1995. — Vol. 73. — Р. 227-239.
32. L-Ornithine-L-Aspartate in Experimental Portal-Systemic Encephalopathy: Therapeutic Efficacy and Mechanism of Action / C. Rose, A. Michalak, P. Pannunzio, G. Therrien, G. Quack, G. Kircheis, R.F. // Butterworth Metabolic Brain Disease. — 1998. — Vol. 13, Is. 2. — Р. 147-157.
33. Therapeutic efficacy of L-ornithine-L-aspartate infusions in patients with cirrhosis and hepatic encephalopathy: results of a placebo-controlled, double-blind study / Kircheis G., Nilius R., Held C., Berndt H., Buchner M., Görtelmeyer R., Hendricks R., Krüger B., Kuklinski B., Meister H., Otto H.J., Rink C., Rösch W., Stauch S. // Hepatology. — 1997. — Vol. 25. — P. 1351-1360.
34. A double-blind, randomized, placebo-controlled trial of intravenous L-ornithine-L-aspartate on postural control in patients with cirrhosis / Schmid M., Peck-Radosavljevic M., König F., Mittermaier C., Gangl A., Ferenci P. // Liver Int. — 2010. — Vol. 30, № 4. — P. 574-82.
35. ESPEN Guidelines on Parenteral Nutrition: Hepato–logy / M. Plauth, E. Cabre, B. Campillo, J. Kondrup, G. Marchesini, T. Schu, A. Shenkin, J. Wendon // / Clinical Nutrition. — 2009. — Vol. 28. — P. 436–444.
36. Плотникова Е.Ю. Роль L-орнитина-L-аспартата в комплексном лечении больных с гипераммониемией / Е.Ю. Плотникова // Клинические перспективы гастроэнтерологии, гепатологии. — 2013. — № 2. — С. 41-49.
37. Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М.: М-Вести, 2002. — 320 с.
38. Role of Nutrition in the Management of Hepatic Encephalopathy in End-Stage Liver Failure / C. Bémeur, P. Desjardins, R.F. Butterworth // Journal of Nutrition and Metabolism. — 2010. — Vol. 2010, Article ID 489823, 12 pages, doi:10.1155/2010/489823.
39. Parenteral immunonutrition in patients with acute pancreatitis: A systematic review and meta-analysis / T. Jafari, A. Feizi, G. Askari, A.A. Fallah // Clinical Nutr. — 2015. — Vol. 34, № 1. — P. 35-44.
40. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver / Vilstrup H., Amodio P., Bajaj J., Cordoba J., Ferenci P., Mullen K.D., Weissenborn K., Wong P. // Hepatology. — 2014. — Vol. 60, № 2. — P. 715-735.
41. Эффективность L-орнитина-L-аспартата в комплексном лечении печеночной энцефалопатии / Никонов В.В., Нудьга А.Н., Ковалева Е.А. // Медицина неотложных состояний. — 2011. — № 6 (37).
42. Williams J.Z. Effect of a specialized amino acid mixture on human collagen deposition / J.Z. Williams, N. Abumrad, A. Barbul // Ann. Surg. — 2002. — Vol. 236. — Р. 369-375.
43. Ткач С.М. L-орнитин_L-аспартат как универсальный гепатопротектор-детоксикант с плейотропными эффектами / С.М. Ткач // Здоров’я України. — 2013. — № 3. — С. 60-61.
44. Efficacy of L-ornithine L-aspartate in acute liver failure: a double-blind, randomized, placebo-controlled study / Acharya S.K., Bhatia V., Sreenivas V., Khanal S., Panda S.K. // Gastroenterology. — 2009. — Vol. 136, № 7. — P. 2159-2168.
45. Эффективность L-орнитина-L-аспартата (Гепа-Мерц) в терапии острого панкреатита / Ю.С. Винник, С.В. Миллер, О.В. Теплякова, Н.И. Цедрик, Е.В. Онзуль // Вестник хирургической гастроэнтерологии. — 2011. — № 2. — С. 70.
46. Бутров А.В., Борисов А.Ю. Опыт применения препарата Гепа Мерц в лечении больных с острой хирургической патологией, осложненной развитием алкогольного делирия // Новости анестезиологии и реаниматологии. — 2006. — № 3. — С. 68-71.
47. Применение препарата Гепа-Мерц при механической желтухе неопухолевого генеза / В.В. Лаптев, С.А. Румянцева, А.Ю. Цкаев, Н.Е. Гивировская, А.В. Черняков, Н.А. Смирнова, Е.В. Малькова // Анналы хирургической гепатологии. — 2008. — Т. 13, № 4. — С. 106-111.
/36.jpg)
/39.jpg)