Статья опубликована на с. 43-50
Многие пациенты после крупных и малых оперативных вмешательств испытывают умеренную и сильную послеоперационную боль. Неадекватное купирование данного болевого синдрома влечет за собой целый спектр медицинских и экономических последствий, таких как более длительное время восстановления после операции, задержка в способности вставать с постели, повышение частоты осложнений, увеличение срока пребывания в стационаре, потенциал трансформации боли в хроническую послеоперационную боль. Исторически основной группой средств для борьбы с выраженной послеоперационной болью являются опиоиды. Однако их применение связано с развитием большого количества побочных эффектов и потенциальным злоупотреблением [1].
В связи с этим в последние десятилетия был предложен мультимодальный подход к купированию послеоперационной боли, обычно включающий в себя комбинирование опиоидов и нестероидных противовоспалительных средств (НПВС). Данный подход часто позволяет добиться более выраженного обезболивания и, кроме того, уменьшить количество используемых опиоидов и связанных с ними побочных эффектов [1].
Одним из подобных средств, хорошо зарекомендовавших себя в режимах мультимодальной терапии для борьбы с послеоперационной болью, является кеторолак. Будучи по структуре НПВС, данное лекарственное средство вызывает анальгезию, сравнимую с таковой у опиоидов [2]. Большим прорывом стало появление на фармацевтическом рынке новой, более удобной интраназальной формы кеторолака как альтернативы внутривенной и внутримышечной формам, которая прошла успешную апробацию в клинических исследованиях высокого качества. В связи с актуальностью темы мы посвятили настоящий обзор оценке фармакологических свойств интраназального кеторолака и результатов его применения для лечения послеоперационной боли у пациентов после крупных и малых хирургических вмешательств.
Общие сведения о кеторолаке и его новой интраназальной форме
Кеторолак относится к НПВС с сильной обезболивающей активностью [2]. По механизму действия его относят к смешанным ингибиторам циклооксигеназы (ЦОГ) 1-го и 2-го типа с высокой аффинностью к ЦОГ-1 [3]. Обезболивающие эффекты кеторолака были изучены, в частности, в послеоперационном периоде у стационарных и амбулаторных больных. После крупных абдоминальных, ортопедических и гинекологических вмешательств и амбулаторных лапароскопических и гинекологических процедур кеторолак вызывал ослабление слабой/умеренной/сильной боли у большинства пациентов и обладал такой же обезболивающей активностью, как стандартные дозы морфина и петидина (меперидина). Обезболивающие эффекты кеторолака могут быть несколько отсрочены, однако часто персистируют дольше, чем таковые у опиоидов. Комбинированная терапия кеторолаком и опиоидами приводит к снижению использования опиоидов на 25–50 %, а также других НПВС. Одновременно это сопровождается снижением частоты опиоид-связанных побочных эффектов, более быстрому восстановлению функции желудочно-кишечного тракта и меньшему пребыванию в стационаре [2].
Длительное время в практике врачей для послеоперацинной анальгезии были доступны внутривенная и внутримышечная формы кеторолака. Однако по-настоящему революционной стала разработка сравнимой по эффективности интраназальной формы, популярность которой продолжает расти. Легкость использования новой формы и отсутствие необходимости выполнения внутривенных и внутримышечных инъекций делает удобной ее применение у стационарных и особенно амбулаторных больных.
В выполненных исследованиях было продемонстрировано, что для интраназальной и внутримышечной форм кеторолака характерны одинаковые фармакокинетические параметры, что подразумевает их сходную эффективность и безопасность [4]. Кеторолак вводили 15 здоровым волонтерам в однодозовом перекрестном рандомизированном клиническом исследовании фазы 1. Субъекты открыто рандомизированно получали 15 и 30 мг внутримышечного кеторолака и слепо рандомизированно — 15 и 30 мг интраназального кеторалака. В результате было выяснено, что интраназальный кеторолак хорошо переносился и единственное, что беспокоило некоторых из добровольцев, — это симптомы со стороны носа, проявлявшиеся в виде легкого раздражения. Интраназальный кеторолак быстро и хорошо абсорбировался (медиана tmax 0,50–0,75 ч), время полувыведения составляло приблизительно 5–6 ч; оба параметра соответствовали аналогичным значениям для внутримышечного кеторолака. Относительная биодоступность двух форм также была одинаковой. Более того, в диапазоне от 15 до 30 мг была отмечена дозопропорциональность двух лекарственных форм кеторолака. По результатам этого исследования был сделан вывод о том, что интраназальный кеторолак является терапевтической альтернативой внутримышечной форме кеторолака.
Интраназальный кеторолак выпускают в виде назального дозированного спрея. Стандартная однократная доза составляет 31,5 мг. Для ее достижения необходимо сделать по 1 впрыскиванию (15,75 мг) в каждую ноздрю. Препарат вводится 3–4 раза в сутки не более 5 дней. Интраназальный кеторолак используют для кратковременного лечения умеренной/сильной боли, требующей обезболивания на опиоидном уровне [5, 6].
Результаты нового исследования свидетельствуют о том, что увеличение системной экспозиции интраназального кеторолака у пожилых людей в возрасте ≥ 65 лет требует снижения их однократной дозы наполовину, до 15,75 мг (одно впрыскивание в одну ноздрю), исходя из аналогичной тактики у внутримышечного кеторолака [7].
В связи с хорошей исследованностью интраназального кеторолака для лечения умеренной/сильной послеоперационной боли мы включили в настоящий обзор результаты рандомизированных контролируемых двойных слепых исследований данного препарата в практике обезболивания после крупных и малых оперативных вмешательств.
Клиническая эффективность
Интраназальный кеторолак для обезболивания после крупных оперативных вмешательств
Среди доступных исследований нам удалось обнаружить 2 рандомизированных контролируемых двойных слепых исследования применения интраназального кеторолака для борьбы с умеренной/тяжелой послеоперационной болью у пациентов после крупных хирургических вмешательств [8, 9].
Исследование C. Brown и соавт. [8]
В первое исследование было включено 300 пациентов (средний возраст 52 года, диапазон от 19 до 81 года), которым требовалось выполнение абдоминальных или ортопедических хирургических вмешательств. Среди абдоминальных операций основной была тотальная гистерэктомия (87 % пациентов), среди ортопедических — эндопротезирование тазобедренного сустава (72 %). Другие операции включали овариоцистэктомию, ламинэктомию, восстановление разорванных сухожилий вращательной манжеты плеча, репозицию и фиксацию переломов, сальпинго-оофорэктомию, реконструкцию молочной железы, аппендэктомию, эндопротезирование коленного и голеностопного суставов. У большинства пациентов (77 %) применяли общую анестезию. После операции пациенты оставались в стационаре от 2 до 5 дней (0-й день исследования соответствовал дню операции, 4-й день исследования —5-му дню после операции).
В день после операции (день 0) пациентам назначали интраназальный кеторолак 31,5 мг или сравнимое плацебо до 3 раз в день, если выраженность боли по визуальной аналоговой шкале (ВАШ) была ≥ 40 мм. Изначально кеторолак вводили медсестры, принимавшие участие в исследовании, — по одному впрыскиванию (100 мкл) в каждую ноздрю, что обеспечивало дозу 31,5 мг/прием. Одновременно они инструктировали пациентов о том, как это правильно делать. И в дальнейшем, если пациенту было комфортно, он принимал лекарственное средство самостоятельно. В дополнение к этому с 0-го дня пациенты имели доступ к PCA (пациент-контролируемая анальгезия) с помощью морфина сульфата.
На следующий день после операции (день 1) за 3 ч до приема кеторолака или плацебо пациентов лишали возможности принимать морфин с помощью PCA. Если в течение 5 ч после этого выраженность боли по ВАШ не достигала 40 мм, то пациентов включали в многодозовую фазу исследования. В ходе этой фазы пациенты получали интраназальный кеторолак 31,5 мг или плацебо 3 раза в день, максимум до 4-го дня исследования. При необходимости в первые 48 ч после операции пациенты могли использовать PCA с помощью морфина, а спустя 48 ч после операции — резервное обезболивающее средство (перорально парацетамол). Если же при проведении оценки по ВАШ выраженность боли была ≥ 40 мм, пациентов включали в однодозовую фазу исследования. Во время этой фазы пациентам назначали одну дозу интраназального кеторолака 31,5 мг или плацебо, без доступа к PCA с помощью морфина и наблюдали за пациентами в течение 6 ч. Пациентов из однодозовой фазы переводили затем в многодозовую фазу, когда 1) боль возвращалась к исходному уровню либо 2) требовалось дополнительное обезболивание морфином с помощью PCA.
Исходя из дизайна исследования, пациентов рандомизировали в соотношении 2 : 1 (группа с кеторолаком — n = 199, плацебо-группа — n = 101).
Среди показателей, изученных в однодозовой фазе, были разница в интенсивности боли (PID), суммированная PID в течение 6 ч (SPID6), начало обезболивания, максимальный обезболивающий эффект, длительность анальгезии и качество анальгезии. Все показатели были изучены в течение первых 6 ч после приема одной дозы кеторолака или плацебо. Важно отметить, что SIPD6 была выбрана авторами в качестве первичной конечной точки исследования.
Разница в интенсивности боли (PID) представляет собой разницу между исходной выраженностью боли (до приема первой дозы кеторолака или плацебо в день 1, т.е. до начала однодозовой фазы) и спустя 30 мин, 1, 2, 3, 4, 5 и 6 ч (после приема первой дозы кеторолака или плацебо в день 1, т.е. после начала однодозовой фазы). Авторы сообщают, что среднее значение PID было достоверно больше в группе с кеторолаком по сравнению с плацебо спустя 30 мин, 1, 2, 3 ч и в соответствии с рядом статистических критериев спустя 4 ч (в большинстве случаев p ≤ 0,005). Это свидетельствует о большей обезболивающей активности кеторолака по сравнению с плацебо.
Суммированная PID в течение 6 ч (SPID6) была первичной конечной точкой исследования — основным показателем, по которому судили об обезболивающей активности кеторолака по сравнению с плацебо. Данный показатель является стандартным в исследованиях боли и рассчитывается по формуле: SPID = ∑PIDi • ∆ti. То есть для каждой отметки времени, например для 2 ч, рассчитывается соответствующее значение PID (исходная выраженность боли минус выраженность боли спустя 2 ч) и умножается на прошедшее время (на 2 ч), и затем подобным образом полученные значения суммируются для всех 6 ч однодозовой фазы. Математическое описание показателя SPID6 взято из источников [10–12]. В результате в цитируемом нами исследовании [1] было установлено, что среднее значение ± станд. откл. SPID6 в группе с кеторолаком было достоверно выше по сравнению с плацебо (83,3 ± 10,6 против 37,2 ± 12,9; p = 0,007) (рис. 1). Это свидетельствует о большей обезболивающей активности кеторолака по сравнению с плацебо.
/45.jpg)
При изучении начала обезболивающего эффекта было установлено, что у достоверно большего количества пациентов в группе с кеторолаком по сравнению с плацебо наблюдалось значимое ослабление боли спустя 1 ч (84 и 70 %) и 1,5 ч (84 и 72 %) однодозовой фазы (p < 0,05). Максимальный обезболивающий эффект был достоверно большим в группе с кеторолаком по сравнению с плацебо (среднее ± станд. откл.: 30,9 ± 1,9 мм против 19,8 ± 2,8 мм; р = 0,001). Длительность анальгезии в группе с кеторолаком составила 3 ч, что было достоверно больше по сравнению с плацебо-группой, где она составила 1,3 ч (p < 0,04). Об этом параметре судили по времени, через которое пациенты выражали желание вернуться к РСА с помощью морфина. Авторы исследования сообщают, что полученная длительность анальгезии оказалась меньше, чем в других исследованиях: в других работах с кеторолаком ее значения достигали 6–8 ч. Авторы связывают это с тем, что пациенты в 0-й день имели возможность опробовать анальгезию с помощью морфина, и поэтому в 1-й день, во время однодозовой фазы, их ожидания от морфиновой анальгезии заставляли быстрее вернуться к РСА с помощью морфина. Это искусственно занижало полученное время длительности анальгезии с помощью кеторолака. Качество анальгезии (0 — плохая, 1 — некоторая, 2 — хорошая, 3 — очень хорошая, 4 — отличная) было более высоким в группе с кеторолаком по сравнению с плацебо с 30 мин по 5 ч однодозовой фазы (p < 0,05).
Среди показателей, изученных в многодозовой фазе, были общая оценка болевого контроля (для 0, 1, 2, 3 и 4-го дней исследования), качество анальгезии (8, 32, 40, 48 ч после первой дозы тестируемого препарата) и средний общий расход морфина (в течение 48 ч после операции). В ходе многодозовой фазы пациенты получали вначале интраназальный кеторолак 31,5 мг или плацебо 3 раза в день + при необходимости PCA с помощью морфина в течение первых 48 ч после операции, а затем интраназальный кеторолак 31,5 мг или плацебо 3 раза в день + при необходимости резервное обезболивающее средство (перорально парацетамол) спустя 48 ч после операции.
В результате было выяснено, что общая оценка болевого контроля и качество анальгезии в большинстве точек были одинаковы для групп с кеторолаком и плацебо. Также было обнаружено, что в плацебо-группе наблюдался больший расход морфина сульфата: в течение 48 ч после операции в группе с кеторолаком средний ± станд. откл. общий расход морфина составил 51,40 ± 2,75 мг, в группе с плацебо — 77,40 ± 5,28 мг (p < 0,001) (рис. 2).
Таким образом, в рандомизированном контролируемом двойном слепом исследовании C. Brown и соавт. [8] у пациентов с умеренной/тяжелой послеоперационной болью после крупных хирургических вмешательств были обнаружены следующие преимущества интраназального кеторолака по сравнению с плацебо: большая обезболивающая активность, более раннее начало (30 мин), большая длительность и лучшее качество анальгезии, меньший расход морфина.
Исследование N. Singla и соавт. [9]
В дополнение к вышеописанному было выполнено еще одно исследование сходного дизайна, в которое были включены пациенты (n = 321; диапазон возраста от 18 до 64 лет), нуждавшиеся в абдоминальной операции. Среди абдоминальных операций основной была гистерэктомия с оофорэктомией или без таковой (69,5 %). Другие оперативные вмешательства включали оофорэктомию, миомэктомию, резекцию кишечника, илеостомию, колэктомию, колостомию, цистэктомию, герниопластику, оментэктомию, простатэктомию, кесарево сечение. Большинству пациентов (99 %) требовалась общая анестезия. После операции пациенты пребывали в стационаре от 2 до 5 дней.
После выполнения операции на усмотрение исследователя пациенту мог быть введен внутривенный опиоид до достижения комфортного состояния (авторы работы не описывают критерии достижения этого состояния). После этого пациент давал оценку выраженности боли, и если она была ≥ 40 мм по шкале ВАШ, ему назначали интраназальный кеторолак 31,5 мг или сравнимое плацебо 4 раза в день в течение первых 48 ч после операции. Кроме того, при необходимости пациенты могли использовать РСА с помощью морфина не менее 48 ч после операции. Спустя 48 ч после операции пациентам назначали интраназальный кеторолак 31,5 мг или сравнимое плацебо, максимум до 4 раз в день. Когда исчезала необходимость в РСА с помощью морфина, при усилении боли могло быть использовано резервное обезболивающее средство (гидрокодон/ацетаминофен). Во всех случаях кеторолак назначали из расчета по одному впрыскиванию (100 мкл) в каждую ноздрю, что обеспечивало дозу 31,5 мг/прием.
Пациентов рандомизировали в соотношении 2 : 1 (группа с кеторолаком — n = 214, плацебо-группа — n = 107).
В ходе исследования были изучены следующие основные показатели: разница в интенсивности боли (PID), суммированная PID в течение 6 ч (SPID6), максимальный обезболивающий эффект в течение 6 ч после приема первой дозы тестируемого препарата; общая оценка болевого контроля в течение 5 дней исследования; качество анальгезии спустя 20, 40, 60 мин, 2, 3, 4, 5, 6, 12, 18, 24, 30, 36, 42 и 48 ч после приема первой дозы тестируемого препарата; средний общий расход морфина в течение 72 ч после операции (при использовании в этот срок других анальгетиков (гидрокодон/ацетаминофен) делали пересчет на их морфиновые эквиваленты). SPID6 была выбрана авторами в качестве первичной конечной точки исследования.
В результате исследования было выяснено, что среднее значение PID было достоверно больше в группе с кеторолаком по сравнению с плацебо спустя 20 мин, 1, 2, и 3 ч после приема первой дозы тестируемого препарата (p ≤ 0,034). Среднее значение (полученное с помощью метода наименьших квадратов) ± станд. откл. SPID6 в группе с кеторолаком было достоверно выше по сравнению с плацебо (117,4 ± 7,7 против 89,9 ± 10,6; p = 0,032) (рис. 3). Максимальный обезболивающий эффект был одинаков в группах с кеторолаком и плацебо (среднее, полученное с помощью метода наименьших квадратов, ± станд. откл.: 32,7 ± 1,5 мм против 30,0 ± 2,1 мм; р > 0,05).
Общая оценка болевого контроля (0 — плохая, 1 — некоторая, 2 — хорошая, 3 — очень хорошая, 4 — отличная) была более высокой в группе с кеторолаком по сравнению с плацебо только в 1-й день исследования (среднее ± станд. откл.: 2,60 ± 0,06 против 2,40 ± 0,09; р = 0,009). Качество анальгезии (0 — плохая, 1 — некоторая, 2 — хорошая, 3 — очень хорошая, 4 — отличная) практически во все контрольные точки времени в группе с кеторолаком было достоверно выше по сравнению с плацебо (p < 0,05). Средний общий расход морфина в течение 72 ч достоверно не различался между обеими группами, что было связано с малым количеством пациентов, принимавших так долго морфин или резервное обезболивающее средство. Средний общий расход морфина в течение 48 ч после операции был достоверно меньше в группе с кеторолаком по сравнению с плацебо (65 мг против 85 мг, стандартные отклонения не были доступны; р = 0,004) (рис. 4).
/47.jpg)
Следовательно, в рандомизированном контролируемом двойном слепом исследовании N. Singla и соавт. [9] у пациентов с умеренной/тяжелой послеоперационной болью после крупных хирургических вмешательств были обнаружены следующие преимущества интраназального кеторолака перед плацебо: большая обезболивающая активность, более раннее начало (20 мин) и более высокое качество анальгезии, меньший расход морфина.
Интраназальный кеторолак для обезболивания после малых оперативных вмешательств
К настоящему времени было выполнено 1 рандомизированное контролируемое двойное слепое исследование применения интраназального кеторолака для борьбы с послеоперационной болью у пациентов после малых хирургических вмешательств [13]. Ниже мы приводим его краткую характеристику.
Исследование G.M. Grant и соавт. [13]
В цитируемое исследование было включено 80 пациентов, которым требовалась экстракция третьего моляра, не прорезавшегося из-за блокады костной тканью. После операции пациентам назначали либо интраназальный кеторолак (n = 40) в дозе 31,5 мг, либо плацебо (n = 40). За пациентами наблюдали до 8 ч после приема тестируемого препарата или до тех пор, пока у пациентов не возникала потребность в приеме резервного обезболивающего средства. Выраженность боли оценивали по ВАШ.
В указанные сроки в ходе исследования были изучены следующие основные показатели: суммированная PID в течение 8 ч (SPID8), общее ослабление боли и общая оценка болевого контроля. SPID8 была выбрана авторами в качестве первичной конечной точки исследования.
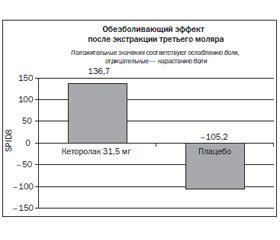
В результате было обнаружено, что среднее значение ± станд. откл. SPID8 было достоверно выше в группе с кеторолаком по сравнению с плацебо (136,7 ± 33,0 против –105,2 ± 29,1; p < 0,001) (рис. 5). Общее ослабление боли было достоверно выше в группе с кеторолаком по сравнению с плацебо во все контрольные отметки времени (p < 0,001). Время до ощутимого (21,5 мин) и значимого (66,0 мин) ослабления боли было достоверно меньше в группе с кеторолаком по сравнению с плацебо (p < 0,001). Время до приема резервного обезболивающего средства было достоверно больше в группе с кеторолаком по сравнению с плацебо (360 мин против 96 мин; p < 0,001) (рис. 6). При проведении общей оценки болевого контроля было выяснено, что хороший, очень хороший и отличный контроль в группе с кеторолаком наблюдался значительно чаще, чем в плацебо-группе (60 против 13 %).
/48.jpg)
Таким образом, в рандомизированном контролируемом двойном слепом исследовании G.M. Grant и соавт. [13] у пациентов с послеоперационной болью после малого хирургического вмешательства были обнаружены следующие преимущества интраназального кеторолака перед плацебо: большая обезболивающая активность, более раннее начало анальгезии (21,5 мин), более позднее возникновение потребности в приеме резервного обезболивающего средства.
Безопасность
В официальной информации к кеторолаку сообщается о том, что подобно другим неселективным НПВС данный препарат потенциально может увеличивать гастроинтестинальный риск — вызывать образование тяжелых язв и провоцировать язвенные кровотечения, повышать риск других кровотечений, увеличивать сердечно-сосудистый риск — вероятность образования инфарктов и инсультов. В ряде случаев осложнения могут носить смертельный характер [14].
Однако в процитированных в настоящем обзоре рандомизированных контролируемых исследованиях [8, 9, 13] при назначении кеторолока в дозе 31,5 мг 3–4 раза в день сроком до 5 дней вышеперечисленные побочные эффекты отмечены не были. Единственным побочным эффектом, который встречался значительно чаще в группах с кеторолаком по сравнению с плацебо-группами, была риналгия и раздражение в полости носа. Эти симптомы были легкими, носили транзиторный характер и не становились тяжелее при использовании препарата несколько дней. По результатам выполненных исследований авторы сообщают о хорошей переносимости интраназального кеторолака.
При использовании других парентеральных форм кеторолака также было отмечено, что риск развития серьезных побочных эффектов, таких как желудочно-кишечное кровотечение или кровотечение из места операции, достаточно мал. Он увеличивается лишь в том случае, если препарат назначают в больших дозах, более 5 дней и у пожилых лиц [15].
Учитывая приведенные данные, доза всех парентеральных форм кеторолака у лиц старше 65 лет должна быть снижена наполовину [7].
Ранее уже упоминалось о способности парентеральных форм кеторолака уменьшать количество потребляемого больными морфина и, как следствие, частоту опиоид-связанных побочных эффектов [2]. В процитированных клинических исследованиях [8, 9] была отмечена тенденция к снижению частоты встречаемости тошноты, запоров и зуда. В одном из этих исследований [8] сообщается о том, что недооценка влияния интраназального кеторолака на опиоид-зависимую тошноту и рвоту могла быть связана с тем, что 80 % пациентов принимало противорвотные средства в течение первых 48 ч после операции.
При проведении доклинических исследований интраназального кеторолака не было обнаружено токсических и мутагенных свойств. В частности, при повторном введении данного препарата крысам в течение 14 дней, с последующим периодом восстановления в течение 14 дней, не было отмечено гибели, значимых отклонений в общем состоянии и динамике массы тела животных. При пятикратном введении интраназального кеторолака крысам-самцам не было отмечено увеличения числа аберрантных клеток, а также числа аберраций хромосомного и хроматидного типов [16].
Следовательно, анализ безопасности позволяет заключить, что кратковременное (до 5 дней) применение интраназального кеторолака в стандартной дозировке 31,5 мг (у пожилых — 15,75 мг) 3–4 раза в день не приводит к развитию серьезных побочных эффектов и хорошо переносится. Единственными симптомами, которые беспокоили пациентов значительно чаще по сравнению с плацебо, были риналгия и раздражение в полости носа. Они были легкими, носили транзиторный характер и не нарастали с течением времени. Была выявлена способность интраназального кеторолака уменьшать частоту опиоид-связанных побочных эффектов (тошнота, запоры и зуд). В доклинических исследованиях интраназального кеторолака не было обнаружено токсических и мутагенных свойств.
Заключение
В течение десятилетий внутривенная и внутримышечная формы кеторолака успешно использовались клиницистами для борьбы с выраженными болевыми синдромами. Создание новой интраназальной формы кеторолака позволяет облегчить прием препарата, уменьшив объем парентеральных вмешательств, и переложить контроль за анальгезией на пациента при сохранении такого же высокого терапевтического эффекта. В частности, в настоящем обзоре была продемонстрирована выраженная клиническая эффективность и безопасность интраназального кеторолака в борьбе с умеренной/сильной послеоперационной болью у пациентов после крупных и малых оперативных вмешательств. Одновременно было отмечено снижение количества применяемых опиоидов и тенденция к уменьшению опиоид-связанных побочных эффектов. Полученные результаты гарантируют широкое применение интраназального кеторолака для борьбы с болевыми синдромами в клиниках Украины и других стран мира.
На отечественном фармацевтическом рынке интраназальная форма кеторолака доступна под патентованным названием Асприкс производства ООО НПФ «Микрохим» (Украина). Препарат выпускают во флаконах по 4 мл (40 доз), что позволяет полностью покрыть курс лечения как при 3-, так и 4-кратном введении. Препарат Асприкс дает возможность врачам и их пациентам использовать самые передовые разработки в области послеоперационной анальгезии, что ведет к оптимизации проводимого курса терапии.
Подготовил к.м.н. А.В. Савустьяненко
/45.jpg)
/46.jpg)

/47.jpg)
/48.jpg)