Статтю опубліковано на с. 12-16
Кардиоваскулярные события являются основной причиной смертности пациентов с хронической болезнью почек (ХБП). Основу фармакотерапии, позволяющей увеличить выживаемость пациентов, составляют блокаторы ренин-ангиотензиновой системы, среди которых ведущее место принадлежит ингибиторам ангиотензинпревращающего фермента (ИАПФ) и блокаторам рецепторов ангиотензина (БРА) (KDIGO, 2012) [1]. Препараты этих групп принято называть ренопротекторными, так как с доказательной точки зрения они способствуют увеличению сроков до начала почечно-заместительной терапии при ХБП. Основное фармакологическое действие этих групп препаратов состоит в уменьшении негативной роли ангиотензина II и периферической вазодилатации.
По мере прогрессирования ХБП возрастает значение гиперактивности симпатической системы. Ее роль состоит в компенсации снижения скорости клубочковой фильтрации (СКФ), возникающей из-за снижения количества функционирующих нефронов. Увеличение активности симпатической системы сопровождается повышением артериального давления (АД) и возрастанием кардиоваскулярных рисков, что в большинстве случаев требует назначения комбинированной антигипертензивной терапии [2]. Дополнение терапии ИАПФ/БРА/прямыми ингибиторами ренина (ПИР) проводится симпатолитиками, блокаторами кальциевых каналов, бета-блокаторами, блокаторами альдостерона и диуретиками. Выбор ИАПФ/БРА определяется путем выведения почки/печень в зависимости от уровня СКФ и базируется на доказательной базе по снижению кардиоваскулярных рисков.
Стандартная тактика медикаментозной коррекции при ХБП выглядит так, как представлено в табл. 1.
В клинической нефрологии на смену клонидину пришли моксонидин и урапидил. Среди блокаторов кальциевых каналов более оправдано использование лерканидипина, действующего через низковольтные рецепторы. Пальма первенства среди бета-блокаторов принадлежит небивололу, который не ухудшает гломерулярный кровоток и снижает центральное аортальное давление. Таким образом, в практической нефрологии стали использовать формулу БРИМОНЕЛ — БР(А)И(АПФ)МО(ксонидин)НЕ(биволол)Л(ерканидипин) [3].
Подбор доз и комбинации этих препаратов, то есть персонифицированную индивидуализацию лечения, современная фармакология предлагает проводить на основе фармакогенетических тестов и индивидуальной переносимости.
Многочисленные исследования последних лет свидетельствуют, что гетерогенность ответа пациентов с артериальной гипертензией (АГ) на прием различных антигипертензивных препаратов на 50 % обусловлена генетическими особенностями [4]. Персонализированная терапия основана на индивидуальных геномных профилях, которые предполагают характеристику 5 типов кластеров генов и их соответствующих метаболических профилей. К ним относятся гены, связанные с патогенезом заболевания, механизмом действия лекарственного средства (ЛС), метаболизмом (фаза I и II) и транспортом ЛС, а также плейотропные гены, включенные в многогранные каскады и реакции метаболизма [5].
Большинство известных генетических маркеров артериальной гипертензии представляют собой однонуклеотидные замены (полиморфизмы). Эти полиморфизмы довольно широко распространены в популяции. На данный момент идентифицировано более 1500 генетических полиморфизмов, ассоциированных с уровнем АД, которые осуществляют свой вклад через различные патогенетические механизмы [6]. Однако степень и достоверность ассоциаций варьируют, а для некоторых локусов данные являются противоречивыми. Перспективным направлением становится применение генетического тестирования для индивидуального подбора антигипертензивной терапии, так как существуют генетические маркеры, ассоциированные с эффективностью и безопасностью лечения АГ.
Применение генетических тестов целесообразно при нестандартном течении болезни и подозрении на моногенные формы АГ. Из всех генетических вариаций, влияющих на реакции лекарственных средств, проводимые фармакогенетические тестирования были сфокусированы на анализе генов, кодирующих ферменты, ответственные за реакции фазы I и II в метаболизме ЛС, особенно генов семейства цитохрома P450 (CYP450) [7, 8]. Изучение этих генов проводилось чрезвычайно высокими и прогрессивными темпами на протяжении последних 25 лет [9, 10].
Некоторые антигипертензивные препараты первой линии, включая блокаторы кальциевых каналов, бета-адреноблокаторы, блокаторы рецепторов ангиотензина II, ингибиторы ангиотензинпревращающего фермента и диуретики, подвергаются метаболизму через различные изоформы CYP [11–14]. К ним относятся изоферменты CYP2D6, CYP2C9, CYP2C19 и CYP3A4/5, которые являются наиболее значимыми для пациента в реакции ответа на ЛС [15] (табл. 2).
В недавно опубликованном наиболее крупном популяционном фармакогенетическом исследовании, которое проводилось в Испании, у 1115 пациентов с АГ (средний возраст — 48 лет) изучалась роль генетического полиморфизма основных метаболизирующих ферментов системы Р450 — изоформ CYP3A4/5, CYP2D6, CYP2C19, CYP2C9 [16].
Фармакогенетические характеристики анализируемых образцов представлены на рис. 1. Так, у цитохромов CYP2D6 и CYP2C9 были отмечены довольно низкие значения присутствия нормальных метаболизаторов (EM) (EM 55,4 и 60,4 % соответственно) по сравнению с цитохромами CYP2C19 (EM 74,9 %) и CYP3A4/5 (EM 79,56 %).
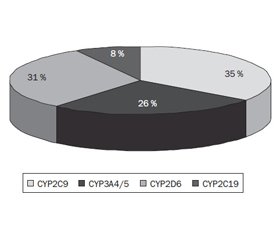
Ферментативный метаболизм антигипертензивных ЛС осуществляется через основные гены семейства CYP — CYP2C9, CYP3A4/5 и CYP2D6 (рис. 2).
По результатам генотипирования была показана частота встречаемости разных генотипов в популяции пациентов с АГ. Выявлено, что наибольшая вариабельность отмечается для изоферментов CYP2D6 (44,6 %) и CYP2C9 (39,6 %). При анализе частоты применения разных антигипертензивных препаратов доли ЛС, метаболизирующихся этими изоферментами, составили 16 и 25 % соответственно, а ошибки при назначении этих классов препаратов имели место в 31 и 35 % случаев соответственно (рис. 3).
Каким образом это применимо в практике? Одной из лабораторий в Украине начато тестирование путем полимеразной цепной реакции цитохрома 450, гена CYP2D6. Мутации гена CYP2D6, приводящие к недостатку данного фермента, вызывают замедление метаболизма β-адреноблокаторов (табл. 2). Напротив, мутации CYP2D, представляющие собой тандемные копии гена, ведут к избыточной экспрессии цитохрома Р450 оксидазы. Лицам с такими аллелями для достижения терапевтического эффекта необходимы существенно большие дозы препаратов.
Медленные метаболизаторы по CYP2D6 — это гомо- или гетерозиготные носители функционально дефектных аллельных вариантов данного гена CYP2D6. В зависимости от первичного повреждающего эффекта возможны следующие результаты:
— отсутствие синтеза CYP2D6 (аллельный вариант CYP2D6*5);
— синтез неактивного белка (аллельные варианты CYP2D6*3, CYP2D6*4, CYP2D6*6, CYP2D6*7, CYP2D6*8, CYP2D6*11, CYP2D6*12, CYP2D6*14, CYP2D6*15, CYP2D6*19, CYP2D6*20);
— синтез дефектного белка со сниженной активностью (варианты CYP2D6*9, CYP2D6*10, CYP2D6*17, CYP2D6*18, CYP2D6*36).
Наличие в генотипе аллелей, снижающих активность фермента CYP2D6, увеличивает риск развития артериальной гипотензии при приеме стандартных доз вышеперечисленных групп препаратов. Подобного рода ситуации требуют подбора индивидуальной дозы препарата.
Среди описанных на сегодняшний день аллелей гена CYP2D6 95 % всех медленных метаболизаторов являются носителями вариантов CYP2D6*3, CYP2D6*4 и CYP2D6*5, остальные варианты обнаруживают гораздо реже.
Наиболее распространенным аллельным вариантом гена CYP2D6 является CYP2D6*4.
С клинической точки зрения важна диагностика для установления медленных метаболизаторов среди пациентов, так как именно для них целесо–образно использование меньших доз антигипертензивных препаратов. В последний год мы проводим такой подбор для пациентов. Персонифицированная индивидуализация позволяет:
— избежать побочных эффектов, например снижения вкуса пищи, распознавания запахов, эректильной дисфункции, частоты кашля;
— получить экономию затрат на приобретение медикаментов;
— избежать токсичных эффектов, например ангионевротического отека, назального васкулита или резкого снижения СКФ.
Последнее осложнение отчетливо прослеживается по мере снижения функции почек и/или истощения функционального резерва почек, когда необходимость ИАПФ/БРА/ПИР как базовых средств теряет актуальность. В своей практике в последние годы мы все чаще используем практику отказа от ИАПФ/БРА/ПИР при снижении скорости клубочковой фильтрации менее 30 мл/мин (ХБП 4–5). Это связано с тем, что исчезает почечный субстрат для ренопротекции. В результате приведенная выше формула меняется на МНЕЛД — М(оксонидин)НЕ(биволол)Л(ерканидипин)Д(иуретик), где ди–уретик обычно петлевой, а именно: торасемид, фуросемид или ксипамид.
Подбор их дозы также возможен на основе фармакогенетических исследований. Особенно важно это при использовании альдактона и эплеренона (табл. 2), которые могут повышать калий крови, но остаются важным дополнением в блокаде ренин-ангиотензиновой системы.
Тактика индивидуализации дозы ИАПФ/БРА/ПИР при низком функциональном резерве почек прописана в рекомендациях Комитета экспертов Всероссийского научного общества кардиологов и Научного общества нефрологов России еще в 2009 году [17]. Мы в своей практике на протяжении последних 3 лет постепенно отказываемся от использования ИАПФ/БРА/ПИР при СКФ менее 30 мл/мин (ХБП 4–5). Наши данные свидетельствуют об отсутствии роста смертности от кардиоваскулярных причин у таких больных и некотором увеличении додиализного времени. Однако чрезвычайно важным является индивидуальный подход в назначении оптимальных доз моксонидина, небиволола, лерканидипина и диуретика.
Получение доказательных данных, очевидно, позволит пересмотреть повсеместную тактику использования ИАПФ/БРА/ПИР как базовой начальной терапии при ХБП и использовать индивидулизированное лечение в зависимости от ее стадии. При этом основная задача снижения кардиоваскулярной смертности, возможно, найдет свое новое решение. Дальнейшее изучение фармакогенетических аспектов эффективности антигипертензивных препаратов может способствовать оптимизации лечения пациентов с АГ, разработке фармакогенетических предикторов для индивидуального выбора антигипертензивных препаратов и повышения эффективности лечения и улучшения прогноза [18].
Конфликт интересов. Не заявлен.
Список литературы
1. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease // Kidney inter. — 2013. — Suppl. 3. — Р. 1-150.
2. Grassi G Sympathetic overdrive in hypertension: clinical and therapeutic relevance // The e-journal of the ESC Council for Cardio–logy Practice. — 24 Nov 2015. — Vol. 13, № 36.
3. Ivanov D. Почки. Нирки. Kidneys. — 2016. — № 1(16). — Р. 16.
4. Turner S.T., Schwartz G.L., Chapman A.B. et al. Antihypertensive pharmacogenetics: getting the right drug into the right patient // J. Hypertension. — 2001. — № 19. — Р. 1-11.
5. Cacabelos R. The Metabolomic Paradigm of Pharmacogeno–mics in Complex Disorders // Metabolomics. — 2012. — № 2. — e119.
6. International Consortium for Blood Pressure Genome-Wide Association Studies et al, Genetic variants in novel pathways infl uence blood pressure and cardiovascular disease risk // Nature. — 2011. — V. 478. — P. 103-9.
7. Schwartz G.L., Turner S.T. Pharmacogenetics of antihypertensive drug responses // Am. J. Pharmacogenomics. — 2004. — № 4. — Р. 151-160.
8. Kirchheiner J., Seeringer A. Clinical implications of pharmacogenetics of cytochrome P450 drug metabolizing enzymes // Biochim. Biophys. Acta. — 2007. — № 1770. — Р. 489-494.
9. Flockhart D.A., Tanus-Santos J.E. Implications of cytochrome P450 interactions when prescribing medication for hypertension // Arch. Intern. Med. — 2002. — № 162. — Р. 405-412.
10. Ingelman-Sundberg M. Pharmacogenetics of cytochrome P450 and its applications in drug therapy: the past, present and future // Trends Pharmacol. Sci. — 2004. — № 25. — Р. 193-200.
11. Kreutz R. Pharmacogenetics of antihypertensive drug response // Curr. Hypertens. Rep. — 2004. — № 6. — Р. 15-20.
12. Cacabelos R. World guide for drug use and pharmacogeno–mics. — EuroEspes Publishing, Corunna, 2012.
13. Höcht C., Bertera F.M., Mayer M.A., Taira C.A. Issues in drug metabolism of major antihypertensive drugs: beta-blockers, calcium channel antagonists and angiotensin receptor blockers // Expert Opin. Drug Metab. Toxicol. — 2010. — № 6(2). — Р. 199-211.
14. Siest G., Jeannesson E., Visvikis-Siest S. Enzymes and pharmacogenetics of cardiovascular drugs // Clin. Chim. Acta. — 2007. — № 381. — Р. 26-31.
15. Rodríguez Arcas M.J., García-Jiménez E., Martínez-Martínez F., Conesa-Zamora P. Role of CYP450 in pharmacokinetics and pharmacogenetics of antihypertensive drugs // Farm. Hosp. — 2011. — № 35. — Р. 84-92.
16. Torrellas C., Carril J.C., Cacabelos R. Benefits of Pharmacogenetics in the Management of Hypertension // J. Pharmacogeno–mics & Pharmacoproteomics. — 2014. — № 5. — Р. 1-7.
17. http://www.health-medix.com/articles/misteztvo/2009-03-24/7-14.pdf
18. Polimanti R., Iorio A., Piacentini S. et al. Human pharmacogenomic variation of antihypertensive drugs: from population genetics to personalized medicine // Pharmacogenomics. — 2014. — № 15(2). — Р. 157-67.

/12-16/12-a.jpg)
/12-16/13-1.jpg)
/12-16/14-1.jpg)
/12-16/15-1.jpg)
/12-16/15-2.jpg)