Статтю опубліковано на с. 172-178
Некомпактна кардіоміопатія, згідно з класифікацією МКХ-10 та рекомендаціями Асоціації кардіологів України 2016 року, належить до розділу некласифікованих кардіоміопатій (І42.8) [1] і є генетично гетерогенним захворюванням. Відомі автосомно-домінантні та Х-зчеплені варіанти спадкування, що значаться як ізольовані форми некомпактного лівого шлуночка. Ізольований некомпактний лівий шлуночок (ІНЛШ) являє собою рідкісний варіант вроджених кардіоміопатій. Відомі такі форми: некомпактний міокард лівого шлуночка, сімейний, ізольований, автосомно-домінантний першого типу (ген, картований на хромосомі 18q12.1-q12.2), захворювання обумовлено мутацією альфа-дистробревіну, некомпактний міокард лівого шлуночка, сімейний, ізольований, автосомно-домінантний другого типу (ген, картований на хромосомі 11р15) та некомпактний міокард лівого шлуночка, сімейний, ізольований, Х-зчеплений (ген, картований на хромосомі Хq28), захворювання обумовлено мутацією TAZ gene (тафазин), впливає на метаболізм кардіоліпіну [2].
Захворювання виникає під час ембріонального розвитку трабекулярних утворень міокарда. Пов’язане з порушенням упорядкування та ущільнення хаотично розташованих трабекул [3]. Підвищена трабекулярність звичайно не зустрічається у постнатальному періоді [4]. Найчастіше ІНЛШ спостерігається в поєднанні з різними вадами серця [5]. Уперше кардіоміопатія як самостійна нозологічна форма описана Thomas K. Chin та співавт. у 1990 році [6].
Частоту ІНЛШ остаточно не встановлено. За даними Ervin N. Oechslin (2000) [7], на підставі вивчення ехокардіоскопій частота зустрічальності становить 14 випадків на 100 тис. населення. Сімейні форми захворювання у дитячій популяції спостерігаються у 40–50 % випадків та у 18 % серед дорослих. Серед чоловіків захворювання зустрічається значно частіше [7].
Раніше некомпактний міокард позначали як персистуючі міокардіальні синусоїди, або як губчастий міокард. Переважно виявляється в лівому шлуночку та може зустрічатись у правому та в обох камерах серця.
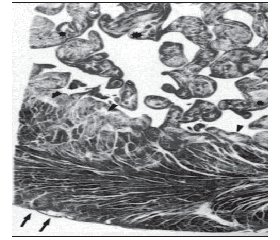
Некомпактний міокард не має специфічної гістологічної картини. Більшість патоморфологів відзначають підвищений фіброз трабекулярних структур (рис. 1, 2) [8].
Для перебігу захворювання характерний пролонгований безсимптомний період і фіналізація тяжкою серцевою недостатністю, що потребує трансплантації серця [9, 10]. Клінічні прояви захворювання неспецифічні, у 60–82 % випадків захворювання маніфестує з симптомокомплексу серцевої недостатності (задишка, набряки, тахікардія). Клінічна картина подібна до дилатаційної кардіоміопатії. Смертність протягом 3–6 років становить до 80 %. Найчастіше спостерігається діастолічна та систолічна дисфункція лівого шлуночка, системні емболії, шлуночкові та передсердні тахіаритмії, схильність до раптової смерті. Зведені літературні дані клінічних і демографічних проявів ІНЛШ наведені у табл. 1.
/173-1.gif)
Електрокардіографічні зміни неспецифічні та поліморфні. Описані випадки відхилення електричної осі серця вліво, атріовентрикулярні блокади різного ступеня, блокади лівих ніжок системи Гіса (21–44 %), фібриляція передсердь (7–26 %) та інші шлуночкові та надшлуночкові порушення серцевого ритму [11]. Опубліковані дані, що констатують високу частоту зустрічальності змін кінцевої частини шлуночкового комплексу: косонисхідна та горизонтальна депресія сегмента ST та інверсія зубця Т [12]. У частині випадків за сукупністю клінічних і лабораторних даних діагностувався інфаркт міокарда на ангіографічних інтактних коронарних артеріях. За даними автопсій, ішемічні зміни знаходили у трабекулах і потовщеному міокарді (найчастіше в субендокардіальних відділах). Однією з найпоширеніших гіпотез розвитку інфаркту є дисфункція судин мікроциркуляторного русла. Ішемізація міокарда також розглядається як одна з причин розвитку та прогресування ремоделювання лівого шлуночка та серцевої недостатності [13].
Ехокардіографія (ЕхоКГ) — найбільш важливий метод діагностики ІНЛШ. При ехокардіоскопії (ЕхоКС) за короткою віссю виявляється два шари міокарда: більш компактний — субепікардіальний і некомпактний через наявність трабекулярності — субендокардіальний. Важливою діагностичною ознакою є співвідношення некомпактного міокарда до компактного наприкінці систоли. Для ІНЛШ співвідношення становить 2, при гіпертрофії міокарда лівого шлуночка гіпертензивної етіології — 1,1, для дилатаційної кардіоміопатії — 0,8 (рис. 3). Зазвичай гіпертрабекулярні сегменти гіпокінетичні.
ЕхоКГ-ознаки, що розроблені R. Jenni та співавт. [14], тут наведені за Г.И. Стрижаковим та співавт., 2004 [15]:
1. Відсутність іншої кардіальної патології.
2. Гіпертрофія лівого шлуночка з підвищеною трабекуляризацією більше ніж одного сегмента стінки лівого шлуночка.
3. Гіпертрабекуляризація спостерігається переважно в апікальній частині та середніх відділах лівого шлуночка.
4. Типова «двошарість» міокарда лівого шлуночка, товщина губчастого шару в два рази більша від неураженого міокарда.
5. Широкі міжтрабекулярні кармани, що поєднуються з порожниною лівого шлуночка.
Діагноз правомірний за наявності всіх перерахованих критеріїв.
Поєднання міжтрабекулярних карманів із порожниною лівого шлуночка допомогає диференціювати губчастий міокард із персистуючими синусоїдами. Останні являють собою розширення коронарних судин за типом гемангіом, що здійснюють кровообіг із коронарного русла в порожнину шлуночків, зустрічаються у 0,08–0,3 % хворих, яким проводилась коронарографія [16].
Гіпертрабекулярність правого шлуночка складно діагностується при стандартній ЕхоКС, тому що збільшення трабекул є нормальним явищем для цієї порожнини серця. Доцільне використання ЕхоКС з контрастуванням і магнітно-резонансної томографії (МРТ) серця. Останній метод дозволяє більш чітко виконати морфометрію серця та пошарову структуру міокарда, не залежить від доступу та ехо-вікна порівняно з ЕхоКС, відрізняється меншою суб’єктивністю. Рекомендовано для проведення усім хворим, у яких на підставі ЕхоКС виникла пі–дозра щодо ІНЛШ.
МРТ-критерії некомпактності міокарда:
— співвідношення некомпактного міокарда та компактного наприкінці діастоли > 2,3 (рис. 4) [17];
— маса трабекулярної частини становить > 20 % від загальної маси міокарда лівого шлуночка (чутливість — 93,7 %, специфічність — 93,7 %) [18];
— виявлення фіброзу трабекулярної частини міо–карда при проведенні МРТ-дослідження з гадолінієм [19].
Слід зазначити, що некомпактний міокард зустрічається при таких спадкових вадах і синдромах, як дефект міжшлуночкової та міжпередсердної перегородки, стеноз легеневої артерії, синдром Roifman (орфанне автосомно-рецесивне захворювання, що характеризується затримкою росту, спондилоепіфізарною дисплазією, когнітивною затримкою, дисморфізмом особи, а також клітинним імунодефіцитом), синдром Barth (кардіоміопатія, нейтропенія, недостатнє розвинення скелетної мускулатури і м’язова слабкість, затримка росту, непереносимість фізичного навантаження, кардіоліпінові аномалії, ацидурія), м’язові дистрофії Emery — Dreifus, Becker, синдром Melnick — Needles та міотубулярна кардіоміопатія.
Лікування
Специфічної терапії не існує. Головні вектори спрямовані на лікування серцевої недостатності, профілактику емболічних ускладнень та лікування порушень серцевого ритму.
З метою тромбопрофілактики призначається варфарин у лікувальних дозах з контролем міжнародного нормалізованого відношення (2–3), незважаючи на наявність/відсутність фібриляції передсердь.
Для усунення та профілактики небезпечних порушень серцевого ритму застосовують аміодарон, при недостатній ефективності та прогресуванні аритмій хворі є кандидатами на імплантацію кардіо–вертера-дефібрилятора, на певний час є ефективним проведення епікардіальних абляцій субстратів аритмій.
У лікуванні серцевої недостатності застосовуються стандартні підходи медикаментозної терапії (діуретики, сартани, інгібітори ангіотензинпере–творювального ферменту, адреноблокатори, вазодилататори, блокатори альдостерону, дигоксин з обережністю (ризик провокації шлуночкових аритмій)). При розвиненні внутрішньошлуночкової блокади з розширенням комплексу QRS 130 мс та більше існує досвід імплантації ресинхронізуючих кардіостимуляторів з тимчасовим покращенням клінічного стану хворого.
Несприятливий прогноз та мала ефективність терапії обґрунтовують спрямування хворих із серцевою недостатністю III функціонального класу (за NYHA) і зниженою систолічною функцією (фракція викиду < 40 %) на трансплантацію серця. Шестирічна виживаність серед хворих з донорськими серцями становила понад 80 %, що робить цей метод найефективнішим.
Пропонуємо клінічний випадок із практики авторів.
Клінічний випадок
Хвора С., 26 років, доставлена бригадою швидкої допомоги 04.05.2015 р. Скарги на загальну слабість, періодичні напади серцебиття, що тривають до 2 хвилин, запаморочення та втрату свідомості. Протягом останньої доби втрата свідомості була неодноразовою, тривалістю до кількох хвилин. Клінічних проявів серцевої недостатності не відзначено.
Погіршення стану з 28.04.2015 р., коли під час нападу серцебиття раптово втратила свідомість. Подібні стани повторювались неодноразово: 01, 02 та 03.05.2015 р.
З анамнезу захворювання відомо, що уперше в житті серцебиття та синкопи відзначає з березня 2011 р., проходила обстеження в м. Вінниці з приводу ідіопатичної кардіоміопатії (некомпактний міокард). Пролапс мітрального клапана I ст. Синдром інтермітуючого подовженого QT, можливо вродженого генезу. Пароксизмальна поліморфна шлуночковая тахікардія з синкопальними станами. Після виписки рекомендовано приймати ритмокор 1 табл. 2 рази, соталол 80 мг по 1/4 табл. 2 рази на день, моваліс 7,5 мг 2 рази на день — 3 тижні. Протягом 3 місяців регулярно, а потім епізодично приймала соталол, емпірично збільшила дозу до 40 мг 2 рази на день. За консультацією до аритмолога не звернулась.
З анамнезу життя відомо, що мати після народження дитини страждала від нападів серцебиття з синкопами, померла у віці 51 року від кардіоміопатії (медичної документації не збереглось). Наша хвора самостійно на 21-му році життя народила здорову дитину (ЕхоКС та консультація дитячого кардіолога проведені). Скарги кардіального характеру відзначає рік потому.
При об’єктивному огляді: зріст — 162 см, маса тіла — 44 кг. Клінічно: значних відхилень не знайдено.
При лабораторному клінічному, імунологічному та біохімічному обстеженні 06.05.2015 р. жодних відхилень не знайдено. Електролітний склад і функція щитоподібної залози не змінені. Лабораторних ознак запалення не знайдено.
ЕКГ (05–08.05.2015 р.): ритм синусовий з частотою 52 за хвилину. Нормальне розташування електричної осі серця. Порушення процесів реполяризації лівого шлуночка дифузні, не специфічні (інверсія Т у грудних відведеннях), QT — 470 мс (рис. 5).
Зазначимо, що протягом періоду стаціонарного обстеження (3 доби) у хворої неодноразово фіксували пароксизми шлуночкової тахікардії (завжди поліморфної), інвертований Т протягом доби був динамічним за амплітудою. Вражали зміни показника QT, що протягом однієї доби варіював від 380 до 560 мс. Після призначення адреноблокатора метопрололу та введення препаратів магнію зафіксовано зникнення шлуночкових порушень ритму, зменшилась дисперсія QT.
Під час холтерівського моніторування (05.05.2015 р.) знайдено: інтермітуючий синдром подовженого QT. Часта шлуночкова політопна екстрасистолія, у тому числі рання типу «R на T», групові у вигляді куплетів, триплетів та пароксизми шлуночкової тахікардії. Визначено два епізоди розвитку фібриляції шлуночків понад 30 с, перед якими було значне подовження QT (рис. 6–8).
Хворій проведено ЕхоКС (06 та 07.05.2015 р.): порожнини серця не розширені. Систолічна функція збережена (фракція викиду — 65 %). Пролапс мітрального та трикуспідального клапанів I ст. Збільшена трабекулярність апікальної частини лівого шлуночка (рис. 9, 10).
Зважаючи на наявність суттєвого подовження інтервалу QT та індукцію шлуночкових тахікардій, саме після максимального подовження прийнято рішення про доцільність застосування бета-адреноблокаторів і препаратів магнію для започаткування терапії. У відділенні призначено метопролол, початкова доза 12,5 мг 2 рази на день, з урахуванням відсутності побічних дій поступово доза збільшена до 50 мг 2 рази на день. Спочатку внутрішньовенно у перші дві доби вводилась магнезія 4 г/добу. На другу добу лікування хвора відзначила зникнення відчуття серцебиття, також не відмічені синкопи. На контрольній ЕКГ не зафіксовано шлуночкових порушень ритму, відмічено зменшення інтервалу QT до 380–400 мс.
Хворій повторно проведено холтерівське моніторування, за даними якого на фоні синусового ритму (середня добова частота 58 за хвилину) зафіксовано 112 поодиноких шлуночкових екстрасистол. Максимальний QT 400 мс.
Незважаючи на отриманий клінічний ефект від призначеного лікування, хворій запропонована консультація лікаря-аритмолога. На нашу спільну з аритмологами думку, хворій абсолютно показана імплантація кардіовертера-дефібрилятора. За відносними показаннями рекомендована імплантація однокамерного стимулятора у режимі ААІ. Рекомендовано проведення інвазивного електрофізіологічного дослідження серця для вирішення питання щодо абляції субстрату порушення ритму.
На жаль, у зв’язку із сімейними обставинами хвора повинна була повернутися до Вінниці, подальші контакти лише телефонні. Для регулярного прийому ми рекомендували метопролол у добовій дозі 100 мг та магнерот — 2 табл. 3 рази на день. Безумовно, до рекомендацій увійшла необхідність імплантації кардіовертера-дефібрилятора.
Із телефонних контактів відомо, що рекомендовану терапію пацієнтка приймає регулярно, однак восени минулого року відзначала порушення ритму у вигляді короткочасних пароксизмів серцебиття, у зв’язку з чим приймає додатково 50 мг метопрололу. Поставлена на чергу у локальному департаменті охорони здоров’я на отримання девайсу.
Сподіваємось, що нашій хворій ніщо не завадить, тепер уже, як нам відомо, самостійно виховати дитину.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування / За ред. Коваленка В.М., Лутая М.І., Сіренка Ю.М. та співавт. — К.: Моріон, 2016.
2. Белозеров Ю.М. Детская кардиология. Наследственные синдромы. — Элиста: Джангар, 2008.
3. Dusek J., Ostadal B., Duskova M. Postnatal persistence of spongy myocardium with embryonic blood supply // Arch. Pathol. 1975; 99: 312-317.
4. Varnava A.M. Isolated left ventricular non-compaction: a distinct cardiomyophaty? // Heart. 2001; 86: 599-600.
5. Lauer R.M., Fink H.P., Petry E.L. et al. Angiographic de–monstration of intramyocardial sinusoids in pulmonary-valve atresia with intact ventricular septum and hypoplastic right ventricle // N. Engl. J. Med. 1964; 271: 68-72.
6. Chin T.K., Perloff J.K., Roberta G. Isolated Noncompaction of Left Ventricular Myocardium: a study of eight cases // Circulation. 1990; 82(2): 507-513.
7. Oechslin E., Attenhofer C., Rohas J., Kauffman P., Jenni R. Long-term follow-up of 34 adult with isolatedventrscular noncompaction // A distinct cardiomyophaty with poor prognosis // J. Am. Coll. Cardiol. 2000; 36: 493-500.
8. Finsterer J., Stollberger C., Feichtinger H. Historical appearance of left ventricular hypertrabeculation/noncompaction // Cardiology. 2002; 98: 162-164.
9. Ali S.K., Godman M.R. The variable clinical presentation of, and outcome for, noncompaction of the ventricular myocardium sn snfants and children, an under-diagnosed cardiomyopathy // Cardiol. Yaung. 2004 Aug; 14(4): 409-16.
10. Koh Y.Y., Seo YU., Woo J.J., Chang K.S., Hong S.P. Familian isolated noncompaction of the ventricular myocardium in asymptomatic phase // Yonsei. Med. J. 2004 Oct 31; 45(5): 931-5.
11. Nihei K., Shinomiya N., Kabayama H. et al. Wolf-Parkinson-White Syndrome in Isolated Noncompaction of the Ventricular Myocardium // Csrc. J. 2004; 68(1): 82-84.
12. McCrohon J.A., Richmond D.R., Pennell D.J. et al. Isolated Noncompaction of the Myocardium. A Rarity or Missed Diad–noses? // Circulation. 2002; 106: e22-e23.
13. Toyono M., Kondo C., Nakajima Y. et al. Effects of carvedilol on left ventricular function, mass and scintigraphic findings in isolated left ventricular non-compaction // Heart. 2001; 86: e4.
14. Jenni R., Oechslin E., Schneider J., Atteenhofre Jost C., Kaufmann P.A. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as distinct cardiomyopathy // Heart. 2001; 86: 666-71.
15. Строжаков Г.И., Тронина О.А., Мелехов А.В. Изолированный губчатый миокард — наследственная неклассифицируемая кардиомиопатия // Сердечная недостаточность. — 2004. — Т. 5. № 4.
16. Stierle U., Giannitsis E., Sheikhzadeh A., Potratz J. Myocardial ischemia in generalized coronary artery-left ventricular microfistulae // Int J Cardiol. 1998; 63: 47-52.
17. Petersen S.E., Selvanayagam J.B., Wiesmann F., Robson M.D., Francis J.M., Anderson R.H., Watkins H., Neubauer S. Left ventricular non-compaction: insights from cardiovascular magne–tic resonance imaging // J. Am. Coll. Cardiol. 2005; 46: 101-5.
18. Habib G., Charron P., Eicher J.C., Giorgi R., Donal E., Laperche T., Boulmier D., Pascal C., Logeart D., Jondeau G., Cohen-Solal A., Working Groups ‘Heart Failure and Cardiomyopathies’ and ‘Echocardiography’ of the French Society of Cardiology. Isolated left ventricular non-compaction in adults: clinical and echocardiographic features in 105 patients. Results from a French registry // Eur. J. Heart Fail. 2011; 13: 177-85.
19. Dodd J.D, Holmvang G., Hoffmann U., Ferencik M., Abbara S., Brady T.J., Cury R.C. Quantification of left ventricular noncompaction and trabecular delayed hyperenhancement with cardiac MRI: correlation with clinical severity // AJR Am J Roentgenol. 2007; 189: 974-80.
/176-1.gif)

/173-1.gif)
/174-1.gif)
/175-1.gif)
/177-1.gif)