Сейчас уже ни один врач не представляет себе, как лечить тяжелого пациента без проведения инфузионной терапии. Инфузионная терапия — это не только внутривенное введение инфузионных растворов и лекарственных средств для лечения определенной патологии, а целая система общего воздействия на организм. Объемы инфузии в интенсивной терапии (ИТ) могут достигать нескольких литров в сутки и зависят от цели ее назначения [1].
Основная задача ИТ — восстановление объема циркулирующей крови (ОЦК) при кровопотерях, обезвоживании, коррекция ОЦК при шоках и других патологических состояниях, сопровождающихся гиповолемией, а также обеспечение нормальной микроциркуляции в тканях, нормализация кислородно-транспортной функции крови. Не менее важная задача [2], а иногда и выступающая на первое место — регулирование кислотно-щелочного статуса (КЩС), осмолярного давления крови, восстановление электролитного баланса.
Есть и другие задачи, которые ставятся перед ИТ, они определяют, что входит в ИТ, какие растворы используются в каждом отдельном случае.
В настоящее время складывается ситуация, при которой постоянное появление новых сред и недостаточная информированность врачей об их терапевтических свойствах затрудняют рациональный выбор этих сред. Поэтому в повседневной практике часто действует порочное правило: если не знаешь, что капать, — капай глюкозу пополам с физиологическим раствором [3]. При этом зачастую, назначая как бы проверенные годами препараты, врач не задумывается о последствиях своих назначений, не задается вопросом, а есть ли универсальные инфузионные среды? Какой раствор может претендовать на звание универсального? Какими качествами он должен обладать, чтобы решать возложенные на ИТ задачи?
Инфузионный раствор в идеале должен не оказывать негативного эффекта на прогноз заболевания, обладать удовлетворительной фармакокинетикой, не накапливаться в тканях, не оказывать отрицательного эффекта на электролитный состав плазмы, КЩС, не обладать негативными эффектами на гемостаз и иммунную систему, должен быть дешевым, экономически выгодным в производстве и доставке, легко храниться и иметь длительный срок годности. Следует сразу отметить, что на текущий момент не существует ни одного инфузионного раствора, удовлетворяющего данным требованиям [4]. А если так, то какие среды хотя бы по ряду параметров приближаются к понятию «идеал»?
Немного о равновесии
Нормально функционирующий организм можно представить как единую, автономно регулируемую равновесную систему, где устойчивость процессов приводит к относительному постоянству гомеостаза. Одной из форм такого равновесия является баланс между кислотами, способными отдавать Н+-ион, и щелочами, присоединяющими Н+-ион. Постоянство среды находится в достаточно узких пределах, балансируя вокруг значения рН 7,4. Механизм регуляции рН биологической среды сложен, одним из его основных звеньев является ряд буферных систем крови, которые сохраняют значение рН внутренней среды в допустимых границах. Так как в основе регулирования КЩС наибольшее значение отдается системе бикарбонатного буфера, способом описания этих процессов в клинической практике является уравнение Хендерсона — Хассельбаха:
/64.jpg)
С помощью этого уравнения можно оценить любую из его переменных, если известны две другие. Так, эквивалентная, или нормальная, СHCO3– и СH2CO3 в плазме крови составляет в норме ~26 и 1,3 мэкв/л соответственно (СH2CO3 = S · PCO2). Константа диссоциации (слабой) угольной кислоты pKa = 6,1. Для таких данных можно вычислить, что значение pH плазмы крови будет:
/64_2.jpg)
Большой спектр патологических состояний вызывает нарушения КЩС как в сторону снижения рН (ацидоз), так и в сторону его повышения (алкалоз). Уравнение Хендерсона — Хассельбаха достаточно логично описывает процесс формирования патологического состояния, и согласно ему под метаболическим ацидозом понимают первичное снижение HCO3– в плазме крови. Это состояние может развиться в следующих трех ситуациях: 1) связывание HCO3– сильными нелетучими кислотами; 2) чрезмерные потери HCO3– через ЖКТ или почки; 3) быстрое введение не содержащих HCO3– (или донаторов HCO3–) растворов. Ключом к пониманию формирования метаболического ацидоза служит такое понятие, как анионная разница (AР) — разница между концентрациями основных измеряемых анионов и катионов. В норме анионная разница равна 12 (9–15) ммоль/л. Вычислить ее можно по формуле:
/64_3.jpg)
При патологических состояниях в клинике интенсивной терапии у пациентов на фоне гипоксии и циркуляторных нарушений происходит накопление нелетучих кислот (лактат, кетокислоты), сопровождающееся нарастанием концентрации ионов водорода и снижающее концентрацию HCO3–. За счет снижения концентрации HCO3– увеличивается анионная разница.
В случае развития метаболического (гиперхлоремического) ацидоза с нормальной анионной разницей дефицит HCO3– вызывает выраженное повышение содержания хлоридов, что позволяет удержать анионную разницу на нормальном уровне. Основной механизм развития такого состояния — потери ионов бикарбоната. В случае введения изотонического солевого раствора — это снижение концентрации бикарбоната за счет увеличения объема плазмы. И данное расстройство рассматривается как гиперволемический ацидоз, связанный с дефицитом основного объема на фоне повышения концентрации хлоридов.
Однако в поддержании внутреннего равновесия принимают участие и другие буферные системы, независимо регулирующие рН плазмы. Внутриклеточные эритроцитарные и межклеточные буферы вышеприведенное уравнение Хендерсона — Хассельбаха в учет не берет, хотя они играют важную роль в формировании кислотно-щелочного равновесия и, следовательно, должны быть учтены, в особенности когда речь идет о инфузионной терапии. Предложенная канадским физиологом P.A. Stewart (1983) математическая модель кислотно-основного гомеостаза учитывает, что основными (независимыми) факторами, определяющими концентрацию протонов водорода, являются СО2, слабые кислоты и разница сильных ионов (РСИ). РСИ представляет собой разность зарядов между сильными катионами (натрий, калий, магний и кальций) и анионами (хлорид, сульфат, лактат и другие) плазмы, и сумма всех отрицательных зарядов слабых кислот плазмы (Аtot) представляет собой общую концентрацию стабильных буферов, альбумина, глобулинов и фосфата [5–7].
РСИ не случайно является независимой переменной. Сильные ионы не изменяются в процессе каких-либо реакций в системе. Ни один из этих ионов не образуется и не поглощается. Все они поступают извне и контролируются внешними механизмами. Если рассматривать только основные измеряемые сильные ионы, можно рассчитать очевидную разницу сильных ионов — РСИ (apparent, очевидная разница) [8]:
Обычные значения РСИ составляют от 40 до 42 мэкв/л. Поскольку основную часть РСИ составляют Na+ и Cl–, то РСИ можно упрощенно представить в виде их разности. Натрий четко регулируется организмом, так как он определяет тоничность, поэтому основную роль в изменении РСИ и, следовательно, внеклеточного pH играет Cl– [8].
Касательно Аtot альбумин является наиболее важным белком, его количество не регулируется кислотно-щелочной системой, а зависит от коллоидного осмотического давления и осмолярности внеклеточного пространства в печени, являющихся первичным фактором, который контролирует скорость образования альбумина [9]. Фосфаты составляют только 5 % от всего количества Аtot, из этого следует, что значение Atot в плазме определяется в основном альбумином.
Инфузия простых растворов и КЩС
В повседневной практике мы постоянно сталкиваемся с инфузионной терапией, часто необдуманно используя инфузионные среды. Становится очевидным, что на pH крови во время проведения инфузионной терапии больше влияет РСИ инфузируемого раствора, а не его pH. В 0,9% NaCl РСИ = 0, так как Na+ = Cl– = 154 мэкв/л. При инфузии больших объемов растворов с РСИ = 0 происходит два одновременных процесса: снижение РСИ плазмы и разведение (снижение) Atot. Так как РСИ плазмы — положительная величина, то его снижение сопровождается увеличением количества отрицательно заряженных ионов. Для достижения электронейтральности при избыточном отрицательном потенциале увеличивается концентрация H+ (или уменьшается HCO3–), возникает метаболический ацидоз [10]. В свою очередь, разведение Аtot (слабых кислот) плазмы формирует метаболический алкалоз, но так как сильные ионы больше влияют на pH, чем слабые кислоты, в итоге формируется гиперхлоремический метаболический ацидоз (ГХМА). Несколько литров 0,9% NaCl, введенного внутривенно в течение нескольких часов, достоверно вызывают гиперхлоремию, связанную с метаболическим ацидозом с нормальной анионной разницей.
В подтверждение вышеприведенным теоретическим выкладкам формирование гиперхлоремического метаболического ацидоза при использовании 0,9% NaCl в качестве базисного раствора было продемонстрировано в ряде клинических исследований как у здоровых добровольцев [11], так и у различных групп хирургических больных [12, 13].
Клинические исследования B.I. Mirza и B.L. Jaber [14, 15] показали, что периоперационное использование раствора NaCl приводит к развитию значительной гипобикарбонатемии и гиперхлоремии. При этом указывалось на гиперхлоремию как основную причину развития ацидоза, так как реальная величина развивающегося дефицита HCO3– превышала расчетный дефицит HCO3–, полученный с учетом вводимого объема раствора, т.е. обусловленный дилюцией.
Такие растворы, как глюкоза, маннитол, не содержат в своем составе сильные ионы и имеют РСИ = 0. Инфузия таких растворов снижает внеклеточный РСИ и независимо от уровня хлоридов сдвигает КЩС в сторону ацидоза. Экспериментальное исследование 1966 года S. Asano с соавторами, в котором введение безэлектролитных растворов 5% глюкозы и маннитола приводило к такому же сдвигу рН, что и введение изотонического раствора натрия хлорида, используется в работах W. Lang и R. Zander [16] в качестве аргумента в пользу значимости разведения бикарбоната в патогенезе ятрогенного ацидоза. Кроме того, часть больных имеет предсуществующие метаболические нарушения, и любое дополнительное напряжение в системе КЩС чревато декомпенсацией.
Поскольку результаты последующих исследований, касающихся развития ацидоза при использовании изотонического раствора NaCl либо растворов гидроксиэтилкрахмала (также содержащих избыток хлора), интерпретировались с позиции теории Стюарта [17], это приводило к преувеличению роли гиперхлоремии и недооценке собственно дилюционного эффекта в развитии ацидоза. В подтверждение этого тезиса обычно приводится работа Т. Morgan с соавторами, где показано, что соблюдение соотношения натрия и хлора, обеспечивающее РСИ до 24 мэкв/л, позволяет избежать влияния на рН крови [18]. Таким образом, в гипотетическом идеальном растворе должно присутствовать катионов — 154 ммоль/л, анионов (в основном за счет хлоридов) — 130 ммоль/л и носителей резервной щелочности — 24 ммоль/л.
Гиперхлоремический метаболический ацидоз
Современные руководства по ведению критических пациентов «Intravascular Volumetherapyin Adult. Guidelines from the Association of the Scientific medical societies in Germany» (2016), «Intravenous fluid therapy in adults in hospital», «NICE clinical guideline» (2016), «Intravenous fluid therapy in children and young people in hospital» (2015), «International guidelines for management of severe sepsis and septic shock» (2013–2016) [19–22] не рекомендуют применять рутинно изотонический солевой раствор для волемической поддержки у пациентов в отделениях интенсивной терапии. С чем это связано?
В своих работах C.S. Wilcox (1986) и J.A. Kellum (2005) [23, 24] сообщают, что в эксперименте при воспроизведении ГХМА возникают осложнения, такие как вазодилатация, почечная вазоконстрикция и усиление системного воспалительного ответа. Из клиник N.J. Wilkes (2001) и T.J. Morgan (2005) сообщают о развитии у больных с ГХМА таких симптомов, как задержка мочи, абдоминальный дискомфорт, тошнота и рвота [25, 26]. Wilkes (2001) и O’Malley (2005) публикуют данные о снижении мочеотделения, что связывается с хлоридиндуцированной почечной вазоконстрикцией вследствие снижения концентрации ренина у пациентов после трансплантации почек [27, 28]. Кроме того, у пациентов отмечалось более значительное повышение концентрации калия и более выраженный ацидоз. Изменения гемодинамики в клубочках, перераспределение почечного кровотока, микроциркуляторная дисфункция и системный воспалительный ответ в совокупности приводят к нарушению функции почек, даже при сохраненном или увеличенном почечном кровотоке [11]. Если у пациента уже имеется почечный канальцевый или гипер–хлоремический ацидоз вследствие потерь кишечного содержимого, инфузия изотонического NaCl может существенно усугубить состояние [9].
В «The management of diabetic ketoacidosis in adults» (September 2013) гиперхлоремический ацидоз трактуется как следствие инфузии больших объемов NaCl 0,9%, которые могут привести к почечной вазоконстрикции и стать причиной олигурии. Возмещение потерь жидкости при помощи 0,9% NaCl у пациентов с кетоацидозом замедляло коррекцию дефицита оснований по сравнению с использованием сбалансированных растворов [29].
Также сообщалось [30], что у пациентов, которым проводились экстренные абдоминальные операции, использование 0,9% NaCl привело к увеличению летальности (5,6 % против 2,9 % при использовании сбалансированных растворов, P < 0,001) и увеличению количества осложнений: острой почечной недостаточности (ОПН) с необходимостью почечно-заместительной терапии (ПЗТ), трансфузий крови и электролитным нарушениям (33,7 % против 23 % при использовании сбалансированных растворов, P < 0,001), а также к увеличению риска инфекционных осложнений. Отказ от использования больших доз хлоридсодержащих растворов снижал риск развития ОПН и потребность в проведении ПЗТ. Гиперхлоремия увеличивает 30-дневную летальность, являясь ее независимым предиктором.
О развитии коагулопатии на фоне гиперхлоремии после инфузии простых кристаллоидов сообщают J.H. Waters и G. Martin — у больных, прооперированных по поводу аневризмы аорты [31, 32]. ГХМА в экспериментах по сепсису у крыс показал свои провоспалительные свойства, вызывая дозозависимое увеличение экспрессии цитокинов (TNF-α, IL-6, IL-10) [33].
Что же касается экономической составляющей, как считают зарубежные авторы, использование 0,9% NaCl ведет к увеличению расходов на лечение по сравнению с использованием сбалансированных инфузионных растворов вследствие развития гиперхлоремического ацидоза и увеличения количества дополнительных анализов, необходимых для адекватной коррекции данного состояния [20].
Где искать резерв
Чтобы избежать расстройств КЩС, необходимо, чтобы РСИ плазмы снижалась только до уровня, достаточного для противодействия эффекту разведения кислот, иными словами, достаточного для компенсации дилюционного ацидоза и поддержания изопротонемии. Таким образом, РСИ сбалансированного кристаллоидного раствора должна быть меньше, чем РСИ плазмы, но больше нуля. Экспериментальным путем установлено, что идеальная РСИ раствора должна составлять 24 мэкв/л. То есть 24 мэкв ионов Cl– в растворе должны быть заменены на соответствующее количество OH–, HCO3–.
Поскольку бикарбонат с трудом можно поддерживать в стабильном состоянии в обычных инфузионных растворах или хранить во флаконах, в большинстве растворов он был заменен так называемыми предшественниками бикарбоната. Кроме того, бикарбонат натрия нельзя использовать в инфузионных растворах, содержащих кальций, или смешивать с ним, поскольку быстро образуется осадок карбоната кальция. Исходя из этого, ГХМА можно предотвратить, используя адекватные концентрации предшественников бикарбоната — метаболизируемых анионов, носителей резервной щелочности для замещения HCO3–.
Таким образом, вопрос о необходимости включения носителя резервной щелочности в состав базисного электролитного раствора не должен вызывать сомнений, предметом дискуссии может быть лишь природа и количество этого носителя. Такой подход особенно оправдан у больных, находящихся в критических состояниях, поскольку они, с одной стороны, требуют введения больших объемов жидкости, а с другой — имеют сниженные возможности компенсации кислотно-основных сдвигов (гиповентиляция, снижение буферной емкости вследствие гипоальбуминемии и т.д.).
Как известно, исторически первым носителем резервной щелочности в составе сбалансированного раствора стал лактат. На сегодняшний день, несмотря на достаточно большое разнообразие растворов, в составе которых имеются метаболизируемые основания, в 19-м Списке основных лекарственных средств ВОЗ (апрель 2015) [34] в пункте 26.2 указывается, что единственным рекомендуемым носителем резервной щелочности в составе инфузионных сред является лактат натрия.
Лактат является сильным ионом, поэтому в лактатсодержащих растворах реальная РСИ равна нулю, однако in vivo эффективная РСИ в сбалансированных лактатсодержащих растворах имеет положительную величину, что связано с быстрым печеночным метаболизмом лактата после введения.
В процессе основного обмена миокард, мышцы, мозг, слизистые оболочки кишечника и эритроциты производят примерно 1 ммоль лактата на 1 кг массы тела в час, и более половины этого количества метаболизируется в печени [35].
Как следует из формулы СH3 — CHOH — COONa + + 3O2 → 2CO2 + 2H2O + NaHCO3, для окисления лактата необходим кислород и на метаболизм каждого моля лактата используется 3 моля О2. У здоровых добровольцев, которым давали болюс 330 ммоль лактата, происходило увеличение расхода O2 почти на 30 %, и это в основном благодаря увеличению потребления кислорода в печени (почти 30 %) и мышцах (более 40 %) [35]. В эксперименте было показано, что максимальная скорость метаболизма лактата может приближаться к 450 ммоль/ч. Около 20 % вырабатываемого лактата используется в процессе глюконеогенеза, а приблизительно 80 % — окисляется. Экзогенно поступающий лактат, до 70 % от общего количества, может использоваться в качестве субстрата для глюконеогенеза. Из-за того, что до 70 % экзогенного лактата подвергается глюконеогенезу после превращения в пируват (часть цикла Кори), могут иметь место нарушения гомеостаза глюкозы, особенно у пациентов с сахарным диабетом. Оставшиеся 30 % лактата превращаются в цикле Кребса в ацетил-КоА с последующим образованием CO2.
У пациентов при отсутствии тяжелых нарушений функции печени назначение L-лактата в количестве до 100 ммоль/час (около 4 литров раствора Рингера лактата в час) не вызывает увеличения лактата плазмы [36].
Лактатные сбалансированные растворы — альтернатива простым средам
Одними из наиболее известных коммерческих сбалансированных растворов в Украине и за рубежом являются инфузионные среды, выпускаемые под названиями «Рингера лактат» и «Раствор Хартмана». Они содержат 28 ммоль/л лактата, что в отсутствие дисфункции печени определяет РСИ = 27 мэкв/л. РСИ раствора имеет более высокое значение, чем необходимо, но тем не менее эффективно нивелирует или даже устраняет обусловленный инфузией метаболический ацидоз без развития клинически значимого алкалоза. В лечении диабетического кетоацидоза лактатные растворы эффективны для профилактики возникающего в процессе лечения ацидоза с нормальной анионной разницей (ГХМА) [37].
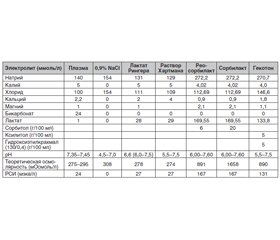
Электролитный состав лактатных растворов в сравнении с плазмой и 0,9% NaCI приведен в табл. 1, и, как видно, на роль идеального раствора более всего претендуют лактатный Рингер и раствор Хартмана.
/67.jpg)
Растворы на основе лактата натрия, несмотря на почти 100-летний срок со дня изобретения, продолжают быть востребованными в повседневной медицинской практике. В США фармацевтическая компания Baxter Healthcare производит Рингера лактат, Рингера лактат с 5% глюкозой, раствор Хартмана, раствор Хартмана с 5% глюкозой, модифицированный раствор Хартмана. Раствор Хартмана и Рингера лактат производятся компанией «B. Braun Melsungen AG» (Германия), «Hospira» («Pfizer»), INC. USA выпускает Ионостерил (помимо лактата в составе присутствуют фосфаты и Mg++), Рингера лактат и Hextend® (6% раствор гидроксиэтилкрахмала на основе лактатного раствора). Югославская фармфирма «Hemofarm A.D.» производит раствор Хартмана. ЗАО «Инфузия» (Украина) предлагает лактатные растворы — раствор Хартмана магниевый и безмагниевый, раствор Дарроу. Лактатный буфер используется производителем фармпрепаратов из Германии «Fresenius Kabi Deutschland GmbH» в составе 3% раствора желатина Гелоплазма баланс. В Белоруссии компания СП ООО «ФармЛенд» изготавливает Рингера лактат, раствор Хартмана и раствор Лактосол. Сложный раствор натрия лактата известен также под коммерческими названиями «Раствор Биеффе» (Lactated Ringer’s Hartman’s) и «Рингера Лактат Виафло» (Ringer Lactate Viaflo), производитель «Bieffe Medital» (Испания).
Отечественный производитель инфузионных сред «Юрия Фарм» в составе своей продукции предлагает Гекотон® — многокомпонентный, сбалансированный, коллоидно-гиперосмолярный раствор нового поколения, классический Рингера лактат и появившиеся в последнее время принципиально новые препараты — полиионные многофункциональные среды Реосорбилакт, Сорбилакт с содержанием натрия лактата более 300 ммоль/л (РСИ до 300 мэкв/л), то есть во много раз выше, чем в Рингера лактате или растворе Хартмана (26–30 ммоль/л).
Необходимость клинического использования сбалансированных растворов с резервной щелочностью (имеющих высокий РСИ ≥ 24 мэкв/л) на основе лактата нашла отражение в современных руководствах по ведению критических пациентов и инфузионной поддержке в отделениях интенсивной терапии [19–22, 29]. До сих пор ВОЗ считает лактат натрия единственным веществом для создания комбинированных инфузионных сред с носителем резервной щелочности.
Рингера лактат с высоким уровнем доказательной базы в руководстве по внутривенной инфузии у взрослых пациентов (2016) [20] рекомендован для проведения инфузионной внутривенной поддержки с целью предупреждения развития ГХМА. Такого же мнения придерживаются авторы руководств по инфузионной терапии у взрослых и детей при сепсисе [21, 22], а также у хирургических пациентов (British Consensus Guidelines on Intravenous Fluid Therapy for Adult Surgical Patients (2012)). В рекомендациях для оказания помощи в военных условиях (USA) при геморрагическом шоке из кристаллоидных растворов предпочтительно рекомендуется использовать лактатный Рингер в связи с низкой себестоимостью и доступностью во многих странах [39, 40].
Выводы
Эра простых растворов уходит в прошлое. В современных условиях, когда имеющийся набор аппаратно-лабораторных приборов позволяет контролировать каждый шаг терапии, современному врачу необходимо иметь доступные высокоэффективные препараты, способные предотвращать возможные нарушения гомеостаза и быстро устранять возникающие нарушения. Инфузионные лактатные среды доказывают свою эффективность в повседневной практике. Появление в клинической практике отечественных полиионных многофункциональных сред дало положительный толчок разработке новых методик интенсивной терапии с их применением как у критических пациентов, так и в общесоматической практике. Многие авторы сходятся во мнении, что уникальность полиионной многофункциональной среды обусловливает необходимость дальнейшего изучения ее влияния на гомеостаз пациентов.
Список литературы
1. Strunden M.S., Heckel K., Goetz A.E., Reuter D.A. Perioperative fluid and volume management: physiological basis, tools and strategies // Ann. Intensive Care. — 2011. — 1, 2. — Published online. — 2011, Mar 21. — doi: 10.1186/2110-5820-1-2.
2. Myburgh J.A., Mythen M.G. Resuscitation fluids // N. Engl. J. Med. — 2013. — V. 369. — P. 1243-1251.
3. Инфузионная терапия при критических состояниях / А.С. Владыка, В.В. Суслов, О.А. Тарабрин; под ред. проф. В.В. Суслова. — К.: Логос, 2010. — 274 с.
4. Moore F.D. Metabolic care of the surgical patient / Ed. by W.B. Saunders. — Philadelphia, 1961.
5. Stewart P.A. Modern quantitative acid-base chemistry // Can. J. Physiol. Pharmacol. 1983; 61: 1444-1461.
6. Stewart P.A. Independent and dependent variables of acid-base control // Respir. Physiol. 1978; 33: 19-26.
7. Morgan T.J. Acid-base and bio-energetics during balanced versus unbalanced normovolaemic haemodilution / T.J. Morgan, B. Venkatesh, A. Beindorf et al. // Anaesth. Intensive Care. 2007; 35: 173-179.
8. Yunos N., Bellomo R., Hegarty C., Story D., Ho L., Bailey M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults // JAMA: The Journal of the American Medical Association. 2012; 308 (15): 1566-1572. (Guideline Ref ID YUNOS2012)
9. Story D.A., Morimatsu H. and Bellomo R. Strong ions, weak acids and base excess: a simplified Fencl-Stewart approach to clinical acid-base disorders // British Journal of Anaesthesia. 2004; 92, 1: 54-60.
10. Story D.A., Liskaser F., Bellomo, R. Saline infusion, acidosis, and the Stewart approach // Anesthesiology. 2000; 92 (issue 2): 624.
11. Williams E.L., Hildebrand K.L., McCormick S.A. et al. The Effect of intravenous lactated Ringer's solution versus 0.9 % sodium chloride solution on serum osmolality in human volunteers // Anesth. Analg. 1999; 88: 999-1003.
12. Takil A., Eti Z., Irmak P., Gögüs F. Early postoperative respiratory acidosis after large intravascular volume infusion of lactated Ringer's solution during major spine surgery // Anesth. Analg. 2002; 95: 294-298.
13. Scheingraber S., Rehm M., Sehmisch C., Finsterer U. Rapid saline infusion produces hyperchloraemic acidosis in patients undergoing gynecologic surgery // Anesthesiology. 1999; 90 (5): 1265-1270.
14. Mirza B.I., Sahani M., Leehey D.J. et al. Saline_induced dilutional acidosis in a maintenance hemodialysis patient // Int. J. Artif. Organs. 1999; 22: 676-678.
15. Jaber B.L., Madias N.E. Marked dilutional acidosis complicating management of right ventricular myocardial infarction // Am. J. Kidney Dis. 1997; 30: 561-567.
16. Lang W., Zander R. The accuracy of calculated base excess in blood // Clin. Chem. Lab. Med. 2002; 40: 404-410.
17. Герасимов Л.В., Мороз В.В. Водно-электролитный и кислотно-основный баланс у больных в критических состояниях // Общая реаниматология. — 2008. — 4, 4. — C. 79-85.
18. Morgan T.J., Venkatesh B., Hall J. Crystalloid strong ion difference determines metabolic acid_base change during in vitro hemodilution // Crit. Care Med. 2002; 30: 157-160.
19. Gernot Marx, Achim W. Schindler, Christoph Mosches. Intravascular volume therapy in adults (Guidelines from the Association of the Scientific Medical Societies in Germany) // Eur. J. Anaesthesiol. 2016; 33: 1-34.
20. Intravenous fluid therapy in adults in hospital. NICE clinical guideline 174 (December 2013. Last update October 2016, https://www.nice.org.uk/guidance/)
21. Intravenous fluid therapy in children and young people in hospital (2015) NICE guideline NG29 Sepsis: recognition, diagnosis and early management NICE guideline [NG51] Published date: July 2016 Last updated: July 2016
22. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock // Intensive Care Med. 2013; 39(2): 165-228.
23. Wilcox C.S. Regulation of renal blood flow by plasma chloride // J. Clin. Invest. 1983; 71: 726-735.
24. Kellum J.A., Song M., Venkataraman R. Effects of hyperchloremic acidosis on arterial pressure and circulating inflammatory molecules inexperimental sepsis // Chest. 2004; 125 (1): 243-248.
25. Morgan T.J. The meaning of acid_base abnormalities in the intensive care unit: part III — effects of fluid administration // Crit. Care. 2005; 9(2): 204-211.
26. Wilkes N.J., Woolf R., Mutch M. et al. The effects of balanced versus saline based hetastarch and crystalloid solutions on acid base and electrolyte status and gastric mucosal perfusion in elderly surgical patients. Anesth. Analg. 2001; 93: 811-816.
27. Wilkes N.J., Woolf R., Mutch M. et al. The effects of balanced versus saline_based hetastarch and crystalloid solutions on acid_base and electrolyte status and gastric mucosal perfusion in elderly surgical patients // Anesth. Analg. 2001; 93: 811-816.
28. Catherine M.N., O'Malley H., Robert J. et al. A randomized, doubleb-lind comparison of lactated Ringer's solution and 0.9 % NaCl during renal transplantation // Anesth. Analg. 2005; 100: 1518-1524.
29. Prowle J.R. Fluid administration and the kidney / J.R. Prowle, R. Bellomo // Curr. Opin. Crit. Care. 2013 Aug; 19 (4): 308-14.
30. Smith C.A. Cost-minimization analysis of two fluid products for resuscitation of critically injured trauma patients / C.A. Smith, J.J. Duby, G.H. Utter et al. // Am. J. Health Syst. Pharm. 2014; 71: 470-475.
31. Waters J.H., Gottlieb A., Schoenwald P. et al. Normal saline versus lactated Ringer's solution for intraoperative fluid management in patientsundergoing abdominal aortic aneurysm repair: an outcome study // Anesth. Analg. 2002; 95 (1): 256.
32. Martin G., Wakeling H., El-Moalem H. et al. A prospective, randomizedcomparison of thromboelastographic coagulation profile in patientsreceiving lactated Ringer's solution, 6 hetastarch in a balanced salinevehicle, or 6 % hetastarch in saline during major surgery // J. Cardiothorac. Vasc. Anesth. 2002; 16: 441-446.
33. Kellum J.A. Hyperchloremic acidosis increases circulationg inflammatory molecules in experimental sepsis / J.A. Kellum, M. Song, E. Almasri // Chest. 2006; 130: 962-967.
34. Http://www.who.int/medicines/publications/essentialmedicines/EML2015_8-May-15.pdf
35. Valeri C.R. Effects of the resuscitation fluid and the hemoglobin based oxygen carrier (HBOC) excipient on the toxicity of the HBOC: Ringer’s D,L-lactate, Ringer’s L-lactate, and Ringer’s ketone solutions / C.R. Valeri, G. Ragno, R.L. Veech // Artif. Cells Blood Substit. Immobil. Biotechnol. 2006; 34: 601-606.
36. Gunnerson K.J. Lactate versus nonlactate metabolic acidosis: a retrospective outcome evaluation of critically ill patients / K.J. Gunnerson, M. Saul, S. He, J.A. Kellum // Crit. Care. 2006; 10: R22.
37. Morgan J. The meaning of acid-base abnormalities in the intensive care unit: Part III — effects of fluid administration // Critical Care. 2005; 9: 204-211.
38. British Consensus Guidelines on Intravenous Fluid Therapy for Adult Surgical Patients (4 июня 2012).
39. Captain Thileepan Naren, Colonel Alistair Royse and Lieutenant Colonel Michael C. Reade Review of fluid resuscitation and massive transfusion protocols from a military perspective ADF // Health. 2011; 12, 1.
40. Schreiber M.A. The use of normal saline for resuscitation in trauma // Journal of Trauma-Injury Infection and Critical Care. 2011; 70 (5): S13-S14.
41. Горовенко Н.Г., Гуменюк Н.И., Деркач Н.Н. Использование инфузионных растворов для коррекции метаболического ацидоза // Український хіміотерапевтичний журнал. — 2008. — № 1–2 (22). — С. 29-32.
42. Глумчер Ф.С., Стрепетова О.В., Перебийнис М.В. Применение реосорбилакта в комплексной терапии больных с алкогольной интоксикацией // Український хіміотерапевтичний журнал. — 2012. — № 3 (26). — С. 50-53.
43. Захараш М.П., Кучер Н.Д., Пойда А.И., Яремчик И.А. Роль препарата Сорбилакт в раннем послеоперационном периоде у больных колопроктологического профиля // Мистецтво лікування. — 2004. — № 9. — С. 28-29.
44. Волков А.В., Постернак Г.И., Ткачева М.Ю. Опыт применения препаратов сорбилакт и реосорбилакт в комплексной терапии больных с синдромом диабетической стопы // Український хіміотерапевтичний журнал. — 2008. — № 1–2 (22). — С. 99-100.
45. Гуменюк Н.И., Морская Н.Д., Яхница Т.В., Ломтева Е.А., Беренда Е.А. Влияние реосорбилакта на газовый состав и кислотно-основное состояние крови у больных с хроническим легочным сердцем и гиперкапнией // Український пульмонологічний журнал. — 2005. — № 4. — С. 34-37.
46. Хамидов Д.Б., Косимов З.К., Хомидов Д.Д., Киямов С.Э. Комплексный полифункциональный раствор реосорбилакт в интенсивной терапии эндогенной интоксикации у больных с острым перитонитом // Научно-практический журнал ТИППМК. — 2011. — № 2. — С. 77-79.
47. Рижко О.О. Інфузійна терапія реосорбілактом // Укр. пульмонол. журнал. — 2003. — № 2. — С. 334-335.
48. Чепкий Л.П., Главацкий А.Я., Гавриш Р.В. и др. Интенсивная терапия отека головного мозга при хирургическом лечении опухолей мозга // Біль, знеболювання і інтенсивна терапія. — 2002. — № 2. — С. 23-28.
49. Гуменюк Н.И., Ломтева Е.А. Влияние инфузионных препаратов на основе сорбитола и натрия лактата на агрегацию тромбоцитов in vitro у больных с хроническим легочным сердцем // Укр. пульмонол. журн. — 2005. — № 2. — С. 54-56.
/64.jpg)
/64_2.jpg)
/64_3.jpg)
/64_4.jpg)

/67.jpg)