Вступ
Останнім часом значну увагу приділяють проблемі вивчення гострого та хронічного болю [1–4]. В метааналізі, що був проведений G. Davies та співавт. в 2006 році [5], продемонстровано порівнянний ефект за аналгетичною активністю пролонгованої епідуральної і паравертебральної аналгезії (ЕДА і ПВА) у хворих після торакотомії. Такі самі результати було продемонстровано і в одному з останніх метааналізів, який був проведений у 2014 році і включав 18 досліджень за участю 777 пацієнтів [6]. Але і в першому, і в другому метааналізах спостереження проводилися лише протягом перших двох діб післяопераційного періоду. У той же час немає даних стосовно рівня знеболювання за візуальною аналоговою шкалою (ВАШ) протягом третьої доби післяопераційного періоду, адже саме в цей час відбувається найбільш інтенсивна активізація пацієнтів.
У роботі M. Scarci та співавт. [7] дана оцінка рівня знеболювання за ВАШ у хворих після торакотомії в стані спокою та при кашлі. Але як у зарубіжній, так і у вітчизняній літературі немає даних стосовно рівня болю під час дозованого напруження дихальної мускулатури (виконання спірометрії). У великому метааналізі, який був опублікований у 2016 році [8] і включав 14 досліджень (у цілому 698 хворих після торакотомії), пролонгована паравертебральна блокада за аналгетичною активністю була порівнянна з епідуральною, але в жодному з 14 досліджень не оцінювали рівень болю під час виконання спірометрії.
У дослідженні, проведеному в 2016 році в провідних клініках Німеччини (м. Ессен, м. Магдебург), вивчалася проблема хронічного болю у хворих після торакотомії. Із 131 пацієнта через 6 місяців після операції хронічний больовий синдром розвинувся у 51 (39 %) [9]. Для знеболювання застосовували як наркотичні анальгетики, так і епідуральну аналгезію, але паравертебральна блокада не вивчалася. В огляді S.R. Humble та співавт. [10] призначення габапентиноїдів запобігало розвитку хронічного болю, але у хворих після торакотомії було малоефективним.
У нашій роботі ми намагалися дати об’єктивну оцінку знеболювання у хворих після торакотомії як в стані спокою, так і під час фізичного навантаження дихальної мускулатури. Проводили оцінку гострого болю в ранньому післяопераційному періоді та хронічного больового синдрому у віддаленому періоді. Для обґрунтування використовували не лише ВАШ, а й об’єктивні критерії — показники функції зовнішнього дихання (ФЗД) та газового складу артеріальної крові.
Мета роботи: оцінити ефективність методики післяопераційного знеболювання із застосуванням пролонгованої паравертебральної блокади у хворих після торакотомії.
Матеріали і методи
Проаналізовано ефективність знеболювання в ранньому післяопераційному періоді (протягом трьох діб) та частоту виникнення хронічного больового синдрому у віддаленому післяопераційному періоді (через 6 місяців) у хворих після торакотомії. Залежно від типу післяопераційного знеболювання хворі були розподілені на 3 групи (табл. 1).
У дослідження було залучено 85 пацієнтів чоловічої та жіночої статі незалежно від віку, які потребували оперативного втручання на легенях, з компенсованою функцією дихання; операційний доступ — торакотомія; об’єм видаленої легеневої паренхіми не перевищував 20 %. У дослідження не були включені пацієнти із хронічними захворюваннями в стадії декомпенсації, із непереносимістю нестероїдних протизапальних препаратів (НПЗП) та пептичною виразкою в анамнезі, хворі на цукровий діабет та з хронічними системними запальними захворюваннями. Також не включалися пацієнти, які мали протипоказання для проведення регіонарних або нейроаксіальних методів знеболювання.
Статистично значимої різниці між групами за демографічними показниками не виявлено. Характеристика хворих наведена в табл. 2.
Перед початком оперативного втручання, за 30 хв, хворим виконували премедикацію. Внутрішньом’язово вводили промедол у дозі 20 мг.
Усі 85 хворих були оперовані під загальною анестезією з інтубацією трахеї та штучною вентиляцією легень (ШВЛ). Для індукції використовували 10 мг сибазону, 0,1 мг фентанілу, 3–5 мг/кг тіопенталу натрію або 1–1,25 мг/кг пропофолу внутрішньовенно. З м’язових релаксантів використовували 0,6 мг/кг тракріуму. Інтубацію виконували шляхом прямої ларингоскопії. У випадках прогнозованої складної інтубації використовували фібробронхоскопію (апарат PENTAX FB 18 BS, Japan).
Підтримуючу базисну анестезію проводили з використанням інгаляційного анестетика севофлуран (Sevoran, Abbott Laboratories Ltd, Великобританія) у концентраціях 1–1,5 об.% та оксиду діазоту у співвідношенні з киснем 2 : 1. Для знеболювання використовували 1,4 мкг/кг/год фентанілу у вигляді безперервної внутрішньовенної (в/в) інфузії. У І та ІІ групах (ЕДА та ПВА) для регіонарного знеболювання використовували безперервну інфузію 0,2% розчину ропівакаїну (Naropin, AstraZeneca, Södertälie, Швеція) — 6 мл/год в епідуральний і паравертебральний простір відповідно. Потреба у фентанілі в цих групах була вдвічі меншою. Міоплегія підтримувалася безперервним введенням 0,3 мг/кг/год тракріуму. Нервово-м’язову провідність контролювали за допомогою електронейростимулятора (innervator 252, Fisher & Paykel Healthcare, Нова Зеландія).
Для безперервного введення медикаментів використовували перфузійні насоси (Perfusor Spase B. Braun Melsungen AG, Німеччина).
Штучна вентиляція легень проводилася по закритому контуру в режимі низькопоточної вентиляції (Low Flow) апаратом Primus (Dräger, Німеччина). Адекватність ШВЛ контролювали за показником pCO2 (35–45 мм рт.ст.). Проводили постійний моніторинг показників периферійної гемодинаміки неінвазивним методом, електрокардіографію з контролем інтервалу ST і SpO2 за допомогою монітора Siemens SC 9000 XL (Німеччина).
Після оперативного втручання всіх пацієнтів переводили до відділення анестезіології та інтенсивної терапії для подальшої терапії.
У контрольній групі проводили контрольовану пацієнтом аналгезію (КПА) 0,05% розчином морфіну гідрохлориду, який вводили внутрішньовенно за допомогою перфузійного насоса (Perfusor Spase B. Braun Melsungen AG, Німеччина). З НПЗП використовували кеторолаку трометамін 30 мг 3 рази/добу.
У ІІ дослідній групі хворим з ЕДА проводили знеболювання шляхом безперервної інфузії в епідуральний простір 0,2% розчину ропівакаїну зі швидкістю 6 мл/год. Катетеризацію епідурального простору виконували перед початком оперативного втручання на рівні ThV. Внутрішньом’язово вводили 30 мг 3 рази/добу розчин кеторолаку трометаміну та 10 мг морфіну гідрохлориду. За потреби додатково вводили 10 мг розчину морфіну гідрохлориду внутрішньом’язово. Післяопераційне знеболювання розчином ропівакаїну було продовженням інтраопераційної анестезії і проводилося протягом трьох діб.
У ІІІ досліджуваній групі хворим проводили пролонговану паравертебральну аналгезію. Блокаду виконували перед початком оперативного втручання.
Для катетеризації паравертебрального простору використовували методику за Luyet [11]. У V міжреберному просторі, зліва або справа, залежно від сторони операції, за допомогою ультразвуку (УЗ) верифікували паравертебральний простір. Ми користувалися портативним УЗ-апаратом експертного рівня M-turbo (Sonosite, США). Після асептичної обробки шкіри у точці пункції проводили внутрішньошкірну та підшкірну анестезію місцевим анестетиком (1% лідокаїн 2 мл). Точка пункції розташована латеральніше на 3–4 см від остистого відростка V хребця.
Для пункції та катетеризації паравертебрального простору використовували набір для пролонгованої регіонарної аналгезії (Contiplex D Continuous Peripheral Nerve Block Catheter Set; B. Braun, Melsungen, Німеччина).
Однією рукою фіксували датчик, попередньо покритий стерильною плівкою, іншою рукою під УЗ-контролем проводили голку в напрямку паравертебрального простору (у медіальному та краніальному напрямках).
Після досягнення паравертебрального простору вводили місцевий анестетик — 0,75% ропівакаїн 10 мл. Після вилучення голки в паравертебральному просторі залишався тимчасовий пластиковий стилет, через який вводили катетер для післяопераційного знеболювання. Катетер фіксували асептичною пов’язкою, до нього приєднували бактеріальний фільтр.
Ефективність дослідження оцінювали за ВАШ в стані спокою та під час фізичного навантаження дихальної мускулатури (виконання спірометрії). Оцінку знеболювання в стані спокою проводили протягом трьох діб в післяопераційному періоді. Перше оцінювання проводили через 4 години після операції. Наступні вимірювання — через 24, 36 годин (перша доба), у кінці другої та третьої діб післяопераційного періоду. Для оцінки ефективності післяопераційного знеболювання під час рухової активності ми проводили дослідження ФЗД, під час якого відбувалося максимальне напруження м’язів дихальної мускулатури. Досліджували на другу добу післяопераційного періоду. Ефективність знеболювання також оцінювали за ВАШ.
Ефективне зовнішнє дихання, рання екстубація та активізація пацієнта відіграють важливу роль у відновлювальний період у хворих після операцій взагалі і особливо після операцій на легенях [12]. Тому важливим питанням була оцінка ФЗД у післяопераційному періоді. Дослідження проводили до операції та на другу добу післяопераційного періоду. Для оцінки статичного легеневого об’єму нами була обрана життєва ємність легень (ЖЄЛ), за допомогою якої оцінювалися рестриктивні зміни. Для оцінки динамічного вентиляційного параметра (оцінювали обструктивні зміни) — об’єм форсованого видиху за 1 с (ОФВ1). Ці критерії оцінки ФЗД є загальноприйнятими в світі та використовуються найчастіше у хворих після торакотомії [13]. Показники вимірювалися у відсотках щодо нормальних значень і розраховувалися автоматично спірометричним апаратом MS-PFT analyzer unit (Jaeger, Німеччина) за номограмою залежно від зросту та маси пацієнта.
Проте нормальна спірометрія показує виключно вентиляційні розлади, але не розлади дифузії або перфузії та, відповідно, стан газового складу артеріальної крові [13]. У клінічній практиці для оцінки газового складу артеріальної крові зазвичай достатньо використання наступних показників: парціального тиску кисню (pO2), парціального тиску вуглекислого газу (pCO2) та pH крові [13]. У нашій роботі ми також використовували ці параметри з метою оцінки впливу післяопераційного больового синдрому в умовах трьох різновидів післяопераційного знеболювання на функцію органів системи дихання. Газовий склад артеріальної крові досліджували до операції, через 4 години після операції та вранці наступної доби. Дослідження проводили на апараті Easy Blood Gas (Medica Corporation, США).
Результати та обговорення
Отримані результати дослідження адекватності післяопераційного знеболювання у трьох дослідних групах хворих після торакотомії свідчать, що найефективнішим методом післяопераційного знеболювання протягом першої доби післяопераційного періоду виявилася епідуральна анестезія/аналгезія ропівакаїном. Протягом другої доби ефективність післяопераційного знеболювання за допомогою пролонгованої паравертебральної блокади була порівнянна з ефективністю епідуральної анестезії/аналгезії, а на третю добу ефективність ПВА навіть перевищила ЕДА.
На всіх етапах дослідження ЕДА і ПВА забезпечували повноцінне післяопераційне знеболювання — в жодному випадку показники ВАШ не перевищували 40 балів.
За ефективністю післяопераційного знеболювання на всіх етапах дослідження ЕДА і ПВА суттєво переважали метод КПА морфіном, що знайшло своє відображення в майже вдвічі нижчих показниках болю за ВАШ.
Протягом двох діб у післяопераційний період у пацієнтів контрольної групи показники болю за ВАШ були вищі від 40 балів, що може свідчити про недостатню ефективність післяопераційного знеболювання, незважаючи на високі добові дози морфіну, які у більшості пацієнтів цієї групи перевищували 50 мг/добу.
Результати знеболювання наведено в табл. 3.
При аналізі рівня болю за ВАШ під час виконання ФЗД слід зауважити, що інтенсивність больового синдрому суттєво зростала, особливо в контрольній групі. Незважаючи на суттєво більші дози наркотичних анальгетиків, рівень болю на другу добу післяопераційного періоду в контрольній групі був значно вищим і становив 62 бали. У дослідних групах рівень болю був приблизно однаковим і становив 39 балів у групі ЕДА і 35 балів — у групі ПВА (табл. 4).
При аналізі показників болю за ВАШ слід відмітити, що максимальний показник, зафіксований у групі із паравертебральною блокадою, не перевищував 41 бал. У групі епідуральної блокади цей показник становив практично 52 бали, але в контрольній групі знеболювання морфіном у деяких пацієнтів цей показник досягав 74 балів.
Найкращий знеболюючий ефект під час виконання ФЗД спостерігався у двох дослідних групах, а саме: пролонгованої епідуральної і пролонгованої паравертебральної блокад, але пролонгована паравертебральна блокада забезпечувала диференційовано кращий знеболюючий ефект.
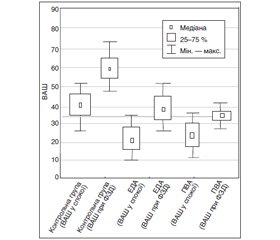
Для порівняння ефективності різних методів знеболювання в стані спокою та під час виконання ФЗД на другу добу після операції нами було проведено співставлення результатів, що наведено на рис. 1.
Під час виконання ФЗД у контрольній групі відмічено зростання інтенсивності болю на 20,2 бала за ВАШ. У групі ЕДА зареєстровано зростання рівня болю на 18,3 бала, а в групі ПВА — лише на 11,5 бала. Аналіз діаграми також показав, що площа показників групи із ПВА (від 25 до 75 %) значно менша, ніж у контрольній групі і в групі з ЕДА, а найвищі зареєстровані показники порівняно з іншими групами також менші.
Під час аналізу тенденцію зростання інтенсивності больового синдрому під час виконання ФЗД можна помітити, що найменший рівень відмічався в групі ПВА. Не набагато більший рівень болю був у групі ЕДА. Значно гірші показники відмічено в контрольній групі. Кращий знеболюючий ефект у групі пролонгованої паравертебральної блокади обумовлений найбільш близьким місцем впливу анестезуючого засобу на ланцюг проведення больового імпульсу від місця операційної травми, якраз на етапі трансмісії.
За даними спірометрії у групі пацієнтів, у яких для знеболювання використовували паравертебральну аналгезію, показники ЖЕЛ на 8,71 % були кращими порівняно з показниками ЖЕЛ у пацієнтів, яким для знеболювання використовували епідуральну аналгезію, та на 9,49 % кращі від контрольної групи. Крім того, при максимальному напруженні дихальної мускулатури (дослідження ОФВ1) різниця між показниками в дослідних групах збільшилася. Так, при порівнянні показників у групі пацієнтів ПВА з показниками групи пацієнтів ЕДА різниця становила 10,7 % на користь першої, а при порівнянні пацієнтів групи ПВА з контрольною групою — 17,7 %. Результати дослідження ФЗД при застосуванні різних методів знеболювання наведено в табл. 5, 6.
Таким чином, можна зробити висновок, що пролонгована ПВА порівняно з іншою дослідною групою (ЕДА) та контрольною групою краще впливала на показники зовнішнього дихання.
При дослідженні pH та газового складу артеріальної крові було встановлено, що всі методики, які застосовувалися в нашій роботі, не призводили до порушень кислотно-лужної рівноваги та газового складу артеріальної крові. Показники pН, pO2, та pCO2 залишалися в межах нормальних значень. Усі досліджувані нами різновиди післяопераційної аналгезії суттєво не впливали на функцію органів системи дихання. Результати наведено в табл. 7, 8.
Дослідження газового складу артеріальної крові показало, що всі застосовані методи знеболювання не призводили до розвитку гіпоксії, гіперкапнії та порушень кислотно-лужної рівноваги. Але була помітна певна тенденція в групах з епідуральним і паравертебральним знеболюванням, де рівень СО2 був значно нижчим, що запобігало розвитку гіповентиляції.
Для оцінки впливу різних методів знеболювання на формування хронічного болю ми проводили опитування хворих через 6 місяців після торакотомії. З кожної дослідної групи було відібрано по 15 хворих. Найбільша кількість хворих — 8 (53 %), які скаржилися на біль в ділянці післяопераційної рани, була в групі знеболювання розчином морфіну. З них 1 хворий (6,5 %) відмічав біль як сильний, 3 хворі (20 %) — як помірний і 4 хворі (26,5 %) — як слабкий.
У групах, в яких для знеболювання було застосовано нейроаксіальну (ЕДА) або регіонарну (ПВА) методики, випадків розвитку хронічного болю відмічено менше. Так, в групі ЕДА через 6 місяців після операції хронічний біль в ділянці післяопераційного рубця турбував 5 хворих (33,3 %), 2 хворі (13,3 %) розцінили біль як середньої інтенсивності, 3 (20 %) — як слабкий. Сильний біль не турбував жодного хворого.
Найменша кількість хворих — 3 (20 %), яких турбував біль в ділянці післяопераційного рубця через 6 місяців після операції, відмічена в групі, в якій для знеболювання застосовували регіонарну (паравертебральну) аналгезію. Це на 13,3 % менше, ніж у групі, в якій для знеболювання застосовували нейроаксіальну (епідуральну) аналгезію, і на 33 % менше від групи, в якій для знеболювання застосовували внутрішньовенну інфузію розчину морфіну. При цьому сильного болю хворі не відчували взагалі, 1 хворий (6,6 %) скаржився на помірний біль, 2 хворі (13,6 %) відмічали біль як слабий.
Таким чином, у віддаленому післяопераційному періоді хронічний больовий синдром виникав рідше у хворих, в яких в комплексі післяопераційного знеболювання застосовували пролонговану паравертебральну аналгезію.
У нашій роботі було проведено оцінювання наявності технічних ускладнень і невдач під час виконання анестезії/аналгезії і побічних ефектів при проведенні післяопераційного знеболювання. Технічні невдачі були пов’язані з анатомічними особливостями та хибним вибором довжини голки. Із загальних ускладнень спостерігалися затримка сечі, нудота, блювання, шкірний свербіж. Із місцевих — кровотеча з місця виходу катетера та його дислокація.
Найчастішою помилкою під час виконання інвазивних методів знеболювання (5 випадків) був хибний вибір довжини голки Tuohy для пункції епідурального простору у хворих з надлишковою масою тіла (індекс маси тіла становив від 32,2 до 40,4). У 2 випадках спостерігалося невдале виконання катетеризації епідурального простору, пов’язане з технічними труднощами, обумовленими анатомічними особливостями пацієнта (остеохондроз грудного відділу хребта). У 3 випадках спостерігалося запаморочення під час виконання епідуральної (2 випадки) та паравертебральної (1 випадок) блокад. В одному випадку хвора під час виконання епідуральної блокади раптово відмовилася від цього різновиду анестезії/аналгезії. Ще в одному випадку після катетеризації паравертебрального простору спостерігалася кровотеча з підшкірно-жирової клітковини. Після вилучення катетера кровотеча припинилася.
Із загальних ускладнень найчастіше спостерігалися затримка сечі, нудота, блювання. Так, в групі ЕДА затримка сечі відмічена в 5 випадках, у контрольній групі — у 9, частіше в першу добу післяопераційного періоду. Хворим було встановлено сечовий катетер. У групі ПВА такого ускладнення не було взагалі. Нудота спостерігалася в усіх трьох групах безпосередньо після операції і протягом першої доби. У контрольній групі і групі ЕДА — протягом усього періоду спостереження. Блювання зустрічалося лише в контрольній групі і групі ЕДА протягом першої доби після операції. Шкірне свербіння зустрічалося рідко (лише в 3 випадках у контрольній групі) і було пов’язано безпосередньо із застосуванням морфіну. Ускладнення у вигляді розладів гемодинаміки (гіпотензія, брадикардія) були відсутні. Можливі більш тяжкі ускладнення у вигляді пошкодження спинного мозку, епідуральної гематоми або гнійно-септичних проявів також були відсутні.
Найбільша кількість технічних невдач та ускладнень спостерігалася в групі з епідуральною аналгезією. Насамперед вони були обумовлені складностями під час виконання пункції та катетеризації епідурального простору. На відміну від епідуральної блокади при пункції та катетеризації паравертебрального простору технічних невдач та ускладнень практично не спостерігалося. Це було обумовлено застосуванням УЗ-навігації. Серед клінічних проявів з боку пролонгованої паравертебральної блокади ускладнень не було взагалі.
Висновки
1. Пролонгована паравертебральна та епідуральна блокада забезпечують відмінну якість післяопераційного знеболювання у хворих після торакотомії.
2. У стані спокою пролонгована паравертебральна блокада забезпечує знеболювання, порівнянне з епідуральною аналгезією, а під час фізичного навантаження дихальної мускулатури перевищує її.
3. Порівняно з епідуральною аналгезією, особливо із знеболюванням розчином морфіну, пролонгована паравертебральна блокада краще впливає на функцію зовнішнього дихання.
4. Застосування пролонгованої паравертебральної та епідуральної аналгезії запобігає розвитку гіповентиляції в ранньому післяопераційному періоді.
5. Застосування пролонгованої паравертебральної аналгезії у хворих після торакотомії краще впливає на профілактику розвитку хронічного больового синдрому у віддалений післяопераційний період порівняно з іншими методами знеболювання.
6. При катетеризації паравертебрального простору застосування УЗ-візуалізації зменшує кількість ускладнень та технічних невдач порівняно із катетеризацією епідурального простору.
7. При застосуванні пролонгованої паравертебральної аналгезії порівняно з іншими методами знеболювання загальних клінічних ускладнень не спостерігалось взагалі.
8. Пролонгована паравертебральна аналгезія є ефективним і безпечним методом знеболювання у хворих після торакотомії.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. De Oliveira GS Jr, Agarwal D, Benzon HT. Perioperative single dose ketorolac to prevent postoperative pain: a meta-ana–lysis of randomized trials. Anesth Analg. 2012;114(2):424-33. doi: 10.1213/ANE.0b013e3182334d68
2. Bugada D, Lavand'homme P, Ambrosoli AL et al. SIMPAR group. Effect of postoperative analgesia on acute and persistent postherniotomy pain: a randomized study. J Clin Anesth. 2015;27(8):658-64. doi: 10.1016/j.jclinane. 2015.06.008
3. Cooper SA, Desjardins PJ, Turk DC et al. Research design considerations for single-dose analgesic clinical trials in acute pain: IMMPACT recommendations. Pain. 2016;157(2):288-301. doi: 10.1097/j.pain.00000000 00000375
4. Gilron I, Kehlet H. Prevention of chronic pain after surgery: new insights for future research and patient care. Can J Anaesth. 2014;61(2):101-11. doi: 10.1007/s12630-013-0067-8
5. Davies G, Myles PS, Graham JM. Сomparison of the analgesic efficacy and side-effects of paravertebral vsepidural blockade for thoracotomy — a systematic review and meta-analysis of randomized trials. Br J Anaesth. 2006;96:418-26.
6. Ding X, Jin S, Niu X, Ren H, Fu S, Li Q. A comparison of the analgesia efficacy and side effects of paravertebral compared with epidural blockade for thoracotomy: an updated meta-analysis. PLoS One. 2014;9(5):e96233. doi: 10.1371/journal.pone.0096233
7. Scarci M, Joshi A, Attia R. In patients undergoing thoracic surgery is paravertebral block as effective as epidural analgesia for pain management? Interact Cardiovasc Thorac Surg. 2010;10(1):92-6. doi: 10.1510/icvts.2009. 221127
8. Yeung JH, Gates S, Naidu BV, Wilson MJ, Gao Smith F. Paravertebral block versus thoracic epidural for patients undergoing thoracotomy. Cochrane Database Syst Rev. 2016;2:CD009121. doi: 10.1002/14651858.CD009121. pub2
9. Kampe S, Geismann B, Weinreich G, Stamatis G, Ebmeyer U, Gerbershagen HJ. The Influence of Type of Anesthesia, Perioperative Pain, and Preoperative Health Status on Chronic Pain Six Months After Thoracotomy-A Prospective Cohort Study. Pain Med. 2016; pii: pnw230.
10. Humble SR, Dalton AJ, Li L. A systematic review of therapeutic interventions to reduce acute and chronic post-surgical pain after amputation, thoracotomy or mastectomy. Eur J Pain. 2015;19(4):451-65. doi: 10.1002/ejp.567
11. Samer N. Narouze. Atlas of Ultrasound-Guided Procedures in Interventional Pain Management. Ed. Samer N. Narouze. Springer; 2010. 372 p.
12. Thomas Hachenberg, Tobias Welte, Stefan Fischer. Anästhesie und Intensivtherapie in der Thoraxchirurgie. Stuttgart: Georg Thieme Verlag KG; 2010; 255-258.
13. Thomas Hachenberg, Tobias Welte, Stefan Fischer. Anästhesie und Intensivtherapie in der Thoraxchirurgie. Stuttgart: Georg Thieme Verlag KG; 2010; 83-91.
/154_2.jpg)

/151.jpg)
/153_2.jpg)
/154.jpg)
/154_3.jpg)
/155.jpg)
/155_2.jpg)