Резюме
Актуальність. Гіпертермія викликає церебральне пошкодження і погіршує неврологічне відновлення при важкій черепно-мозковій травмі (ЧМТ). Метою роботи було вивчення неврологічних наслідків у пацієнтів з тяжкою ЧМТ та рефрактерною к фармакологічній корекції гіпертермією при використанні цільового температурного менеджменту з залученням езофагеального охолоджувального пристрою в комплексі інтенсивної терапії порівняно з групою контролю. Матеріали та методи. Обстежено 20 пацієнтів віком від 23 до 54 років із діагнозом «важка ЧМТ». Пацієнти були розподілені на 2 групи: пацієнтам I групи (n = 10) здійснювався стандартний комплекс інтенсивної терапії, що базується на міжнародних рекомендаціях щодо менеджменту важкої ЧМТ (2007, 2016 рр.); у II групі (n = 10) у стандартний комплекс інтенсивної терапії було включено цільовий температурний менеджмент (ЦТМ) за допомогою гіпотерма «Blanketrol II» (CSZ, США) і езофагеального пристрою для охолодження (Esophageal Cooling Device, ACT, США) з метою досягнення нормотермії у діапазоні 36,5–37 °С. У всіх пацієнтів оцінювався неврологічний статус за шкалою коми Глазго на наступних етапах: початково, на 5-ту, 10-ту добу та на момент виписки з лікувального закладу. Наслідки перенесеної ЧМТ визначалися за шкалою СРС (Сerebral Performance Categories), з оцінкою максимального балу при знаходженні у відділенні реанімації та інтенсивної терапії (ВРІТ) та на момент виписки з лікувального закладу. Результати. Аналіз динаміки неврологічного відновлення при виписці з лікувального закладу виявив достовірне поліпшення в групі пацієнтів із застосуванням ЦТМ, що знайшло відображення у середньому значенні за шкалою коми Глазго 13,50 ± 1,36 бала порівняно з 11,5 ± 1,8 бала в контрольній групі (p < 0,05). При аналізі кращих значень за шкалою СРС в період знаходження пацієнтів в умовах ВРІТ добре неврологічне відновлення, що відповідало СРС 1–2, було отримано у 20 та 50 %, погане на рівні СРС 3–4 — у 70 і 50 % пацієнтів у контрольній та групі із застосуванням ЦТМ відповідно. При виписці з лікувального закладу неврологічне відновлення на рівні СРС 1–2 було виявлено у 30 % порівняно з 80 %, на рівні СРС 3–4 — у 70 % порівняно з 20 % пацієнтів у контрольній і групі із застосуванням ЦТМ відповідно. Міжгрупові відмінності середніх значень за шкалою СРС на момент виписки з лікувального закладу мали вірогідний характер та становили 2,90 ± 0,94 і 2,00 ± 0,77 (Р = 0,02) в контрольній і основній групах відповідно. Висновки. Використання цільового температурного менеджменту з метою забезпечення нормотермії створює сприятливі умови для більш повного відновлення порушених неврологічних функцій після важкої черепно-мозкової травми.
Актуальность. Гипертермия вызывает церебральное повреждение и ухудшает неврологические исходы при тяжелой черепно-мозговой травме (ЧМТ). Целью работы стало изучение влияния на неврологические исходы у пациентов с тяжелой ЧМТ и рефрактерной к фармакологической коррекции гипертермией использования целевого температурного менеджмента с применением эзофагеального охлаждающего устройства в комплексе интенсивной терапии в сравнении с группой контроля. Материалы и методы. Обследовано 20 пациентов в возрасте от 23 до 54 лет с диагнозом «тяжелая ЧМТ». Пациенты были разделены на 2 группы. Пациентам I группы (n = 10) проводился стандартный комплекс интенсивной терапии, базирующейся на международных рекомендациях по лечению тяжелой ЧМТ (2007, 2016). Во II группе (n = 10) в стандартный комплекс интенсивной терапии был включен целевой температурный менеджмент (ЦТМ), осуществляемый при помощи гипотерма «Blanketrol II» (CSZ, США) с использованием эзофагеального устройства для охлаждения (Esophageal Cooling Device, ACT, США) с целью достижения нормотермии в диапазоне 36,5–37 °С. У всех пациентов оценивался неврологический статус по шкале комы Глазго: исходно, на 5-е, 10-е сутки, на момент выписки из лечебного учреждения. Исходы перенесенной ЧМТ определялись по шкале СРС (Сerebral Performance Categories) на следующих этапах: лучшее значение в момент нахождения пациента в отделении реанимации и интенсивной терапии (ОРИТ), а также при выписке из лечебного учреждения. Результаты. Анализ динамики неврологического восстановления на момент выписки из лечебного учреждения выявил достоверное улучшение в группе пациентов с применением ЦТМ, что нашло отражение в среднем уровне баллов по шкале комы Глазго 13,50 ± 1,36 балла по сравнению с 11,5 ± 1,8 балла в контрольной группе (p < 0,05). При анализе лучших баллов по шкале исходов СРС в период нахождения пациентов в условиях ОРИТ хорошее неврологическое восстановление, соответствовавшее СРС 1–2, было получено у 20 и 50 %, а плохое неврологическое восстановление на уровне СРС 3–4 было выявлено у 70 и 50 % пациентов в контрольной и основной группе с применением ЦТМ соответственно. При выписке из лечебного учреждения неврологическое восстановление СРС 1–2 было выявлено у 30 и 80 %, СРС 3–4 — у 70 и 20 % пациентов в контрольной и основной группе с применением ЦТМ соответственно. Межгрупповые различия средних значений по шкале СРС на момент выписки из лечебного учреждения носили достоверный характер: 2,90 ± 0,94 и 2,00 ± 0,77 (Р = 0,02) в контрольной и основной группе соответственно. Выводы. Использование целевого температурного менеджмента с целью поддержания нормотермии создает благоприятные условия для более полного восстановления нарушенных неврологических функций после тяжелой черепно-мозговой травмы.
Background. Hyperthermia causes cerebral injury and worsens neurological outcomes in severe traumatic brain injury (TBI). The aim of the work was to study neurological outcomes in patients with severe TBI and refractory hyperthermia, while providing the target temperature management (TTM) with using an esophageal cooling device in the intensive care as compared to the control group. Materials and methods. Twenty patients aged 23 to 54 years with a diagnosis of severe TBI were examined. They were divided into 2 groups: I (n = 10) — these patients underwent a standard intensive care based on the international guidelines for the management of severe head injury (2007, 2016); II group (n = 10) — the TTM was carried out with the help of the Blanketrol II (CSZ, USA) and invasive technology using the Esophageal Cooling Device (ACT, USA) to achieve normothermia in the range of 36.5–37 C. The indication for the use of TTM was the development of febrile and hectic fevers of non-infectious origin in patients with TBI. The trigger for the start of TTM was hyperthermia ≥ 38.3 C, which can not be ameliorated by pharmacological correction with antipyretics. The TTM was performed to achieve the target value of the body’s normothermia. Exclusion criterion from the study was a neurological deficit ≤ 4 on the Glasgow Coma Scale (GCS). All patients were assessed neurological status on the GCS at the stages: initially, on days 5, 10 and at the time of discharge from the hospital. The outcomes of the TTM were determined on the scale of Cerebral Performance Categories (CPC) at the stages: the maximum score when in the ICU and at the time of discharge. Results. There were no deaths in any group of patients examined. An analysis of the dynamics of neurologic recovery at the time of discharge from the hospital showed a significant improvement in the group of patients using TTM on the GCS in comparison with control group. During the analysis of poor outcomes, in the group using TTM, a decrease in the severity of neurologic damage was revealed compared to the control group of patients. Thus, the most unfavorable outcome of severe TBI as a delay of neurologic recovery at the level of the apallic syndrome or akinetic mutism of the corresponding CPC-4 in the first group developed in 30 % of patients, while in the second group — in no patient. We did not find any clinically significant side effects when using the Esophageal Cooling Device. It should be emphasized that factors limiting the application of the Esophageal Cooling Device for the purpose of arresting hyperthermia of the central origin have been identified, such as the inability to conduct enteral nutrition and the lesser accuracy of monitoring the body temperature when using a rectal sensor. Limitations of this study are a small sample of patients and heterogeneity of traumatic brain injury, which requires additional studies. Conclusions. An analysis of the dynamics of neurologic recovery after severe TBI at the time of discharge from the hospital showed a significant improvement in the group of patients using the TTM of 13.50 ± 1.36 points on the GCS in comparison with 11.50 ± 1.80 points in the control group (p < 0.05). According to the best scores on the scale of outcomes of the CPC when in the ICU, a good neurologic recovery was achieved in 20 and 50 % of the corresponding CPC 1–2, and a poor neurologic recovery at the level of the CPC 3–4 was found in 70 and 50 % of patients in the control group and the main group with the application of TTM, respectively. At the discharge from the hospital, neurologic recovery at the level of CPC 1–2 was detected in 30 compared to 80 %, and at the level of CPC 3–4 — in 70 and 20 % of patients in the control and TTM group, respectively. Intergroup differences in mean values on the scale of the CPC at the time of discharge from the hospital were reliable: 2.90 ± 0.94 and 2.00 ± 0.77 (P = 0.02) in the control and TTM groups, respectively. The use of target temperature management to maintain normothermia creates more favorable conditions for a more complete restoration of impaired neurological functions after severe TBI.
Введение
Центральная нервная система особенно уязвима при длительной или чрезмерной гипертермии, вызывая развитие церебрального повреждения [1–3]. На клеточном уровне гипертермия вызывает структурно-функциональные изменения нейронов в виде нарушения деполяризации, трансмембранного ионного транспорта, механизмов передачи клеточных сигналов и функции митохондрий [4]. Наиболее температурно-чувствительными элементами нервных клеток являются митохондриальные и цитоплазматические мембраны, причем необратимые изменения структуры белка, по всей видимости, происходят при температуре < 40 °C [5]. При повышении температуры скорость повреждения возрастает, кроме того, гипертермия потенцирует нейрональное повреждение, вызванное гипоксией и ишемией [4].
Тепловой стресс может приводить к некрозу или апоптозу клеток. Гибель клеток в зависимости от их типа развивается при температуре < 40–41 °С и увеличивается в геометрической прогрессии при удлинении времени воздействия температуры. Гибель клеток может не развиваться немедленно. Высокая температура может вызывать набухание и некроз клеток в момент или вскоре после воздействия теплового стресса. Более умеренная гипертермия может приводить к гибели клеток в течение последующих нескольких дней [4].
Местные эффекты заключаются в изменении экспрессии большого количества про- и противовоспалительных цитокинов во время острой и восстановительной фаз после гипертермического воздействия. К системным эффектам гипертермии относят повышение проницаемости гематоэнцефалического барьера (ГЭБ), являющейся температурозависимой. Так, было отмечено значительное увеличение транспорта веществ при температуре < 38–39 °С, с дальнейшим прогрессивным усилением проницаемости ГЭБ при повышении температуры выше указанного уровня [3–5].
В последние годы международной консенсусной конференцией предложена концепция целевого температурного менеджмента (ЦТМ) (ТТМ — Target Тemperature Мanagement). Профиль целевого температурного менеджмента включает в себя три различные фазы: 1) индукция; 2) поддержание; 3) реверсия — возврат к температурному статусу, поддерживаемому внутренним физиологическим контролем [6, 7].
Целью данного исследования стало изучение влияния на неврологические исходы у пациентов с тяжелой ЧМТ и рефрактерной к фармакологической коррекции гипертермией использования целевого температурного менеджмента с применением эзофагеального охлаждающего устройства в комплексе интенсивной терапии в сравнении с группой контроля.
Материалы и методы
Нами были обследованы 20 пациентов в возрасте от 23 до 54 лет с диагнозом «тяжелая черепно-мозговая травма». Всем пациентам проводилась интенсивная терапия в отделении реанимации и интенсивной терапии (ОРИТ) политравмы КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова».
Все включенные в исследование пациенты были разделены на 2 группы. Пациентам I группы (n = 10) проводился стандартный комплекс интенсивной терапии согласно рекомендациям 2007 и 2016 гг., и в частности «Руководства по лечению тяжелой черепно-мозговой травмы — 2016» (Guidelines for the Management of Severe Traumatic BrainInjury 4th Edition) в условиях реанимационного отделения стационара [8].
Во II группе (n = 10) стандартный комплекс интенсивной терапии был дополнен включением целевого температурного менеджмента (ЦТМ) при помощи гипотерма «Blanketrol II» (CSZ, США) с использованием эзофагеального устройства для охлаждения (Esophageal Cooling Device, ACT, США) с целью достижения нормотермии в диапазоне 36,5–37 °С.
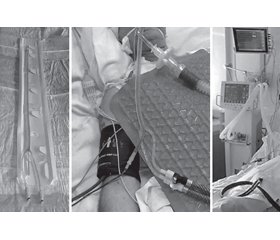
Эзофагеальное устройство для охлаждения представляет собой силиконовый зонд, который устанавливается орофарингеально, при этом в устройстве имеется канал для декомпрессии желудка (рис. 1). После подключения устройства к гипотерму «Blanketrol II» в нем обеспечивается циркуляция охлажденной жидкости, таким образом, целевое значение температуры пациента достигается путем охлаждения ядра тела через пищевод.
Аппарат «Blanketrol II» автоматически обеспечивает достижение и поддержание целевой температуры путем обратной связи, а также осуществляет динамический мониторинг температуры тела (ядра) пациента, воды в эзофагеальном устройстве и заданных параметров.
Показанием к применению ЦТМ было развитие фебрильных и гектических лихорадок неинфекционного генеза у пациентов с ЧМТ. Триггером для начала ЦТМ было развитие гипертермии ≥ 38,3 °С, не поддающейся фармакологической коррекции с использованием антипиретиков. ЦТМ осуществлялся для достижения целевого значения нормотермии тела.
Пациенты I группы обследовались ретроспективно, купирование гипертермии у них осуществлялось путем проведения фармакологической антипиретической терапии, а также обкладывания тела пузырями со льдом в проекциях прохождения магистральных сосудов.
В исследование не включались пациенты, которые имели на момент начала исследования неврологический дефицит ≤ 4 баллов по шкале комы Глазго. Указанные группы были репрезентативными по основным клиническим и половозрастным характеристикам (табл. 1).
Пациентам всех групп проводилась механическая вентиляция легких через эндотрахеальную трубку или трахеостомическую канюлю. Проводилось непрерывное мониторирование поверхностной температуры тела при помощи кардиомонитора. Температура ядра тела измерялась: в I группе тимпанитная, посредством инфракрасного термометра, во II группе — при помощи ректального датчика, подключавшегося к гипотерму «Blanketrol II».
У всех пациентов оценивался неврологический статус по шкале комы Глазго на следующих этапах: исходно, на 5-е, 10-е сутки и при выписке из лечебного учреждения.
Исходы перенесенной ЧМТ определялись по шкале СРС (Сerebral Performance Categories):
СРС 1 — функциональное состояние мозга в норме. Возможны незначительные психологические или неврологические нарушения, не оказывающие существенного влияния на функцию мозга. Трудоспособность сохранена.
СРС 2 — умеренные нарушения функции мозга в виде гемиплегии, судорог, атаксии, дизартрии, стойких нарушений памяти или умственной деятельности, но при этом сознание сохранено, пациент способен к самообслуживанию. Частичная потеря трудоспособности.
СРС 3 — тяжелые нарушения функции мозга, при этом сознание сохранено, но познавательные способности ограничены — пациент нуждается в уходе (тяжелые нарушения памяти, тетраплегия, деменция). Инвалидизация.
СРС 4 — сознание отсутствует — кома, вегетативное состояние.
СРС 5 — смерть мозга.
Исходы перенесенной ЧМТ по шкале СРС оценивались на следующих этапах исследования: лучшее значение в момент нахождения пациента в ОРИТ и при выписке из лечебного учреждения.
Статистическую обработку результатов исследования проводили с использованием табличного процессора Libre Office.org (версия 5.3.5.1.) и статистических онлайн-калькуляторов (http://www.socscistatistics. com).
Результаты
В обеих группах пациентов не было выявлено достоверных различий по уровню исходной гипертермии. Отмечалась тенденция к более глубокому исходному неврологическому дефициту во II группе исследования (табл. 2). Летальных исходов не было зарегистрировано ни в одной группе обследованных пациентов. Межгрупповая оценка неврологического статуса на 5-е и 10-е сутки –исследования выявила тенденцию к более быстрому восстановлению в группе пациентов с применением целевого температурного менеджмента. В то же время анализ динамики неврологического восстановления после полученной тяжелой ЧМТ на момент выписки из лечебного учреждения выявил достоверное улучшение в группе пациентов с применением целевого температурного менеджмента. Так, при оценке пациентов по шкале комы Глазго на момент выписки из лечебного учреждения было получено 11,5 ± 1,8 балла и 13,50 ± 1,36 балла в первой и второй группах соответственно (p < 0,05).
Интегративным показателем качества и полноты восстановления неврологических функций при проведении интенсивной терапии является исход перенесенной ЧМТ, включающий сохранение мыслительных функций, способности к самообслуживанию и последующей трудоспособности, что оценивалось нами по шкале СРС (табл. 3). При анализе лучших значений по шкале исходов СРС в период нахождения пациентов в условиях ОРИТ хорошее неврологическое восстановление, что соответствовало СРС 1–2, в первой группе было получено у 20 % по сравнению с 50 % во второй группе пациентов. Плохое неврологическое восстановление, соответствующее СРС 3–4, в первой группе было выявлено у 70 % пациентов, а во второй группе — у половины обследованных. Полученные результаты коррелировали с динамикой восстановления неврологического статуса при оценке по шкале комы Глазго в группах исследования.
/61-1.jpg)
При анализе влияния использованных вариантов интенсивной терапии на исходы тяжелой ЧМТ на момент выписки из лечебного учреждения между группами исследования были выявлены следующие различия. Хорошее неврологическое восстановление на уровне СРС 1–2 в первой группе было выявлено у 30 % пациентов, а в группе с применением ЦТМ — у 80 %. Плохое неврологическое восстановление, соответствовавшее СРС 3–4, было выявлено у 70 % пациентов первой группы и только у 20 % пациентов второй группы. При анализе плохих исходов в группе с применением ЦТМ было выявлено снижение тяжести неврологического повреждения по сравнению с контрольной группой пациентов. Так, самый неблагоприятный исход полученной тяжелой ЧМТ в виде задержки неврологического восстановления на уровне апаллического синдрома или акинетического мутизма, соответствовавший СРС 4, в первой группе развился у 30 %, в то время как во второй группе он не был выявлен ни у одного пациента.
В целом межгрупповые различия по исходу полученной тяжелой ЧМТ, согласно средним значениям по шкале СРС на момент выписки из лечебного учреждения, носили достоверный характер. Так, в первой группе данный показатель составил 2,90 ± 0,94, а во второй группе — 2,00 ± 0,77 (Р = 0,02). Таким образом, обеспечение поддержания нормотермии путем использования технологии ЦТМ позволяет достоверно улучшить неврологические исходы тяжелой ЧМТ на этапе выписки из лечебного учреждения.
Нами не было выявлено каких-либо клинически значимых побочных эффектов при использовании эзофагеального охлаждающего устройства.
Обсуждение
Пациенты всех исследованных групп имели тяжелую ЧМТ, что сопровождалось неврологическим дефицитом на уровне комы I–II степени, сопора и глубокого оглушения. Развитие гипертермии существенно углубляло неврологический дефицит у пациентов с тяжелой ЧМТ. Гипервентиляция, внутричерепная гипертензия (ВЧГ) и артериальная гипотензия, обусловливая снижение церебральной перфузии, нарушают репаративные механизмы в головном мозге. Усиление гипертермии обеспечивает углубление вторичного повреждения головного мозга при ЧМТ [2–5]. В целом выделяют три основные цели температурного менеджмента у пациентов в критических состояниях: нейропротекция, коррекция ВЧГ, а также купирование лихорадки как фактора вторичного повреждения головного мозга [6, 7]. Результаты данного исследования оценивали важность использования ЦТМ для купирования гипертермии центрального генеза и влияние данного метода интенсивной терапии на неврологическое восстановление и исходы перенесенной тяжелой ЧМТ. В результате было получено достоверное улучшение неврологического статуса по шкале комы Глазго на момент выписки из лечебного учреждения в группе с использованием ЦТМ. Аналогичные результаты были получены при анализе неврологических исходов при выписке из лечебного учреждения и характеризовались большим числом пациентов с хорошим неврологическим восстановлением (СРС 1–2) и меньшей степенью инвалидизации после перенесенного тяжелого травматического повреждения головного мозга.
При этом необходимо подчеркнуть, что были также выявлены факторы, лимитирующие использование эзофагеального охлаждающего устройства для купирования гипертермии, например невозможность проведения энтерального питания, а также меньшая точность мониторинга температуры ядра тела при использовании ректального –датчика.
Ограничениями данного исследования являются малая выборка и гетерогенность травматического повреждения головного мозга у пациентов, что требует проведения дополнительных исследований.
Таким образом, полученные результаты исследования свидетельствовали о лучшей динамике неврологического восстановления пациентов при использовании в комплексе интенсивной терапии тяжелой ЧМТ целевого температурного менедж–мента с целью поддержания нормотермии.
Выводы
1. Анализ динамики неврологического восстановления после полученной тяжелой ЧМТ при выписке из лечебного учреждения выявил достоверное улучшение в группе пациентов с применением целевого температурного менеджмента, что составило 13,50 ± 1,36 балла по шкале комы Глазго по сравнению с 11,5 ± 1,8 балла в контрольной группе (p < 0,05).
2. При анализе лучших значений исходов СРС в период нахождения пациентов в условиях ОРИТ хорошее неврологическое восстановление, соответствовавшее СРС 1–2, было отмечено у 20 и 50 %, а плохое неврологическое восстановление на уровне СРС 3–4 было выявлено у 70 и 50 % пациентов в контрольной и группе с применением целевого температурного менеджмента соответственно.
3. При выписке из лечебного учреждения неврологическое восстановление на уровне СРС 1–2 было выявлено у 30 % по сравнению с 80 %, а на уровне СРС 3–4 — у 70 и 20 % пациентов в контрольной и основной группе с применением целевого температурного менеджмента соответственно. Межгрупповые различия средних значений по шкале СРС на момент выписки из лечебного учреждения носили достоверный характер и составили 2,90 ± 0,94 и 2,00 ± 0,77 (Р = 0,02) в контрольной и основной группах соответственно.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/60-1.jpg)
/61-1.jpg)