Газета «Новости медицины и фармации» Акушерство и гинекология (636) 2017 (тематический номер)
Вернуться к номеру
Патогенез и лабораторная диагностика ДВС-синдрома в акушерстве
Авторы: Мельник А.А. — к.б.н.
Рубрики: Акушерство и гинекология
Разделы: Справочник специалиста
Версия для печати
В настоящее время акушерские кровотечения остаются основной причиной материнской смерт-ности в мире [1]. Состояние беременности, которое приводит к кровотечениям с высокой смертностью, называется диссеминированным внутрисосудистым свертыванием крови (ДВС). Впервые ДВС описал в 1901 году Joseph DeLee, который, наблюдая случай смертельного кровотечения при преждевременной отслойке нормально расположенной плаценты, объяснил это состояние как «временная гемофилия» [2]. Непосредственно термин «ДВС-синдром» предложил в 1950 г. американский патолог D. McKay. При вскрытии трупа женщины, погибшей на фоне отслойки плаценты от множественных массивных кровоизлияний, он обнаружил многочисленные тромбы, обтурирующие главным образом мелкие и мельчайшие сосуды. Позже, в 1965 г., D. McKay опубликовал монографию «Синдром диссеминированного внутрисосудистого свертывания как промежуточный механизм патогенеза болезней человека» [3]. Необходимо отметить, что D. McKay принадлежит одно из удачных определений ДВС-синдрома: «Это динамический биологический процесс, который вовлекает множество химических веществ и физиологических активаторов. Возникая в момент проникновения в кровь прокоагулянтного материала, он прогрессирует до стадии агрегации тромбоцитов и формирования фибрина, которые могут приводить к образованию микротромбов в капиллярах, артериолах и венах различных органов. Внутрисосудистое свертывание часто сочетается с активацией фибринолитической системы, расщеплением фибрина и фибриногена, высвобождением продуктов их деградации. Этот процесс сопровождается сильной вазомоторной реакцией и не заканчивается до тех пор, пока коагуляционный механизм и вазомоторный аппарат не нормализуют свою функцию, а продукты деградации фибрина/фибриногена не будут удалены из крови». Современные представления о ДВС-синдроме позволяют заключить, что это патологический синдром, в основе которого лежит активация сосудисто-тромбоцитарного и коагуляционного гемостаза, в результате чего кровь сначала сворачивается в микроциркуляторном русле, блокирует его фибрином и клеточными агрегатами, а при истощении потенциала свертывающей и противосвертывающей систем теряет способность к свертыванию, что проявляется кровотечением и развитием синдрома полиорганной недостаточности. ДВС-синдром, соответственно, является ключевым фактором, обусловливающим развитие полиорганной недостаточности и летального исхода по причине смертельного кровотечения. ДВС-синдром неспецифичен и универсален, так как возникает при самых разнообразных заболеваниях.
Патогенез ДВС-синдрома
Основа патогенеза ДВС-синдрома заключается в глубокой дисфункции всех звеньев системы гемостаза, которая характеризуется последовательной их активацией и истощением. По этой причине происходит смена фаз ДВС-синдрома — от гиперкоагуляции и высокой спонтанной агрегации тромбоцитов в начале до переходного периода и последующей глубокой гипокоагуляции, вплоть до полной несвертываемости крови и тромбоцитопении в конце. Уже на ранних этапах обнаруживается истощение не столько факторов свертывания, сколько важнейших физиологических антикоагулянтов — протеина С (ПрС), протеина S (ПрS), антитромбина III (АТ III). Депрессия физиологических антикоагулянтов тем значительнее, чем тяжелее ДВС. У больных с различными по происхождению вариантами ДВС-синдрома в процессе их формирования и развития отмечается ряд принципиальных закономерностей:
1) наступление фазы гиперкоагуляции;
2) срыв и прогрессирующее истощение основных антикоагулянтов (ПрС, ПрS, АТ III).
Стадии ДВС-синдрома
I стадия — гиперкоагуляция. При однократном и массивном образовании тромбопластина она кратко-временна, но отчетлива по лабораторным признакам. Данный период характеризуется активацией плазменных систем свертывания крови, внутрисосудистой агрегацией тромбоцитов и других форменных элементов крови, нарушением микроциркуляции в разных органах в результате блокады сосудистого русла массами фибрина и агрегатами клеток.
II стадия — гипокоагуляция. Обусловлена потреблением значительной части имеющихся в организме фибриногена, факторов V, VIII, XIII и других прокоагулянтов, а также тромбоцитов. Одновременно в крови накапливаются патологические ингибиторы свертывания крови, в частности продукты деградации фибрина и фибриногена (ПДФ), обусловливающие увеличение антикоагулянтной активности крови.
III стадия — активация фибринолиза (афибриногенемии с патологическим фибринолизом). Активация фибринолитической системы ведет к растворению кровяных сгустков и создает предпосылки для развития геморрагического синдрома.
IV стадия — восстановительная. Характеризуется возвращением к физиологическим границам коагуляционного потенциала. В этой стадии в той или иной мере происходит восстановление функции органов, которое зависит от степени их поражения. Стадия может закончиться полным выздоровлением. Возможно развитие тяжелых осложнений уже в отсутствие как такового ДВС-синдрома — почечной, печеночной недостаточности, неврологических, кардиальных и других осложнений.
Причины ДВС-синдрома в акушерстве
ДВС-синдром зависит от характера акушерской патологии, вызвавшей кровотечение, сопутствующих соматических заболеваний, особенностей течения беременности и др. При этом наблюдается множество клинических и лабораторных вариантов ДВС-синдрома, протекающего индивидуально у каждой пациентки.
Причины ДВС-синдрома в акушерстве [4, 5]:
1. Отслойка плаценты.
2. Септический аборт и внутриутробная инфекция.
3. Эмболия околоплодными водами.
4. Внутриутробная гибель плода.
5. Внематочная беременность.
6. Преэклампсия/эклампсия.
7. Кесарево сечение (10 %).
8. Трансфузия несовместимой крови.
9. Травматические роды, в том числе энергичный массаж матки (высвобождение тканевого фактора).
10. Синдром массивной гемотрансфузии.
11. HELLP-синдром.
12. Острая жировая дистрофия печени.
Патофизиология ДВС-синдрома при акушерской патологии
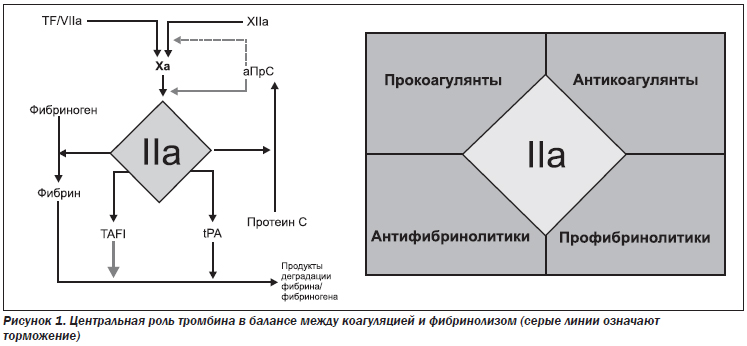
В данном вопросе очень важным является понимание процесса свертывания крови в норме и наблюдаемого во время ДВС. Нормальный коагулянтный ответ начинается с воздействия тканевого фактора (TF) вместе с фактором VIIa на фактор Xа для дальнейшего превращения протромбина в тромбин (IIa) [6]. Тромбин является прокоагулянтом при превращении фибриногена в фибрин и контролирует антикоагуляционный процесс путем генерирования активированного протеина С (аПрС), снижая активность факторов Vа и VIIIа. Растворение сгустка и генерирование продуктов деградации фибрина/фибриногена происходят через тромбининдуцированный тканевой активатор плазминогена (tPA) с регуляцией фибринолиза, включающей активацию ингибитора фибринолиза, активируемого тромбином (TAFI) [7, 8]. Таким образом, тромбин играет центральную роль в балансе между про- и антикоагулянтной функцией и про- и антифибринолитической активностью (рис. 1).
Центральное место в развитии ДВС-синдрома принадлежит тромбину, для которого характерна чрезмерная генерация in vivo. Хотя образование тромбина в основном зависит от протромбиназного комплекса на поверхности тромбоцитов, клетки без фосфолипидов также могут поддерживать такие реакции in vivo [9, 10]. Они образуются в результате апоптоза или повреждения клеточных мембран, выпячивая фосфатидилсерин, находящийся на внутренней стороне мембраны. Микрочастицы, которые переносят внутренний фосфатидилсерин, продуцируют прокоагулянт, и их уровни увеличиваются при беременности [11].
Также важное значение имеет обеспечение фосфолипидной поверхности липопротеинами, такими как окисленный липопротеин низкой плотности и липопротеин очень низкой плотности. Последний может увеличиваться при ДВС-синдроме в несколько раз [12]. Кроме того, дисрегуляция липопротеинов влияет на активность тромбина через относительное уменьшение липопротеинов высокой плотности, которые обладают антикоагулянтными свойствами [13]. Было показано, что циркулирующие липопротеины коррелируют с более высокой частотой преэклампсии [14]. У женщин с преэклампсией отмечены 3-кратное увеличение уровня липопротеинов очень низкой плотности и значительно сниженная концентрация липопротеинов высокой плотности. Этот дисбаланс между про- и антикоагулянтными липопротеинами приводит к эндотелиальной дисфункции и служит патогенезом преэклампсии.
Плацента как активатор коагуляционной системы
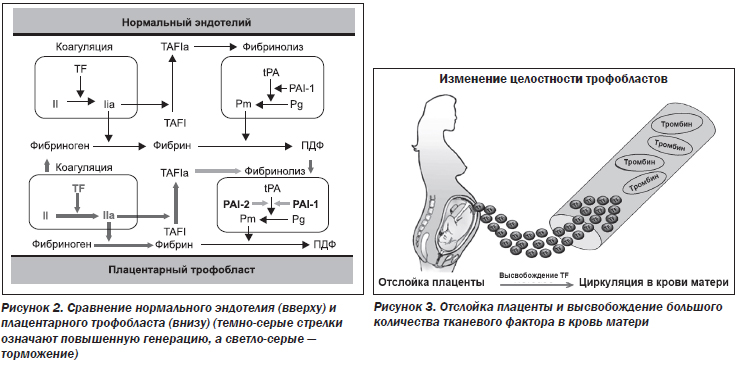
Плацента обладает повышенным статусом коагуляционной активности за счет увеличения продуцирования тканевого фактора. При этом наблюдаются увеличение степени превращения протромбина (фактор II) в тромбин (фактор IIa) и дальнейшее расщепление фибриногена до фибрина. Происходит увеличение TAFIa, который вместе с повышенными уровнями PAI-1 и -2 снижает фибринолитическую активность. Этот процесс обычно осуществляется через нормальную tPA-индуцированную генерацию плазмина из плазминогена, образуя в конечном итоге продукты деградации фибрина/фибриногена (рис. 2).
В сосудистой оболочке плаценты содержатся эмбриональные трофобластные клетки, обладающие эндотелиальной клеточной способностью регулировать гемостаз. Эти клетки имеют несколько различных гемостатических свойств, которые важны для поддержания гемостаза при нормальной беременности. К ним относятся экспрессия TF, изменение антикоагулянт-ной функции, супрессия фибринолиза и воздействие анионных фосфолипидов.
1. Экспрессия тканевого фактора
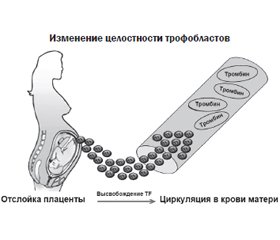
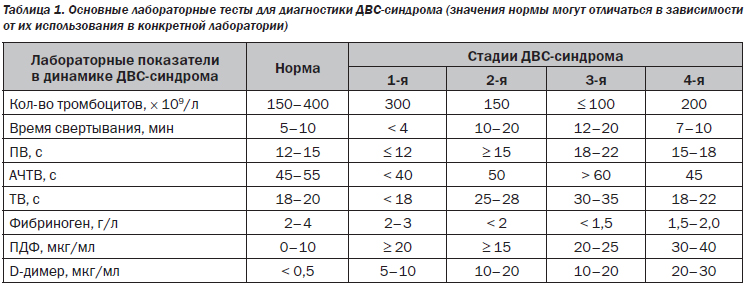
Синцитиотрофобласты из нормальной плаценты человека обладают сильно выраженной активностью TF [15]. Нарушение целостности трофобластов, что классически наблюдается при отслойке плаценты, приводит к высвобождению большого количества тканевого фактора в материнском кровообращении. Это способствует активации коагуляционного каскада и распространению воспалительного ответа, который может легко стать системным, что приведет к неконтролируемому высвобождению тромбина и последующему развитию ДВС [16] (рис. 3). Для поддержания гемостаза во время эмбрионального развития необходим соответствующий баланс между TF и TFPI в разных органах [17].
2. Изменение антикоагулянтных функций
Тромбомодулин (ТМ) экспрессируется на трофобластах плаценты таким же образом, как и на поверхности кровеносных сосудов [18]. В работе М. Boffa и др. ([19] показано, что растворимые уровни ТМ на 12-й неделе гестации были одинаковыми при нормальной и патологической беременности. Эндотелиальный рецептор протеина С (EPCR) также экспрессируется на синцитиотрофобластах, что делает возможным аПрС-зависимому протеаза-активированному рецептору-1 блокировать апоптоз клеток плаценты [20]. Высокие уровни антител к EPCR связаны с более высоким риском первого эпизода смерти плода. Аутоантитела (анти-EPCR) могут активировать комплемент и быть причиной провос-палительного разрушения трофобластов и гибели плода. Активность протеина С не зависит от сроков гестации, в то время как прогрессивное уменьшение уровня протеина S наблюдается с увеличением срока гестации. Резистентность активированного протеина С увеличивается в течение беременности у 45 % беременных женщин по сравнению с небеременными женщинами того же возраста [21]. Уровни антитромбина III не изменяются в течение беременности [22]. В целом системная антикоагулянтная активность снижена по сравнению с небеременными женщинами, что подтверждается общим прокоагулянтным сдвигом при нормальной беременности [23]. Отмечено закономерное снижение уровня АТ III в ходе ДВС-синдрома из-за его действия на нейтрализацию тромбина, фактора Хa и других плазменных сериновых протеаз.
3. Подавление фибринолиза
При увеличении уровня PAI-1 плацента продуцирует PAI-2. При нормальной беременности показатель PAI-1 постепенно увеличивается, достигая заметного повышения в 3-м триместре. Это значительное увеличение сравнимо с относительно неизменяемыми уровнями tPA, что приводит к уменьшению лизиса сгустка и протромботического смещения у беременных женщин [24]. Эта так называемая повышенная защита против лизиса сгустка действует опосредованно через ингибитор фибринолиза, активируемого тромбином. TAFI представляет собой карбоксипептидазу В-подобного профермента, который синтезируется в печени и активируется тромбин-тромбомодулиновым комплексом. При активации снижается регуляция фибринолиза и значительно увеличивается уровень TAFI у беременных, достигая пика в последнем триместре. При ДВС-синдроме чрезмерная генерация тромбина еще больше увеличивает уровни TAFI как ингибитора фибринолиза.
4. Воздействие анионных фосфолипидов
Было показано, что фосфолипиды играют важную роль в росте поверхности плаценты при дифференциации и внутриклеточном слиянии ворсистого цитотрофобласта в синцитиотрофобласт [25]. Экстернализация фосфатидилсерина является важным компонентом этого процесса интертрофобластного слияния. Дифференциация цитотрофобластных ворсинок — это результат перераспределения мембранных фосфолипидов с обогащенным фосфатидилсерином на поверх-ности синцитиотрофобласта. При патологических состояниях ДВС в акушерстве наблюдается насыщение фосфатидилсерином трофобластной поверхности.
Эндотелиальная дисфункция и активация тромбоцитов
Интактные, дисфункциональные или активированные клетки, а также ремнанты клеточных поверхностей, медиаторы воспаления и коагуляционные белки являются частью взаимодействия, в котором неконтролируемая активация коагуляционного каскада приводит к ДВС. Эндотелиальные клетки, тромбоциты и в некоторых случаях лейкоциты могут участвовать в возникновении процесса, который приводит к ДВС при высвобождении провоспалительных цитокинов, распространяющих активацию коагуляции на их поверх-ности или индуцируя экспрессию TF на их мембране [26, 27]. Системный воспалительный ответ, который связан с увеличением циркулирующих провоспалительных цитокинов, таких как фактор некроза опухоли α (TNF-α) и интерлейкин-1 (IL-1), приводит к сверхэкспрессии TF лейкоцитами и эндотелиальными клетками. Результатом этого будет неконтролируемый коагуляционный ответ, который в конечном итоге приведет к ДВС. Тканевой фактор может экспрессироваться не только мононуклеарными клетками, но и сосудистыми эндотелиальными и опухолевыми клетками. Необходимо отметить, что если физиологические антикоагулянты функционируют нормально, то, несмотря на мощное инициирование коагуляции тканевым фактором, активация коагуляции может не возникнуть. Однако при ДВС-синдроме происходит нарушение всех основных природных антикоагулянтов (АТ III, ПрС и ингибитор тканевого фактора — TFPI). Концентрация антитромбина III, самого важного ингибитора тромбина, заметно снижена при ДВС, так как расщепляется эластазой из активированных нейтрофилов. Действие антикоагулянтов связано с эндотелием, поэтому активация эндотелиальных клеток и их дисфункция являются важными компонентами дисбаланса между свертывающей и антисвертывающей системами.
Активация тромбоцитов может ускорить образование фибрина. Экспрессия TF в моноцитах заметно стимулируется при наличии тромбоцитов и гранулоцитов в Р-селектинзависимых реакциях. Этот эффект является результатом индуцированной активации ядерного фактора каппа В при связывании активированных тромбоцитов с нейтрофилами и мононуклеарными клетками. Во время беременности лейкоциты матери имеют высокий активационный статус по сравнению с небеременными женщинами и обладают характеристиками, похожими на сепсис [28]. В случае сепсиса, вызванного инфекционными агентами, септическим абортом или эмболией амниотической жидкостью, это равновесие нарушено, и у матери развивается ДВС-синдром.
Лабораторная диагностика ДВС-синдрома
Лабораторная диагностика ДВС-синдрома должна быть срочной, основанной на четко построенной системе простых и легко выполнимых тестов. Вместе с тем эти тесты должны отражать фазы развития ДВС-синдрома, а также контролировать проводимое лечение. Продолжительность клинических проявлений ДВС-синдрома может достигать 7–9 часов и более. Изменения в системе гемокоагуляции, определяемые с помощью лабораторных методов, сохраняются дольше, чем клинические, поэтому лабораторная диагностика ДВС-синдрома имеет первостепенное значение. Для лабораторной диагностики ДВС-синдрома используют простые и легкодоступные коагуляционные тесты, которые включают анализ количества тромбоцитов, время свертывания, протромбиновое время (ПВ), активированное частичное протромбиновое время (АЧТВ), тромбиновое время (ТВ), фибриноген, продукты деградации фибирина/фибриногена (ПДФ) и D-димер (табл. 1). Одним из ключевых моментов в этом процессе является то, что эти тесты отражают динамические изменения на основе клинических наблюдений.
Кроме основных лабораторных тестов, для врача-клинициста важно иметь информацию о возможности применения в своей практике более широкого спектра лабораторного тестирования.
1. Дополнительные тесты
Уровни природных антикоагулянтов, такие как антитромбин III и протеин С, снижены у пациентов с ДВС, что отмечено у 90 % пациентов с ДВС. Лабораторные значения этих природных ингибиторов предоставляют ценную информацию для диагностики и мониторинга ДВС-синдрома, однако они не используются в лабораторных исследованиях, так как не добавляют никакой диагностической информации. Низкие уровни антитромбина III и протеина С не являются специфичными для ДВС-синдрома по причине того, что они могут быть связаны с заболеванием печени или с другими патологиями.
2. Новые тесты
В дополнение к анализу общего количества тромбоцитов возможно использовать другие параметры тромбоцитов для постановки ДВС-синдрома. Некоторые современные гематологические анализаторы имеют возможность идентифицировать ретикулярные тромбоциты, измеряемые как фракция незрелых тромбоцитов. Недавние исследования показали, что увеличение ретикулярных тромбоцитов коррелирует с диагнозом явного ДВС-синдрома. Наличие ретикулярных тромбоцитов коррелирует с увеличением продуктов деградации фибрина и показывает лучший прогноз ДВС, чем тромбоциты. Поскольку ДВС включает активацию воспалительного процесса, анализ воспалительных маркеров, таких как С-реактивный белок, интерлейкин-6, -8, фактор некроза опухоли альфа, прокальцитонин и липопротеинсвязывающий белок, будет осуществляться в самое ближайшее время.
3. Специализированные тесты
Для установления диагноза ДВС-синдрома могут применяться специализированные лабораторные тесты.
Специализированные тесты для ДВС-синдрома
Избыточная генерация тромбина
— Увеличение комплекса «тромбин — антитромбин».
— Увеличение фибринопептидов.
— Увеличение фрагментов протромбина 1 и 2.
Снижение протеинов С и S, антитромбина III. Повышенный фибринолиз
— Увеличение плазмина.
— Снижение уровня плазминогена.
— Снижение α2-антиплазмина.
— Увеличение комплекса «плазмин — антиплазмин».
— Высокие уровни ингибиторов активатора плазминогена.
Новые маркеры (тромбоз-воспаление)
— Повышенный растворимый тромбомодулин.
— Увеличение количества гистонов и внеклеточной ДНК.
— Повышение групп белков высокой мобильности-1.
— Активация нейтрофилов.
— Снижение ADAMTS-13 (a disintegrin and metalloprotei-nase with a thrombospondin type 1 motif, member 13).
— Маркеры комплемента (С3, комплекс мембранной атаки и маннозосвязывающий лектин).
— Пресепсин (растворимый кластер дифференцировки, субтип 14).
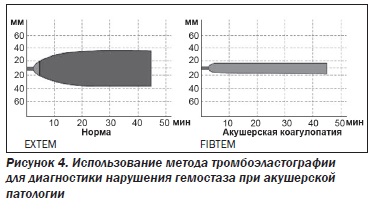
4. Тромбоэластография
Тромбоэластография представляет собой интегральный метод оценки системы гемостаза с использованием анализа вязкоэластических свойств сгустка. Одновременная диагностика коагуляционного каскада, активности фибринолиза и тромбоцитарного звена может обнаружить расстройства системы гемостаза в течение 10–20 мин (рис. 4). Для этих целей широкое применение в мире нашли анализаторы TEG (Haemoscope Corporation, США) и ROTEM (Tem GmbH, Германия).
Шкалы для диагностики ДВС-синдрома
Раннее и точное распознавание ДВС-синдрома является отличительной чертой успеха в лечении этого осложнения. К сожалению, в большинстве случаев диагноз «ДВС-синдром» основывается на клинической оценке пациента. Следует отметить, что не существует ни одного лабораторного или клинического теста, который был бы чувствительным и специфичным для диагностики ДВС. По этим причинам, а также в связи с необходимостью предоставить врачу-клиницисту данные по раннему выявлению ДВС были предприняты усилия для создания скрининг-систем, построенных на идентификации пациентов с высоким риском этого опасного осложнения.
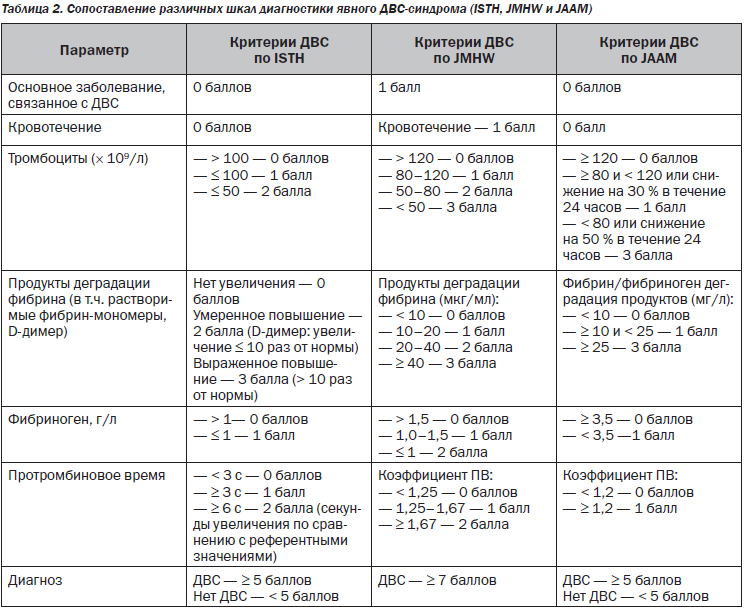
У пациентов с подозрением на ДВС-синдром предлагается использовать для постановки диагноза следующие шкалы: ISTH (International Society on Thrombosis and Hemostasis), JMHW (Japanese Ministry of Health and Welfare), JAAM (Japanese Association for Acute Medicine) (табл. 2) [29–32].
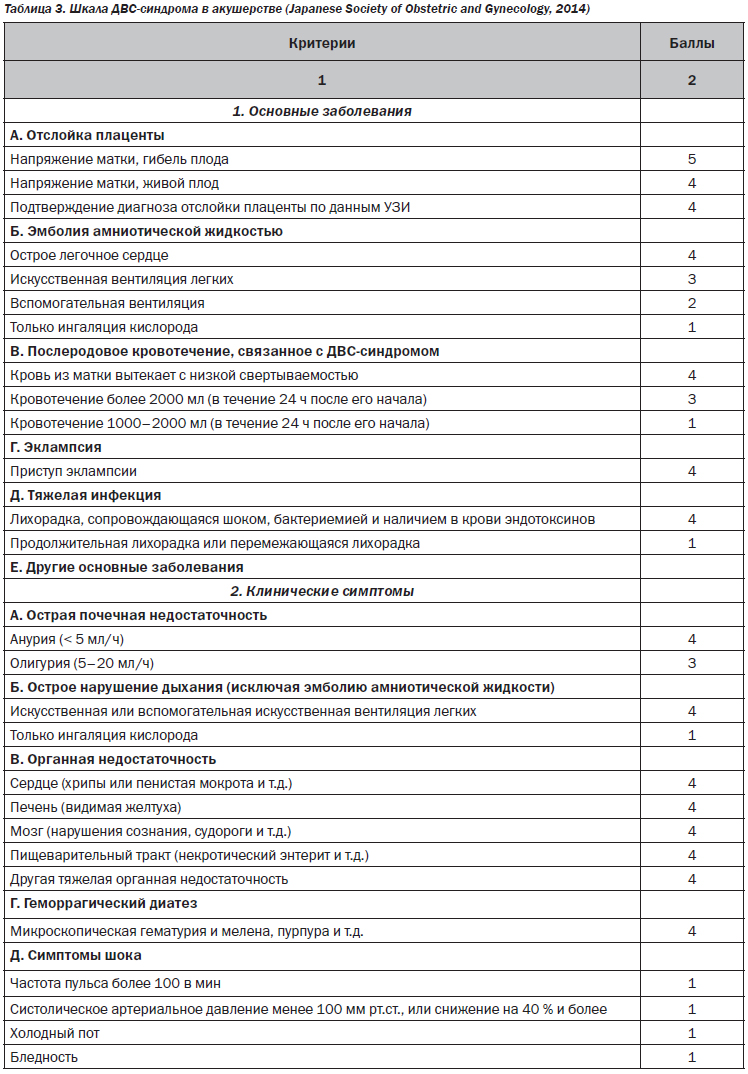
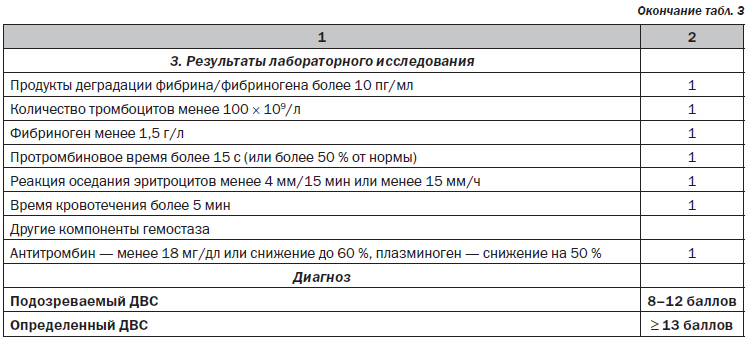
Общепринятые шкалы диагностики ДВС-синдрома по ISTH, JMHW, JAAM не всегда могут учитывать особенности физиологии гемостаза при беременности (увеличение ПДФ, фибриногена) и особенности критических состояний в акушерстве. Для диагностики ДВС-синдрома в акушерстве целесообразно использовать шкалу Japanese Society of Obstetric and Gynecology, 2014 [33] (табл. 3),
которая учитывает особенности основного заболевания, клинических симптомов, органной недостаточности и лабораторных исследований. Эта шкала объединяет клинические ситуации с пре-обладанием кровотечения и ситуации с преобладанием микротромбоза и органной недостаточности. Несмотря на некоторую ограниченность, характерную для всех шкал, именно подобный комплексный подход должен использоваться врачом акушером-гинекологом и врачом анестезиологом-реаниматологом для диагностики ДВС-синдрома и выбора лечебной тактики: применение заместительной терапии компонентами крови или физиологическими антикоагулянтами.
Заключение
ДВС-синдром связан с акушерской патологией и представляет собой опасную для жизни ситуацию. Понимание механизмов развития и быстрая информативная диагностика этого заболевания, а также своевременное лечение способствуют благоприятному исходу. Лабораторные тесты являются очень важными компонентами диагностического процесса, однако ни один из них, доступный в настоящее время, окончательно не способен диагностировать ДВС. Для диагностики ДВС-синдрома в акушерстве рекомендуется использовать пять основных тестов — на определение количества тромбоцитов, фибриногена, продуктов деградации фибрина/фибриногена, протромбинового времени, D-димера, а также современные тесты — на наличие воспалительных маркеров и метод тромбоэластографии. Для повышения диагностической значимости при установлении диагноза ДВС-синдрома, связанного с акушерской патологией, применяют международные шкалы для подсчета баллов.
Список литературы
1. Williams J., Mozurkewich E., Chilimigras J., Van De Ven C. Critical care in obstetrics: pregnancy-specific conditions // Best Pract. Res.: Clin. Obstet. Gynaecol. — 2008. — 22(5). — 825-46.
2. DeLee J.B. A case of fatal hemorrhagic diathesis, with premature detachment of the placenta // Am. J. Obstet., Dis. Women, Child. — 1901. — 44. — 785-92.
3. McKay D.G. Disseminated Intravascular Coagulation. An Intermediary Mechanism of Disease. — New York: Harper & Row, 1965.
4. Rattray D.D., O’Connell C.M., Baskett T.F. Acute disseminated intravascular coagulation in obstetrics: a tertiary centre population review (1980 to 2009) // J. Obstet. Gynaecol. Can. — 2012. — 34. — 341-347.
5. Erez O., Novack L., Beer-Weisel R. et al. DIC score in pregnant women — a population based modification of the International Society on Thrombosis and Hemostasis score // PLoS One. — 2014. — 9. — 93240.
6. Hoffman M., Monroe D.M. Coagulation 2006: a modern view of hemostasis // Hematol. Oncol. Clin. North Am. — 2007. — 21. — 1-11.
7. Medved L., Nieuwenhuizen W. Molecular mechanisms of initiation of fibrinolysis by fibrin // Thromb. Haemost. — 2003. — 89. — 409-19.
8. Bajzar L., Morser J., Nesheim M. TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex // J. Biol. Chem. — 1996. — 271. — 16603-8.
9. Rosing J., van Rijn J.L., Bevers E.M. et al. The role of activated human platelets in prothrombin and factor X activation // Blood. — 1985. — 65. — 319-32.
10. Moyer M.P., Tracy R.P., Tracy P.B. et al. Plasma lipoproteins support prothrombinase and other procoagulant enzymatic complexes // Arterioscler., Thromb., Vasc. Biol. — 1998. — 18. — 458-65.
11. Bretelle F., Sabatier F., Desprez D. et al. Circulating microparticles: a marker of procoagulant state in normal pregnancy and pregnancy complicated by preeclampsia or intrauterine growth restriction // Thromb. Haemost. — 2003. — 89. — 486-92.
12. Dennis M.W., Downey C., Brufatto N. et al. Prothrombinase enhancement through quantitative and qualitative changes affecting very low density lipoprotein in complex with C-reactive protein // Thromb. Haemost. — 2004. — 9. — 522-30.
13. Griffin J.H., Kojima K., Banka C.L. et al. High-density lipoprotein enhancement of anticoagulant activities of plasma protein S and activated protein C // J. Clin. Invest. — 1999. — 103. — 219-27.
14. Sattar N., Bendomir A., Berry C. et al. Lipoprotein subfraction concentrations in preeclampsia: pathogenic parallels to atherosclerosis // Obstet. Gynecol. — 1997. — 89. — 403-8.
15. Aharon A., Brenner B., Katz T. et al. Tissue factor and tissue factor pathway inhibitor levels in trophoblast cells: implications for placental hemostasis // Thromb. Haemost. — 2004. — 92. — 776-86.
16. Oyelese Y., Ananth C.V. Placental abruption // Obstet. Gynecol. — 2006. — 108. — 1005-16.
17. Pedersen B., Holscher T., Sato Y. et al. A balance between tissue factor and tissue factor pathway inhibitor is required for embryonic development and hemostasis in adult mice // Blood. — 2005. — 105. — 2777-82.
18. Brenner B. Haemostatic changes in pregnancy // Thromb. Res. — 2004. — 114. — 409-14.
19. Boffa M.C., Valsecchi L., Fausto A. et al. Predictive value of plasma thrombomodulin in preeclampsia and gestational hypertension // Thromb. Haemost. — 1998. — 79. — 1092-5.
20. Isermann B., Sood R., Pawlinski R. et al. The thrombomodulin — protein C system is essential for the maintenance of pregnancy // Nat. Med. — 2003. — 9. — 331-7.
21. Clark P., Brennand J., Conkie J.A. et al. Activated protein C sensitivity, protein C, protein S and coagulation in normal pregnancy // Thromb. Haemost. — 1998. — 79. — 1166-70.
22. Bremme K., Ostlund E., Almqvist I. et al. Enhanced thrombin generation and fibrinolytic activity in normal pregnancy and the puerperium // Obstet. Gynecol. — 1992. — 80. — 132-7.
23. Cerneca F., Ricci G., Simeone R. et al. Coagulation and fibrinolysis changes in normal regnancy // Eur. J. Obstet. Gynecol. Reprod Biol. — 1997. — 73. — 31-6.
24. Robb A.O., Mills N.L., Din J.N. et al. Acute endothelial tissue plasminogen activator release in pregnancy // J. Thromb. Haemost. — 2009. — 7. — 138-42.
25. Das M., Xu B., Lin L. et al. Phosphatidylserine efflux and intercellular fusion in a BeWo model of human villous cytotrophoblast // Placenta. — 2004. — 25. — 96-407.
26. Levi M. Pathogenesis and management of peripartum coagulopathic calamities (disseminated intravascular coagulation and amniotic fluid embolism) // Thromb. Res. — 2013. — 131(Suppl. 1). — 32-4.
27. Levi M., van der Poll T. Inflammation and coagulation // Crit. Care Med. — 2010. — 38. — 26-34.
28. Sacks G.P., Studena K., Sargent K., Redman C.W. Normal pregnancy and preeclampsia both produce inflammatory changes in peripheral blood leukocytes akin to those of sepsis // Am. J. Obstet. Gynecol. — 1998. — 179. — 80-6.
29. Bakhtiari K., Meijers J.C.M., de Jonge E., Levi M. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation // Crit. Care Med. — 2004. — 32. — 2416-21.
30. Yanada M., Matsushita T., Suzuki M., Kiyoi H., Yamamoto K., Kinoshita T. et al. Disseminated intravascular coagulation in acute leukemia: clinical and laboratory features at presentation // Eur. J. Haematol. — 2006. — 77. — 282-7.
31. Gando S., Iba T., Eguchi Y., Ohtomo Y., Okamoto K., Koseki K. et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: Comparing current criteria // Crit. Care Med. — 2006. — 34. — 625-31.
32. Sawamura A., Hayakawa M., Gando S., Kubota N., Sugano M., Wada T. et al. Application of the Japanese Association for Acute Medicine disseminated intravascular coagulation diagnostic criteria for patients at an early phase of trauma // Thromb. Res. — 2009. — 124. — 706-10.
33. Minakami H., Maeda Т., Fujii T. et al. Guidelines for obstertical practice in Japan: Japan Society of Obstertics and Gynecology (JSOG) and Japan Association of Obstetricians and Gynecologists (JAOG) 2014 edition // J. Obstet. Gynaecol. Res. — 2014 Jun. — 40(6). — 1469-99.