Используемые в клинической практике плазмозамещающие растворы не компенсируют одну из основных функций крови — газотранспортную. В связи с этим во второй половине ХХ века начались активные поиски кровезаменителей — переносчиков кислорода. Необходимость их разработки и клинического применения в разных странах была вызвана неуклонно увеличивающейся из года в год, особенно при чрезвычайных ситуациях, потребностью в донорской крови, возможностями ее заготовки, которые с каждым годом существенно уменьшаются, а также ограничением сроков хранения донорской крови. По данным Министерства здравоохранения (МЗ) Украины, с 1991 до 2005 г. число доноров в нашей стране снизилось на 53,8 %, составляя лишь 1,6 % от численности населения (при 4–6 % в развитых странах).
Высока опасность посттрансфузионных осложнений из-за несовместимости крови реципиента и донора, риска передачи с кровью донора всевозрастающего числа различных вирусных и инфекционных осложнений. Нельзя не упомянуть и об отказе ряда больных от ее переливания по религиозным и иным соображениям.
Разработка искусственных заменителей крови с газотранспортной функцией базируется на целом ряде принципиальных преимуществ перед донорской кровью, таких как:
— универсальность;
— отсутствие необходимости в изосерологическом подборе;
— инфекционная безопасность;
— отсутствие риска иммунологического конфликта;
— длительные сроки годности;
— способность длительное время циркулировать в кровеносном русле реципиента с сохранением газотранспортной функции;
— возможность в случае необходимости увеличения их промышленного производства и накопления в больших количествах [1, 2].
Исследования по созданию искусственных кровезаменителей с газотранспортной функцией велись и ведутся в нескольких направлениях:
— на основе хелатных соединений, в т.ч. металлопроизводных хлорофилла, как переносчиков кислорода;
— модифицированного гемоглобина;
— перфторорганических соединений (перфтор–углеродов);
— использования молекулярно-биологических и клеточных технологий;
— нанотехнологического создания искусственных эритроцитов [4–7].
Первое направление исследований, которое имеет большое историческое значение, охватывало поисковые работы по изучению возможности использования хелатных соединений как переносчиков кислорода. В результате этих исследований были синтезированы: кобальтгистидин, кобальт-бис-салицил-альдегид-диимин, ацетат железа индиго, хелат фталоцианина марганца. Однако если в неводных средах возможно многократное обратимое присоединение кислорода к этим соединениям, то в водных средах после 1–3 циклов присоединения и отдачи кислорода они необратимо окисляются, что не позволяет их использовать в живом организме. В связи с этим развитие данного направления создания газотранспортных кровезаменителей на основе хелатных соединений было приостановлено.
Кровезаменители на основе модифицированного гемоглобина. Первые попытки использования свободного гемоглобина (гемолизированных эритроцитов) были предприняты еще в 1768 г., однако в результате было выявлено развитие диссеминированного внутрисосудистого свертывания и сердечно-сосудистой недостаточности. В 1933 г. на страницах журнала «Science» W.R. Amberson и соавт. сообщили об опыте клинического использования раствора гемоглобина, при этом авторы описали побочные эффекты в виде развития гипертензии и острой почечной недостаточности [8].
Позже, в 1949 г., W.R. Amberson и соавт. опубликовали статью об успешном использовании раствора гемоглобина. Так, авторы вводили небольшие объемы раствора гемоглобина 14 молодым акушерским пациенткам с геморрагическим шоком и в результате получили эффект улучшения гемодинамики, восполнение дефицита объема циркулирующей крови, повышение кислородной емкости крови, а также стимуляцию гемопоэза. Но снова был зарегистрирован ряд побочных эффектов: вазоконстрикция, почечная недостаточность, абдоминальная боль [9].
В последующем в целом ряде работ было показано, что побочные эффекты, наблюдаемые после введения гемоглобина, были связаны с наличием фрагментов мембраны эритроцитов (стромы). Это привело к выводу, что использование чистых растворов гемоглобина, без липидного загрязнения, может быть безопасным.
Вместе с тем отделенный от стромальной оболочки эритроцита гемоглобин не может использоваться в качестве кровезаменителя, поскольку вне эритроцита тетрамерная молекула гемоглобина в сосудистом русле распадается на две субъединицы — αβ-димеры, которые обладают нефротоксичными свойствами. В монографии Л.В. Усенко и Г.А. Шифрина (1995) описан гемодинамический эффект 0,5% раствора гемоглобина на растворе Рингера лактат в экспериментальном исследовании на собаках при возмещении кровопотери в объеме 22,6 мл/кг. Отмечались хорошая переносимость, гемодинамический эффект и отсутствие патологических изменений в почках при морфологическом их исследовании [2].
И все же внутривенное использование раствора очищенного свободного гемоглобина было малоэффективным из-за его быстрого (в течение 2–4 часов) выведения из сосудистого русла, при этом он имел в 2 раза меньшую эффективность переноса О2 вследствие высокого к нему сродства. В связи с этим для создания препаратов на основе гемоглобина путем его модификации необходимо было решить целый ряд проблем, таких как короткий период полураспада тетраметрической молекулы гемоглобина на димеры и мономеры и избыточное сродство к О2 вследствие отсутствия естественного аллостерического эффектора — 2,3-дифосфоглицерата, содержащегося в эритроцитах. При этом препарат должен обладать параметром Р50, который определяет сродство кислорода к гемоглобину и представляет собой парциальное давление О2, при котором 50 % молекул гемоглобина образуют соединение оксигемоглобин (т.е. насыщение гемоглобина кислородом составляет 50 %). В норме показатель Р50 составляет около 26–27 мм рт.ст.
Необходимо отметить, что препараты гемоглобина не должны обладать антигенными свойствами. При этом интересно, что гемоглобин сам по себе ими не обладает, однако его полимеризованные формы вызывают выработку антител пропорционально степени полимеризации. Препараты на основе модифицированного гемоглобина должны достаточно долго оставаться в системной циркуляции и не элиминироваться путями, присущими элиминации свободного гемоглобина. Целый ряд физико-химических свойств данных препаратов (онкотичность, осмотичность, вязкость, реология) не должны существенно отличаться от таковых у нативной крови.
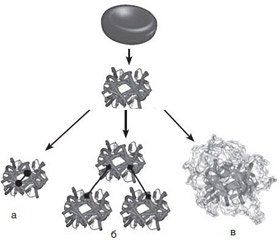
В целом модификацию молекулы гемоглобина можно достигнуть несколькими путями (рис. 1):
а) образованием внутримолекулярных поперечных связей. Дело в том, что, несмотря на стабильность α- и β-димеров молекулы гемоглобина, они быстро фильтруются почками. Для предотвращения диссоциации тетрамера гемоглобина обеспечивают поперечную связку α- или и β-субъединиц между собой. Указанная модификация молекулы гемоглобина, сохраняя время нахождения в сосудистом русле, снижает его аффинность к кислороду;
б) полимеризацией — соединением множества молекул олигомера гемоглобина посредством диальдегидов, таким образом увеличивая молекулярную массу образующейся молекулы до 500 кДа (у нативной молекулы гемоглобина масса не превышает 64,5 кДа), что предотвращает ее экскрецию почками;
в) конъюгацией — объединением молекулы гемоглобина ковалентными связями с биологическими полимерами, подобными полисахариду, таким образом предотвращая почечную экскрецию;
г) инкапсуляцией — включением гемоглобина в клеточноподобные структуры — липидные везикулы, капсулы [10].
В целом выделяют следующие виды кровезаменителей с газотранспортной функцией на основе модифицированного гемоглобина (НВОС — Hemoglobin-Based Oxygen Carriers) [11–14]:
1. Гемоглобин, поперечно связанный диаспирином — HemAssist (Baxter, Deerfield, США), модификация достигнута поперечным связыванием α-цепей с помощью диаспирина. В связи с увеличением летальности при использовании данной группы препаратов модифицированного гемоглобина разработки гемоглобина, поперечно связанного диаспирином, прекращены.
2. Полимеризированный человеческий гемоглобин — PolyHeme (Northfield Laboratories, Evanston, США), пиридоксал гемоглобин — получают из донорских эритроцитов с истекшим сроком хранения. Полимеризация гемоглобина достигается при помощи глутаральдегида. Период полужизни PolyHeme составляет 24 часа, молекулярная масса — > 126 кД, Р50 — 28–30 мм рт.ст. Третья стадия клинических испытаний продемонстрировала увеличение уровня летальности при его использовании.
3. Полимеризированный коровий гемоглобин — Hemopure, HBOC-201 (ОРК Biotech, Cambridge, США, Россия), препарат на основе коровьего гемоглобина, полимеризированного глутаральдегидом. Это один из двух препаратов группы кровезаменителей HBOC (второй — это российский препарат геленпол, который в настоящее время не зарегистрирован), который допущен к клиническому применению у людей, и единственный препарат с доказанной эффективностью и безопасностью. Так, с 2001 г. Hemopure используется в клинической практике в ряде стран Южной Африки у взрослых хирургических пациентов с острой кровопотерей, а также у пациентов, у которых невозможна либо ограниченно возможна трансфузия донорской крови. Активное внедрение данного препарата в клиническую практику данных стран было обусловлено прежде всего эпидемией ВИЧ-инфекции в южноафриканских странах и, соответственно, высоким риском инфицирования в случае использования донорской крови [15]. В 2002 г. после рассмотрения результатов клинических испытаний препарата Hemopure FDA предложило компании Biopure провести дополнительные исследования его эффективности и безопасности, однако в августе 2009 г. был получен окончательный отказ на проведение дальнейших испытаний препарата, а фирма Biopure, понесшая значительные финансовые потери, заявила о банкротстве и была приобретена российской компанией ОРК Biotech, которая зарегистрировала в 2011 г. препарат в России, и было получено разрешение на его клиническое применение под названием «гемопюр» [16]. Однако, по сообщениям СМИ, в 2015 г. данный препарат был снят с фармрынка России [17].
Период полужизни Hemopure составляет 20–23 часа, молекулярная масса — 130–500 кД, Р50 — 34 мм рт.ст. При его введении отмечается повышение содержания в сыворотке уровня железа, ферритина и эритропоэтина прямо пропорционально уровню концентрации препарата в плазме крови как у мужчин, так и у женщин. При этом свободный гемоглобин в моче не обнаруживался [18].
Выявленные побочные эффекты препарата представлены в виде развития вазоконстрикции и повышения уровня амилазы и липазы крови.
Аналогичный препарат, который получил название Oxyglobin или HBOC-301, представляет собой единственный кровезаменитель с газотранспортной функцией на основе модифицированного гемоглобина, который разрешен FDA в США и Европейской комиссией в странах Евросоюза для использования в ветеринарной практике [19, 20].
4. Гемоглобин рафимер — Hemolink (Hemosol Research Corporation, Mississauga, Канада), в данном препарате β-цепи гемоглобина поперечно связаны О-раффинозой, а также соединяются поверхностные аминокислоты, обусловливая полимеризацию гемоглобина. Выявлена его кардиотоксичность [10].
5. Гемоглобин, модифицированный малеимидактивированным полиэтиленгликолем — Hemospan, MP4OX (Sangart Inc., San Diego, США), подоб–ная модификация гемоглобина позволяет укрупнить молекулу гемоглобина. Период полужизни Hemospan составляет 18 часов, молекулярная масса — 90 кД, Р50 — 5–6 мм рт.ст. Данная группа препаратов вызывает минимальную вазоконстрикцию, но сопровождается артериальной гипертензией. Проводится ряд клинических испытаний [21, 22].
6. Технология инкапсуляции путем включения молекулы гемоглобина в липидные везикулы при помощи раствора фосфолипидов с формированием липосом — псевдоэритроцитов, а также с использованием нанотехнологий для формирования нанокапсул [10, 23].
7. Рекомбинантные гемоглобины — продуцируемые после введения вектора методами генной инженерии, клетками кишечной палочки или дрожжей [24].
8. На основе гемоглобина беспозвоночных — HEMOXYcarrier, Hemarina-M101, был разработан французскими исследователями на основе естественного высокомолекулярного (3600 кД) внеклеточного гемоглобина морских беспозвоночных — полихет (Рolychaete annelid). Были продемонстрированы антиоксидантная активность и высокая аффинность к кислороду. В настоящее время продолжаются экспериментальные исследования [25].
Необходимо подчеркнуть, что в СССР разработкой кровезаменителей на основе модифицированного гемоглобина с начала 1970-х годов занимается Ленинградский институт переливания крови. Уже в 1972 г. появилось сообщение С.Ф. Малахова и А.Л. Костюченко [26] о первом опыте клинического применения у 17 пациентов гемоглобинсодержащего раствора эригем в первые сутки после оперативных вмешательств на легких. Эригем производился в лиофилизированном виде, перед введением разводился раствором Рингера и вводился пациентам в дозе, содержащей около 30 г гемоглобина. В последующем был создан кровезаменитель геленпол на основе полимеризованного гемоглобина крови человека (получаемого из эритроцитов донорской крови), который также представляет собой лиофильно высушенное полимерное производное гемоглобина крови человека. Препарат геленпол вначале был разрешен к клиническому применению в Российской Федерации, но затем снят с производства [17].
Геленпол имеет следующие физико-химические характеристики: Р50 — 26–28 мм рт.ст. при tо –37 оС; рН 6,5–7,5; средняя молекулярная масса — 120–160 кД; содержание метформы гемоглобина — до 3 %; время полувыведения — 12–18 ч; срок хранения — 2 года при tо +4 оС без потери функциональной активности. Содержимое флакона растворяют непосредственно перед применением в 400 мл 0,9% раствора натрия хлорида или 5% глюкозы, при этом раствор имеет красно-вишневый цвет. Вводят геленпол в дозе 400–2400 мл. Специфические групповые свойства крови у геленпола отсутствуют, поэтому при его инфузии не требуется предварительного определения групповой совместимости с кровью больного. Е.А. Селиванов и соавт. при использовании геленпола при острой кровопотере и тяжелых формах гипоксии выявили побочные эффекты в виде развития общей и легочной гипертензии, эзофагального спазма, повышения вязкости крови, временного снижения сердечного выброса [27, 28].
Вместе с тем необходимо отметить, что количество публикаций о клиническом применении геленпола очень незначительно, что не дает возможности сделать какие-либо выводы о его эффективности и безопасности.
На рис. 2 показаны оптимальные размеры частиц существующих в настоящее время препаратов на основе модифицированного гемоглобина.
Одним из интересных эффектов, наблюдающихся при внутривенном введении препаратов модифицированного гемоглобина с поперечной связью либо полимеризованных, является развитие вазоконстрикции со значительным увеличением среднего артериального давления, сохраняющегося в течение нескольких часов.
Данный эффект объясняют связыванием оксида азота, высвобождением эндотелина и сенситизацией α-адренорецепторов. Как показал целый ряд исследований, препараты на основе гемоглобина, связывая NO, могут нарушать региональную ауторегуляцию кровотока в большинстве систем органов, обусловливая развитие вазоконстрикции и гипоперфузии.
При этом связывание NO также приводит к образованию различных нитросоединений и метгемоглобина [10, 29, 30]. В проведенном метаанализе было показано повышение риска развития инфаркта миокарда и смерти при использовании препаратов свободного гемоглобина. Это, по-видимому, обусловлено связыванием NO, являющегося естественным ингибитором тромбоцитарной агрегации и адгезии, что, в свою очередь, может приводить к гиперкоагуляции и способствовать формированию тромбов [31]. С другой стороны, указанный эффект препаратов на основе гемоглобина обеспечивает высокий гемостатический эффект, что важно в случае кровотечения. Также выделяют гастроинтестинальные побочные эффекты: тошноту, рвоту, диарею.
В целом гемоглобиновые кровезаменители, полученные с использованием диаспирина (DCLHb) либо полимеризованные глутаральдегидом или пиридоксальфосфатом (HBOC-201; PolyHeme), относят к первому поколению. Малеимидполиэтиленгликоль — конъюгированный гемоглобин (MP4 — Hemospan), который относится ко второму поколению. Сравнительные характеристики обоих поколений препаратов модифицированного гемоглобина представлены в табл. 1.
Необходимо отметить, что уже более 50 лет продолжаются попытки создания кровезаменителя на основе гемоглобина, но вот что писал профессор Г.Р. Иваницкий: «Уже много раз казалось, что вот-вот будет создан газотранспортный гемоглобиновый кровезаменитель, но возникали новые проблемы, которые отбрасывали исследователей на исходные позиции» [1].
Ощущаются миллионы лет эволюции живой природы, создавшей, на первый взгляд, достаточно простую молекулу гемоглобина и структурно бесхитростную эритроцитарную клетку, аналогов которым человечеству пока не удается создать.
Кровезаменители на основе перфторуглеродов. Более перспективными для клинической практики среди искусственных кровезаменителей с функцией переноса кислорода оказались перфторорганические (перфторуглеродные) соединения [1, 33]. Необходимо отметить, что сам по себе фтор представляет собой самый реакционноспособный неметалл, который реагирует со всеми элементами, кроме инертных газов. Взаимодействие фтора со многими веществами переходит в горение и взрыв, приводя к разрушению многих материалов, в связи с чем в 1810 г. А. Ампер и назвал его фтором: от греческого рhthoros — «разрушение», «порча» или «вред».
Ввиду вышесказанного удивительным является аномальная химическая инертность перфторорганических соединений (ПФОС). Химическая инертность ПФОС и их аномально высокая способность растворять значительные количества газов определили их роль в качестве уникальных переносчиков кислорода и углекислоты. Представляя собой органические соединения, у которых все атомы водорода замещены атомами фтора, перфторуглероды обеспечивают физическое, а не химическое, как в молекуле гемоглобина, растворение газов благодаря тому, что они представляют собой жидкости со свойствами, близкими к свойствам газов, поскольку в ПФОС межмолекулярные взаимодействия так же слабы, как и в газах [34]. Причем растворимость кислорода в ПФОС при постоянной температуре повышается прямо пропорционально давлению этого газа над раствором (закон Генри).
Первые попытки использования этого свойства ПФОС в медицинской практике были предприняты в середине 1960-х гг. S.A. Howlett и соавт., L.C. Clark и F. Gollan, которые применили перфторбутилтетрагидрофуран для оксигенирования и перфузии изолированных органов животных. R.P. Geyer и соавт. (1968) осуществили полную замену крови крыс эмульсией перфтортрибутиламина, используя в качестве эмульгатора плюроник F-68 (сополимер полиоксиэтилена и полиоксипропилена). В результате животные жили на протяжении 5–6 часов в атмосфере 100% кислорода, сохраняя все жизненные функции. Смерть животных наступала вследствие повреждения легких. В 1975 г. те же авторы после полной замены циркулирующей крови на эмульсию ПФОС получили выживание всех животных, помещенных в условия смертельной концентрации угарного газа [35].
Таким образом, открытие перфторорганических соединений позволило подойти нетрадиционным путем к созданию газотранспортных сред, пригодных для медико-биологического применения. И уже в 1979 г. японской фирмой Green Cross Corporation был создан и выпущен первый кровезаменитель с газотранспортной функцией на основе ПФОС — Fluosol-DA, который начали широко применять в клиниках Японии. В этом же году препарат был впервые применен в США. К концу 1983 г. число пациентов, которым ввели кровезаменитель, превысило 500 человек [31]. В последующем в США был создан целый ряд препаратов на основе ПФОС — Oxygent, LiquiVent, Oxyfluor. Аналогичные разработки велись также в Китае, которые завершились созданием препарата Emulsion 11.
Параллельно проводились исследования ПФОС в Советском Союзе. Основателем советской школы фторорганической химии является И.Л. Кнунянц (1906–1990). Использование ПФОС в биологическом эксперименте, а затем и в клинике связано с именем яркого ученого и блестящего анестезиолога-реаниматолога Феликса Федоровича Белоярцева (1941–1985). Так, в 1975 г. в НИИ сердечно-сосудистой хирургии им. А.Н. Бакулева профессор Ф.Ф. Белоярцев впервые в стране выполнил работы по длительной внелегочной оксигенации с использованием фторуглеродных оксигенаторов и по замене газовой среды в легких на жидкий перфторуглерод (так называемая жидкостная вентиляция легких).
В 1979 г. Ф.Ф. Белоярцев перешел в Институт биофизики АН СССР, возглавляемый его бессменным директором, чл.-корр. РАН, профессором Г.Р. Иваницким. Ими была инициирована крупномасштабная отечественная научно-исследовательская программа «Перфторуглероды в биологии и медицине» (1980–1985 гг.), реализация которой привела к созданию препарата для клинического применения на основе эмульсии ПФОС — перфторана.
Препарат прошел трудный путь до начала своего применения в практической медицине. С 1996 г. МЗ РФ разрешил его промышленный выпуск и широкое клиническое использование. С 1999 г. он был допущен Государственным фармакологическим центром МЗ Украины для клинического применения в Украине.
В Украине приоритетные научные исследования использования перфторана при критических состояниях были выполнены группой ученых под руководством чл.-корр. НАН и НАМН Украины проф. Л.В. Усенко начиная с 1983 г. В эксперименте на животных (Клигуненко Е.Н., Доронин А.Г., Залевский В.С., Талдыкин П.И., Новиков А.И.) была обоснована целесообразность применения препарата при тяжелой черепно-мозговой травме и острой кровопотере.
На основании разрешения Фармкомитета СССР в 1985 г. была проведена II фаза клинических испытаний перфторана, в которой участвовала наша клиника. В дальнейшем уже в Украине наша клиника продолжила исследования перфторана при целом ряде критических состояний согласно научно-исследовательским работам МЗ Украины: «Разработка технологии использования негемоглобинового переносчика кислорода — перфторана — при критических состояниях в условиях эксперимента и клиники» (1993–1996 гг.), «Исследования эффективности и переносимости препарата «Перфторан» (1997 г.). В результате этих исследований были разработаны технологии применения перфторана у больных с тяжелой черепно-мозговой травмой, при кровопотере, остром инфаркте миокарда, постреанимационной болезни, ожоговом шоке.
В 1998 г. группа российских ученых была отмечена премией Правительства РФ в области науки и техники «За создание перфторуглеродных сред для управления жизнедеятельностью клеток, органов и организма», среди лауреатов отмечен вклад и украинских ученых (Усенко Л.В.). Знаком «Золотой перфторан» была отмечена проф. Е.Н. Клигуненко.
В 2001 г. Всемирная организация здравоохранения ввела перфторан в международную анатомо-клинико-химическую классификацию (АТС) в раздел «Кровезаменители и инфузионные растворы» под рубрикой ВО05А А03. Перфторан до сих пор остается единственным кровезаменителем с газотранспортной функцией, разрешенным к применению в широкой клинической практике.
Перфторан представляет собой 10% субмикронную перфторуглеродную эмульсию с функцией переноса кислорода. Основой газотранспорта в перфторане являются два перфторуглерода — перфтордекалин и перфторметилциклогексилпиперидин в соотношении 2 : 1. Проксанол, включенный в состав перфторана в качестве стабилизатора эмульсии ПФОС, в свою очередь, обладает рядом положительных биологических эффектов в виде улучшения микроциркуляции, увеличения текучести крови, за счет взаимодействия с гидрофобными участками мембраны белков обратимо угнетает кальциевый ток кардиомиоцитов, что предотвращает повреждение миокарда при критических состояниях [35].
Все вышеназванное обусловливает полифункциональное действие перфторана:
— увеличение кислородотранспортной функции крови;
— улучшение газообмена и метаболизма на уровне тканей;
— улучшение реологических свойств крови и микроциркуляции;
— восстановление центральной и периферической гемодинамики;
— кардио- и нейропротективный эффект, в том числе за счет стабилизации мембран;
— сорбционные и диуретические свойства;
— противоотечное действие;
— дозозависимое иммунопротективное действие;
— блокаду медленных кальциевых токов;
— антиаритмическое действие за счет активации энергетического обмена [36].
Необходимо отметить, что кислородная емкость перфторана по сравнению с гемоглобином эритроцитов значительно ниже, а его газотранспортные свойства, как показали многочисленные исследования, реализуются за счет следующих эффектов перфторана:
— на порядок более высокой скорости насыщения и отдачи кислорода, чем у гемоглобина, содержащегося в эритроцитах (так, у гемоглобина эта реакция при рН 6,8 и to 25 °C протекает за 200–250 мс, в то же время у ПФОС — всего за 14–26 мс);
— ускорения оксигенации и деоксигенации в смеси «кровь — эмульсия ПФОС»;
— огромной диффузионной поверхности субмикронных частиц эмульсии, участвующей в газообмене: так, суммарная поверхность газообмена у перфторана составляет 847 м2/100 мл по сравнению с 70 м2/100 мл у эритроцитов;
— эстафетного механизма передачи кислорода между эритроцитами и частицами эмульсии ПФОС, своеобразной роли демпфера в результате образования дополнительной емкости газов крови в плазме, создающего подпор для кислорода при его потреб–лении;
— из частичек ПФОС в кровотоке образуются каналы типа жемчужных нитей, проводимость кислорода по которым в 20–25 раз выше, чем по окружающей их плазме. ПФОС увеличивают резервные возможности транспорта газов кровью за счет дополнительного процесса облегченной диффузии или увеличения массопереноса кислорода на этапе «эритроциты — плазма — ткани» и углекислоты в противоположном направлении. Таким образом, обеспечивается формирование кислородотранс–портного конвейера, участниками которого являются частицы эмульсии ПФОС и эритроциты;
— субмикронный размер частиц эмульсии перфторана позволяет им проникать в те участки, куда не может проникать эритроцит, размеры которого в 70–100 раз больше. Это увеличивает полезную площадь капиллярного массопереноса и обеспечивает снабжение кислородом тканей с недостаточным кровообращением (рис. 3);
— за счет уменьшения вязкости крови и повышения деформируемости эритроцитов [36–44].
Вышеприведенное обусловливает увеличение массопереноса газов крови. Период полувыведения эмульсии перфторуглеродов из кровотока составляет 20–30 часов. Период полувыведения из кровотока поверхностно-активного вещества (ПАВ) проксанола-268 составляет около 6 часов. Он выводится в неизмененном виде в основном через легкие (93 %), малая часть — через кожу, из печени с желчью, около 1 % — при помощи экзоцитоза. Временно 20–30 % перфторуглеродов аккумулируются макрофагами. ПАВ выводится через почки.
К настоящему времени накоплен большой клинический опыт применения перфторана при острой кровопотере и геморрагическом шоке, черепно-мозговой травме, постреанимационной болезни, остром инфаркте миокарда, септическом шоке, острых отравлениях, жировой эмболии в качестве компонента кардиоплегии при кардиохирургических вмешательствах, сосудистой хирургии и трансплантологии [45–52].
В зависимости от вида и тяжести критического состояния определены оптимальные, минимально эффективные и предельно допустимые дозы препарата: минимально эффективная доза — 2–3 мл/кг массы тела; оптимальная доза — 5–7 мл/кг массы тела; предельно допустимая доза — 30 мл/кг массы тела.
Перфторан хранится в замороженном состоянии при t° от –4 до –18 °С в течение 3 лет. В размороженном виде при температуре +4 °С — в течение 2 недель. Допускается 3-кратная разморозка/заморозка препарата без существенного изменения среднего размера части эмульсии.
Накопленный опыт использования перфторана в комплексе интенсивной терапии различных критических состояний, освещенный в зарубежной и отечественной литературе, наш многолетний собственный опыт свидетельствуют о его высоком клиническом эффекте.
Перфторан имеет значимые преимущества по сравнению с донорской кровью при оказании ургентной и плановой помощи пациентам с редкими группами крови или в случаях сложностей при подборе донорской крови, при отказе от переливания крови по религиозным или иным соображениям, открывает новые возможности в самых различных областях хирургии, интенсивной терапии, а также в условиях военной медицины и медицины катастроф.
Молекулярно-биологические, клеточные и нанотехнологии. Наиболее перспективным на современном этапе направлением исследований по проблеме, касающейся искусственной крови, является использование методов клеточной и молекулярной биологии. Так, в США (Advanced Cell Technologies) в 2008 г. были получены полноценно функционирующие эритроциты из эмбриональных стволовых клеток [4]. Источниками стволовых клеток является перифeрическая кровь у взрослых, кордовая (пуповинная) кровь, плюрипотентные клетки, которые могут быть использованы в качестве предшественников для культивирования in vitro дифференцирующихся в функционально активные эритроциты [53]. Так, французскими исследователями из Университета Пьера и Марии Кюри (Macropharma) была доказана возможность трансфузии эритроцитов, выращенных из стволовых клеток in vitro. Авторам удалось дифференцировать стволовые клетки CD34+ человека-донора в эритроциты, после чего были получены миллиарды однородных эритроцитов. Были продемонстрированы нормальные параметры деформируемости полученных эритроцитов, аффинитета гемоглобина и антигенной экспрессии. Данные эритроциты, введенные в кровеносное русло лицу, которое являлось донором стволовых клеток, сохраняли свою жизнеспособность и газотранспортные свойства (94–99 % в течение первых 5 суток и 41–63 % на 26-е сутки), что является близким к периоду полужизни трансфузированных нативных эритроцитов. Проводится целый ряд исследований в данном направлении в различных научных центрах [53].
В Японии разрабатывается искусственная кровь, которая в отличие от аллогенной крови не имеет групповой и резус-принадлежности и исключает риск инфицирования вирусами. Вместо гемоглобина был использован модифицированный альбумин, при этом с целью придания ему свойств, обеспечивающих транспорт кислорода, к нему был присо–единен гем — железосодержащий фрагмент гемоглобина. Препарат получил название «гемальбумин». Данный препарат имеет длительный срок хранения [5].
Наиболее футуристичным подходом является использование нанотехнологий, и в частности разработка молекулярных газотранспортных устройств — так называемых респироцитов (рис. 4). Респироциты представляют собой роторы, каждый из которых имеет участок связывания в виде карманов, который по окружности попеременно контактирует с плазмой крови и внутренней камерой при вращении диска, селективно связывая определенные молекулы при контакте с плазмой. После того как сайт связывания вращается, связанные молекулы принудительно выбрасываются наружу, и таким образом предполагается реализация газообмена. При этом роторы должны быть полностью обратимыми, чтобы они могли быть использованы для связывания либо отдачи газа в зависимости от направления вращения ротора. Предполагается, что данные наноустройства после достижения терапевтических целей должны быть извлечены из системного кровотока [7].
/16-1.jpg)
Указанные наномедицинские устройства, которые функционируют в качестве искусственных эритроцитов, выполняя газотранспортные функции, могут доставить в 236 раз больше кислорода к тканям в единице объема, чем нативные эритроциты, а также имеют аналогичное преимущество в транспорте углекислоты. Предполагается, что респироцит должен быть изготовлен из алмазоподобного материала, использовать различные химические и тепловые датчики давления, при этом он сможет функционировать практически бесконечно в отличие от эритроцитов, имеющих естественную продолжительность жизни в пределах 4 месяцев [7]. Данные нанотехнологии в будущем смогут решить целый ряд проблем в лечении критических состояний.
Современное состояние проблемы создания и исследования кровезаменителей с газотранспортной функцией позволяет сделать заключение о том, что в настоящее время данная группа препаратов так и остается до сих пор не реализованным потенциалом, поскольку они не являются в буквальном смысле слова кровезаменителями. Существующие единичные препараты с газотранспортной функцией, которые были допущены к клиническому использованию, не способны полностью заменить функцию крови и не позволяют отказаться от донорских эритроцитов, однако при этом они позволяют выиграть драгоценное время, внося решающий вклад в дело спасения пациентов в критических состояниях, и побуждать к дальнейшей разработке более современных кровезаменителей.
По нашему глубокому убеждению, данные инфузионные среды, моделирующие самую главную — кислородно-транспортную функцию крови, в будущем займут достойное место среди различных методов, альтернативных применению донорской крови.
Список литературы
1. Иваницкий Г.Р. Донорская кровь и ее альтернативы // Перфторорганические соединения в биологии и медицине. — Пущино, 1999. — С. 5-20.
2. Усенко Л.В., Шифрин Г.А. Интенсивная терапия при кровопотере. — 2-е изд., исправ. и доп. — К.: Здоров’я, 1995. — 235 с.
3. Софронов Г.А., Селиванов Е.А., Ханевич М.Д. Стратегия поиска искусственных заменителей крови // Физиологически активные вещества на основе перфторуглеродов в экспериментальной и клинической медицине. — СПб., 1999. — С. 78-85.
4. Lu S.J., Feng Q., Park J.S., Vida L., Lee B.-S., Strausbauch M., Wettstein P.J., Honig G.R., Lanza R. Biologic pro–perties and enucleation of red blood cells from human embryonic stem cells // Вlood. — 2008. — Vol. 112. — P. 4475-4484. doi: 10.1182/blood-2008-05-157198.
5. Mozzarelli A., Bettati S. (еds.) Chemistry and Biochemistry of Oxygen Therapeutics: From Transfusion to Artificial Blood. — Wiley, 2011. — 466 p.
6. Azuma H., Fujihara M., Sakai H. Biocompatibility of HbV: Liposome — encapsulated hemoglobin molecules — liposome effects on immune function // J. Funct. Biomater. — 2017. — Vol. 8, № 24. — Р. 1-8. doi: 10.3390/jfb8030024.
7. Freitas R.A. Exploratory Design in Medical Nanotechnology: A Mechanical Artificial Red Cell // Artificial Cells, Blood Substitutes, and Immobil. Biotech. — 1998. — Vol. 26. — P. 411-430.
8. Mulder A.G., Steggerda F.R. Mammalian life without red blood corpuscles // Science. — 1933. — Vol. 78. — P. 106-107.
9. Amberson W.R., Jennings J.J., Rhode C.M. Clinical experience with haemoglobin — saline solution // J. Appl. Physiol. — 1949. — Vol. 1. — P. 469-489.
10. Шевченко Н.В., Худяков С.Н., Зырянов А.А., Пыренков Д.А. Характеристика переносчиков кислорода в современных заменителях крови // Казанский медицинский журнал. — 2012. — № 2. — С. 398-400.
11. Winslow R.M. Current status of oxygen carriers (‘blood substitutes’): 2006 // Vox Sang. — 2006. — Vol. 91, № 2. — Р. 102-10.
12. Mozzarelli A., Ronda L., Faggiano S. et al. Haemoglobin-based oxygen carriers: research and reality towards an alternative to blood transfusions // Blood Transfus. — 2010. — Vol. 8(Suppl. 3). — P. 59-68. doi: 10.2450/2010.010S; doi: 10.2450/2010.010S.
13. Toma V.A., Farcaș A.D, Roman I., Sevastre B., Hathazi D., Scurtu F., Damian G., Silaghi-Dumitrescu R. Comparative in vivo еffects of Hemoglobin-Based Oxygen Carriers (HBOC) with va–rying prooxidant and physiological reactivity // PLOS ONE. — 2016, April 20. — P. 1-16. doi: 10.1371/journal.pone.0153909.
14. Van Hemelrijck J., Levien L.J., Veeckman L., Pitman A., Zafirelis Z., Standl T. A safety and efficacy evaluation of hemoglobin-based oxygen carrier HBOC-201 in a randomized, multicenter red blood cell controlled trial in noncardiac surgery patients // Anesth. Analg. — 2014. — Vol. 119(4). — Р. 766-776. doi: 10.1213/ANE.0000000000000305.
15. Jahr J.S., Moallempour M., Lim J.C. HBOC-201, hemoglobin glutamer-250 (bovine), Hemopure (Biopure Corporation) // Expert Opin. Biol. Ther. — 2008. — Vol. 8. — Р. 1425-1433.
16. Жибурт Е.Б., Шестаков Е.А. Гемопюр — кровезаменитель на основе гемоглобина // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. — 2012. — Т. 7, № 2. — С. 74-81.
17. Советский кровезаменитель вновь начнут производить в России. Режим доступа: https://vademec.ru/article/golubuyu krov kotoruyu planiruetsya ispolzovat pri perеsadke golovy-nachnut proizvodit v rossii 16 Мая 2016.
18. Hughes G.S., Francome S.F., Antal E.J. et al. Hemoglobin effects et a novel hemoglobin-based oxygen carrier is normal male and female subjects // J. Lab. Clin. — 1995. — Vol. 126. — Р. 444-451.
19. Chen J.Y., Scerbo M., Kramer G. A review of blood substitutes: examining the history, clinical trial results, and ethics of hemoglobin-based oxygen carriers // Clinics. — 2009. — Vol. 64(8). — P. 803-813. doi: 10.1590/S1807-59322009000800016.
20. Levien L.J. South Africa: clinical experience with Hemopure // ISBT Science Series. — 2006. — Vol. 1 — Р. 167-173.
21. Vandegriff K.D., Malavalli A., Wooldridge J., Loh–man J., Winslow R.M. MP4, a new nonvasoactive PEG-Hb conjugate // Transfusion. — 2003. — Vol. 43(4). — P. 509-516. doi: 10.1046/j.1537-2995.2003.00341.x.
22. Young M.A., Riddez L., Kjellström B.T., Bursell J., Winslow F., Lohman J. MalPEG-hemoglobin (MP4) improves hemodynamics, acid-base status, and survival after uncontrolled hemorrhage in anesthetized swine // Crit. Care Med. — 2005. — Vol. 33, № 8. — P. 1794-1804. doi: 10.1097/01.CCM.0000172648.55309.13.
23. Барон Ж.Ф., Аттели Н., Сирье Д. Раствор гемоглобина: мечта или реальность? // Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций. — Архангельск, 1997. — С. 63-67.
24. Varnado C.L., Mollan T.L., Birukou I. Development of Recombinant Hemoglobin-Based Oxygen Carriers // Antioxid. Redox Signal. — 2013. — Vol. 18. — P. 2314-2328.
25. Rousselot M., Delpy E., Drieu La Rochelle C. et al. Are–nicola marina extracellular hemoglobin: a new promising blood substitute // Biotechnol. J. — 2006. — Vol. 1, № 3. — P. 333-345.
26. Малахов С.Ф., Костюченко А.Л. Клиническое применение нового кислородопереносящего кровезаменителя // Новое в анестезии и реанимации. Материалы первой годичной конференции Ленинградского общества анестезиологов и реаниматологов. — Л., 1972. — С. 32-34.
27. Селиванов Е.А., Быстрова И.М., Ханевич М.Д., Парашин М.Е. Экспериментальное и клиническое изучение кровезаменителя — переносчика кислорода на основе модифицированного гемоглобина // Физиологически активные вещества на основе перфторуглеродов в военной медицине. — СПб., 1997. — С. 95-96.
28. Корик В.Е., Коновалов С.В., Афонова В.А., Крикухин Ю.С. Влияние геленпола на газотранспортную функцию крови // Физиологически активные вещества на основе перфторуглеродов в экспериментальной и клинической медицине. — СПб., 2001. — С. 27-28.
29. Yu B., Bloch K.D., Zapol W.M. Hemoglobin Based Red Blood Cell Substitutes and Nitric Oxide // Trends Cardiovasc. Med. — 2009. — Vol. 19, № 3. — Р. 103-107. doi: 10.1016/j.tcm.2009.06.004.
30. Elmer J., Alam H.B., Wilcox S.R. Hemoglobin-based oxy–gen carriers for hemorrhagic shock // Resuscitation. — 2012. — Vol. 83. — P. 285-292. doi: 10.1016/j.resuscitation.2011.09.020.
31. Natanson C., Kern S.J., Lurie P. et al. Cell-free hemoglobin-based blood substitutes and risk of myocardial infarction and death: a meta-analysis // JAMA. — 2008. — Vol. 29. — P. 2304-2312. doi: 10.1001/jama.300.11.1295-a.
32. Sakai H., Sou K., Horinouchi H., Kobayashi K., Tsuchida E. Haemoglobin — vesicles as artificial oxygen carriers: present situation and future visions // Intern. Med. — 2007. — Vol. 263. — P. 4-15. doi: 10.1111/j.1365-2796.2007.01893.
33. Маевский Е.И. О некоторых проблемах внедрения наукоемких продуктов на примере истории препарата перфторан / Г.Р. Иваницкий, Е.Б. Жибурт, Е.И. Маевский (ред.) // Перфторуглеродные соединения в биологии и медицине. — Пущино, 2004. — C. 32-48.
34. Иваницкий Г.Р., Белоярцев Ф.Ф. О развитии фундаментальных и прикладных исследований по проблеме «Перфторуглероды в биологии и медицине в СССР // Медико-биологические аспекты применения эмульсий перфтор–углеродов. — Пущино, 1983. — C. 3-38.
35. Усенко Л.В., Клигуненко Е.Н., Криштафор А.А., Царев А.В. Перфторуглеродные соединения в биологии и медицине. Часть 1. Клиническая фармакология перфторорганических соединений // Укр. мед. часопис. — 2000. — № 3. — C. 56-61.
36. Мороз В.В., Кирсанова А.К., Новодержкина И.С. и др. Мембранопротекторное действие перфторана на эритроциты при острой кровопотере // Общая реаниматология. — 2011. — № 1. — С. 5-9.
37. Мороз В.В. Основные направления исследования перфторуглеродов в биологии и медицине // Реаниматология и интенсивная терапия. — 1997. — № 1. — С. 19-27.
38. Кокоз Ю.М., Кобринский Е.М., Фрейдин А.А., Исламов Б.И., Маевский Е.И., Белоярцев Ф.Ф., Иваницкий Г.Р. Действие газопереносящей эмульсии перфторуглеродов на миокард (ионный транспорт, сократительная активность и чувствительность к медиаторам) // ДАН СССР. — 1983. — № 2. — С. 459-461.
39. Воробьев С.И., Иваницкий Г.Р., Ладилов Ю.В., Образцов В.В., Склифас А.Н., Пономарчук В.В., Онищенко Н.А. Модификация мембран клеток перфторуглеродами как возможный механизм уменьшения степени ишемического повреждения миокарда // ДАН СССР. — 1988. — № 1. — С. 228-230.
40. Кузнецова И.Н., Гербут К.А., Лягушкина Л.В. Изменения массопереноса газов крови в условиях гипоксии при инфузии эмульсии перфторуглеродов // Физиологический журнал СССР. — 1986. — № 2. — С. 231-238.
41. Воробьев С.И. Перфторан: плазмозаменитель с газотранспортной функцией. — Пущино: ПНЦ-РАН, 1996. — 48 с.
42. Зарицкий А.Р., Кузнецова И.Н., Переведенцева Е.В., Фок М.В. Влияние эмульсий перфторуглеродов на скорость оксигенации и деоксигенации крови // Журнал физической химии. — 1993. — № 3. — С. 591-594.
43. Perevedentseva E.V., Zaritskiy A.R., Fok M.V., Kuz–netsova I.N. Perfluorocarbon emulsion increase transfer of oxygen in plasma from erythrocyte to tissue // Art Cells, Blood Subs. and Immob. Boitech. — 1998. — Vol. 262. — P. 223-229.
44. Усенко Л.В., Е.Н. Клигуненко, Ф.Ф. Белоярцев Наш опыт применения негемоглобиновых кислородонесущих кровезаменителей при острой нейротравме // Материалы VI науч. конф. анестезиологов-реаниматологов. — Кустанай, 1986. — Часть II. — C. 101-103.
45. Усенко Л.В., Клигуненко Е.Н. Опыт применения перфторана при тяжелой черепно-мозговой травме и постасистолическом синдроме // Перфторуглероды и медицина. — Новосибирск, 1990. — C. 126-130.
46. Усенко Л.В., Естрін А.О., Перцева Т.О., Черкасова О.Г. Гемопротекторні ефекти перфторану у хворих на гострий інфаркт міокарда // Медичні перспективи. — 1996. — № 1. — С. 21-27.
47. Усенко Л.В., Криштафор А.А. Перфторан в профилактике постгипоксической энцефалопатии // Перфторорганические соединения в биологии и медицине. — Пущино, 1999. — C. 76-87.
48. Усенко Л.В., Клигуненко Е.Н., Криштафор А.А., Царев А.В. Перфторуглеродные соединения в биологии и медицине. Часть 2. Перфторуглеродные соединения и эмульсии в хирургии // Укр. мед. часопис. — 2000. — № 6. — C. 27-33.
49. Усенко Л.В., Болтянский С.В. Продвинутая острая нормоволемическая гемодилюция с использованием перфторана у больных пожилого возраста при абдоминальных операциях // Г.Р. Иваницкий, Е.Б. Жибурт, Е.И. Маевский (ред.). Перфторуглеродные соединения в биологии и медицине. — Пущино, 2004. — C. 60-64.
50. Мороз В.В., Крылов Н.Л., Иваницкий Г.Р. Применение перфторана в клинической медицине // Анестезиология и реаниматология. — 1995. — № 6. — С. 12-17.
51. Мороз В.В., Крылов Н.Л. Некогда спорные, но сего–дня решенные, вопросы применения перфторана в клинике // Перфторорганические соединения в биологии и медицине. — Пущино, 1999. — C. 25-32.
52. Богданова Л.А., Маевский Е.И., Иваницкий Г.Р., Пушкин С.Ю., Аксенова О.Г. Краткий обзор применения перфторана в клинике // Г.Р. Иваницкий, Е.Б. Жибурт, Е.И. Маевский (ред.). Перфторуглеродные соединения в биологии и медицине. — Пущино, 2004. — C. 18-32.
53. Trakarnsanga K., Griffiths R.E., Wilson M.S., Blair A., Satchwell T.J., Meinders M., Cogan N., Kupzig S., Kurita R., Nakamura Y., Toye A.M., Anstee D.J., Frayne J. An immorta–lized adult human erythroid line facilitates sustainable and sca–lable generation of functional red cells // Nature communications. — 14 Mar 2017. — Vol. 8: 14750. — P. 1-7. doi: 10.1038/ncomms14750.

/11-1.jpg)
/12-1.jpg)
/13-1.jpg)
/15-1.jpg)
/16-1.jpg)