Введение
Внутривенное введение жидкости с целью реанимации у пациентов с гиповолемией является стандартной клинической практикой в течение более 185 лет, начиная с использования гипотонического солевого раствора с добавлением бикарбоната натрия для внутривенной жидкостной реанимации во время эпидемии холеры 1832 года в Лондоне [1]. Хотя после первых сообщений эффективность внутривенной инфузионной терапии оспаривалась многими авторитетами того времени и она не входила в рутинную клиническую практику еще около 100 лет.
Сегодня внутривенная инфузионная терапия — одно из наиболее распространенных вмешательств у пациентов, получающих лечение в условиях чрезвычайных ситуаций, операционных и отделений интенсивной терапии (ОИТ).
Основные показания для внутривенного введения жидкости: жидкостная реанимация, поддержание или замещение физиологического объема циркулирующей жидкости и электролитов организма, растворение и доставка лекарственных средств и парентеральное питание.
Шок — это генерализованное нарушение кровообращения, сопровождающееся системной артериальной гипотензией и приводящее к неадекватной перфузии тканей. Шок является одним из наиболее распространенных синдромов у критических пациентов. Шок может быть вызван любым патологическим процессом, который ведет к потере внутрисосудистого объема, патологической вазодилатации, дисфункции миокарда или обструкции венозного возврата либо сердечного выброса.
Выделяют следующие виды шока: гиповолемический (недостаточный внутрисосудистый объем), кардиогенный (отказ сердечного насоса), обструктивный (ограничение гемоциркуляции, например, из-за легочной эмболии или миомы предсердий) и распределительный (сосудистая гипотония вследствие сепсиса или других системных воспалительных состояний, таких как ожоги, тяжелая травма и др.). Шок может также представлять смешанную картину, например, при сепсисе, ожогах и анафилаксии, повышенная проницаемость сосудов приводит к потере внутрисосудистого объема и гиповолемическому шоку, в то же время патологическая вазодилатация вызывает распределительный шок. Компенсаторные реакции на все виды шока схожи. Причина шока может быть очевидной (как у пациентов с травмой или массивным кровотечением) или неясной (невосприимчивый к терапии септический шок часто клинически неотличим от гиповолемического шока) [2].
Независимо от этиологии первой реакцией клинициста, когда он сталкивается с гипотензивным пациентом в критическом состоянии, зачастую является внутривенное введение болюса жидкости. Согласно современной физиологической концепции во время проведения инфузионной терапии у пациентов с шоком следует рассмотреть четыре фазы инфузионной терапии: 1) жидкостной реанимации; 2) оптимизации волемического статуса; 3) стабилизации волемического статуса; 4) эвакуации избытка жидкости, чтобы дать ответы на четыре основных клинических вопроса: 1) когда начинать внутривенную инфузию жидкости? 2) когда прекратить внутривенную инфузию жидкости? 3) когда начинать деэскалацию инфузионной терапии или активное удаление жидкости? 4) когда прекратить деэскалацию инфузионной терапии? [3, 4].
Определение показаний и оценка инфузионной терапии
При изучении клинической практики жидкостной реанимации в ОИТ Европы и Америки наиболее распространенными причинами для начала жидкостной реанимации были нарушение тканевой перфузии (гиперлактатемия, ацидоз) или низкий сердечный выброс (44–61 % случаев). Следующими распространенными показаниями были существенные нарушения витальных функций (артериального давления (АД), сердечного ритма (частота сердечных сокращений), темпа диуреза или центрального венозного давления (25–35 % случаев)) даже при отсутствии признаков нарушений тканевой перфузии [5–8].
Этапы клинического течения циркуляторного шока представлены ниже: реанимация (спасение), оптимизация, стабилизация и деэскалация [9].
Фаза спасения (жидкостной реанимации): необходимо выполнить быструю дифференциальную диагностику причины шока, по возможности с использованием эхокардиографии; задачей интенсивной терапии рекомендовано считать достижение минимального целевого АДср. 60–65 мм рт.ст.; вводят инфузионные болюсы изотонических кристаллоидов — до 500 мл — с оценкой ответа пациента; целесообразно рассмотреть инфузию альбумина у септических пациентов, если они остаются нестабильными на фоне стандартной инфузионной терапии; продукты крови и транексамовая кислота необходимы в случае кровотечения; показана ранняя инотропная и вазопрессорная поддержка; применение методов damage control surgery по показаниям.
Угрожающая жизни фаза циркуляторного шока длится от нескольких минут и дольше. Она характеризуется вазодилатацией, приводящей к низкому среднему АД и нарушениям микроциркуляции. Может сопровождаться гипердинамическим сосудистым шоком, наблюдаемым при сепсисе, ожогах, тяжелом остром панкреатите, циррозе печени и др. или низким сердечным выбросом (септический шок с тяжелой гиповолемией или септический шок при сепсисассоциированной кардиомиопатии).
Инфузионная терапия обычно соответствует стратегии ранней, адекватной, целенаправленной инфузии (early, adequate, goal-directed, fluid management strategy).
На этом этапе индивидуально для каждого пациента мы должны найти ответ на первый вопрос: когда начинать инфузионную терапию?
Болюс жидкости — это быстрое внутривенное вливание в течение короткого времени. В клинической практике болюс жидкости обычно назначают в случае гиповолемии, гипотонии, недостаточного кровотока или нарушения микроциркуляторной перфузии. Объем болюса жидкости обычно 500–1000 мл. Минимальный объем жидкости, способный увеличить венозный возврат, составляет 4 мл/кг [10].
Для оценки инфузионной терапии вместо использования статических маркеров сердечной преднагрузки, которые не позволяют достоверно предсказать реакцию на инфузию жидкости, следует использовать динамические индексы. Принцип этих показателей заключается в том, чтобы наблюдать влияние на сердечный выброс изменений в преднагрузке сердца, вызванных спонтанно или при помощи специальных маневров. Используют тест пассивного поднятия ног, который имитирует введение жидкости [11]. Другие тесты используют изменения сердечной преднагрузки, вызванные механической вентиляцией. Дыхательные изменения пульсового давления и ударного объема или диаметра полой вены не могут использоваться во многих случаях у критических пациентов [12]. Тест конечно-экспираторной окклюзии легко выполнять у пациентов, находящихся на механической вентиляции, которые могут переносить респираторные паузы на 15 секунд [13]. Прогнозирование реакции на инфузию жидкости позволяет избежать ненужного введения жидкости и способствует уменьшению совокупного баланса жидкости. Это также позволяет проводить удаление излишка жидкости, поскольку помогает определить, что такое удаление не приведет к гемодинамическим нарушениям. Порог, определяющий положительную реакцию на инфузию жидкости, зависит от динамических изменений сердечной преднагрузки, вызванных тестом (например, 15 % — для пробного болюса жидкости, 10 % — для теста пассивного поднятия ног, 5 % — для теста конечно-экспираторной окклюзии).
Фаза оптимизации: характеризуется постепенной нормализацией перфузии органов, цвета и температуры кожи; в качестве целевых показателей рекомендовано достижение АДср. > 65 мм рт.ст., сердечного индекса — > 2,2 л/мин/м2, диуреза — > 0,5 мл/ г/ч, нормального уровня сывороточного лактата (обычно < 2 ммоль/л); возможно дальнейшее введение изотонических кристаллоидов при необходимости (чем больше потребность в инфузии жидкости, тем тяжелее состояние больного и больше вероятность декомпенсации и риск развития полиорганной недостаточности); по показаниям — продолжить инотропную и вазопрессорную поддержку.
На этом этапе мы должны попытаться найти ответ на второй вопрос: когда прекратить инфузионную терапию? Индексы реактивности на инфузию жидкости имеют первостепенное значение, так как инфузию следует прекращать, когда эти показатели становятся отрицательными. Необходимо учитывать клинические данные для прогнозирования риска перегрузки жидкостью (признаки острого легочного или почечного повреждения и др.). Можно рассмотреть измерение окклюзионного давления в легочной артерии, оценку внесосудистой легочной воды, а также индекса легочной сосудистой проницаемости. Внутрибрюшная гипертензия также является потенциальным следствием введения слишком большого количества жидкости.
Фаза стабилизации: отмечается дальнейшее улучшение перфузии органов, целевое АДср. > 65 мм рт.ст., сердечный индекс > 2,2 л/мин/м2, диурез > 0,5 мл/кг/ч, сывороточный лактат < 2 ммоль/л; рекомендован ограничительный подход к инфузии; при необходимости проводят поддержку и протезирование функции органов; можно начать энтеральное/парентеральное питание (если не противопоказано); показан ограничительный подход к оксигенотерапии. Инфузионая терапия необходима только для коррекции нормальных или патологических потерь жидкости (почечных, желудочно-кишечных, перспирационных). Необходимы ежедневный контроль и коррекция баланса жидкости во избежание перегрузки. Совокупный баланс жидкости представляет собой сумму ежедневных балансов жидкости за определенный период времени.
Фаза деэскалации: рекомендуют поддержание параметров, достигнутых во время фазы стабилизации; уменьшается необходимость в поддержке и протезировании функции органов; инфузию проводят только в случае необходимости; требуется достижение отрицательного жидкостного баланса, при необходимости с применением диуретиков или ультрафильтрации; показано продолжение энтерального питания с использованием дополнительного парентерального, если к 5-му дню не нормализуется трофический статус.
В этой фазе пациент может либо продолжить восстановление со спонтанной эвакуацией избыточных жидкостей, которые были введены ранее, либо, как это отмечается у многих критических пациентов, может развиться глобальный синдром повышенной проницаемости (GIPS).
Термины «деэскалация, дересусцитация» были впервые предложены в 2012 году [14]. Они относятся к позднему целенаправленному удалению жидкости и позднему консервативному управлению жидкостью (late goal-directed fluid removal and late conservative fluid management).
Позднее целенаправленное удаление жидкости (late goal-directed fluid removal) включает удаление жидкости с использованием диуретиков и ультрафильтрации. Оно характеризуется прекращением инфузии и достижением отрицательного баланса жидкости [15].
Позднее консервативное управление жидкостью (late conservative fluid management) предполагает избегание перегрузки жидкостью. Недавние исследования показали, что два последовательных дня отрицательного баланса жидкости в течение первой недели пребывания в ОИТ являются сильным и независимым предиктором выживания [16].
На этой стадии дересусцитации мы пытаемся найти ответ на третий и четвертый вопросы: когда начинать удаление жидкости и когда прекратить удаление жидкости?
Чтобы ответить на эти вопросы, может быть полезным тестирование чувствительности пациента к инфузии. Если не обнаружена чувствительность, разумно предположить, что удаление жидкости не приведет к снижению сердечного выброса. Напротив, положительные показатели реагирования на инфузию могут указывать на необходимость ограничения удаления жидкости.
Представленная выше четырехфазная модель приобрела достаточно широкую популярность. Однако на инфузионную терапию также влияют первичная патология пациента, способы достижения целевых конечных точек терапии, реакция пациента на лечение. В идеале инфузионная терапия, подобно другим медицинским воздействиям, должна быть адаптирована к потребностям конкретного пациента.
Физиология жидкостной реанимации
Жидкостная реанимация является базовым методом интенсивной терапии у пациентов с симптомной гиповолемией. Компенсаторные реакции на гиповолемию включают опосредованные симпатической нервной системой катехоламиновые и гормональные реакции, которые направлены на поддержание сосудистого тонуса и эффективного объема циркулирующей крови [9, 17].
Опосредованная барорецепторами и индуцированная катехоламинами вазоконстрикция воздействует на емкость венозной системы с целью увеличения венозного возврата и поддержания сердечного выброса [18, 19]. Кроме того, активация ренин-ангиотензин-альдостероновой и адренокортикоидной систем вызывает антидиуретический эффект, задерживая воду.
Гиповолемический шок возникает, когда внутрисосудистый дефицит объема превышает способность этих компенсаторных механизмов, что приводит к нарушению перфузии жизненно важных органов.
Основной целью введения реанимационных жидкостей являются восстановление и поддержание внутрисосудистого объема. Сопутствующее лечение вазоактивными агентами увеличивает эндогенный нейрогормональный ответ [20, 21].
Гиповолемия может быть вызвана острым кровотечением или потерей других жидкостей организма, обычно из верхних и нижних отделов желудочно-кишечного тракта (диарея, рвота, свищи), мочевыводящих путей или кожи (особенно у пациентов с тяжелыми ожогами). Воспалительные состояния, возникающие при сепсисе и после ожогов, обширные операции или травмы могут приводить к смешанной картине распределительного и гиповолемического шока. При сепсисе и после ожоговой травмы гиповолемия является результатом внесосудистой потери жидкости из-за повышенной сосудистой проницаемости, тогда как при травме и обширной хирургии гиповолемия вызвана нескорректированной потерей крови. Травма и повреждение тканей вызывают воспалительный ответ, который у критических пациентов может привести к распределительному шоку.
Быстрая дифференциальная диагностика причины шока может быть существенно облегчена при использовании эхокардиографии [22].
Классическая модель Старлинга
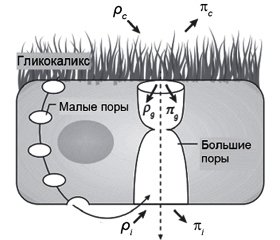
Согласно модели, разработанной Эрнестом Старлингом 75 лет назад, жидкость выходит в интерстиций из сосудистой сети на артериальном конце капиллярного русла (где градиент гидростатического давления превышает градиент осмотического давления) и возвращается из интерстиция на венозном конце капиллярного русла (где в результате предшествующей потери жидкости при переходе через капиллярное русло гидростатическое давление будет ниже, а осмотическое давление выше). Однако большая часть этой теории несовместима с данными современных клинических исследований и пониманием роли эндотелиального слоя гликокаликса. В частности, давнее убеждение, что жидкость возвращается в систему кровообращения в посткапиллярном венозном русле и что резорбция жидкости может быть увеличена путем внутривенного введения жидкости, увеличивающей коллоидное осмотическое давление, в настоящее время не подтверждается [23]. Эта классическая модель теперь считается ошибочной и заменена пересмотренным принципом Старлинга.
На рис. 1 схематично представлен принцип переноса жидкости через капиллярные мембраны [1].
Пересмотренная модель Старлинга
Классическая модель Старлинга основывалась на его наблюдении, что после введения изотонического солевого раствора в ткани задней конечности собаки кровь, циркулирующая в конечности, подвергалась гемодилюции, что трактовали как результат поглощения физиологического раствора сосудистой сетью [24]. Однако при введении сыворотки, а не физиологического раствора жидкость из тканей не поглощалась.
По мере развития знаний о физиологии эндотелия эта модель была пересмотрена и заменена альтернативной, которая основана на физиологической роли гликокаликса и преобладает в настоящее время [25].
Эндотелиальный гликокаликсный слой является ключевым фактором, определяющим проницаемость мембраны, что представлено коэффициентом σ в уравнении Старлинга. Данный слой представляет собой сеть связанных с мембраной гликопротеинов и протеогликанов на внутренней стороне эндотелиальных клеток сосудов. Гликокаликс состоит из внутреннего плотного матричного слоя с мембранными гликопротеинами толщиной до 200–300 нм, который образует первичный избирательный барьер для макромолекул плазмы. Внешний, менее плотный, слой выступает на один или несколько микрометров в просвет сосуда, образуя микроструктуру, которая поддерживает движение эритроцитов. В субгликокаликсном пространстве создается коллоидное онкотическое давление, которое является основным определяющим фактором транскапиллярного потока жидкости. Жидкость из интерстициального пространства попадает в циркуляцию через небольшое количество больших пор, но основной путь возвращения интерстициальной жидкости в кровоток — это лимфа.
Как эндотелиальный, так и гликокаликсный барьер регулируются воспалительными медиаторами, эндотелиальными стабилизирующими агентами и физическими силами на сосудистой стенке. Физиология эндотелиального гликокаликса остается не до конца изученной, хотя продолжающиеся исследования подчеркивают важную роль медиаторов, таких как сфингозин-1-
фосфат и ангиопоэтин-2, в регулировании структуры гликокаликса и сосудистой проницаемости в условиях физиологической нормы и патологических процессов [26, 27].
Структура и функция эндотелиального гликокаликса различаются в разных кровеносных сосудах и при различных физиологических и патологических состояниях [28]. Повреждение гликокаликса при локальных или системных воспалительных процессах приводит к экстравазации жидкости с развитием интерстициального отека, так называемого глобального синдрома повышенной проницаемости (GIPS) и последующей перегрузки жидкостью [23]. Проницаемость слоя эндотелиального гликокаликса (и, следовательно, потенциальная возможность развития интерстициального отека) также существенно различается между системами и органами.
Клинические следствия пересмотренной теории Старлинга заключаются в том, что объемно-заместительный эффект коллоидных растворов намного ниже, чем считалось ранее, и это особенно выражено в случае локального или системного воспаления. Эти новые наблюдения обеспечивают физиологическую основу, чтобы заново оценить эффективность различных жидкостей для инфузионной терапии у больных в критических состояниях, таких как сепсис, травма и обширные операции, связанных с нарушением структуры эндотелия и функций гликокаликса.
Жидкости для внутривенного введения
В табл. 1 и 2 приведены химический состав, свойства, риски и преимущества некоторых широко используемых для внутривенных инфузий жидкостей [1].
Кристаллоиды
Кристаллоидами называют растворы ионов, которые способны проникать через полупроницаемые мембраны. Они дешевле, чем коллоиды, и являются наиболее часто используемыми жидкостями во всем мире. Они также имеют длительный срок хранения.
За исключением чистых растворов глюкозы, кристаллоиды содержат натрий, хлор и другие анионы, которые определяют их тоничность относительно внеклеточной жидкости. Эти физико-химические свойства являются важными факторами как их эффективности в качестве жидкости для расширения объема сосудов, так и потенциальной токсичности. Традиционная физиологическая теория утверждает, что распределение введенных внутривенно кристаллоидов во внутриклеточном и внеклеточном пространствах (включая плазму) определяется концентрацией натрия.
При внутривенной инфузии кристаллоиды с концентрацией натрия, близкой к его концентрации во внутрисосудистой жидкости (140 ммоль/л), приводят к временному увеличению внутрисосудистого объема. Кристаллоиды могут использоваться либо в качестве реанимационных жидкостей (для увеличения или поддержания внутрисосудистого объема), либо в качестве поддерживающих жидкостей (для поддержания гидратации, кислотно-щелочного и электролитного баланса) у лиц, не способных переносить энтеральное введение жидкости. Кристаллоидные растворы для инфузионной терапии могут представлять собой физиологические и буферизированные (сбалансированные) солевые растворы.
Физиологический раствор
Нормальный физиологический раствор (0,9%) хлорида натрия — изотонический кристаллоид, который традиционно наиболее часто назначается во всем мире.
Его используют в качестве растворителя для многих коллоидных растворов, включая препараты альбумина человека, желатина и гидро–ксиэтилкрахмал (ГЭК). Поскольку натрий и хлор присутствуют в нем в равных концентрациях (по 154 ммоль/л), быстрое введение большого объема может вызвать гиперхлоремический метаболический ацидоз. Побочные эффекты, связанные с этим метаболическим ацидозом, особенно на животных моделях, включают нарушения функции почек и внутренних органов, гипотонию и коагулопатию [29–32]. Обсервационные исследования показали, что внутривенное введение нормального физиологического раствора может быть связано с повышенным риском хирургических осложнений, острым повреждением почек и смертью по сравнению с введением кристаллоидов с более низкими концентрациями хлоридов [33].
Однако эти неблагоприятные эффекты не получили подтверждения в нескольких рандомизированных клинических исследованиях, опубликованных недавно [34–36].
С учетом того, что большая часть доказательств неблагоприятных эффектов физиологического раствора получена в обсервационных исследованиях с высокой вероятностью погрешностей, эти доказательства можно считать неубедительными.
Нормальный физиологический раствор рекомендуют в качестве реанимационной жидкости первой линии для пациентов, которые являются гиповолемичными из-за потерь жидкости из верхних отделов желудочно-кишечного тракта, что приводит к гипохлоремическому метаболическому алкалозу и также характерно для пациентов с диабетическим кетоацидозом.
В то же время кристаллоидная (и коллоидная) жидкостная реанимация в настоящее время не приветствуются у пациентов с тупой и проникающей травмой [37]. В этой популяции с целью уменьшения смертности принято следовать принципам damage control resuscitation.
У пациентов с травматическим повреждением головного мозга нормальный физиологический раствор предпочтительнее альбумина [38]. Не рекомендуют использование у этих пациентов гипотонических кристаллоидных растворов. Догоспитальная реанимация с использованием гипертонического солевого раствора также не доказала пользы у пациентов с травмой мозга [39].
Буферизированные (сбалансированные) солевые растворы
Вероятность развития побочных эффектов, связанных с высоким содержанием хлорида в нормальном физиологическом растворе, привела к более широкому использованию буферизированных кристаллоидов. В этих растворах концентрацию хлора снижают путем добавления других анионов для достижения химического состава, близкого к химическому составу внеклеточной жидкости. Преобладающими анионами внеклеточной жидкости являются хлорид и бикарбонат, но растворы, содержащие бикарбонат, нестабильны в пластиковых полимерных контейнерах; используют альтернативные анионы, такие как лактат, ацетат, глюконат и малат [40]. Выбор аниона определяется желаемыми физико-химическими свойствами, фармакокинетикой и коммерческими соображениями. В частности, анионы должны быть нетоксичными, быстро и эффективно метаболизироваться, не влиять на риск печеночной и/или
почечной дисфункции, иметь рН, который не вызывает гемолиз или повреждение эндотелия.
Например, лактат может использоваться у пациентов без тяжелой дисфункции печени, поскольку он подвергается глюконеогенезу и входит в цикл Кребса через ацетил-коэнзим А. Ацетат также быстро метаболизируется, в том числе с помощью внепеченочных путей, что делает его теоретически привлекательным для использования у пациентов с повреждением или дисфункцией печени. Одно из предостережений заключается в том, что использование ацетата в растворах для гемодиализа связано с гипотензией, дисфункцией миокарда и нарушениями обмена веществ. Цитрат, хотя и используется в диализных жидкостях, не является компонентом буферизованных кристаллоидных растворов. В дополнение к хлоридзамещающему аниону буферизированные растворы могут содержать катионы, отличные от натрия (например, калий, кальций и магний), в концентрациях, аналогичных внеклеточной жидкости.
Некоторые буферизированные солевые растворы относительно гипотоничны, то есть они имеют более низкую концентрацию натрия, чем внеклеточная жидкость. Чрезмерное введение таких растворов может привести к гиперлактатемии, метаболическому алкалозу, гипотоничности (для соединений, содержащих лактат натрия) и кардио-токсичности (для соединений, содержащих ацетат). Если растворы, содержащие кальций, вводят совместно с цитратными эритроцитами, во время введения могут образовываться микротромбы. Гипотонические кристаллоиды противопоказаны пациентам с травматическим повреждением головного мозга из-за их теоретического потенциала в отношении провоцирования отека мозга.
Коллоидные растворы
Коллоидные растворы представляют собой суспензию больших молекул плазмы или полусинтетических молекул, которые не могут проникать через неповрежденные полупроницаемые мембраны. Продолжительность внутрисосудистого объемзамещающего эффекта, производимого конкретными коллоидами, варьирует и зависит от скорости метаболизма и очистки составляющих молекул. Как правило, внутрисосудистое объемное расширение, достигаемое производными плазмы (4–6 ч), продолжительнее, чем у полусинтетических коллоидов (1–4 ч), хотя фактическая продолжительность существенно различается между пациентами.
Теоретическое преимущество коллоидов над кристаллоидами заключается в том, что для увеличения внутрисосудистого объема необходим меньший объем жидкости, предполагающий, что использование коллоидов приведет к уменьшению отека интерстиция. Однако данные высококачественных слепых рандомизированных клинических исследований, сравнивающих безопасность и эффективность коллоидных и кристаллоидных растворов, продолжают демонстрировать довольно умеренный объемный эффект коллоидов в сравнении с кристаллоидами — 1 : 1,4. Инфузия коллоидных растворов может снизить давление фильтрации за счет увеличения онкотического давления, что также может привести к снижению скорости клубочковой фильтрации, однако клиническая значимость этого эффекта неясна [41–43].
Альбумин человеческий
Из доступных коллоидов человеческий альбумин традиционно считался самым физиологически приемлемым раствором для реанимации и широко использовался во время Второй мировой войны [44]. Однако высокая стоимость альбумина и опасения относительно возможности передачи инфекций снизили его популярность после того, как стали доступны альтернативные полусинтетические коллоиды.
В физиологических условиях альбумин является преобладающим белком плазмы и главной составляющей плазменного коллоидно-осмотического давления. Нормальный биологический период полувыведения альбумина составляет 15 дней. Эндогенный плазменный альбумин обладает многими физиологическими функциями, в том числе действует в качестве буферной молекулы, является важным переносчиком как для эндогенных, так и для экзогенных молекул, а также основным внеклеточным антиоксидантом. Человеческий альбумин представлен в клинической практике в виде 4, 5, 20 или 25% раствора.
В целом использование альбумина в сравнении с физиологическим раствором для жидкостной реанимации приводит к аналогичным результатам у пациентов в ОИТ. Данные из высококачественных рандомизированных клинических исследований показывают, что по сравнению с физиологическим раствором альбумин не снижает смертность у пациентов в ОИТ, включая тех, у кого наблюдалась гипоальбуминемия при поступлении в ОИТ, и, что важно, не влияет на риск развития острого повреждения почек [45, 46].
Гипотонические растворы 4% альбумина противопоказаны у пациентов с травмой мозга из-за риска развития внутричерепной гипертензии [47, 48].
У пациентов с сепсисом имеются сомнительные данные в отношении того, связано ли поддержание концентрации альбумина в сыворотке с уменьшенной смертностью. По данным исследования SAFE, реанимация с альбумином, а не солевым раствором могла бы снизить смертность [49].
Использование гиперонкотического (20–25%) альбумина для реанимации и поддержания концентрации сывороточного альбумина ≥ 30 г/л было положительно оценено в исследовании Albumin Italian Outcome in Sepsis (ALBIOS). Анализ выявил снижение смертности в подгруппе пациентов с септическим шоком. Два небольших рандомизированных исследования, проведенные у пациентов с циррозом, бактериальным перитонитом либо другими бактериальными инфекциями, показали, что добавление концентрированного альбумина к терапии антибиотиками снижает риск почечной недостаточности и смерти [50, 51].
В двух небольших рандомизированных клинических исследованиях пациенты с гипопротеинемией и острым повреждением легких, получавшие фуросемид, были случайным рандомизированы в соотношении 1 : 1 для получения концентрированного альбумина или нормального физиологического раствора. У пациентов, получавших альбумин, улучшились оксигенация и другие показатели дисфункции органов [52, 53].
Таким образом, имеющиеся в настоящее время данные свидетельствуют о том, что в целом альбумин эквивалентен физиологическому раствору для жидкостной реанимации у критических пациентов, но может иметь положительные эффекты у пациентов с сепсисом и со спонтанным бактериальным перитонитом или другими бактериальными инфекциями. Изоонкотический альбумин (4 или 5%) в гипотоническом растворителе противопоказан пациентам с травмой головного мозга.
Гидроксиэтилкрахмал
ГЭК получают путем гидроксиэтилзамещения амилопектина, полученного из сорго, кукурузы или картофеля. Он является наиболее часто используемым полусинтетическим коллоидом во всем мире. В растворах ГЭК растворителем выступает физиологический солевой раствор или буферизированные кристаллоиды. Растворы ГЭК различают по концентрации, средней молекулярной массе и степени молярного замещения.
Старые, гиперонкотические препараты ГЭК, такие как 10% пентастарх, имеют высокую молекулярную массу (> 200 кДа) и высокую степень молярного замещения (> 0,6). Использование таких 10% растворов ГЭК (200/0,6) связано с повышенным риском развития острого повреждения почек, зуда и коагулопатии, увеличением необходимости использования заместительной почечной терапии [54].
В ответ на эти результаты производители выпустили менее концентрированные растворы ГЭК с более низкой молекулярной массой, такие как 6% ГЭК с молекулярной массой 130 кДа и молярным замещением около 0,4 (6% ГЭК (130/0,4) и 6% ГЭК (130/0,42)). Эти новые рецептуры ГЭК широко используются для жидкостной реанимации, особенно у пациентов, подвергающихся общей анестезии для обширных операций, и у пациентов с травмой и сепсисом. К сожалению, эти ГЭК второго поколения, похоже, также нефротоксичны [55–58].
Крупные высококачественные слепые рандомизированные клинические исследования продемонстрировали дозозависимый побочный эффект 6% ГЭК (130/0,42) в ацетате Рингера на риск смерти и потребность в заместительной почечной терапии у пациентов с тяжелым сепсисом и септическим шоком, а также увеличение использования заместительной почечной терапии у всех пациентов в ОИТ, получивших 6% ГЭК (130/0,4) в солевом растворе [41, 43].
Метаанализ существующих данных демонстрирует существенное увеличение риска смерти и использования заместительной почечной терапии у пациентов, получающих ГЭК, а нефротоксичность, связанная с ГЭК, также проявляется в почках, пересаженных от доноров, которые получали растворы ГЭК [59, 60].
Совокупность имеющихся данных свидетельствует о том, что применение ГЭК приводит к неприемлемым рискам токсичности и не приносит никакой пользы по сравнению с кристаллоидами. Более того, назначение ГЭК не дает никаких очевидных преимуществ, связанных со смертностью или другими результатами [61, 62].
В результате регулирующие органы, такие как FDA и Европейское лекарственное агентство (EMA), установили ограничения на использование ГЭК у критических пациентов с высоким риском [63–65].
Желатин
Желатин готовят путем гидролиза бычьего или свиного коллагена. Наиболее распространенными препаратами являются сукцинированный желатин и связанный с мочевиной желатин-полигелин, оба из которых имеют длительный срок хранения. Они готовятся на физиологическом растворе. Желатин имеет относительно низкую молекулярную массу (30–35 кДа) и увеличивает объем плазмы только 1–2 ч, после чего он метаболизируется и выводится через почки.
Использование жидкостей на основе желатина связано с повышенным риском развития острого повреждения почек из-за накопления желатина в ретикулоэндотелиальной системе, а также может вызвать опасную для жизни анафилаксию. Отсутствуют крупномасштабные исследования по сравнению эффективности и безопасности желатинов с другими реанимационными жидкостями, и их роль в качестве реанимационных жидкостей не была четко определена. Что касается растворов ГЭК, то в отсутствие каких-либо данных, предполагающих преимущество растворов желатина над кристаллоидами, их дальнейшее использование трудно оправдать [66, 67].
Объем жидкости и перегрузка жидкостью
Лечение пациента с шоком неизбежно приводит к некоторой перегрузке жидкостью и электролитами в результате жидкостной реанимации с целью восстановления внутрисосудистого объема, увеличения сердечного выброса, доставки кислорода и улучшения оксигенации тканей. Капиллярная утечка, присущая шоку, способствует экстравазации жидкости, вызывая относительную центральную гиповолемию, которая часто требует дальнейшего введения жидкости, несмотря на интерстициальный отек.
Ряд исследований демонстрирует связь между перегрузкой жидкостью и худшими исходами лечения для критических пациентов, особенно у пациентов с септическим шоком и/или острым респираторным дистресс-синдромом [16].
Массивная инфузия жидкости потенциально вызывает порочный круг, в котором интерстициальный отек индуцирует органную дисфункцию, которая способствует накоплению жидкости, может вызывать отек и дисфункцию органов. Поэтому интенсивная терапия шока должна включать мероприятия по уменьшению совокупного водного баланса [68–71].
Как правило, жидкость первоначально вводится в виде болюса (например, обновленные рекомендации по сепсису рекомендуют 30 мл/кг в первый час интенсивной терапии [72] с последующей поддерживающей инфузией).
Известно, что введение жидкости у пациентов с олигурией и риском развития острого повреждения почек обычно приводит к накоплению жидкости, что может быть вредным для почек. У здоровых людей введение 2 л кристаллоидной жидкости увеличивает объем почек [73]. Поскольку почка является инкапсулированным органом, такой отек может приводить к повышению резистентности к венозному возврату и способствовать почечной ишемии. Рестриктивный подход к жидкостной терапии, дополненный при необходимости инотропной или вазопрессорной поддержкой для поддержания перфузии органов и давления фильтрации в почках улучшит результаты интенсивной терапии.
В поддержку рестриктивного подхода свидетельствуют результаты экспериментального исследования Conservative Versus Liberal Approach to Fluid Therapy of Septic Shock in Intensive Care (CLASSIC) [74], которое показало, что острое повреждение почек реже случается у пациентов с септическим шоком, которым случайным образом была использована ограничительная жидкостная стратегия.
Совокупные данные исследований ранней целенаправленной терапии (early goal-directed therapy — EGDT), которые предусматривали использование агрессивной инфузионной терапии у пациентов с септическим шоком, не обнаружили положительного эффекта EGDT на смертность или функцию органов [75, 76].
Противоположные данные получены в рандомизированном исследовании, опубликованном в 2018 году, в котором 3000 пациентов были рандомизированы на рестриктивную или либеральную стратегию инфузии жидкости во время и после обширных операций на брюшной полости [77]. Пациенты, которым назначалась либеральная терапия, имели более низкие показатели острого повреждения почек и хирургических инфекций, меньшее число пациентов получали заместительную почечную терапию.
Эти данные свидетельствуют о том, что доказательства, полученные в ходе испытаний у пациентов с тяжелыми заболеваниями, особенно с сепсисом, не следует экстраполировать для выбора тактики интенсивной терапии в периоперационном периоде и наоборот.
Несмотря на то, что механизмы, посредством которых либеральная жидкостная стратегия может привести к плохим результатам, еще предстоит установить, существующая теория утверждает, что вероятным виновником является введение больших количеств натрия и хлора. Быстрая инфузия и высокообъемная инфузионная терапия остаются распространенными в клинической практике из-за убеждения, что острое повреждение почек может возникнуть в результате нескорригированной гиповолемии. Однако в настоящее время эта практика не поддерживается, но и не опровергается существующими рандомизированными клиническими исследованиями.
В качестве поддерживающей инфузии для покрытия ежедневных основных потребностей пациента в воде, глюкозе и электролитах обычно используют 25–30 мл/кг массы тела воды, 1 ммоль/кг калия, 1–1,5 ммоль/кг натрия в день и глюкозу или декстрозу 5 или 10% 1,4–1,6 г/кг (во избежание голодного кетоацидоза) [78].
Тип жидкости
Тип жидкости, получаемой пациентами, может влиять как на функцию органа, так и на исход лечения пациента. Эффекты ГЭК, альбумина и желатина уже обсуждались выше. Значительная часть доказательств, подтверждающих использование буферизированных растворов, а не обычного физиологического раствора, взята из обсервационных исследований в периоперационной медицине [31].
Данные из рандомизированных клинических исследований у критических пациентов неуклонно накапливаются, но пока не являются окончательными. В исследовании Р. Young и соавт. (2015) не выявлено различий между кристаллоидными инфузионными растворами в отношении риска развития острого повреждения почек и потребности в заместительной почечной терапии [33].
Наиболее убедительные доказательства на сегодняшний день взяты из двух рандомизированных клинических исследований, проведенных в США [34, 35]. Сравнивали нормальный физиологический раствор с двумя буферизированными кристаллоидами (либо лактатным раствором Рингера, либо PlasmaLyte A) для лечения всех пациентов в ОИТ. Показано, что буферизированные растворы реже способствовали появлению серьезных неблагоприятных явлений со стороны почек. Это преимущество было наиболее заметно у пациентов, у которых была исходно скомпроментирована почечная функция.
Продолжается анализ данных исследований BaSICS [79] (11 000 пациентов в ОИТ в Бразилии) и PLUS [80] (8,8 тыс. пациентов в ОИТ в Австралии и Новой Зеландии). Вне рандомизированных клинических исследований было бы разумно предпочесть буферизованные солевые растворы над изотоническим солевым раствором, хотя призывы отказаться от использования нормального физиологического раствора могут оказаться преждевременными [81, 82].
«Четыре D» инфузионной терапии
При назначении инфузионной терапии у пациентов с шоком мы должны учитывать состав, фармакодинамические и фармакокинетические свойства инфузионных сред. В клинической ситуации мы должны рассмотреть «четыре D» жидкостной терапии: drug, dosing, duration and deescalation — препарат, доза, продолжительность введения и деэскалация [3, 83].
Оценка ответа пациента на инфузию жидкости
Состояние, при котором пациент будет реагировать на введение жидкости путем значительного увеличения ударного объема и/или сердечного выброса или их суррогатов, считают положительным ответом на проводимую инфузионную терапию. Пороговое значение — 15 % обычно используют для определения такого ответа.
Ряд исследований показывает, что положительная реакция на инфузию жидкости, которая является нормальным физиологическим состоянием, встречается только у половины пациентов, получающих внутривенную жидкость в отделениях интенсивной терапии [84].
Выводы
— Внутривенное введение жидкостей является одним из наиболее распространенных вмешательств в медицине критических состояний, но большая часть физиологической теории, на которой основана практика, являлась ошибочной и была изменена.
— Существует четыре основных показания для внутривенного введения жидкости у критических больных: жидкостная реанимация, поддержание или замещение физиологического объема циркулирующей жидкости и электролитов организма, растворение и доставка лекарственных средств и парентеральное питание.
— Необходимо рассматривать назначение внутривенных жидкостей, как и других лекарственных препаратов (например, антибиотиков), с учетом четырех D (drug, dosing, duration, deescalation — выбор препарата, доза, продолжительность введения, деэскалация).
— Четыре фазы жидкостной терапии (реанимация, оптимизация, стабилизация и эвакуация) соответствуют современной патофизиологической теории и требуют ответить на четыре основных вопроса инфузионной терапии: 1. Когда начинать внутривенную инфузию? 2. Когда прекратить инфузию жидкости? 3. Когда начать удаление жидкости? 4. Когда прекратить удаление жидкости?
— Кристаллоидные жидкости следует использовать в качестве терапии первой линии; у большинства пациентов; буферизованные солевые растворы, по-видимому, дают преимущества по сравнению с обычным физиологическим раствором.
— Использование альбумина может быть полезным у пациентов с сепсисом, циррозом или инфекциями, но альбумин в гипотоническом растворе противопоказан пациентам с травматическим повреждением мозга.
— Синтетические коллоиды, особенно гидро–ксиэтилкрахмал и желатин, не должны использоваться из-за их неприемлемых профилей безопасности и отсутствия доказанных преимуществ по сравнению с кристаллоидами.
— Стратегии, которые ограничивают внутривенное введение жидкости, могут снизить заболеваемость и смертность, но для подтверждения этих данных необходимы более масштабные исследования.
Список литературы
1. Latta T. Injections into the veins in cholera // London Med. Gaz. — 1832. — 379-382.
2. Finfer S., Myburgh J., Bellomo R. Intravenous fluid therapy in critically ill adults // Nature Reviews Nephrology — 2018. — 14. — 541-557.
3. Malbrain M., Van Regenmortel N., Saugel B. et al. Рrinciples of fluid management and stewardship in septic shock: it is time to consider the four D's and the four phases of fluid therapy // Ann. Intensive Care. — 2018. — 8(1) — 66.
4. Cecconi M. et al. Fluid challenges in intensive care: the FENICE study: a global inception cohort study // Intensive Care Med. — 2015. — 41. — 1529-1537.
5. Finfer S. et al. Resuscitation fluid use in critically ill adults: an international cross-sectional study in 391 intensive care units // Crit. Care. — 2010. — 14. — 185.
6. Hammond N.E. et al. Patterns of intravenous fluid resuscitation use in adult intensive care patients between 2007 and 2014: an international crosssectional study // PLoS ONE. 2017. — 12. — e0176292.
7. Boulain T. et al. Volume expansion in the first 4 days of shock: a prospective multicentre study in 19 French intensive care units // Intensive Care Med. — 2014. — 41. — 248-256.
8. Miller T.E., Bunke M., Nisbet P. et al. Fluid resuscitation practice patterns in intensive care units of the USA: a cross- sectional survey of critical care physicians // Perioper. Med. (Lond.) — 2016. — 5. — 15.
9. Vincent J.L., DeBacker D. Circulatory shock // N. Engl. J. Med. — 2013. — 369. — 1726-1734.
10. Aya H.D., Rhodes A., Chis Ster I. et al. Hemodynamic effect of different doses of fluids for a fluid challenge: a quasi-randomized controlled study // Crit. Care Med. — 2017. — 45(2). — 161-8.
11. Monnet X., Teboul J.L. Passive leg raising: five rules, not a drop of fluid! // Cri Care. — 2015. — 19. — 18.
12. Monnet X., Marik P., Teboul J.L. Prediction of fluid responsiveness: an update // Ann. Intensive Care. — 2017. — 6(1). — 111.
13. Jozwiak M., Depret F., Teboul J.L. et al. Predicting fluid responsiveness in critically ill patients by using combined end-expiratory and end-inspiratory occlusions with echocardiography // Crit. Care Med. — 2017. — 45(11). — 1131-8.
14. Cordemans C., De Laet I., Van Regenmortel N. et al. –Aiming for a negative fluid balance in patients with acute lung injury and increased intra-abdominal pressure: a pilot study looking at the effects of PAL-treatment // Ann. Intensive Care. — 2012. — 2 (Suppl. 1). — 15.
15. Cordemans C., De Laet I., Van Regenmortel N. et al. Fluid management in critically ill patients: the role of extravascular lung water, abdominal hypertension, capillary leak and fluid balance // Annals Intensive Care. — 2012. — 2 (Suppl. 1). — 1.
16. Malbrain M.L., Marik P.E., Witters I. et al. Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice // Anaesthesiol Intensive Ther. — 2014. — 46 (5). — 361-80.
17. Myburgh J.A., Mythen M.G. Resuscitation fluids // N. Engl. J. Med. — 2013. — 369. — 1243-1251.
18. Funk D.J., Jacobsohn E., Kumar A. The role of venous return in critical illness and shock — part I: physiology // Crit. Care Med. — 2013. — 41. — 255-262.
19. Funk D.J., Jacobsohn E., Kumar A. Role of the venous return in critical illness and shock: part II — shock and mechanical ventilation // Crit. Care Med. — 2013. — 41. — 573-579.
20. Persichini R. et al. Effects of norepinephrine on mean systemic pressure and venous return in human septic shock // Crit. Care Med. — 2012. — 40. — 3146-3153.
21. Scheeren T.W., Vos J.J. Good old physiology in a modern jacket // Crit. Care Med. — 2012. — 40. — 3309-3311.
22. McLean A.S. Echocardiography in shock management // Crit. Care — 2016. — 20. — 275.
23. Woodcock T.E., Woodcock T.M. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy // Br. J. Anaesth. — 2012. — 108. — 384-394.
24. Starling E.H. On the absorption of fluids from the connective tissue spaces // J. Physiol. — 1896. — 19. — 312-326.
25. Levick J.R., Michel C.C. Microvascular fluid exchange and the revised Starling principle // Cardiovasc. Res. — 2010. — 87. — 198-210.
26. Lukasz A. et al. Endothelial glycocalyx breakdown is mediated by angiopoietin-2 // Cardiovasc. Res. — 2017. — 113. — 671-680.
27. Curry F.E. Layer upon layer: the functional consequences of disrupting the glycocalyx-endothelial barrier in vivo and in vitro // Cardiovasc. Res. — 2017. — 113. — 559-561.
28. Rabelink T.J., de Zeeuw D. The glycocalyx — linking albuminuria with renal and cardiovascular disease // Nat. Rev. Nephrol. — 2015. — 11. — 667-676.
29. Yunos N.M., Bellomo R., Story, D. et al. Bench-to-bedside review: chloride in critical illness // Crit. Care. — 2010. — 14. — 226-226.
30. Kellum J.A., Song M., Venkataraman R. Effects of hyperchloremic acidosis on arterial pressure and circulating inflammatory molecules in experimental sepsis // Chest. — 2004. — 125. — 243-248.
31. Shaw A.D. et al. Major complications, mortality, and resource utilization after open abdominal surgery: 0.9% saline compared to Plasma-Lyte // Ann. Surg. — 2012. — 255. — 821-829.
32. Yunos N.M. et al. Association between a chlorideliberal versus chloride- restrictive intravenous fluid administration stra-tegy and kidney injury in critically ill adults // JAMA. — 2012. — 308. — 1566-1572.
33. Young P. et al. Effect of a buffered crystalloid solution versus saline on acute kidney injury among patients in the intensive caxare unit: the SPLIT randomized clinical trial // JAMA. — 2015. — 314. — 1701-1710.
34. Self W.H. et al. Balanced crystalloids versus saline in noncritically ill adults // N. Engl. J. Med. — 2018. — 378. — 819-828.
35. Semler M.W. et al. Balanced crystalloids versus saline in critically ill adults // N. Engl. J. Med. — 2018. — 378. — 829-839.
36. Bampoe S. et al. Perioperative administration of buffered versus non- buffered crystalloid intravenous fluid to improve outcomes following adult surgical procedures // Cochrane Database Syst. Rev. — 2017. — 9. — CD004089.
37. Harris T., Thomas G.O., Brohi K. Early fluid resuscitation in severe trauma // BMJ. — 2007. — 345. — e 5752.
38. The SAFE Study Investigators et al. Saline or albumin for fluid resuscitation in patients with traumatic brain injury // N. Engl. J. Med. — 2007. — 357. — 874-884.
39. Cooper D.J. et al. Prehospital hypertonic saline resuscitation of patients with hypotension and severe traumatic brain injury: a randomized controlled trial // JAMA. — 2004. — 291. — 1350-1357.
40. Morgan T.J. The ideal crystalloid — what is ‘balanced’? // Curr. Opin. Crit. Care. — 2013. — 19. — 299-307.
41. Myburgh J.A. et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care // N. Engl. J. Med. — 2012. — 367. — 1901-1911.
42. Gan T.J. et al. Hextend, a physiologically balanced plasma expander for large volume use in major surgery: a randomized phase III clinical trial. Hextend Study Group // Anesth. Analg. — 1999. — 88. — 992-998.
43. Perner A. et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis // N. Engl. J. Med. — 2012. — 367. — 124-134.
44. Finfer S. et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit // N. Engl. J. Med. — 2004. — 350. — 2247-2256.
45. Caironi P. et al. Albumin replacement in patients with severe sepsis or septic shock // N. Engl. J. Med. — 2014. — 370. — 1412-1421.
46. Charpentier J., Mira J. Efficacy and tolerance of hyperoncotic albumin administration in septic shock patients: the EARSS study [abstract] // Intensive Care Med. — 2011. — 37 (Suppl. 1). — 115-0438.
47. Caironi P., Gattinoni L. The clinical use of albumin: the point of view of a specialist in intensive care // Blood Transfus. — 2009. — 7. — 259-267.
48. Cooper D.J. et al. Albumin resuscitation for traumatic brain injury: is intracranial hypertension the cause of increased mortality? // J. Neurotrauma. — 2013. — 30. — 512-518.
49. The SAFE Study Investigators et al. Effect of baseline serum albumin concentration on outcome of resuscitation with albumin or saline in patients in intensive care units: analysis of data from the saline versus albumin fluid evaluation (SAFE) study // BMJ. — 2006. — 333. — 1044-1046.
50. Finfer S. et al. Impact of albumin compared to saline on organ function and mortality of patients with severe sepsis // Intensive Care Med. — 2011. — 37. — 86-96.
51. Guevara M. et al. Albumin for bacterial infections other than spontaneous bacterial peritonitis in cirrhosis. A randomized, controlled study // J. Hepatol. — 2012. — 57. — 759-765.
52. Martin G.S. et al. Albumin and furosemide therapy in hypoproteinemic patients with acute lung injury // Crit. Care Med. — 2002. — 30. — 2175-2182.
53. Martin G.S. et al. A randomized, controlled trial of furosemide with or without albumin in ypoproteinemic patients with acute lung injury // Crit. Care Med. — 2005. — 33. — 1681-1687.
54. Brunkhorst F.M. et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis // N. Engl. J. Med. — 2008. — 358. — 125-139.
55. Schortgen F. et al. Effects of hydroxyethylstarch and gelatin on renal function in severe sepsis: a multicentre randomised study // Lancet. — 2001. — 357. — 911-916.
56. Mutter T.C., Ruth C.A., Dart A.B. Hydroxyethyl starch (HES) versus other fluid therapies: effects on kidney function // Cochrane Database Syst. Rev. — 2013 — 7. — CD007594.
57. Schick M.A. et al. The impact of crystalloid and colloid infusion on the kidney in rodent sepsis // Intensive Care Med. — 2010. — 36. — 541-548.
58. Wiedermann C.J., Joannidis M. Accumulation of hydroxyethyl starch in human and animal tissues: a systematic review // Intensive Care Med. — 2014. — 40. — 160-170.
59. Zarychanski R. et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis // JAMA. — 2013. — 309. — 678-688.
60. Cittanova M.L. et al. Effect of hydroxyethylstarch in brain-dead kidney donors on renal function in kidneytransplant recipients // Lancet. — 1996. — 348. — 1620-1622.
61. Annane D. et al. Effects of fluid resuscitation with colloids versus crystalloids on mortality in critically ill patients presen–ting with hypovolemic shock: the CRISTAL randomized trial // JAMA. — 2013. — 310. — 1809-1817.
62. Ertmer C., Annane D., Van Der Linden P. Is the literature inconclusive about the harm from HES? Yes // Intensive Care Med. — 2017. — 43. — 1520-1522.
63. European Medicines Agency. Hydroxyethyl-starch solutions (HES) should no longer be used in patients with sepsis or burn injuries or in critically ill patients // EMA. — 2014. — http://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/Solutions_for_infusion_containing_hydroxyethyl_starch/European_Commission_final_decision/WC500162361.pdf
64. US Food and Drug Administration. Vouluven (6% Hydroxyethyl starch 130/0.4 in 0.9% sodium chloride injection), for administration by intravenous infusion // FDA. — 2007. — https://www.fda.gov/downloads/biologicsbloodvaccines/bloodbloodproducts/approvedproducts/newdrugapplicationsndas/ucm083138.pdf
65. European Medicines Agency. Hydroxyethyl-starch solutions for infusion to be suspended — CMDh endorses PRAC recommendation: suspension due to serious risks of kidney injury and death in certain patient populations // EMA. — 2018. — http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2018/01/news_detail_002892.jsp&mid=WC0b01ac058004d5c1
66. Moeller C. et al. How safe is gelatin? A systematic review and meta-analysis of gelatin- containing plasma expanders versus crystalloids and albumin // J. Crit. Care. — 2016. — 35. — 75-83.
67. Perel P., Roberts I., Ker K. Colloids versus crystalloids for fluid resuscitation in critically ill patients // Cochrane Database Syst. Rev. — 2013. — 2. — CD000567.
68. Sakr Y., Rubatto Birri P.N., Kotfis K. et al. // Higher fluid balance increases the risk of death from sepsis: results from a large international audit // Crit. Care Med. — 2017. — 45(3). — 386-94.
69. O’Connor M.E., Prowle J.R. Fluid overload // Crit. Care Clin. — 2015. — 31(4). — 803-2.
70. Benes J., Kirov M., Kuzkov V. et al. Fluid therapy: double-edged sword during critical care? // Biomed Res Int. — 2015. — 729075.
71. Glassford N.J. et al. Defining the characteristics and expectations of fluid bolus therapy: a worldwide perspective // J. Crit. Care. — 2016. — 35. — 126-132.
72. Levy M.M., Evans L.E., Rhodes A. The surviving sepsis campaign bundle: 2018 update // Crit. Care Med. — 2018. — 46. — 997-1000.
73. Chowdhury A.H., Cox E.F., Francis S.T. et al. A randomi-
zed, controlled, double- blind crossover study on the effects of 2-l infusions of 0.9% saline and Plasma-Lyte 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers // Ann. Surg. — 2012. — 256. — 18-24.
74. Hjortrup P.B. et al. Restricting volumes of resuscitation fluid in adults with septic shock after initial management: the CLASSIC randomised, parallel- group, multicentre feasibility trial // Intensive Care Med. — 2016. — 42. — 1695-1705.
75. PRISM Investigators et al. Early goal-directed therapy for septic shock — a patient- level meta-analysis // N. Engl. J. Med. — 2017. — 376. — 2223-2234.
76. Andrews B. et al. Effect of an early resuscitation protocol on in- hospital mortality among adults with sepsis and hypotension: a randomized clinical trial // JAMA. — 2017. — 318. — 1233-1240.
77. Myles P.S. et al. Restrictive versus liberal fluid therapy for major abdominal surgery // N. Engl. J. Med. — 2018. — 378. — 2263-2274.
78. Moritz M.L., Ayus J.C. Maintenance intravenous fluids in acutely ill patients // N. Engl. J. Med. — 2015. — 373(14). — 1350-60.
79. Zampieri F.G. et al. Study protocol for the Balanced Solution Versus Saline in Intensive Care Study (BaSICS): a factorial randomised trial // Crit. Care Resusc. — 2017. — 19. — 175-182.
80. Hammond N.E. et al. The Plasma-Lyte 148 vs Saline (PLUS) study protocol: a multicentre, randomised controlled trial of the effect of intensive care fluid therapy on mortality // Crit. Care Resusc. — 2017. — 19. — 239-246.
81. Myburgh J. Patient- centered outcomes and resuscitation fluids // N. Engl. J. Med. — 2018. — 378. — 862-863.
82. Kellum J.A. Abnormal saline and the history of intravenous fluids // Nat. Rev. Nephrol. — 2018. — 14. — 358-360.
83. Malbrain M.L., Van Regenmortel N., Owczuk R. It is time to consider the four D’s of fluid management // Anaesthesiol Intensive Ther. — 2015. — 47. — 1-5.
84. Monnet X., Marik P.E., Teboul J.L. Prediction of fluid responsiveness: an update // Ann Intensive Care. — 2016. — 6 (1). — 111.

/69-1.jpg)
/71-1.jpg)
/72-1.jpg)