Журнал «Почки» Том 8, №1, 2019
Вернуться к номеру
Застосування діуретиків при застійній серцевій недостатності: офіційна заява Асоціації серцевої недостатності Європейського товариства кардіологів
Авторы: Wilfried Mullens(1, 2), Kevin Damman(3), Veli-Pekka Harjola(4), Alexandre Mebazaa(5), Hans-Peter Brunner-La Rocca(6), Pieter Martens(1, 2), Jeffrey M. Testani(7), W.H. Wilson Tang(8), Francesco Orso(9), Patrick Rossignol(10), Marco Metra(11), Gerasimos Filippatos(12, 13), Petar M. Seferovic(14), Frank Ruschitzka(15), Andrew J. Coats(16)
(1) — Ziekenhuis Oost Limburg, Genk, Belgium
(2) — University of Hasselt, Hasselt, Belgium
(3) — University of Groningen, University Medical Center Groningen, Groningen, The Netherlands
(4) — Emergency Medicine, University of Helsinki, Helsinki University Hospital, Helsinki, Finland
(5) — University of Paris Diderot, Hôpitaux Universitaires Saint Louis Lariboisière, APHP, U 942 Inserm, F-CRIN INI-CRCT, Paris, France
(6) — Maastricht University Medical Center, Maastricht, The Netherlands
(7) — Yale University, New Haven, CT, USA
(8) — Cleveland Clinic, Cleveland, OH, USA
(9) — University of Florence, Florence, Italy
(10) — Université de Lorraine, Inserm, Centre d’Investigations Clinique 1433 and Inserm U1116; CHRU Nancy; F-CRIN INI-CRCT, Nancy, France
(11) — University of Brescia, Brescia, Italy
(12) — National and Kapodistrian University of Athens, Athens, Greece
(13) — University of Cyprus, Nicosia, Cyprus
(14) — University of Belgrade, Faculty of Medicine, Belgrade, Serbia
(15) — UniversitätsSpital Zürich, Zürich, Switzerland
(16) — IRCCS, San Raffaele Pisana, Rome, Italy
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Для більшості епізодів гострої серцевої недостатності характерне посилення симптомів та ознак застійних явищ з об’ємним перенавантаженням. Мета терапії в таких пацієнтів полягає в полегшенні застійних явищ шляхом досягнення нормоволемії, головним чином за допомогою терапії діуретиками. Проте належне застосування діуретиків залишається складним, особливо при погіршенні функції нирок, резистентності до діуретиків та порушеннях балансу електролітів. У цій офіційній заяві розглядається застосування діуретиків при застійній серцевій недостатності. У роботі розглядаються поширені проблеми, такі як: 1) оцінка застійних явищ та клінічної нормоволемії; 2) оцінка відповіді на діуретики/резистентності до діуретиків при лікуванні гострої серцевої недостатності; 3) підхід до поетапних фармакологічних стратегій застосування діуретиків на основі відповіді на діуретики; 4) лікування поширених порушень балансу електролітів. Рекомендації наведені відповідно до доступних настанов, свідчень та експертних висновків.
Для большинства эпизодов острой сердечной недостаточности характерно усиление симптомов и признаков застойных явлений с объемной перенагрузкой. Цель терапии у таких пациентов заключается в облегчении застойных явлений путем достижения нормоволемии, главным образом с помощью терапии диуретиками. Однако должное применение диуретиков остается сложным, особенно при ухудшении функции почек, резистентности к диуретикам и нарушениях баланса электролитов. В этом официальном заявлении рассматривается применение диуретиков при застойной сердечной недостаточности. В работе рассматриваются распространенные проблемы, такие как: 1) оценка застойных явлений и клинической нормоволемии; 2) оценка ответа на диуретики/резистентности к диуретикам при лечении острой сердечной недостаточности; 3) подход к поэтапным фармакологическим стратегиям применения диуретиков на основе ответа на диуретики; 4) лечение распространенных нарушений баланса электролитов. Рекомендации приведены в соответствии с доступними руководствами, свидетельствами и экспертными выводами.
The vast majority of acute heart failure episodes are characterized by increasing symptoms and signs of congestion with volume overload. The goal of therapy in those patients is the relief of congestion through achieving a state of euvolaemia, mainly through the use of diuretic therapy. The appropriate use of diuretics however remains challenging, especially when worsening renal function, diuretic resistance and electrolyte disturbances occur. This position paper focuses on the use of diuretics in heart failure with congestion. The manuscript addresses frequently encountered challenges, such as (i) evaluation of congestion and clinical euvolaemia, (ii) assessment of diuretic response/resistance in the treatment of acute heart failure, (iii) an approach towards stepped pharmacologic diuretic strategies, based upon diuretic response, and (iv) management of common electrolyte disturbances. Recommendations are made in line with available guidelines, evidence and expert opinion.
діуретики; серцева недостатність; гостра серцева недостатність; фармакотерапія; петльові діуретики
диуретики; сердечная недостаточность; острая сердечная недостаточность; фармакотерапия; петлевые диуретики
diuretics; heart failure; acute heart failure; pharmacotherapy; loop diuretics
Природний перебіг серцевої недостатності характеризується епізодами гострої декомпенсації, що пов’язується з великою кількістю супутніх захворювань та високою смертністю та є тягарем для економіки нашого суспільства [1, 2]. Посилення ознак і симптомів застійних явищ є основною причиною надходження пацієнтів із гострою серцевою недостатністю до відділень невідкладної допомоги [3–5]. Незважаючи на те, що застійні явища часто розвиваються протягом тривалого часу до гострого прояву, у наступних розділах цієї роботи така ситуація буде називатися гострою серцевою недостатністю. Лише в невеликої частки пацієнтів виникають гострі ознаки й симптоми низької перфузії [4].
З огляду на важливу роль застійних явищ при серцевій недостатності діуретики є основою терапії при серцевій недостатності [6]. У настановах наполегливо рекомендується використання петльових діуретиків для полегшення ознак і симптомів гіперволемії (клас І, рівень доказовості В) [7]. У цій роботі розглядається практичне використання діуретиків у пацієнтів із гострою та хронічною серцевою недостатністю на основі сучасних свідчень та експертних висновків.
Застійні явища при серцевій недостатності
Визначення та механізми застійних явищ
Застійні явища при серцевій недостатності визначаються як ознаки та симптоми накопичення позаклітинної рідини, що призводить до підвищення тиску наповнення серця [8]. Тиск наповнення є об’єднаним результатом систолічної та діастолічної функції серця, об’єму плазми та венозної місткості/еластичності [9–11]. Серцева недостатність із підвищеною нейрогуморальною активацією призводить до затримки ниркового натрію та води, що викликає підвищення об’єму плазми [11, 12]. Окрім того, індуковане виведення призводить до внутрішнього звуження артерій і вен, що викликає перерозподіл крові з вісцеральної судинної системи до циркулюючої крові при наявному збільшенні об’єму [13]. У результаті збільшується венозний відтік та тиск наповнення серця [11]. Окрім того, ємнісна функція вен погіршується під час тривалого звуження вен та/або підвищеної індукованої активації при гострій серцевій недостатності [11, 14, 15]. Варто відзначити, що терміни «об’ємне перевантаження» та «застійні явища» часто використовуються як взаємозамінні. Проте було продемонстровано, що 54 % пацієнтів, які потрапляють до лікарні з приводу гострої серцевої недостатності, набирають ≤ 1 кг протягом місяця до госпіталізації, що дозволяє припустити, що термін «об’ємне перевантаження» недостатньо повно характеризує патофізіологію гострої серцевої недостатності і перерозподіл об’єму також сприяє розвитку ознак і симптомів застою крові [16, 17]. Окрім того, серцева недостатність часто пов’язується з кахексією, що утруднює інтерпретацію змін маси тіла. Також кахексія може призводити до втрати білків плазми крові, зниження онкотичного тиску плазми, утруднення відновлення об’єму плазми з інтерстиціальної тканини [18, 19]. Окрім того, зниження маси тіла під час госпіталізації не обов’язково пов’язане з підвищенням частоти стаціонарних супутніх захворювань та смертності або супутніх захворювань та смертності після виписки, проте збільшення маси тіла може пов’язуватися з несприятливим результатом [20, 21]. У зв’язку з цим у настановах Європейського товариства кардіологів (ESC) щодо діагностики та лікування гострої та хронічної серцевої недостатності рекомендується розрізняти гострий перерозподіл рідини та об’ємне перевантаження у пацієнтів із застійними явищами (некласова рекомендація) [7]. Оскільки діуретики головним чином застосовуються для зниження надлишкового об’єму, наступні розділи роботи будуть присвячені застійним явищам із надмірним об’ємним перевантаженням.
Виявлення застійних явищ при серцевій недостатності
Незважаючи на те, що внутрішньосудинне співвідношення між тиском та об’ємом може відрізнятися в різних пацієнтів та в різних клінічних ситуаціях, золотим стандартом діагностики застійних явищ при серцевій недостатності є катетеризація серця з безпосереднім вимірюванням тиску у правому передсерді та тиску заклинювання у легеневих капілярах (PCWP) [22]. Проте інвазивна природа цього методу обмежує його рутинне використання в клінічній практиці. Окрім того, використання катетеризації легеневої вени для управління протизастійною терапією не призвело до покращення результатів у дослідженні застійної серцевої недостатності та ефективності катетеризації легеневої артерії (ESCAPE) порівняно з серійним клінічним обстеженням, незважаючи на значне покращення гемодинаміки [23]. Діагностична точність неінвазивних клінічних та технічних досліджень застійних явищ оцінювалася порівняно з інвазивним дослідженням гемодинаміки та характеризувалася мінливою чутливістю та специфічністю (табл. 1) [22–28]. Фізичні ознаки і симптоми застійних явищ ґрунтуються на визначенні підвищеного тиску наповнення та/або накопичення екстрасудинної рідини на фоні підвищеного тиску наповнення. Таким чином, пульс яремної вени є найбільш корисним результатом фізичного обстеження для визначення об’ємного статусу пацієнта. Прискорений пульс яремної вени (ПЯВ) вказує на системні застійні явища, окрім того, існує висока чутливість (70 %) та специфічність (79 %) між високим ПЯВ та підвищеним лівостороннім тиском наповнення. Зміни ПЯВ під час терапії зазвичай відображають зміни у лівосторонньому тиску наповнен–ня, хоча існує значна варіабельність суб’єктивної експертної оцінки щодо ступеня підвищення ПЯВ [29–31]. Проте серія досліджень за участю 50 пацієнтів із хронічною серцевою недостатністю продемонструвала, що фізичні ознаки застійних явищ (хрипи, набряк та прискорення ПЯВ) були відсутні у 42 % пацієнтів з PCWP ≥ 22 мм рт.ст. [32]. Окрім того, навички проведення фізичного обстеження в поточній практиці погіршилися [33]. Також у той час як рентген грудної клітки може показувати ознаки застою в легенях і плевральній рідині, відхилення на рентгені грудної клітки відсутні у 20 % пацієнтів із застійними явищами [34]. Порівняно з рентгеном грудної клітки ультразвукова діагностика легень є більш ефективною щодо виключення інтерстиціального набряку та плеврального ексудату. Ультразвук легень дозволяє визначити В-лінії, що йдуть із позасудинної рідини до інтерстиціальної тканини та альвеол [35, 36]. Більше трьох В-ліній у понад двох міжреберних просторах білатерально вважаються діагностичним показником, за яким визначається набряк інтерстиціальної тканини та альвеол при гострій серцевій недостатності. Ехокардіографічні параметри (табл. 1) можуть використовуватися для оцінки право- та лівостороннього тиску наповнення, хоча й з меншою точністю при гострій серцевій недостатності [25]. Оцінка тиску в правому передсерді може виконуватися шляхом оцінки спадання та ширини порожнистої вени. Для оцінки лівостороннього тиску наповнення можуть використовуватися допплерографія та тканинна допплерографія. При підвищенні тиску наповнення спостерігається підвищення швидкості раннього діастолічного мітрального наповнення (E-хвиля). Це вказує на збільшення тиску наповнення за наявності низького e’, особливо при короткому періоді сповільнення кровотоку та низькій швидкості А-хвилі [28]. Незважаючи на це, використання e’ може бути обмеженим на пізній стадії серцевої недостатності [25]. У настановах рекомендується виконувати оцінку натрійуретичних пептидів (NP) у всіх пацієнтів із гострою серцевою недостатністю, зокрема, для визначення некардіальних причин диспное (рекомендація класу І, рівень доказовості А) [7]. NP мають високу прогностичність негативного результату для виключення гострої серцевої недостатності із застійними явищами (пороги для виключення гострої серцевої недостатності: натрійуретичний пептид В-типу (ВNP) < 100 пг/мл, N-термінальний про-ВNP (NT-proBNP) < 300 нг/мл і середньорегіональний передсерцевий натрійуретичний пептид < 120 пг/мл) [7, 37]. У пацієнтів із серцевою недостатністю або захворюванням серця в анамнезі комбінація ознак і симптомів застійних явищ, результати рентгену грудної клітки та визначення підвищених рівнів NT дозволяють діагностувати застійні явища [22, 38]. Залежно від локальної доступності ці дослідження можуть об’єднуватися з трансторакальною ехокардіографією або ультразвуковим дослідженням легень. Відповідно до настанов ESC безпосередня оцінка гемодинаміки показана пацієнтам із кардіогенним шоком, стійким до лікування набряком легень або підозрюваною невідповідністю між ліво- та правостороннім тиском наповнення (рекомендація класу IIb, рівень доказовості С) або у випадках невизначеності гемодинамічного статусу [7].
Визначення нормоволемії
Велика кількість пацієнтів виписується з лікарні з залишковими симптоматичними застійними явищами [39–41]. Наприклад, за оцінкою лікуючого лікаря у дослідженні з оцінки стратегій оптимізації застосування діуретиків (DOSE-AHF), нормоволемія була досягнута лише у 15 % пацієнтів після протизастійної терапії [42]. Варто відзначити, що симптоматичні застійні явища при виписці з лікарні є важливим прогностичним фактором несприятливого результату та повторної госпіталізації, особливо при погіршенні функції нирок [20, 43, 44]. Проте навіть у пацієнтів з обмеженими клінічними ознаками та симптомами застійних явищ при виписці з лікарні результат може залишатися несприятливим, що вказує на роль безсимптомних застійних явищ [45]. Полегшення диспное є поганим маркером усунення застійних явищ, оскільки в пацієнтів без диспное часто залишаються значні симптоматичні або гемодинамічні застійні явища [39, 46]. Те саме стосується й аналогічного зменшення маси тіла при стабільному стані пацієнта [47]. Визначення нормоволемії або оптимальної точки припинення протизастійної терапії залишається основною проблемою при серцевій недостатності. На сьогодні не існує надійного експрес-тесту для визначення нормоволемії, оскільки не встановлено, що включає нормоволемія. Теоретично вона пов’язана з оптимальним об’ємом рідини, що дозволяє організму задовольняти метаболічні потреби без надлишку інтерстиціальної рідини або розвитку несприятливого підвищення тиску наповнення серця. Насправді більшість неінвазивних клінічних досліджень, спрямованих на визначення застійних явищ, використовується як сурогатні точки для визначення наявності підвищеного тиску наповнення (тиск у правому передсерді > 7 мм рт.ст. або PCWP > 18 мм рт.ст.) [48]. Проте їх ефективність для визначення точки нормоволемії без залишкового гемодинамічного застою не встановлена. Підвищений інтерес викликають біомаркери для визначення стану усунення застійних явищ, оскільки вони мають перевагу в простоті визначення. Для їх використання як біомаркерів усунення застійних явищ маркери повинні не лише співвідноситися з застійними явищами в певній контрольній точці, але й швидко та точно відповідати на зміни у статусі застійних явищ. NP вивільняються у відповідь на підвищене навантаження на стінку міокарда, таким чином відображаючи інтракардіальний тиск наповнення. Проте на рівні NP, окрім навантаження на стінку, може впливати велика кількість додаткових факторів [37, 49]. На сьогодні жодне рандомізоване контрольоване дослідження не показало, що протизастійна терапія на основі рівня NP забезпечує покращення результату лікування при гострій серцевій недостатності [50]. Проте зміни концентрацій NP із часом можуть допомогти стратифікувати ризик більш детально, оскільки зниження раніше підвищених рівнів NP, досягнуте спонтанно або за допомогою відповідної медикаментозної терапії, як видно, пов’язується з покращенням клінічних результатів [50, 51]. Розчинний CD146, карбогідрат-антиген 125 та адреномедулін є новітніми біомаркерами, що більш точно відображають судинний застій. Вони можуть надати поетапну інформацію на додачу до NP щодо серцевих застійних явищ. Проте їх використання на сьогодні обмежується галуззю досліджень, і вони менш поширені у клінічній практиці [52–54]. Підвищення гемоглобіну (гемоконцентрація) після усунення застійних явищ було запропоноване як маркер зниження внутрішньосудинного об’єму [55–57]. Проте гемоконцентрація є лише сурогатним маркером відносного зниження об’єму плазми між двома контрольними точками і тому не може вказувати на абсолютний об’єм плазми (який може бути цільовим) [58]. Тільки пізня гемоконцентрація (наприклад, протягом останніх днів госпіталізації) пов’язувалася з покращеним результатом, що робить її поганим кандидатом для використання як орієнтиру при протизастійній терапії [56]. Окрім того, зміни в гематокритному числі є незначними й також можуть бути пов’язаними з кровотечею, флеботомією, накопиченням крові в селезінці та змінами положення. Варто відзначити, що підвищення креатиніну плазми крові часто інтерпретується у клінічній практиці як зниження ефективного циркулюючого об’єму, у зв’язку з чим лікарі знижують інтенсивність протизастійної терапії, ґрунтуючись часто на хибному припущенні, що подальша протизастійна терапія може призвести до ураження ниркових канальців. Насправді під час протизастійної терапії при підвищенні креатиніну не слід автоматично припиняти протизастійну терапію, особливо якщо застійні явища зберігаються. Окрім того, підвищення креатиніну під час протизастійної терапії не пов’язується з ураженням ниркових канальців [59, 60]. Клінічні результати є дуже несприятливими, якщо пацієнти виписуються із залишковими застійними явищами на фоні погіршення функції нирок [20]. Крім того, надмірна увага до серійної оцінки рівня біомаркерів як сурогатного маркера змін в об’ємному статусі може призвести до невідповідного підвищення дози петльових діуретиків у пацієнтів зі значними залишковими застійними явищами, що може підвищити частоту гіпотензії, дисфункції нирок та інших небажаних явищ. У той же час покращення рівнів біомаркерів може надати хибну впевненість у можливому усуненні застійних явищ. Згідно з попередньою офіційною заявою, використання оцінки застійних явищ на основі низки параметрів перед випискою з використанням клінічної оцінки у стані спокою та під час динамічних операцій, а також біомаркерів та технічних оцінок відповідно до локального досвіду, імовірно, є найкращою сучасною стратегією (рис. 1), проте вона ніколи не досліджувалась проспективно [22, 61, 62].
Механізми дії діуретиків при серцевій недостатності
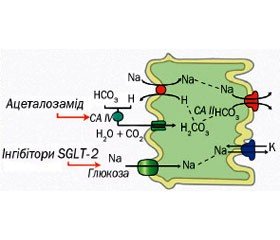
При застійних явищах з об’ємним перевантаженням хронічна затримка натрію та води сприяє подальшому збільшенню внутрішньосудинного об’єму, що призводить до надмірного накопичення екстраваскулярної рідини. Окрім ультрафільтрації, єдиним шляхом виведення натрію та води є підвищення натрійурезу та діурезу. Діуретики збільшують виведення натрію та води. Детальне знання їх фармакокінетики та фармакодинаміки є обов’язковим для успішного застосування [63]. Локалізація дії клітинних механізмів різних діуретиків подана на рис. 2, а огляд їх фармакологічних властивостей — у табл. 2 [64].
Відповідь та резистентність до діуретиків при серцевій недостатності
У процесі досягнення нормоволемії ступінь об’ємного перевантаження та відповіді на діуретики визначає успіх терапії [65]. Можливість стимулювання натрійурезу або діурезу після застосування діуретиків називається відповіддю на діуретики. Стійкістю до діуретиків називають зниження чутливості до діуретиків, що призводить до зниження натрійурезу та обмеження можливості досягнення нормоволемії [66]. Відповідь на діуретики слід інтерпретувати з урахуванням дози та типу застосованого діуретичного засобу, а також ступеня об’ємного перевантаження, конституції та функції нирок. Оскільки петльові діуретики формують основу терапії діуретиками при серцевій недостатності, терміни «резистентність до діуретиків» та «резистентність до петльових діуретиків» часто використовуються як взаємозамінні [65, 67–69]. Для того, щоб оцінити відповідь на терапію з діуретиками, лікарям потрібен індикатор відповіді на діуретики. На сьогодні часто використовуються чисте виведення рідини та зміни маси тіла. Хоча оцінка маси тіла може здаватися простою, вона має технічні складнощі, і коливання маси тіла можуть не відображати зміни в об’ємному перерозподілі [47]. Окрім того, співвідношення між зменшенням маси тіла та виведенням рідини є низьким [47].
Оскільки метою терапії діуретиками є виведення надлишкового натрію (та супутньої води), останнім часом поновився інтерес до оцінки вмісту натрію у сечі як індикатора відповіді на діуретики [70–73]. Окрім оцінки вмісту натрію у регулярних аналізах сечі, аналіз разової порції сечі через 1–2 години після застосування петльового діуретика нещодавно продемонстрував чудове співвідношення із загальним виведенням натрію в аналізі сечі, узятому через 6 годин [73]. Ця стратегія дозволить клініцисту систематично та своєчасно визначати відповідь на петльові діуретики, що може забезпечити більш своєчасне корегування терапії. Проте вміст натрію в сечі значно змінюється протягом послідовних днів терапії петльовими діуретиками при гострій серцевій недостатності [74]. Незважаючи на постійний підвищений об’єм виведення сечі (діурез), об’єм виведення натрію нирками (натрійурез) із часом зменшується. У зв’язку з цим протягом послідовних днів терапії петльовими діуретиками виробляється все більш гіпотонічна сеча, що може бути пов’язане з великою кількістю факторів, включаючи зміну ниркової гемодинаміки, абсорбцію різного субстрату (натрій та/або діуретики), нейрогормональні фактори та структурні зміни в нирках. Хоча декілька досліджень показали прогностичну цінність вмісту натрію у сечі після першого застосування петльових діуретиків, його прогностична цінність протягом послідовних днів не досліджена.
Патофізіологія резистентності до діуретиків є багатофакторною та включає активацію симпатичної нервової системи, активацію ренін-ангіотензин-альдостеронової системи (РААС), ремоделювання нефронів, зміни функції нирок в анамнезі, порушення фармакокінетики та динаміки діуретиків та внутрішньосудинну гіповолемію у зв’язку з повільним відновленням об’єму плазми [65, 75, 76]. У зв’язку з цим рекомендується поетапний фармакологічний підхід, спрямований на досягнення успішного усунення застою з корекцією терапії з діуретиками на основі оцінки терапії на початковій стадії та повторної оцінки терапії замість стандартної терапії з петльовими діуретиками у високих дозах у пацієнтів із погіршенням функції нирок (підвищення креатиніну сироватки крові на > 0,3 мг/дл протягом попередніх 12 тижнів перед декомпенсацією) за оцінкою аналізу post-hoc дослідження DOSE-AHF та дослідження з оцінки оптимізації ниркових стратегій (ROSE-AHF) [77, 78].
Практичне застосування діуретиків при гострій серцевій недостатності
Цілі терапії при гострій декомпенсованій серцевій недостатності
Перед початком протизастійної терапії у пацієнтів із гострою декомпенсацією необхідно визначити, що є причиною застою — об’ємне перевантаження або об’ємний перерозподіл [79]. Цілі терапії пацієнтів із застоєм та об’ємним перевантаженням включають: 1) досягнення повного усунення застійних явищ без залишкового об’ємного перевантаження. Незважаючи на це, часто складно визначити оптимальну точку припинення протизастійної терапії, як зазначено вище; 2) забезпечення достатнього перфузійного тиску для забезпечення перфузії органів; 3) підтримку медикаментозної терапії відповідно до настанов, оскільки ці лікарські засоби також можуть підвищувати відповідь на діуретики та підвищувати довгострокову виживаність [80, 81]. Пацієнти з серцевою недостатністю зі зниженою (HFrEF) або збереженою фракцією викиду (HFpEF), у яких виникає декомпенсація, можуть мати аналогічний профіль застійних явищ [82, 83]. У зв’язку з цим мета протизастійної терапії є аналогічною щодо використання діуретиків у пацієнтів із HFrEF і HFpEF [7]. Практичний поетапний підхід до терапії з діуретиками та оцінки при гострій серцевій недостатності наведений на рис. 3. Після досягнення нормоволемії слід продовжувати терапію з петльовими діуретиками в найнижчій дозі, за якої можливе підтримання нормоволемії [7, 8]. Окрім того, велике значення має включення пацієнтів до детальної міждисциплінарної програми лікування серцевої недостатності, сприяння дотриманню режиму та схеми лікування, підвищення дози терапії, що змінює перебіг захворювання, кардіореабілітація, лікування основних супутніх захворювань, своє–часне подальше спостереження в лікарні та скринінг на предмет потреби в додаткових апаратних та медикаментозних втручаннях [7].
Петльові діуретики
Петльові діуретики формують основу терапії з діуретиками й застосовуються для лікування більше ніж 90 % пацієнтів [3]. Петльові діуретики мають високий ступінь зв’язування з білками (> 90 %) та повинні виділятися в проксимальний звивистий каналець через декілька органічних переносників аніонів. У зв’язку з цим велике значення має належне дозування з достатніми рівнями у плазмі, оскільки функція нирок часто знижується при серцевій недостатності, що призводить до зниження секреції петльових діуретиків. Окрім того, зниження вмісту білка у плазмі може призвести до зниження секреції петльових діуретиків. Петльові діуретики інгібують симпортер Na-K-2Cl на висхідній петлі Генле та мають найбільш сильний діуретичний ефект, сприяючи виведенню натрію та хлору (та калію, хоча і меншою мірою, ніж тіазиди) [64]. Фармакологічні властивості різних петльових діуретиків наведені в табл. 2. Біодоступність фуросеміду при пероральному застосуванні є дуже мінливою (10–90 %) та залежить від абсорбції зі шлунково-кишкового тракту до кровотоку [6]. Біодоступність торасеміду при пероральному застосуванні є стабільно вищою від 80–90 %. Окрім того, торасемід має довший період напіввиведення в пацієнтів із серцевою недостатністю порівняно з фуросемідом і буметанідом [84]. Незважаючи на те, що результати деяких невеликих досліджень вказують на вищий діуретичний ефект торасеміду, відмінності між різними петльовими діуретиками не вивчалися в масштабних рандомізованих дослідженнях [85]. У дослідженні порівняння торасеміду та фуросеміду в лікуванні серцевої недостатності (TRANSFORM-HF) (NCT03296813) планується рандомізувати 6000 госпіталізованих пацієнтів із серцевою недостатністю. Хоча серцева недостатність не є обов’язковою причиною госпіталізації, дослідження має на меті визначення відмінностей між фуросемідом і торасемідом щодо первинної кінцевої точки — смертності з усіх причин. У зв’язку з широким діапазоном біодоступності фуросеміду при пероральному застосуванні існує похибка в перерахунку. У зв’язку з цим пероральна доза 40 мг фуросеміду в цілому еквівалентна 10–20 мг торасеміду й 0,5–1 мг буметаніду. Важливо відзначити,
що петльові діуретики також можуть призвести до вивільнення реніну щільною плямою, блокуючи засвоєння хлору та забезпечуючи додаткову стимуляцію РААС. Окрім того, тривале застосування діуретиків стимулює компенсаційну дистальну тубулярну реабсорбцію натрію у зв’язку з гіпертрофією тубулярних клітин, що призводить до зниження натрійурезу [8]. У настановах рекомендується застосовувати внутрішньовенні петльові діуретики при гострій серцевій недостатності, оскільки засвоєння пероральних діуретиків (зокрема, фуросеміду) може пригнічуватися на фоні застійних явищ у зв’язку з набряком кишечника (клас І, рівень доказовості В) [7]. Важливим є оптимальне дозування та час застосування внутрішньовенних петльових діуретиків. Петльові діуретики проявляють порогові концентрації для стимулювання натрійурезу, у зв’язку з чим необхідна мінімальна доза препарату до підвищення показника виведення натрію [6, 86]. Після цього необхідне прямо пропорційне збільшення дози для досягнення порога натрійуретичної відповіді. Подальше збільшення дози петльових діуретиків вище від цього порога не забезпечить збільшення показника пікового натрійурезу, проте це призведе до більш тривалого періоду петльового діуретика понад пороговим рівнем, а отже, до підвищення загального натрійурезу. Аналогічним чином багаторазові застосування можуть забезпечити додатковий натрійурез, оскільки вони підвищують час над натрійуретичним порогом. Ці фармакологічні характеристики обумовили такі рекомендації при гострій серцевій недостатності: 1) пацієнти з гострою серцевою недостатністю, які раніше не отримували діуретики, повинні отримувати дозу внутрішньовенного фуросеміду, еквівалентну принаймні 20–40 мг фуросеміду. Більш високу дозу слід розглянути для пацієнтів із дисфункцією нирок в анамнезі, оскільки вона пов’язується з правостороннім зміщенням на кривій «доза — відповідь» [6, 86]; 2) пацієнти на амбулаторному діуретичному режимі повинні отримувати препарат внутрішньовенно в дозі, еквівалентній принаймні попередній пероральній дозі. Дослідження DOSE-AHF продемонструвало, що висока доза петльових діуретиків (у 2,5 раза вища від звичайної домашньої дози, з еквівалентом дози фуросеміду принаймні 80 мг/добу) порівняно з низькою дозою (еквівалентна домашній дозі) забезпечила сприятливий ефект щодо додаткових клінічних точок — полегшення диспное, зміна маси тіла та загальна втрата рідини [42]. Погіршення функції нирок (визначається як підвищення креатиніну на більш ніж 0,3 мг/дл) частіше спостерігалося у групі з вищою дозою. Проте аналіз post-hoc дослідження DOSE-AHF продемонстрував, що це підвищення креатиніну не було прогностичним фактором гіршого результату [87]. Окрім того, група з вищою дозою пов’язувалася з кращими результатами при коригуванні на загальний отриманий об’єм петльових діуретиків, що вказує на те, що належне дозування петльових діуретиків для досягнення порога є основою [88]. Визначення індивідуальної порогової дози для пацієнта є складним та обумовлене великою кількістю факторів, включаючи попередню терапію з петльовими діуретиками, конституцію, ступінь об’ємного перевантаження та функцію нирок. Проте внутрішньовенна доза фуросеміду 400–600 мг і буметаніду 10–15 мг вважаються максимальною загальною добовою дозою, при перевищенні якої очікується обмежений додатковий натрійурез зі збільшенням частоти побічних ефектів. Загалом петльові діуретики застосовуються багаторазово (двічі або тричі на добу). Внутрішньовенні петльові діуретики повинні застосовуватися якомога раніше, оскільки застосування петльових діуретиків на ранньому етапі пов’язується з нижчою внутрішньолікарняною смертністю [89]. У дослідженні DOSE-AHF не спостерігалося різниці між тривалою та болюсною інфузією. Проте перед тривалою інфузією не застосовувалася ударна болюсна доза, що могло призвести до недосягнення порогової дози у групі тривалої інфузії. При болюсній інфузії дози слід дотримуватися 6-годинних інтервалів між дозами для максимального збільшення часу понад натрійуретичним порогом та з метою уникнення зворотної затримки натрію [90]. Перед тривалою інфузією слід застосовувати ударну дозу, що забезпечує своєчасне досягнення стабільної концентрації діуретика у плазмі крові [6].
Поетапне фармакологічне лікування
Оцінка на ранньому етапі та інтенсифікація терапії з петльовими діуретиками
Більша частина діуретичного ефекту внутрішньовенних петльових діуретиків проявляється протягом перших декількох годин з відновленням вихідних показників виведення натрію через 6–8 годин. У зв’язку з цим оцінка відповіді на діуретики на ранньому етапі є обов’язковою та дозволяє ідентифікувати пацієнтів з поганою відповіддю на діуретики [67, 69, 73, 74]. Це дозволить підвищити дозу петльових діуретиків на ранньому етапі та/або застосувати стратегію послідовної блокади нефронів (комбінування діуретиків з різним механізмом дії). Хоча ця концепція очікує формальної перевірки у проспективних дослідженнях, така стратегія є важливою у декількох аспектах. По-перше, стійкі застійні явища продовжують уражати функції органів [91]. По-друге, швидкість відновлення об’єму плазми (швидкість, із якою рідина мобілізується з інтерстиціальної тканини до плазмового компартменту) може знизитися під час усунення застійних явищ [92, 93]. По-третє, пацієнти часто госпіталізуються до відділень невідкладної допомоги протягом перших днів, коли інтенсивна адаптація до терапії є більш ймовірною, ніж у звичайному відділенні. Окрім того, більш швидке усунення застійних явищ може бути особливо цінним у системах охорони здоров’я, що передбачають коротке перебування у стаціонарі.
Окрім оцінки основних показників життєдіяльності, щоденної маси тіла та ознак/симптомів застійних явищ згідно з настановами ESC (рекомендація класу І, рівень доказовості С), ця група дослідження кардіоренальної дисфункції пропонує активно оцінювати відповідь на діуретики на ранніх етапах після початку терапії. Відповідь на діуретики може оцінюватися з використанням об’єму виведення сечі та післядіуретичного (разова порція) вмісту натрію у сечі (рис. 3). Для забезпечення стандартизації та вірогідних результатів пацієнтам із застійними явищами необхідно звільнити сечовий міхур перед застосуванням діуретиків. Ступінь наповнення сечового міхура можна перевірити за допомогою його сканування. Після цього визначення вмісту натрію в разовій порції сечі дозволяє клініцисту інтерпретувати відповідь на діуретики, що дає можливість втручання при низькому вмісті натрію. На фоні застійних явищ з об’ємним перевантаженням уміст натрію у разовій порції сечі < 50–70 мЕкв/л через 2 години та/або щогодинний діурез об’ємом < 100–150 мл протягом перших 6 годин зазвичай вказує на недостатню відповідь на діуретики [72, 73, 94]. У пацієнтів із недостатнім діурезом після першого внутрішньовенного застосування петльових діуретиків уміст натрію в сечі майже завжди є високим. Проте останні дані вказують на те, що в пацієнтів із невеликим/середнім об’ємом виведення сечі вміст натрію в разовій пор–ції сечі забезпечує незалежну прогностичну інформацію щодо госпіталізацій у зв’язку з серцевою недостатністю, окрім об’єму діурезу [71]. Своєчасне подвоєння дози петльових діуретиків може забезпечити більш швидке досягнення порогової дози петльових діуретиків (як зазначено в розділі «Петльові діуретики»). Після досягнення цих доз слід розглянути можливість додавання іншого діуретика, оскільки подальше підвищення дози петльового діуретика не забезпечує поступового збільшення діурезу/натрійурезу. У дослідженні кардіоренальної допомоги при гострій декомпенсованій серцевій недостатності (CARRESS-HF) стратегія поетапної фармакологічної терапії порівнювалася з ультрафільтрацією у пацієнтів із декомпенсованою серцевою недостатністю з погіршенням функції нирок і стійким застоєм (рис. S1 у допоміжних матеріалах online). Підхід до фармакологічного лікування з використанням оцінки діурезу на ранньому етапі з корегуванням дози петльового діуретика та додаванням тіазидного діуретика забезпечив аналогічне усунення застою порівняно з ультрафільтрацією, проте з меншою кількістю серйозних небажаних явищ [95]. Результати порівняльних аналізів post-hoc досліджень DOSE-AHF і ROSE-AHF вказують на те, що підхід поетапного фармакологічного лікування також пов’язується з більшим загальним об’ємом утраченої рідини та маси без погіршення функції нирок [77, 78]. Оскільки вміст натрію в сечі зазвичай змінюється пропорційно об’єму діурезу протягом першого дня протизастійної терапії (за відсутності надмірного споживання рідини пацієнтом), оцінка вмісту натрію в сечі разом з об’ємом сечі є доцільною для корегування інтенсивності дози діуретиків у перший день. Дані щодо доцільності використання вмісту натрію у сечі протягом наступних днів протизастійної терапії є неповними. У дослідженні CARRESS-HF діурез > 5 л на добу дозволив лікарям знизити дозу діуретиків, проте продовження режиму лікування з діуретиками може бути прийнятним при стабільній функції нирок та стабільному артеріальному тиску.
Паралельне застосування з тіазидом або тіазидними препаратами
Тіазид і тіазидні діуретики становлять великий клас препаратів, що блокують котранспортер хлориду натрію (NCC) у дистальному звивистому канальці [96]. Тому з теоретичної точки зору вони можуть частково обходити дистальну підвищену авідність до натрію, що виникає на фоні тривалого застосування петльових діуретиків. Існують значні географічні відмінності у використанні тіазидних діуретиків, і метолазон є найпоширенішим тіазидним діуретиком у Сполучених Штатах Америки [97]. Різні молекули мають однаковий ефект блокування NCC, проте вони відрізняються щодо періодів напіввиведення та побічних ефектів (табл. 2). На відміну від петльових діуретиків метолазон і хлорталідон характеризуються повільною шлунково-кишковою абсорбцією (час до піку до 8 годин) і дуже довгим періодом напіввиведення, тому при початку терапії з низькими пероральними дозами їх слід застосовувати з великою перервою перед застосуванням петльових діуретиків, оскільки досягнення стабільного стану потребує тривалого часу. Проте хлортіазид має короткий період напіввиведення, тому повинен застосовуватися ближче до часу застосування петльових діуретиків. У здорових пацієнтів максимальний діуретичний ефект тіазиду обмежений та забезпечує діуретичну відповідь максимум 30–40 % при застосуванні петльового діуретика у монотерапії [96]. Тіазиди також зв’язуються з білками та потребують достатнього ниркового кровотоку для секреції в канальці. Окрім того, тіазиди можуть стимулювати значний калійурез, оскільки при втраті кожного іона натрію виділяються 2–3 іони калію [98]. Цей ефект втрати калію є особливо вираженим при підвищеному альдостероні, як при серцевій недостатності [99]. Наукове обґрунтування застосування тіазидів при гострій серцевій недостатності обумовлене підвищеною авідністю дистальних нефронів до натрію у випадку (тривалого) застосування петльових діуретиків [100]. Окрім того, дані досліджень на тваринах свідчать про те, що гіпертрофія дистальних відділів нефронів виникає після тривалого застосування петльових діуретиків, що певною мірою пояснює резистентність до петльових діуретиків [101]. На відміну від традиційної школи останні дані свідчать про ефективність тіазидів у пацієнтів зі зниженою швидкістю клубочкової фільтрації (< 30 мл/хв)
[102]. Результати рандомізованих контрольованих досліджень застосування тіазидних діуретиків при серцевій недостатності не були опубліковані. У даний час триває дослідження порівняння метолазону із хлортіазидом при гострій декомпенсованій серцевій недостатності зі стійкістю до діуретиків (NCT03574857). Метааналіз доступних даних спостережень підкреслює часте виникнення гіпокаліємії. В аналізі за показником схильності застосування тіазидів на практиці (у комбінації з петльовими діуретиками у низьких дозах) та петльових діуретиків у високих дозах у пацієнтів із серцевою недостатністю тіазиди, але не петльові діуретики у високих дозах були незалежними прогностичними факторами виникнення гіпонатріємії та гіпокаліємії з показником високого ризику смертності з усіх причин [103]. Враховуючи відносну безпеку петльових діуретиків у дослідженні DOSE-AHF, бажаним є початкове збільшення дози петльового діуретика перед додаванням тіазидного діуретика [42]. Проте у дослідженні CARRESS-HF додавання метолазону було невід’ємною частиною поетапного фармакологічного алгоритму, що обумовило рекомендацію застосування тіазидів як препаратів другої лінії у практичних настановах Товариства серцевої недостатності Америки [90].
Антагоністи мінералокортикоїдного рецептора
Антагоністи мінералокортикоїдного рецептора (АМР) проявляють плейотропні ефекти, проте їх ренальні ефекти включають модуляцію натрієвих та калієвих каналів у дистальному відділі нефрона. АМР мають рекомендацію І класу як лікарські засоби, що змінюють перебіг захворювання при симптоматичній хронічній HFrEF, нейтралізуючи виведення альдостерону, викликане надмірною нейрогормональною активацією [104, 105]. Нещодавно поступовий діуретичний ефект терапії з АМР у високих дозах на додаток до стандартної терапії з петльовими діуретиками при гострій серцевій недостатності вивчався у дослідженні цільової нейрогормональної терапії, спрямованої на альдостерон у комбінації з натрійурезною терапією при серцевій недостатності (ATHENA-HF) [106]. Терапія з 100 мг спіронолактону на добу не була більш ефективною порівняно з 25 мг на добу щодо зниження рівня NT-proBNP або підвищення діурезу через 96 годин. Проте, як показано у табл. 2, спіронолактон є пролікарським засобом, що проявляє дію через 48–72 години після перорального застосування, що може пояснити відсутність ефекту, що спостерігався. Проте АМР у високих дозах були безпечними, оскільки не призвели до гіперкаліємії або погіршення функції нирок. Окрім того, терапія з АМР може бути корисною для нейтралізації гіпокаліємічного ефекту петльових і тіазидних діуретиків, що призводять до втрати калію [106–108]. Варто відзначити, що дані свідчать про виражене низьке використання АМР як класу препаратів, що змінюють перебіг захворювання, при HFrEF [109]. Згідно з висновком експертної групи, початок застосування АМР на ранній стадії у регулярній дозі (25 мг) може бути корисним для зниження частоти гіпокаліємії, викликаної терапією, та може забезпечити вищий шанс виписки пацієнтів із HFrEF з оптимізованим режимом лікування, що змінює перебіг захворювання. Проте застосування АМР на гострій стадії захворювання повинне бути індивідуалізовано з тимчасовим припиненням застосування у випадку розвитку гіперкаліємії.
Ацетазоламід
У зв’язку з гемодинамічними змінами при серцевій недостатності при зниженні ниркового кровотоку з відповідним підвищенням фільтраційної фракції виникають значні підвищення авідності до натрію у проксимальному канальці нефрона [9, 63]. По-перше, більшість натрію реабсорбується у проксимальному канальці нефрона, особливо при декомпенсованій серцевій недостатності. По-друге, збільшене постачання хлору до клітин щільної плями призводить до зниження вироблення реніну, зменшуючи нейрогуморальну активацію [9]. По-третє, ендогенні натрійуретичні пептиди (що діють у дистальному нефроні), імовірно, відновлять свої ефекти [110]. Інгібітор карбоангідрази ацетазоламід пригнічує реабсорбцію натрію у проксимальних канальцях. Неекспериментальне дослідження за участю пацієнтів із декомпенсованою серцевою недостатністю та вираженим об’ємним перевантаженням показало, що додавання ацетазоламіду (500 мг у вигляді внутрішньовенної болюсної інфузії на додаток до петльових діуретиків) призвело до покращення відповіді на петльові діуретики з виведенням ~100 ммоль Na+ при дозах, еквівалентних 40 мг фуросеміду [69]. Окрім того, ацетазоламід ефективно підвищує діуретичну відповідь у комбінації з петльовими діуретиками, як показало одне невелике рандомізоване дослідження за участю 24 пацієнтів із гострим об’ємним перевантаженням та стійкістю до терапії з петльовими діуретиками [110]. У багатоцентровому рандомізованому подвійному сліпому дослідженні IV фази діуретичних ефектів ацетазоламіду при декомпенсованій серцевій недостатності з об’ємним перевантаженням (ADVOR, NCT03505788) буде досліджуватися комбінована терапія з ацетазоламідом на предмет покращення відповіді на петльові діуретики для підвищення діурезу в пацієнтів із декомпенсованою серцевою недостатністю [111]. У неекспериментальних дослідженнях вивчалася лише роль внутрішньовенного ацетазоламіду, а дані щодо ролі ацетазоламіду для перорального застосування відсутні.
Інші потенційні препарати
Окрім того, новий діабетичний клас натрійзалежних переносників глюкози (інгібітори SGLT-2) також пригнічує проксимальну абсорбцію натрію (рис. 2) [9, 112, 113]. Два дослідження за участю діабетичних пацієнтів, у більшості з яких було діагностовано серцево-судинне захворювання, показали, що інгібітори SGLT-2 забезпечили зниження кількості госпіталізацій із приводу серцевої недостатності та меншу крутизну зниження швидкості клубочкової фільтрації з часом [114, 115]. Проте потенціал інгібіторів SGLT-2 при серцевій недостатності з діабетом або без нього не встановлений. Триває декілька досліджень ефекту зміни перебігу захворювання інгібіторів SGLT-2 при хронічній та гострій серцевій недостатності. Амілорид пригнічує дистальні епітеліальні натрієві канали (еNaC), а неофіційні дані свідчать про те, що інгібування еNaC може забезпечити усунення застійних явищ зі зниженням тиску наповнення [116]. Окрім того, постійна надмірна експресія еNaC була наслідком опосередкованої тіазолідиндіоном затримки рідини, що спостерігається при діабеті. Нарешті, антагоністи вазопресину обмежують повторне засвоєння вільної води в дистальному відділі нефрона шляхом нейтралізації аргінін-вазопресину, що призводить до обмеженої доступності водних каналів люмінального аквапорину у збиральних протоках нирок. Це призводить до збільшення акварезу без значного впливу на натрійуретичну відповідь. Селективний антагоніст рецептора V2 толваптан не забезпечив зниження показників супутніх захворювань або смертності в дослідженні ефективності антагоністів вазопресину щодо серцевої недостатності (EVEREST) у пацієнтів із гострою серцевою недостатністю на додачу до стандартної терапії [117]. Це обмежує його використання при застійній серцевій недостатності, оскільки розширенню позаклітинного об’єму головним чином сприяє затримка натрію. Проте на більш пізніх стадіях серцевої недостатності недоцільно високі рівні аргінін-вазопресину сприяють збільшенню об’єму плазми та гіперволемічній гіпонатрійуремії. Нещодавно застосування толваптану на ранніх стадіях та в пацієнтів зі стійкістю до діуретиків, дисфункцією нирок або гіпонатріємією призвело до збільшення втрати маси тіла, проте не забезпечило значного покращення щодо полегшення диспное [118, 119]. На сьогодні антагоністи вазопресину показані лише пацієнтам із гіпонатріємією тяжкого ступеня, а їх широке використання може обмежуватися високою вартістю лікарського засобу. У Європі толваптан доступний, але не є офіційно схваленим Європейською агенцією з лікарських засобів для застосування при серцевій недостатності.
Ультрафільтрація
Ультрафільтрація дозволяє видалити плазмову рідину навколо напівпроникної оболонки за допомогою градієнта трансмембранного тиску, згенерованого апаратом. Існують обмежені переконливі докази ефективності ультрафільтрації як терапії першої лінії порівняно з петльовими діуретиками у пацієнтів із гострою серцевою недостатністю [95, 120]. У зв’язку з цим у більшості центрів ультрафільтрація використовується лише як допоміжна терапія для полегшення застійних явищ при неефективності поетапного фармакологічного лікування [121]. Варто відзначити, що в дослідженні периферичної ультрафільтрації для полегшення застою при серцевій недостатності (PURE-HF) (NCT03161158) оцінюється, чи пов’язується індивідуальна периферична вено-венозна ультрафільтрація (система CHIARA) при застосуванні на додаток до діуретиків у низьких дозах зі зниженням серцево-судинної смертності та частоти госпіталізацій із приводу серцевої недостатності через 90 днів після рандомізації порівняно зі стандартною терапією, включаючи поетапне застосування внутрішньовенних діуретиків при хронічній серцевій недостатності з гострою декомпенсацією з об’ємним перевантаженням (за відсутності повної відповіді на терапію з діуретиками). Замісна ниркова терапія забезпечує лікування метаболічних ускладнень анурії/олігурії, таких як гіперкаліємія, ацидоз та уремія [95, 121], хоча більшість пацієнтів, які отримують таку терапію, мають поганий довгостроковий прогноз, особливо при низькому тиску системної перфузії [122]. Окрім того, у дослідженні CARRESS-HF частка пацієнтів із кровотечею та інфекціями, пов’язаними з катетерним доступом, була значно вищою у групі ультрафільтрації.
Використання діуретиків та порушення балансу електролітів
Порушення балансу електролітів у результаті нейрогормональної активації, дисфункції нирок або ятрогенні порушення у зв’язку із застосованим режимом терапії з діуретиками часто виникають під час епізодів гострої серцевої недостатності, головним чином впливаючи на контроль натрію та калію [121, 123, 124]. Нещодавно було визначено, що зміни в метаболізмі хлору є незалежним прогностичним фактором несприятливих результатів [125]. Гіпонатріємія, що визначається як концентрація натрію у плазмі крові < 135 мЕкв/л, є основним порушенням гомеостазу натрію, що виникає при гострій серцевій недостатності, у той час як гіпернатріємія виникає рідко. Додатковий аналіз Організованої програми ініціювання рятувальної терапії госпіталізованих пацієнтів із серцевою недостатністю (OPTIMIZE-HF) показав, що у 20 % пацієнтів на момент госпіталізації була гіпонатріємія [126]. Частота госпітальної гіпонатріємії під час протизастійної терапії при гострій серцевій недостатності коливається в діапазоні 15–25 % [127]. Патофізіологія гіпонатріємії при серцевій недостатності пов’язана або з неможливістю виведення вільної води (гіпонатріємія розведення), або зі зменшенням об’єму натрію (гіповолемічна гіпонатріємія) [123], або з комбінацією цих факторів. Практичний підхід до гіпонатріємії поданий у табл. 3. Після підтвердження низької осмоляльності плазми на основі клінічної картини та аналізу сечі розрізняють розведення та гіповолемію. Порушення гомеостазу калію зазвичай є результатом застосованої фармакологічної терапії при серцевій недостатності в комбінації з порушенням функції нирок в анамнезі. Гіпокаліємія (K у плазмі < 3,5 мЕкв/л) зазвичай виникає при гострій серцевій недостатності на фоні діурезу з виведенням калію, індукованого діуретиками [110]. У клінічній практиці застосування петльових діуретиків є найпоширенішою причиною гіпокаліємії, проте тіазидні діуретики проявляють навіть більший калійуретичний ефект [110]. Терапія включає додавання терапії першої лінії з АМР під час усунення застійних явищ, підвищення блокади РААС та додавання калію (табл. 3). Окрім виведення калію, діуретики часто призводять до втрати магнію, що може спричинити гіпокаліємію, стійку до терапії. Хоча переконливі докази відсутні, можна розглянути додавання магнію під час терапії з діуретиками. Гіперкаліємія (K > 5,0 мЕкв/л) може виникнути в пацієнтів, які отримують блокатори РААС, особливо за наявності порушення функції нирок в анамнезі, хоча і є менш поширеним явищем, ніж гіпокаліємія [128]. Клінічний підхід до лікування гіперкаліємії поданий у табл. 3.
Діуретики при хронічній серцевій недостатності
Амбулаторна доза петльових діуретиків відрізняється
Застосування петльових діуретиків рекомендується при хронічній серцевій недостатності для запобігання ознакам і симптомам застійних явищ [7]. Ця рекомендація є дійсною для всього спектра фракції викиду лівого шлуночка. Насправді діуретики є єдиною групою препаратів з рекомендацією І класу для пацієнтів із серцевою недостатністю зі зниженою, частково збереженою або збереженою фракцією викиду [7]. Проте ефекти діуретиків при хронічній серцевій недостатності щодо супутніх захворювань та смертності не вивчалися в масштабних проспективних рандомізованих контрольованих дослідженнях. У декількох неекспериментальних дослідженнях застосування петльових діуретиків пов’язувалося з підвищенням рівня смертності навіть після багатопараметричного коригування або підбору за показником схильності [129]. Проте залишається потенційна систематична помилка, оскільки більш тяжко хворим пацієнтам зазвичай призначають петльові діуретики (у більш високих дозах). Метааналіз Кохрейна показав, що в пацієнтів із хронічною серцевою недостатністю петльові діуретики та тіазиди можуть знижувати ризик смерті та прогресування серцевої недостатності порівняно з плацебо і можуть забезпечувати більш високу здатність до навантаження [86]. Проте цей метааналіз включав лише невеликі дослідження з обмеженим періодом подальшого спостереження, що показували нереалістично великі зниження частоти подій. Окрім того, цей аналіз не був оновлений у 2016 р. згідно з вимогами інституту Кохрейна, і після цього був анульований. У зв’язку з цим прогностичний ефект терапії з діуретиками досі невідомий. Без сумніву, для пацієнтів із ризиком застою підтримуюча терапія з петльовими діуретиками буде корисною. Проте у пацієнтів з низьким ризиком прогресування застійних явищ застосування петльових діуретиків насправді може призвести до порушень балансу електролітів, подальшої нейрогормональної активації, прискореного погіршення функції нирок та симптоматичної гіпотензії [130]. Остання може бути особливо важливою для пацієнтів із HFrEF, оскільки вона може обумовити терапію з більш низькими дозами нейрогормональних блокаторів [43]. У зв’язку з цим загалом рекомендується застосовувати найнижчу можливу дозу діуретиків, а доза петльових діуретиків часто потребує корекції відповідно до індивідуальних потреб [131, 132]. Варто відзначити, що індивідуальна потреба в діуретиках значно змінюється з часом. Це було чітко відображено в аналізі post-hoc дослідження датчика CardioMEMS для моніторингу тиску з метою покращення результатів лікування при серцевій недостатності ІІІ класу (CHAMPION), який показав, що в основному підвищення, але також і зниження дози петльових діуретиків були найпоширенішими змінами в терапії, до яких вдавалися лікуючі лікарі [133]. Незважаючи на це, існує невизначеність щодо оптимальної дози петльових діуретиків після виписки. Для пацієнтів, у яких розвинувся епізод гострої серцевої недостатності при попередньому прийомі петльових діуретиків перед госпіталізацією, може бути доцільним застосування більш високої дози після виписки. Окрім того, у випадку, якщо попереднім петльовим діуретиком був фуросемід, можна розглянути перехід на буметанід або торасемід, оскільки вони мають більш передбачувану схему абсорбції та біодоступність, особливо у світлі безсимптомного застою. Проте визначення найбільш доцільної дози діуретика після виписки може бути складним та потребує ретельного подальшого спостереження, особливо на ранніх етапах після виписки. Слід за можливості уникати тривалого застосування тіазидів у стабільних амбулаторних умовах (послідовна блокада нефронів), оскільки така практика часто призводить до тяжких порушень балансу електролітів, які можуть залишитися невиявленими в амбулаторних умовах. Необхідні додаткові дослідження для оцінки амбулаторних показників (на додаток до тиску в легеневій артерії) об’ємного статусу, що можуть забезпечити більш легку адаптацію терапії з діуретиками. Дані реєстрових досліджень свідчать про те, що пацієнти зі слабковираженими симптомами серцевої недостатності (клас І або ІІ за класифікацією Нью-Йоркської асоціації кардіологів (NYHA)) зазвичай отримують такі самі дози петльових діуретиків, що й пацієнти з більш вираженими симптомами серцевої недостатності (клас І і IV за класифікацією NYHA) [134]. Це підкреслює значення повторної оцінки потреби в петльових діуретиках після початку терапії, що покращує кардіостатус (така, як ресинхронізуюча серцева терапія або сакубітрил/валсартан) [112, 135]. Нещодавнє пошукове дослідження продемонструвало потенціал самостійного контролю вмісту хлору в сечі після застосування петльових діуретиків за допомогою тест-смужки з метою визначення потреби в підтримуючій терапії з петльовими діуретиками в амбулаторних пацієнтів зі стабільною серцевою недостатністю [136]. Незважаючи на рекомендацію у настановах щодо застосування найнижчої можливої дози діуретиків та припинення застосування петльових діуретиків за можливості, доступна недостатня кількість інформації щодо припинення застосування петльових діуретиків у пацієнтів із серцевою недостатністю, які отримують лікування з використанням сучасних методів [137, 138]. У проспективному інтервенційному дослідженні за участю 50 амбулаторних пацієнтів зі стабільною серцевою недостатністю оцінювалася можливість зниження дози та припинення застосування петльових діуретиків [138]. Через 30 днів зниження дози було успішним у 62 % пацієнтів, проте дослідження на вихідному рівні, включаючи фізичне обстеження, ехокардіографію та визначення NP, не допомогли передбачити, у яких пацієнтів зниження дози петльових діуретиків буде успішним, а у яких ні [138].
Стратегія лікування серцевої недостатності
Цілі лікування серцевої недостатності є динамічними та відрізняються залежно від ступеня серцевої недостатності. В амбулаторних пацієнтів лікування повинне зосереджуватися на підвищенні дози препаратів, що змінюють перебіг захворювання, оцінці потреби в апаратній терапії, включенні пацієнтів до міждисциплінарних програм зміни перебігу захворювання, спрямованості на самоконтроль, фізичну активність та дотримання дієти [7]. Окрім того, слід вжити заходів, спрямованих на зниження кількості повторних госпіталізацій та покращення якості та подовження тривалості життя. З огляду на середнє споживання солі в західних країнах — 6–8 г, у настановах ESC рекомендується уникати надмірного споживання солі (> 6 г NaCl = 2,4 г Na на добу) та надмірного споживання води (некласова рекомендація) [7]. Обмеження споживання солі та води часто недооцінюється у програмах зміни перебігу захворювання. З іншого боку, дані досліджень на тваринах та епідеміологічні дані свідчать про те, що недостатнє споживання натрію (< 2 г Na+ на добу) пов’язується з ремоделюванням міокарда та гіршим клінічним результатом [139]. У даний час тривають чотири дослідження, у яких оцінюється користь обмеження споживання натрію, включаючи одне дослідження, у якому оцінюється жорстка кінцева точка [140]. Метааналіз обмеження споживання рідини не показав користі або шкоди в пацієнтів із серцевою недостатністю. У зв’язку з цим дієта повин–на бути адаптована відповідно до клінічного контексту. У випадку гострої серцевої недостатності з гіпонатріємією розведення доцільним є більш строге обмеження споживання рідини.
Прогалини у знаннях та майбутні напрямки
Клінічна епідеміологія щодо терапії з діуретиками при серцевій недостатності залишається складною у зв’язку з невеликою кількістю проведених проспективних досліджень. Для визначення ідеальної стратегії терапії з діуретиками та оптимальної оцінки повного усунення застійних явищ (нормоволемії) при серцевій недостатності необхідні додаткові поточні дослідження. Роль умісту натрію у сечі для оцінки доцільності терапії з діуретиками при гострій серцевій недостатності повинна оцінюватися проспективно. Роль інфузії з гіпертонічним розчином NaCl разом із петльовими діуретиками у високих дозах у пацієнтів із гіпонатріємією на фоні об’ємного перевантаження потребує дослідження, оскільки ця концепція підтверджується декількома аналізами, проте на неї поширюються методологічні обмеження [142]. Оцінка протизастійних властивостей інших діуретиків, окрім петльових діуретиків і АМР, потребує рандомізованих контрольованих досліджень. Є потреба в новітніх ефективних та безпечних фармакологічних або механічних методах усунення застою без індукування ішемічного ураження органів. Окрім того, у декількох запланованих дослідженнях буде вивчатися оптимальне використання доступних на сьогодні варіантів лікування з діуретиками. У дослідженні TRANSFORM-HF буде оцінюватися вища ефективність торасеміду порівняно з фуросемідом щодо зниження смертності з усіх причин. Окрім того, у поточних дослідженнях вивчається ефект підшкірного введення фуросеміду порівняно з пероральним прийомом [143].
Додаткова інформація
Додаткова інформація доступна online у розділі «Додаткова інформація» в кінці статті.
Рисунок S1. Зведений огляд дослідження CARRESS-HF.
Конфлікт інтересів: W.M. отримав дослідницькі гранти від компаній Novartis, Vifor, Medtronic, Biotronik, Abbott and Boston Scientific. V.P.H. отримав дослідницькі гранти від компанії Abbott Laboratories та особисті винагороди від компаній Bayer, Boehringer-Ingelheim, MSD, Orion Pharma, Pfizer, Roche Diagnostics, Thermo Fisher і Vifor. A.M. отримав гонорар доповідача від компаній Abbott, Orion, Roche та Servier та винагороду як член експертної ради та/або керівного комітету та/або дослідницькі гранти від компаній BMS, Adrenomed, Neurotronik, Roche, Sanofi та Sphyngotec. H.P.B.L.R. отримав дослідницькі гранти від компаній Roche Diagnostics, Novartis, Servier і Vifor pharma та винагороду експертної ради від компаній Novartis, Roche Diagnostics, Vifor Pharma та Servier. P.M. отримав дослідницький грант від компаній Vifor pharma та Fonds Wetenschappelijk Onderzoek (номер гранту: 1127917N) та консультаційні винагороди від компаній AstraZeneca, Boehringer-Ingelheim, Novartis і Vifor pharma. J.M.T. отримав дослідницькі гранти від NIH, FDA, Boehringer Ingelheim, Sanofi, Abbott, FIRE1, Sequana Medical, Otsuka та консультаційні винагороди від Sanofi, Boehringer Ingelheim, Novartis, BMS, AstraZeneca, FIRE1, Sequana Medical, Cardionomic і RenalGuard. W.H.W.T. отримав гранти від компаній NIH (R01HL103931) та працював консультантом компаній Advisory Board Company, MyoKardia Inc. та Sequana Medical Inc. P.R. повідомляє про особисті винагороди (консультації) від компаній Fresenius, Grünenthal, Idorsia, Novartis, Novo-Nordisk, Relypsa, Stealth Peptides, Vifor Fresenius Medical Care Renal Pharma, Vifor, а також лекторські винагороди від компаній Bayer і CVRx; він є співзасновником компанії CardioRenal. M.M. отримав консультаційні гонорари від компаній Bayer, Novartis і Servier та лекторські винагороди від Abbott Vascular і Novartis. G.F. працював у комітетах досліджень за підтримки компаній Bayer, Novartis, Servier, Vifor, BI та Medtronic. P.S. повідомляє про гранти/отримання допомоги на дослідження від міністерства освіти, науки та технологічного розвитку Сербії; та гонорари або консультаційні винагороди від компаній Servier, Boehringher Ingelheim, Hemofarm, Novartis, AstraZeneca; він брав участь у бюро доповідачів, спонсорованих компанією Fondazione Internationale Menarini. F.R. повідомляє про гранти та персональні винагороди від компаній SJM/Abbott, Novartis, Bayer, Servier; особисті винагороди від компаній Zoll, AstraZeneca, Sanofi, Amgen, BMS, Pfizer, Fresenius, Vifor, Roche, Cardiorentis, Boehringer Ingelheim, окрім Heartware, грантів від Mars під час проведення дослідження; з 1 січня 2018 року не отримував особистих виплат/всі виплати безпосередньо передавалися до Цюрихського університету. A.J.C. повідомляє про отримання особистих винагород від компаній Respicardia, Vifor і Servier. Інші автори не мають конфліктів інтересів.
Редакція перекладу: проф. Іванов Д.Д.,
проф. Пархоменко А.Н.
Оригінальний текст надрукований в European Journal of Heart Failure, 2019,
doi:10.1002/ejhf.1369![]()

/55-1.jpg)
/59-1.jpg)
/60-1.jpg)
/61-1.jpg)
/62-1.jpg)
/63-1.jpg)
/68-1.jpg)