Архив офтальмологии Украины Том 6, №3, 2018
Вернуться к номеру
Вплив поляризованого світла на запалення передньої поверхні ока в комбінованій експериментальній моделі хвороби сухого ока у щурів
Авторы: Риков С.О.(1), Шаргородска І.В.(1), Войтенко Н.В.(2), Агашков К.С.(2), Краснякова М.Є.(2), Лємєнєва А.А.(3)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика МОЗ України, м. Київ, Україна
(2) — Інститут фізіології імені О.О. Богомольця НАН України, м. Київ, Україна
(3) — Київська міська клінічна офтальмологічна лікарня «Центр мікрохірургії ока» МОЗ України, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Справочник специалиста
Версия для печати
Основним проявом хвороб повік, сльозних шляхів та орбіти є хвороба сухого ока, що вважається серйозною хворобою сьогодення й впливає на якість життя. У наш час із цим захворюванням стикається кожен 10-й житель планети. Підвищене навантаження, розвиток мультимедійних технологій, гіподинамія й погіршення екології — основні сучасні причини. У цій роботі використано експериментальну модель сухого ока на щурах із розвитком запалення передньої поверхні ока. Для розвитку запалення використовували опік ока лугом. Флюоресцеїнова проба, що проводилася одразу після ерозування лугом та на 1-шу, 5-ту та 10-ту добу після опіку, виявила поступове збільшення епітелізації та васкуляризації рогівки. Через добу після індукції запалення суттєво та статистично вірогідно підвищувалось сльозовиділення в експериментальних щурів. На сьому добу сльозовиділення зменшувалось до контрольного рівня з подальшою тенденцією до зменшення сльозопродукції. У групі щурів із запаленням передньої поверхні ока, яка отримувала курс терапії поляризованим червоним світлом, не було відзначено суттєвого зниження в продукції сльози на 7-му добу, що може свідчити про можливий протизапальний вплив світлотерапії в даних умовах.
Основным проявлением патологии век, слезных путей и орбиты является болезнь сухого глаза, которая считается серьезной болезнью современности и влияет на качество жизни. В настоящее время с ней сталкивается каждый десятый житель планеты. Повышенная нагрузка, развитие мультимедийных технологий, гиподинамия и ухудшение экологии — основные причины данного заболевания. В данной работе использована экспериментальная модель сухого глаза на крысах с развитием воспаления передней поверхности глаза. Для развития воспаления использовали ожог глаза щелочью. По результатам флюоресцеиновой пробы, которая проводилась сразу после эрозирования щелочью и на 1-е, 5-е и 10-е сутки после ожога, было показано постепенное увеличение эпителизации и васкуляризации роговицы. Через сутки после индукции воспаления существенно и статистически достоверно повышалось слезотечение у экспериментальных крыс. К седьмым суткам слезотечение уменьшалось до контрольного уровня с последующей тенденцией к уменьшению слезопродукции. В группе крыс с воспалением передней поверхности глаза, которая получала курс терапии поляризованным красным светом, не было отмечено значительного снижения в продукции слезы к 7-м суткам, что может свидетельствовать о возможном противовоспалительном влиянии терапии в данных условиях.
Background. The main manifestation of disorders of eyelids, tear ducts and orbits is a dry eye disease (DED), which is considered as a serious disease affecting the quality of life. Now it affects one of ten inhabitants of the planet. Increased load, the development of multimedia technologies, physical inactivity and environmental degradation are the main causes of this disease. The pathogenesis of the dry eye disease is the defect of Fas-mediated apoptosis, which makes it possible to penetrate CD4+ T-lymphocytes into the exocrine tissue with further damage to it. However, at the heart of the development of the dry eye diseases not only the inflammatory mechanism lies. Current questions of modern ophthalmology are the search for new therapies, one of which is the application of Bioptron-piler therapy. Under the influence of polarized light, the energy activity of the cell membrane increases. The regeneration processes are activated, oxygen consumption by tissue increased with the formation of adenosine triphosphate in mitochondria, the bioenergetic potential of cells and the velocity of blood flow in tissues increase, transport through the vascular wall is activated, the vessels are intensively forming. Bioptron-piler-light promotes tissue regeneration as well as immune protection. The purpose was to study the pathophysiological mechanisms of action and clinical efficacy of poly- and monochromatic Bioptron-piler-light in the dry eye disease. Materials and methods. We used rats with an experimental model of the dry eye induced by inflammation of anterior ocular surface. Alkaline burning was used to induce the development of inflammation. The adult male rats of the Wistar line and with body weight from 250–300 g were used for the experiments. The xylazine 10 mg/kg of body weight (Biovet Pulavi, Poland) and ketamine 60 mg/kg of body weight (Farmak, Ukraine) were used for anesthesia. All experimental procedures were carried out in accordance with the rules of the Committee on Animal Bioethics of the Bogomolets Institute of Physiology of NASU (Kyiv, Ukraine) and complied with the directives of the European Commission (86/609/EEC). Bioptron-piler therapy was performed using the red filter of the Bioptron apparatus (Bioptron AG, Zepter Group, Swiss) on the 1st day after DED induction. The animals were fixed and the left eye was shielded. Only the right eye was treated from the distance of 30 cm for 3 min. Each animal received a course of treatment for 10 days. Depending on the etiopathogenetic factor several models were described for the DED study. We have adapted and used the model of combined lesions of the lacrimal duct, meibomian glands, corneal and conjunctival damage with the development of inflammation. The clinical evaluation on the transparency and corneal neovascularization was performed within 10 days, using a score scale. Results. A fluorescein test carried out immediately after alkali application and on 1st, 5th and 10th days demonstrated a gradual increase in corneal epithelization and vascularization. We observed substantial and statistically significant increase of lacrimation in experimental rats on a first day after induction of inflammation compared to naïve animals. To the seventh day, the lacrimation decreased to a control level followed by further decrease in tear production. At the same time, there was no significant reduction in tear production on 7th day (compared to the first day) in a group of rats with the anterior surface inflammation that received polarized red light treatment, which may indicate a possible anti-inflammatory effect of such treatment. It is known that stimulation of cytochrome oxidase by light can lead to an increase at mitochondria energy metabolism, an increase of level intracellular metabolism, activation of proliferation and cell migration. Consequently, in our conditions the processes of epithelization and corneal vascularization significantly slowed down after Bioptron-piler therapy with red light was used, which had a positive anti-inflammatory effect. Conclusions. The evidence of the positive anti-inflammatory effect of Bioptron-piler-light in experimental model of the dry eye disease was obtained. The biological effect of light energy is realized by photochemical transformation in mitochondria through the interaction of cytochrome oxidase and impacts the energy processes inside the cell, proliferation, cell migration, neutralizing reactive oxygen compounds. Anti-inflammatory and protective effect of Bioptron-piler therapy in patients with the dry eye disease requires further clinical study.
хвороба сухого ока; запалення передньої поверхні ока; флюоресцеїнова проба; тест Ширмера; поляризоване світло; пайлер-терапія
болезнь сухого глаза; воспаление передней поверхности глаза; флюоресцеиновая проба; тест Ширмера; поляризованный свет; пайлер-терапия
dry eye disease; inflammation of the ocular anterior surface; fluorescein test; Schirmer test; polarized light; piler therapy
Вступ
Хвороба сухого ока, ХСО, (ксерофтальмія) — це багатофакторне захворювання поверхні ока, що характеризується втратою гомеостазу слізної плівки та супроводжується симптомами зору, у яких нестійкість слізної плівки й гіперосмолярність, запалення й пошкодження очної поверхні та нейросенсорні аномалії відіграють етіологічну роль. Зниження гостроти зору, нав’язливі неприємні відчуття можуть змінювати повсякденну активність та значно впливати на якість життя [1].
У фізіологічних умовах нормально функціонуючий слізний апарат виділяє сльозу — зволожуючу рідину певного якісного складу й у кількості, достатній для створення стабільної плівки, що складається із зовнішнього ліпідного, середнього водного і внутрішнього муцинового шарів. Зміна складу хоча б одного з них призводить до збою роботи всієї системи в цілому. Але, на жаль, до розвитку ксерофтальмії призводить не тільки нестабільність чи якісна неповноцінність сльози. Поверхня ока є функціонально важливою інтегративною одиницею, що анатомічно складається з 7 основних інтерактивних та взаємозалежних компонентів, а саме: зі слізної плівки, слізного та допоміжного слізного апаратів, носослізної дренажної системи, повік, бульбарної та тарзальної частин кон’юнктиви, а також V і VII черепних нервів [2]. Порушення хоча б в одній ланці призводить до виникнення неприємних симптомів: нав’язливого відчуття стороннього предмета, погіршення гостроти зору, виникнення гіперемії, слизових виділень, подразнення та інтенсивної сльозотечі, світлобоязні.
Хвороба сухого ока, або сухий кератокон’юктивіт (Н19.3), вражає мільйони людей у всьому світі і є одним із найбільш поширених офтальмологічних захворювань [3]. У США від цієї патології страждають 3,23 мільйона жінок і 1,68 мільйона чоловіків віком понад 50 років. Оцінка поширеності коливається в діапазоні приблизно від 10 до 30 % усього населення. Дані щодо расової та етнічної схильності обмежені, але частота вища в іспаномовного населення та в азіатських країнах [4].
У 2017 році на семінарі DEWS ІІ (The International Dry Eye WorkShop) було оновлено класифікацію, визначення, діагностику, моніторинг та лікування хвороби сухого ока. Хвороба сухого ока — автоімунне захворювання, що характеризується хронічною запальною інфільтрацією сльозових та слинних залоз. У патогенезі її розвитку лежить дефект Fas-опередкованого апоптозу, що робить можливим проникнення CD4+ T-лімфоцитів в екзокринну тканину з її подальшим пошкодженням [5]. Однак в основі розвитку ксерофтальмії лежить не тільки запальний механізм. До розвитку різних форм також призводять дефект трансмембранної та секреторної експресії муцину, порушення нервової стимуляції процесу сльозопродукції, дисфункція мейбомієвих залоз. Безперечно, існує значна кількість несприятливих факторів, таких як вплив навколишнього середовища й анатомічні особливості, наявність ендокринних, запальних, автоімунних захворювань і використання контактних лінз, вживання лікарських засобів чи офтальмологічна хірургія [6].
У результаті запалення передньої поверхні ока (ЗППО) із розвитком хвороби сухого ока можуть виникнути необоротні й тяжкі наслідки. Через виникнення хронічних епітеліальних дефектів рогівки формуються рогівковий панус і сквамозна метаплазія, що призводить до сліпоти. На жаль, існує лише симптоматичне лікування, що може зменшити страждання пацієнтів, але не позбавити проблеми. На сьогодні актуальним питанням в офтальмології залишається пошук нових методів лікування, одним із яких є застосування пайлер-терапії.
Пайлер-світлотерапія із використанням апарата «Біоптрон» являє собою місцевий та/або системний вплив поляризованими електромагнітними хвилями біологічно необхідного (сонячного) діапазону з використанням рецепторних або сенсорних воріт, транспортуючого сполучнотканинного каркасу та каскаду фотохімічних реакцій для доставки електромагнітної енергії в регуляторні системи або зони, які переживають її дефіцит або дисбаланс. Пайлер-світло — це лінійне поляризоване некогерентне поліхроматичне світло з хвилею завдовжки 400–2000 нм (видимий і легкий інфрачервоний спектр світла, за винятком УФО). При поляризації світлові хвилі проходять тільки в паралельних площинах. Ступінь поляризації близько 95 %. Акцептором світла нарівні з іншими речовинами є кисень клітини, який вибірково поглинає світло: запускається ланцюжок біологічних реакцій, активується перекисне окислення ліпідів, що індукує стрес-реакцію, тобто спостерігається неспецифічна адаптивна відповідь. Під впливом поляризованого світла збільшується енергетична активність клітинної мембрани. Запускаються регенераційні процеси, збільшується поглинання кисню тканиною з утворенням аденозинтрифосфату (АТФ) в мітохондріях, підвищується біоенергетичний потенціал клітин і швидкість кровотоку в тканинах, активується транспорт через судинну стінку, інтенсивно формуються судини. Пайлер-світло впливає на регенерацію тканини, а також на імунний захист [7].
Мета роботи. Вивчення патофізіологічних механізмів дії і клінічної ефективності полі- і монохроматичного пайлер-світла на експериментальній моделі хвороби сухого ока.
Матеріали та методи
Робота була виконана в рамках НДР кафедри офтальмології НМАПО ім. П.Л. Шупика «Клінічне та експериментальне обґрунтування діагностики, лікування і профілактики рефракційних, дистрофічних, травматичних і запальних захворювань органу зору» (державна реєстрація № 0116U002821, дати виконання 2016–2020 роки). Для дослідів використовували дорослих щурів лінії Wistar, самці масою тіла від 250–300 грамів. Для анестезії використовували ксилазин 10 мг/кг маси тіла («Біовет Пулаві», Польща) та кетамін 60 мг/кг маси тіла («Фармак», Україна). Усі експериментальні процедури проводили згідно з нормами Комітету з біоетики тварин Інституту фізіології ім. О.О. Богомольця (м. Київ, Україна) та відповідали директивам Європейської комісії (86/609/EEC). Були докладені всі зусилля для зменшення та мінімізування страждання тварин. При проведенні усіх маніпуляцій дотримувалися умов антисептики та асептики.
Комбінована експериментальна модель хвороби сухого ока на щурах. Протягом дослідження щури були поділенні на дві групи по 10 тварин — контрольну та дослідну. Комбінована модель ХСО реалізовувалася шляхом використання опіку лугом. Під анестезією ксилазином 10 мг/кг маси тіла, кетаміном 60 мг/кг маси тіла та додатковим зрошуванням кожного ока 2% лідокаїном у кожне око закрапували по 25 мкл 0,2% NaOH [8], щоб уся поверхня рогівки була покрита розчином. Через 30 секунд очі промивали ізотонічним розчином NaCl. Для підтвердження ерозіїї рогівки проводили мічення за допомогою флюоресцеїнових тест-смужок. Підтвердженням цього було повне забарвлення обох очей, що свідчило про тотальне ураження всієї поверхні ока. Після операції тварин переносили в суху підігріту клітку та спостерігали за ними до відновлення їх функцій, після чого транспортували у віварій. У подальшому щурів спостерігали та клінічно оцінювали прозорість і васкуляризацію їх рогівки.
Прозорість рогівки визначали за бальною шкалою, де 0 балів — рогівка повністю прозора; 1 бал — дещо затуманена (радужка та зіниця легко видимі); 2 бали — дещо мутна (радужка та зіниця все ще виявляються); 3 бали — мутна (зіниця важко виявляється); 4 бали — рогівка повністю мутна (зіниця не візуалізується).
Васкуляризацію рогівки визначали за 4-бальною шкалою, де 0 балів — судини по лімбу відсутні; 1 бал — судини в 2 мм від лімба рогівки; 2 бали — судини в 4 мм від лімба рогівки; 3 бали — судини в центрі рогівки.
На 1-шу добу після індукції ХСО виконували терапію пайлер-світлом із використанням червоного фільтра апарата «Біоптрон» (Bioptron AG, Zepter Group, Швейцарія). Тварин фіксували, ліве око екранували. Із відстані 30 см протягом 3 хвилин проводили терапію пайлер-світлом тільки правого ока. Кожна тварина отримувала курс лікування щоденно протягом 10 днів. Досліди проводились в затемненій кімнаті за відсутності дії прямого природного та штучного освітлення.
Флюоресцеїнова проба. Пробу проводили анестезованим тваринам відразу після здійснення опіку рогівки лугом, на 5-ту та 10-ту добу для оцінки епітелізації. Стандартні смужки з флюоресцеїном закладали в нижній кон’юнктивальний мішок, після чого очі закривали та декілька разів штучно проморгували для повного поширення барвника по всій поверхні рогівки. Флюоресцеїн збуджували за допомогою офтальмоскопа з лампою з довжиною хвилі 470 nm, у подальшому очі фотографували та проводили оцінку епітелізації.
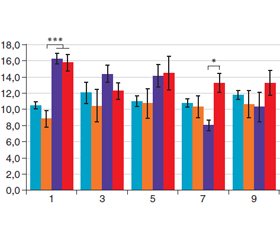
Тест Ширмера. Тест проводився тваринам без анестезії на 1-й, 3-й, 5-й, 7-й та 9-й дні пісня початку індукції моделі ХСО. Зі стандартних смужок для тесту Ширмера вирізали смужки завширшки 2 мм для того, щоб адаптувати під розмір ока щура. Смужки вставляли в нижнє склепіння кон’юнктиви та витримували 5 хв (рис. 1). Довжину вологої частини вимірювали в міліметрах.
Обробка статистичних даних проводили в програмі Windows Microsoft Exсel 2010, статистичне програмне забезпечення SPSS. Отримані результати обробляли методами варіаційної статистики з використанням t-критерію Стьюдента.
Результати та обговорення
Результати дослідження наведені на рис. 2–5.
Комбінована експериментальна модель ХСО у щурів. Для вивчення ХСО існує багато моделей. Усі вони різняться за етіопатогенетичним чинником [9–12]. Протягом дослідження ми адаптували та використали модель комбінованого ураження сльозової протоки, мейбомієвих залоз та пошкодження рогівки і кон’юнктиви з розвитком запалення. Модель реалізовували так: після зрошення поверхні рогівки лужним розчином і промивання ізотонічним розчином NaOH ерозії оцінували оптично з використанням бінокулярного мікроскопа у флюоресцеїновій пробі, яка підтвердила ефективність та специфічність даної моделі. За результатами флюоресцеїнової проби, що проводилася одразу після ерозування лугом та на 1-шу, 5-ту, 10-ту добу, фіксували етапи розвитку епітелізації рогівки (рис. 2).
Використовуючи бальну шкалу, протягом 10 днів дослідження проводили клінічну оцінку прозорості та неоваскуляризації рогівки.
Вивчення впливу червоного поляризованого світла на клінічний перебіг ХСО у щурів. Курс терапії пайлер-світлом із використанням червоного фільтра апарата «Біоптрон» не показав статистично вірогідної відмінності від контролю в оцінці прозорості (рис. 3) і васкуляризації рогівки (рис. 4). Протягом дослідження спостерігалася тенденція до сповільнення процесів епітелізації та васкуляризації.
Завдяки проведенню низки досліджень [11, 12] стало відомо, що стимуляція цитохромоксидази світлом може призводити до підвищення енергетичного обміну в мітохондріях, підвищення рівня метаболізму в середині клітини, активізації проліферації та міграції клітин. Отже, протягом наших досліджень відмічене сповільнення процесів епітелізації та васкуляризації рогівки при пайлер-терапії із використанням червоного світла, що має позитивний протизапальний вплив.
Вплив червоного поляризованого світла на сльозопродукцію. Під час проведення нашого дослідження обох груп ми поділили всіх тварин на дві підгрупи: контрольну інтактну групу, яка не отримувала лікування пайлер-світлом (n = 5); контрольну групу (n = 5), у якій кожна тварина отримувала терапію поляризованим світлом із червоним фільтром за допомогою апарата «Біоптрон»; дослідна група тварин, якій була індукована комбінована модель ЗППО з розвитком ХСО (n = 5), що не отримувала жодного лікування, і група з розвитком ЗППО, яка отримувала курс лікування поляризованим червоним світлом (n = 5). Ліве око тварин екранували. На праве око проводили експозицію поляризованого червоного світла протягом 3 хв з відстані 30 см. Після 10 сеансів терапії пайлер-світлом тварини виводились з експерименту.
Сльозопродукцію оцінювали за допомогою тесту Ширмера (рис. 5). Середні значення продукції сльози дорівнювали 11,2 ± 0,49 мм у контрольній групі та 11,08 ± 0,38 мм у групі, яка походила курс пайлер-терапії із використанням червоного світла. Аналіз результатів показав відсутність статистичної різниці між групами, що дозволило нам припустити, що дана експозиція та протокол лікування не викликають токсичних реакцій з боку сльозопродукції в щурів та є безпечними для подальшого використання й вивчення.
Результати дослідження свідчили, що на першу добу після індукції опіку ми отримали суттєве та статистично вірогідне збільшення сльозопродукції (15,75 ± 1,01 мм; р = 0,003) порівняно з контролем. Порівнюючи результати у групі, яка отримувала лікування червоним поляризованим світлом, отримали подібне статистично вірогідне взаємовідношення в діапазоні 16,25 ± 0,6 мм (р = 0,011).
Оцінка динаміки сльозопродукції протягом наступних днів, на 7-му добу після опіку свідчила про суттєве зниження продукції до 8,00 ± 0,63 мм (р = 0,02) у групі з індукованим ЗППО, за виключенням групи тварин, що отримувала терапію поляризованим червоним світлом. Дана тенденція зберігалася і на 9-ту добу.
Зниження сльозопродукції можна пояснити розвитком ХСО у щурів, що розвивається після хімічної індукції ЗППО. У групі щурів із ЗППО, яка отримувала курс із використанням поляризованого червоного світла, зміни в сльозопродукції протягом усього курсу не були значними, а на 7-му добу тільки в цій групі не було відмічено значного зниження у продукції сльози, що може свідчити про можливий протизапальний та протективний вплив терапії пайлер-світлом у даних умовах.
Висновки
Використання експериментальної моделі хвороби сухого ока дозволило встановити позитивний протизапальний вплив червоного поляризованого світла. Біологічна дія енергії світла реалізувалася шляхом фотохімічної трансформації в мітохондріях через взаємодію цитохромоксидази і впливала на енергетичні процеси в середині клітини, проліферацію, міграцію клітин, знешкоджуючи реактивні сполуки кисню. Отримані результати свідчать про можливість подальшого вивчення впливу поляризованого світла на біологічні процеси в середині клітин і розглядати його як перспективний напрямок у розвитку альтернативної терапії при лікуванні пацієнтів із захворюваннями передньої поверхні ока.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Lemp M.A. The Definition and Classification of Dry Eye Disease Guidelines from the 2017 International Dry Eye Workshop / M.A. Lemp, G.N. And, F.A.C.S. Foulks // Report DEWS II. — 2017. — 455 p.
2. Thoft R.A. The X, Y, Z hypothesis of corneal epithelial maintenance / R.A. Thoft, J. Friend // Invest. Ophthalmol. Vis. Sci. — 1983. — Vol. 24 (10). — P. 1442-1443.
3. Prevalence of Dry Eye Syndrome Among US Women / D.A. Schaumberg, D.A. Sullivan, J.E. Buring, M.R. Dana // Am. J. Ophthalmol. — 2003. — Vol. 136 (2). — P. 318-326.
4. The epidemiology of dry eye disease: report of the Epidemiology Subcommittee of the International Dry Eye WorkShop (2007) // Ocul. Surf. — 2007. — Vol. 5 (2). — P. 93-107.
5. Lemp M.A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes / M.A. Lemp // CLAO J. — 1995. — Vol. 21 (4). — P. 221-232.
6. Nguyen T. Review of hydroxypropyl cellulose ophthalmic inserts for treatment of dry eye. / T. Nguyen, R. Latkany // Clin. Ophthalmol. Dove Press. — 2011. — Vol. 5. — P. 587-591.
7. Гуляр С.А. Антология светотерапии. Медицинские БИОПТРОН-технологии (Теория, клиника, перспективы) / С.А. Гуляр. — К., 2009. — 1024 с.
8. Schrader S. Animal models of dry eye / S. Schrader, A.K. Mircheff, G. Geerling // Dev. Ophthalmol. Karger Publishers. — 2008. — Vol. 41. — P. 298-312.
9. Accelerated Wound Healing of Alkali-Burned Corneas in MRL Mice Is Associated with a Reduced Inflammatory Signat / M. Ueno, B.L. Lyons, L.M. Burzenski et al. // Investig. Opthalmology Vis. Sci. — 2005. — Vol. 46 (11). — P. 4097-4106.
10. Totan Y. Effect of caffeic acid phenethyl ester on corneal neovascularization in rats / Y. Totan, E. Aydin, O. Cekiз et al. // Curr. Eye Res. — 2001. — Vol. 23 (4). — P. 291-297.
11. Hamblin M.R. Mechanisms of low level light therapy / M.R. Hamblin, T.N. Demidova // Proceedings of SPIE — The International Society for Optical Engineering 6140:1. — 2006. — doi: 10.1117/12.646294.
12. Geneva I.I. Photobiomodulation for the treatment of retinal diseases: a review / I.I. Geneva // Int. J. Ophthalmol. Press of International Journal of Ophthalmology. — 2016. — Vol. 9 (1). — P. 145-152.

/39-1.jpg)
/39-2.jpg)
/40-1.jpg)