Журнал «Медицина неотложных состояний» №4(99), 2019
Вернуться к номеру
Сорбилакт® как средство фармакологической коррекции послеоперационного пареза кишечника
Авторы: Ничитайло М.Е.
Институт хирургии и трансплантологии им. А.А. Шалимова, г. Киев, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Післяопераційний парез кишечника (ППК) виникає після багатьох хірургічних втручань, але найбільш часто після абдомінальних операцій — з частотою 10–30 %. Це ускладнення підвищує післяопераційну захворюваність, тривалість госпіталізації і вартість лікування. У систематичному огляді спільноти Cochrane було показано, що жоден препарат із рутинно застосовуваних прокинетиків (неостигмін, метоклопрамід, еритроміцин) або проносних засобів не зменшує тривалість ППК (рівень доказовості Ia). При цьому неостигмін (прозерин) пов’язаний із ризиком розвитку побічних ефектів практично у всіх органах і системах. Застосування метоклопраміду було обмежено Європейським медичним агентством через потенціал розвитку серйозних неврологічних побічних ефектів. Обидва препарати призначаються занадто пізно, на 3–5-й день після операції, часто коли вже наявна картина розвиненого ППК. У цих умовах заслуговує на увагу вітчизняний інфузійний препарат Сорбілакт® з основною діючою речовиною сорбітолом. У багатьох клінічних дослідженнях була продемонстрована його здатність зменшувати тривалість ППК в 1,5–2 рази. При цьому Сорбілакт® прискорював появу аускультативних ознак перистальтики, відходження газів, самостійний стул. Отримані дані були підтверджені інструментально — за допомогою комп’ютерної пневмокінезографії і ультразвукового дослідження. Сорбілакт® можна застосовувати з перших годин після оперативного втручання або навіть під час його виконання. При цьому можуть переслідуватись як профілактичні, так і лікувальні цілі. У виконаних клінічних дослідженнях Сорбілакт® не викликав побічних ефектів. У зв’язку з тим, що сорбітол, який входить до складу Сорбілакта®, в організмі перетворюється на фруктозу, препарат не призначають особам із спадковою непереносимістю фруктози.
Послеоперационный парез кишечника (ППК) возникает после многих хирургических вмешательств, но наиболее часто после абдоминальных операций — с частотой 10–30 %. Данное осложнение повышает послеоперационную заболеваемость, длительность госпитализации и стоимость лечения. В систематическом обзоре сообщества Cochrane было показано, что ни один препарат из рутинно применяемых прокинетиков (неостигмин, метоклопрамид, эритромицин) или слабительных не уменьшает длительность ППК (уровень доказательности Ia). При этом неостигмин (прозерин) связан с риском развития побочных эффектов практически во всех органах и системах. Применение метоклопрамида было ограничено Европейским медицинским агентством из-за потенциала развития серьезных неврологических побочных эффектов. Оба препарата назначаются слишком поздно, на 3–5-й день после операции, часто когда уже имеется картина развитого ППК. В этих условиях заслуживает внимания отечественный инфузионный препарат Сорбилакт® с основным действующим веществом сорбитолом. Во многих клинических исследованиях была продемонстрирована его способность уменьшать длительность ППК в 1,5–2 раза. При этом Сорбилакт® ускорял появление аускультативных признаков перистальтики, отхождение газов, самостоятельный стул. Полученные данные были подтверждены инструментально — с помощью компьютерной пневмокинезографии и ультразвукового исследования. Сорбилакт® можно применять с первых часов после оперативного вмешательства или даже непосредственно во время его выполнения При этом могут преследоваться как профилактические, так и лечебные цели. В выполненных клинических исследованиях Сорбилакт® не вызывал побочных эффектов. В связи с тем, что сорбитол, входящий в состав Сорбилакта®, в организме превращается в фруктозу, препарат не назначают лицам с наследственной непереносимостью фруктозы.
Postoperative ileus (POI) occurs after many surgical interventions, but most often after abdominal operations — with a frequency of 10–30 %. This complication increases postoperative morbidity, duration of hospitalization and cost of treatment. In the Cochrane systematic review, it was shown that none of the routinely used prokinetic drugs (neostigmine, metoclopramide, erythromycin) or laxatives reduce the duration of POI (level of evidence Ia). At the same time, the application of neostigmine is associated with the risk of side effects in almost all organs and systems. The use of metoclopramide was restricted by the European Medicines Agency due to the risk for developing severe neurological side effects. Both drugs are prescribed too late, on days 3–5 after surgery, often when POI is already developed. Under these conditions, the Ukrainian infusion preparation Sorbilact®, with sorbitol as the main active ingredient, deserves attention. Many clinical studies have demonstrated its ability to reduce the duration of POI by 1.5–2 times. At the same time, Sorbilaсt® had clinical benefits by shortening the interval to the appearance of audible bowel sounds on auscultation, passage of flatus and stool. The obtained data were confirmed instrumentally using computer pneumokinesography and ultrasonography. Sorbilact® can be administered in the first hours after surgery, or even directly during it. Both preventive and therapeutic goals can be pursued. In the cited clinical studies, Sorbilact® did not cause any side effects. Due to the fact that sorbitol, which is a component of Sorbilact®, is converted into fructose in the body, the drug is not prescribed to individuals with hereditary fructose intolerance.
Сорбілакт®; сорбітол; післяопераційний парез кишечника
Сорбилакт®; сорбитол; послеоперационный парез кишечника
Sorbilact®; sorbitol; postoperative ileus
Своевременное восстановление моторики ЖКТ является тестом успешности выполненной операции. Несвоевременное разрешение моторных нарушений кишечника становится одной из основных причин тяжелых послеоперационных осложнений, таких как несостоятельность кишечных швов, перитонит, прогрессирующая интоксикация и т.п. По образному выражению Моше Шайна, «пока живот открыт, хирург контролирует его, как только вы его закрыли — он контролирует вас» [1].
Введение
На сегодняшний день не существует принятого во всем мире стандартизированного клинического определения послеоперационного пареза кишечника (син. послеоперационный илеус) [2]. Мы приведем два наиболее удачных, на наш взгляд, определения. В обзоре 2017 г. была предложена следующая формулировка: «Послеоперационный илеус — временное прекращение согласованной перистальтики кишечника после оперативного вмешательства, ограничивающее пассаж кишечного содержимого и приводящее к непереносимости перорального приема жидкостей или твердой пищи» [3]. В метаанализе 2013 г. [2, 4] послеоперационный илеус был определен как комбинация двух или более из следующих пяти знаков на ≥ 4-й день после операции:
— наличие тошноты и рвоты;
— непереносимость твердой или полужидкой пищи в течение предшествующих 24 ч;
— не отходят газы или отсутствует стул в течение предшествующих 24 ч;
— вздутие живота;
— рентгенологическое подтверждение кишечной непроходимости.
Хотя выше приведена цифра «≥ 4», в настоящее время четко не определен день после операции, с которого рассматриваемое состояние должно считаться патологией. Разные исследователи называют дни с 1-го по 7-й [4, 5]. Также обращаем внимание читателя, что далее по тексту мы будем пользоваться термином «послеоперационный парез кишечника» (ППК).
ППК возникает после многих хирургических вмешательств (например, после цистэктомии, операций на абдоминальной аорте и пр.), но наиболее часто (в 10–30 %) — после абдоминальных операций [4, 6, 7]. К основным факторам риска относят мужской пол, пожилой возраст и значительную кровопотерю [4].
ППК является одним из главных осложнений, вызывающих озабоченность врача. Это связано с тем, что данное состояние повышает послеоперационную заболеваемость, длительность госпитализации и стоимость лечения [4]. Охарактеризуем кратко каждый из этих пунктов. ППК вызывает гастроинтестинальный стаз с риском развития тошноты и рвоты; как следствие, возможно развитие легочной аспирации и пневмонии. Помимо этого, может возникнуть обезвоживание, электролитный дисбаланс и даже сепсис [4]. Касательно сроков пребывания в стационаре было подсчитано, что пациенты с диагнозом ППК задерживаются в среднем на 5 дней дольше после абдоминальных операций по сравнению с пациентами без ППК [8, 9]. Пропорционально этому растет и стоимость лечения. Суммарные ежегодные затраты в США на стационарное лечение закодированного (по МКБ) послеоперационного илеуса после абдоминальных операций составляют 1,46 млрд долларов (учитывали первичную госпитализацию и повторную госпитализацию в течение 30 дней) [10].
В связи с актуальностью темы в настоящем кратком обзоре будет рассмотрен патогенез ППК, а также немедикаментозные и в большей степени медикаментозные подходы к его коррекции.
Патогенез
Возникновение ППК имеет многофакторную природу и связано с хирургическими манипуляциями на кишечнике, введением анксиолитиков и опиоидов, развитием послеоперационного стресса. В течении заболевания выделяют три фазы: неврологическую, воспалительную и фазу разрешения (вагусной активации) [4].
Во время более короткой неврологической фазы ингибиторные рефлексы (рис. 1) и ряд других механизмов приводят к повышению активности симпатической нервной системы по сравнению с парасимпатической нервной системой. В результате происходит снижение подвижности кишечника [4].
Для воспалительной фазы характерно более пролонгированное течение. Во время хирургических манипуляций на кишечнике происходит активация дендритных клеток с последующим синтезом интерлейкина-12 (IL-12). Далее цепочка событий развивается по следующей схеме: IL-12 → активация Т-хелперов 1-го типа (ТН1) → секреция интерферона-гамма (IFN-γ) → активация макрофагов → изменение активности энтеральной нервной системы (ЭНС) → уменьшение подвижности кишечника [4, 11, 12]. Очень важным моментом является тот факт, что ТН1-клетки от места операции мигрируют вдоль всего кишечного тракта, способствуя развитию генерализованного ППК [11]. Реализация воспалительной фазы связана с секрецией многих медиаторов воспаления (рис. 1).
В фазе разрешения (вагусной активации) происходит повышение тонуса блуждающего нерва с усилением секреции ацетилхолина. Данный медиатор связывается с α7-никотиновыми ацетилхолиновыми рецепторами (α7nACh) на поверхности макрофагов, что приводит к подавлению тканевой макрофагальной реактивности и высвобождения цитокинов. В результате воспаление прекращается, наступает выздоровление [4, 13, 14].
Важным штрихом к вышеописанному патогенезу является тот факт, что эндогенные и экзогенные опиоиды (морфин и пр.) повышают риск развития ППК, поскольку воздействие на μ-опиоидные рецепторы ослабляет подвижность кишечника. Экзогенные опиоиды часто используют в интра- и послеоперационном периоде для премедикации и борьбы с послеоперационной болью соответственно [8].
Профилактика
Первейшая задача врача сводится к использованию профилактических методов, направленных на предупреждение ППК. По данным метаанализов, уровень доказательности Ia имеют следующие методы: минимально инвазивная хирургия (замена лапаротомии на лапароскопию), послеоперационная анальгезия с эпидуральным катетером (симпатолизис + уменьшение необходимости в опиоидах) и жевание жвачки в послеоперационном периоде (активация цефаловагального рефлекса, который усиливает перистальтику и подавляет воспаление). Среди других мер, эффективность которых требует подтверждения в будущих исследованиях, применяют раннюю мобилизацию пациентов, быстрое возвращение к питанию, отказ от использования назогастрального зонда и т.д. [3, 4, 8].
Для получения большего эффекта рекомендуется применять все эти методы в комплексе. Например, в протоколах ERAS (Enhanced Recovery After Surgery — быстрое восстановление после операции) их фигурирует около десятка [3].
Лечение
Список основных препаратов, которые тестировали в качестве лекарственных средств для лечения ППК, представлен в табл. 1. Потенциально пригодными могли бы быть алвимопан, нестероидные противовоспалительные средства (НПВС), лидокаин, магния сульфат, неостигмин (прозерин), метоклопрамид и мосаприда цитрат. Однако они либо плохо исследованы, либо вызывают побочные эффекты и т.д.
В нашей стране для лечения ППК врачи традиционно используют неостигмин (прозерин) и метоклопрамид, поэтому на этих препаратах мы остановимся подробнее.
В систематическом обзоре сообщества Cochrane, опубликованном в 2008 г., было показано, что ни один препарат из рутинно применяемых прокинетиков (неостигмин, метоклопрамид, эритромицин) или слабительных не уменьшает длительность ППК (уровень доказательности Ia). Эти рекомендации сохраняют свою значимость и сегодня. В выводах к обзору было отмечено, что лидокаин и неостигмин потенциально могут быть эффективны, однако требуется большее число исследований, чтобы это подтвердить; алвимопан был эффективен, однако из-за методологических неточностей сохранил статус недостаточно исследованного препарата [16].
Неостигмин (прозерин) принадлежит к классу ингибиторов ацетилхолинэстеразы (АХЭ). В обычных условиях данный фермент разрушает ацетилхолин, являющийся медиатором в синапсах. Угнетая работу АХЭ, препарат повышает концентрацию ацетилхолина во всех холинергических синапсах организма (за исключением ЦНС, куда лекарство не проникает). Как следствие, практически нет органа или системы органов, где побочные эффекты не могли бы возникнуть. Неостигмин (прозерин) способен вызывать:
— нарушение зрения;
— гиперсаливацию, спастическое сокращение и усиление перистальтики кишечника, тошноту, рвоту, метеоризм, диарею;
— брадикардию, атриовентрикулярную блокаду;
— снижение артериального давления;
— бронхоспазм;
— спазмы и подергивание скелетной мускулатуры;
— учащение мочеиспускания;
— обильное потоотделение и т.д.
С учетом такого количества возможных побочных эффектов становится ясно, что назначение неостигмина (прозерина) в послеоперационном периоде нежелательно и даже опасно [17].
По результатам систематического обзора 2008 г. метоклопрамид не входит в перечень средств, которые потенциально могут быть эффективны [16]. Более того, как за рубежом, так и в нашей стране этот препарат не зарегистрирован для лечения ППК (отсутствует показание в официальной инструкции) [18].
В 2013 г. Европейское медицинское агентство выпустило рекомендации, в которых было предложено ограничить применение метоклопрамида. Причина — способность препарата повышать риск развития серьезных неврологических побочных эффектов. Среди них наиболее частыми являются экстрапирамидные синдромы, включая паркинсонизм, позднюю дискинезию, акатизию и острые дистонии. Предполагаемый механизм связан со способностью метоклопрамида блокировать стриарные D2-рецепторы [19, 20].
Таким образом, по состоянию на сегодняшний день отсутствуют рекомендации по применению неостигмина (прозерина) и метоклопрамида для борьбы с ППК. Кроме того, оба препарата имеют высокий риск развития побочных эффектов.
Сорбилакт® — отечественный препарат для профилактики и лечения послеоперационного пареза кишечника
В условиях, когда всемирно известные средства могут быть неэффективны и/или небезопасны для борьбы с ППК, мы хотели бы обратить внимание специалистов на отечественный препарат Сорбилакт®.
Препарат был разработан сотрудниками Института патологии крови и трансфузионной медицины АМН Украины и выпускается фармацевтической компанией «Юрия Фарм». В состав Сорбилакта® входят сорбитол, основные катионы (Na+, K+, Ca2+, Mg2+), анион (Cl–) и лактат-анион. При этом сорбитол находится в гипертонической (1095 мМ) по отношению к плазме крови концентрации [21].
Компоненты, входящие в состав Сорбилакта® (в пересчете на 1 литр раствора) [22, 23]: сорбитол — 200,0 г; натрия лактат — 19,0 г; натрия хлорид — 6,0 г; кальция хлорид — 0,1 г; калия хлорид — 0,3 г; магния хлорид — 0,2 г. Теоретическая осмолярность 1670 мОсм/л; энергетическая ценность 830 ккал/л; рН 6,0–7,6.
Говоря интегрально о механизме действия Сорбилакта®, авторы пишут, что входящий в его состав гипертонический раствор сорбитола оказывает на гладкие мышцы кишечника выраженное стимулирующее действие. Этот эффект обусловлен центральным механизмом, а также влиянием на местные нервные, гормональные и мышечные структуры стенки кишки [24].
Рассматривая отдельные компоненты механизма действия Сорбилакта®, исследователи выделяют следующие эффекты [24, 25]:
— воздействие на нервно-рецепторный аппарат и преганглионарные образования, регулирующие сокращение ворсинок;
— повышение секреции гормонов вилликинина и холецистокинина;
— усиление кровотока в брыжейке тонкой и толстой кишки (нормализует реологические свойства крови, восстанавливает нарушенную микроциркуляцию), дезинтоксикационное и энергетическое действие;
— активация синтеза витаминов группы В.
Исходя из описанных механизмов можно предположить, что Сорбилакт® влияет как на неврологическую фазу ППК (например, за счет воздействия на нервно-рецепторный аппарат и преганглионарные образования), так и на его воспалительную фазу (улучшение кровотока способствует удалению медиаторов и продуктов воспаления из стенки кишечника).
Важной особенностью Сорбилакта® является то, что его можно применять с первых часов после оперативного вмешательства или даже непосредственно во время его выполнения. Это выгодно отличает его от неостигмина (прозерина) и метоклопрамида, которые назначают на 3-и — 5-е сутки из-за возможных негативных влияний на течение послеоперационного периода. К сожалению, в это время уже часто имеется развившаяся картина ППК [24, 26].
С профилактической целью взрослым и детям старше двенадцати лет Сорбилакт® вводят внутривенно капельно из расчета 2,5–5 мл/кг со скоростью 60–80 капель в 1 минуту. Начало применения препарата возможно сразу после оперативного вмешательства и затем в течение первых 2–3 суток каждые 12 часов. Такая методика обеспечивает гладкое послеоперационное течение, без осложнений со стороны кишечника. Отмечено, что перистальтика кишечника восстанавливается в первые 24–48 часов, газы отходят самостоятельно, пассаж кишечного содержимого быстро нормализуется [25].
С лечебной целью взрослым и детям старше двенадцати лет Сорбилакт® вводят внутривенно капельно в дозе 150–300 мл 3–4 раза в сутки через каждые 6–8 часов в течение 2–3 суток и более до нормализации моторики кишечника. Положительное влияние Сорбилакта® на перистальтику кишечника отчетливо заметно. Уже через 1–3 часа после инфузии препарата начинают отходить газы, выслушивается перистальтика. Однако повторные инфузии препарата следует продолжать до стойкой ликвидации признаков пареза кишечника. Если признаки пареза кишечника выявляются при операции, то Сорбилакт® должен вводиться во время операции [25].
Детям младше 12 лет дозу Сорбилакта® необходимо снизить в соответствии с инструкцией к препарату [22].
Верификация клинической эффективности
С помощью компьютерной пневмокинезографии
Для верификации клинической эффективности Сорбилакта® большое значение имело рандомизированное контролируемое исследование М.П. Захараш и соавт. [24], поскольку влияние препарата на ППК было инструментально подтверждено с помощью компьютерной пневмокинезографии (КПКГ).
В исследование были включены 24 пациента колопроктологического профиля, перенесшие полостные оперативные вмешательства. Основная группа (12 пациентов) в составе комплексной терапии получала Сорбилакт®. Препарат вводили с конца первых суток послеоперационного периода внутривенно капельно по 200 мл с интервалом 8 ч в течение 4 суток. Контрольная группа (12 пациентов) получала ту же комплексную терапию без Сорбилакта®.
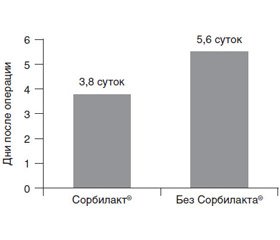
По данным КПКГ, исходно (1-е сутки после операции, до введения Сорбилакта®) в обеих группах пациентов отмечалось практически полное угнетение моторной активности дистального отдела толстой кишки. К 3-м суткам в основной группе наблюдалось достоверно большее улучшение по сравнению с контрольной группой. Полное восстановление моторной активности в основной группе наблюдалось через 3,8 суток, о чем свидетельствовали ритмичные пропульсивные сокращения 5–6 раз/мин (длительность экстрапериодов работы кишки составляла 8–12 мин, после чего следовали периоды покоя 30–35 мин). В контрольной группе полное восстановление происходило через 5,6 суток, что было в 1,5 раза позже, чем в основной группе (рис. 2).
Аускультативные признаки появления перистальтики кишечника в основной группе отмечались в среднем через 2,9 суток, в контрольной — через 4,1 суток. Аналогичные цифры для отхождения газов составили соответственно 3,3 и 5,1 суток. Для самостоятельного стула — соответственно 4,8 и 5,9 суток.
Количество послеоперационных койко-дней в основной группе составило 10,4 дня, что в 1,4 раза меньше, чем в контрольной группе, где данный показатель равнялся 14,3 дня.
Таким образом, принимая во внимание все показатели, устранение ППК на фоне лечения Сорбилактом® происходило примерно в 1,5 раза быстрее по сравнению с группой, не получавшей данный препарат.
С помощью ультразвукового исследования
Для верификации клинической эффективности Сорбилакта® большое значение имело также контролируемое исследование Е.М. Миербекова и соавт. [27], поскольку влияние препарата на ППК было инструментально подтверждено с помощью ультразвукового исследования (УЗИ).
В работу было включено 60 пациентов в возрасте 22–65 лет, оперированных на органах брюшной полости без вскрытия полых органов (синдром Лериша, грыжи пищеводного отверстия диафрагмы, калькулезный холецистит, аневризма брюшной аорты). Основная группа (30 пациентов) в составе комплексной терапии получала Сорбилакт®. Препарат вводили с первых суток после оперативного вмешательства внутривенно капельно по 200–400 мл (3,5–6,5 мл/кг, 60–80 капель в 1 минуту) каждые 12 часов на протяжении пребывания больных в отделении анестезиологии, реанимации и интенсивной терапии (ОАРИТ). Контрольная группа (30 пациентов) получала ту же комплексную терапию без Сорбилакта®.
В ходе исследования было установлено, что в группе пациентов, получавших Сорбилакт®, в первые сутки после операции быстрее начинала прослушиваться (аускультация) и визуализироваться (УЗИ) перистальтика кишечника, отходить газы, чем в контрольной группе обследованных. Послеоперационное время нахождения в ОАРИТ группы пациентов, получавших Сорбилакт®, составило 18,0 ± 3,6 часа, что было в 2 раза меньше, чем в контрольной группе: 38,0 ± 7,8 часа (р < 0,05).
Данные других клинических исследований и рекомендаций
В 2018 г. в г. Алматы был заслушан доклад Т.К. Куандыкова и соавт. на тему «Место малообъемной инфузионной терапии в лечении хирургических больных» [28, 29]. Было сообщено о наблюдении за 22 пациентами в возрасте 25–68 лет после различных хирургических вмешательств на органах брюшной полости, пищеводе, органах забрюшинного пространства, сердце и магистральных сосудах. В одной из групп (10 пациентов) в составе комплексной терапии назначали Сорбилакт® внутривенно в объеме 7,4 ± 1,3 мл/кг в сутки, скорость инфузии 400 мл/час. Показанием к назначению служило наличие ППК. В другой группе назначали реосорбилакт, но мы не будем рассматривать ее в ходе настоящего обзора.
В результате было выяснено, что длительность применения всех исследуемых препаратов составила 3,4 ± 1,2 суток, длительность пребывания пациентов в отделении реанимации и интенсивной терапии составила 9,7 ± 6,4 суток. На фоне применения препарата Сорбилакт® наблюдалось повышение центрального венозного давления, увеличивался часовой диурез и улучшалась перистальтика желудочно-кишечного тракта (с 3,5 ± 1,2 балла до 4,5 ± 1,8 балла).
В исследовании А.Г. Дубровина и соавт. [26] были проанализированы результаты применения Сорбилакта® у 509 детей с острой хирургической патологией и плановыми оперативными вмешательствами за период с 2006 по 2009 г. Первое введение Сорбилакта® проводилось в операционной в конце операции или сразу после нее, в дозе 4–6 мл/кг. Внутривенные инфузии повторяли каждые 8–12 ч; при отсутствии пареза кишечника и в случае, если его развитие не прогнозируется, — в профилактической дозе 3,5–4,0 мл/кг 2 раза в сутки в течение двух суток; при наличии пареза — в лечебной дозе 5–6 мл/кг 2–3 раза в сутки в течение трех суток.
Авторы исследования отмечают, что при лечении Сорбилактом® развившегося ППК восстановление перистальтики имеет следующие особенности:
— 1-е сутки: перистальтика может отсутствовать, выслушивается вялая перистальтика только во время введения и действия Сорбилакта®;
— 2-е сутки: при наличии вялой перистальтики отмечается ее улучшение во время введения и действия Сорбилакта®. В периоды улучшения перистальтики больной частично усваивает энтерально воду, частично выпитая вода выходит по зонду с примесью стаза;
— 3-и сутки: перистальтика восстанавливается, отходят газы. Удаляют желудочный зонд, дети активно пьют.
Таким образом, у больных с ППК восстановление перистальтики на фоне лечения Сорбилактом® происходит к концу 2-х — началу 3-х суток. В том случае, если препарат не использовали, перистальтика восстанавливалась на 4-е сутки.
У плановых больных, оперированных на толстой кишке (болезнь Гиршпрунга с первичным анастомозом, наложение и снятие стом), по поводу кист печени и селезенки, при профилактическом назначении Сорбилакта® пареза кишечника практически не бывает.
В рандомизированное контролируемое исследование К.Е. Дина и соавт. [30] было включено 27 женщин, перенесших массивную кровопотерю III и IV ст., обусловленную прогрессирующей отслойкой нормально расположенной плаценты (у 21 пациентки), предлежанием плаценты (у 4) и атоническим кровотечением (у 2). В плановом порядке кесарево сечение выполнено у 4 женщин, в экстренном — у 23. Всем женщинам проведено оперативное лечение — экстирпация матки.
В ходе исследования было сформировано две группы. В первой из них (13 пациенток) в составе комплексной терапии вводили Сорбилакт® (4–6 мл/кг) и 6% гекодез (20 мл/кг). Во второй группе (14 пациенток) в составе комплексной терапии вводили 0,9% натрия хлорид (28–30 мл/кг) и 6% гекодез (20 мл/кг).
В результате было выяснено, что помимо эффектов, связанных с основной патологией, в группе пациенток, получавших Сорбилакт®, наблюдалось более быстрое восстановление пассажа кишечника — через 43,4 ± 1,4 часа — по сравнению с другой группой (52,6 ± 1,2 часа; p < 0,001).
Наконец, хотелось бы отметить, что успехи клинического применения Сорбилакта® позволили включить данный препарат в украинские методические рекомендации «Использование растворов многоатомных спиртов (препаратов Сорбилакт и Реосорбилакт) в интенсивной терапии при тяжелой политравме» в качестве средства для профилактики и лечения ППК [25].
Безопасность
В процитированных клинических исследованиях сообщается о том, что применение Сорбилакта® не приводило к развитию побочных эффектов [24, 26, 28, 29].
Сорбилакт® содержит в своем составе сорбитол, который в организме превращается во фруктозу. Соответственно, препарат не назначают пациентам с наследственной непереносимостью фруктозы. Обычно это не представляет проблемы: заболевание встречается достаточно редко, с частотой 1 : 20 000 человек (т.е. в Украине не более 2500 заболевших), и пациенты часто знают о болезни и могут заранее уведомить врача [22, 31].
Заключение
Во многих представленных клинических исследованиях была продемонстрирована способность Сорбилакта® уменьшать длительность ППК в 1,5–2 раза. При этом препарат ускорял появление аускультативных признаков перистальтики, отхождение газов, самостоятельный стул. Полученные данные были подтверждены инструментально — с помощью электроэнтерографии и ультразвукового исследования.
Авторы отмечали, что раннее назначение Сорбилакта® способствовало сохранению тонуса кишечника. А это, в свою очередь, способствовало более быстрому запуску перистальтики [24, 26]. В одном исследовании было отмечено, что Сорбилакт® не вызывает резкого усиления перистальтики, как неостигмин (прозерин), а действует мягко. Поэтому его можно применять в первые часы после наложения кишечных анастомозов [26].
Нормализация моторной функции кишечника на фоне применения Сорбилакта® позволяет раньше начать энтеральное питание, а также раннее зондовое питание, уменьшить объем инфузии, потери белка, воды, электролитов, вероятность послеоперационных пневмоний, транслокации кишечной флоры, снизить риск спаечного процесса, а также сократить сроки пребывания пациентов в отделениях интенсивной терапии и хирургических стационарах [24, 26, 27].
В выполненных клинических исследованиях Сорбилакт® не вызывал побочных эффектов.
Таким образом, с учетом эффективности и безопасности препарата Сорбилакт® он может быть рекомендован к широкому применению для профилактики и лечения послеоперационного пареза кишечника при хирургических вмешательствах у взрослых и детей.
1. Моторные нарушения кишечника в раннем послеоперационном периоде, профилактика и лечение / Жакиев Б.С., Карсакбаев У.Г., Мухамедгалиева Б.М. и др. // Оренбургский медицинский вестник. — 2016. — Т. 4, № 3. — С. 43-45.
2. Vather R., Trivedi S., Bissett I. Defining postoperative ileus: results of a systematic review and global survey // J. Gastrointest. Surg. — 2013. — V. 17, № 5. — P. 962-972.
3. Ileus in Adults / Vilz T.O., Stoffels B., Strassburg C. et al. // Dtsch. Arztebl. Int. — 2017. — V. 114, № 29–30. — P. 508-518.
4. Postoperative ileus: Pathophysiology, incidence, and prevention / Venara A., Neunlist M., Slim K. et al. // J. Visc. Surg. — 2016. — V. 153, № 6. — P. 439-446.
5. Does enhanced recovery reduce postoperative ileus after colorectal surgery? / Barbieux J., Hamy A., Talbot M.F. et al. // J. Visc. Surg. — 2017. — V. 154, № 2. — P. 79-85.
6. Definition, incidence, risk factors, and prevention of paralytic ileus following radical cystectomy: a systematic review / Ramirez J.A., McIntosh A.G., Strehlow R. et al. // Eur. Urol. — 2013. — V. 64, № 4. — P. 588-597.
7. Twine C.P., Humphreys A.K., Williams I.M. Systematic review and meta-analysis of the retroperitoneal versus the transperitoneal approach to the abdominal aorta // Eur. J. Vasc. Endovasc. Surg. — 2013. — V. 46, № 1. — P. 36-47.
8. Zeinali F., Stulberg J.J., Delaney C.P. Pharmacological management of postoperative ileus // Can. J. Surg. — 2009. — V. 52, № 2. — P. 153-157.
9. Postoperative ileus: profiles, risk factors, and definitions — a framework for optimizing surgical outcomes in patients undergoing major abdominal colorectal surgery / Delaney C., Kehlet H., Senagore A. et al. // Clinical consensus update in general surgery / Ed. by G. Bosker. — Roswell (GA): Pharmatecture, LLC. — 2006. Available: www.clinicalwebcasts.com/pdfs/GenSurg_WEB.pdf
10. Inpatient economic burden of postoperative ileus associated with abdominal surgery in the United States / Goldstein J.L., Matuszewski K.A., Delaney C.P. et al. // P&T. — 2007. — V. 32, № 2. — P. 82-90.
11. The role of lymphoid tissue in the attenuation of the postoperative ileus / Koscielny A., Engel D., Maurer J. et al. // Am. J. Physiol. Gastrointest. Liver Physiol. — 2013. — V. 304, № 4. — P. G401-G412.
12. Muscularis macrophages: Key players in intestinal homeostasis and disease / De Schepper S., Stakenborg N., Matteoli G. et al. // Cell Immunol. — 2018. — V. 330. — P. 142-150.
13. Stimulation of the autonomic nervous system in colorectal surgery: a study protocol for a randomized controlled trial / Berghmans T.M., Hulsewé K.W., Buurman W.A., Luyer M.D. // Trials. — 2012. — V. 13. — Numb. of publ. 93.
14. Tracey K.J. Physiology and immunology of the cholinergic antiinflammatory pathway // J. Clin. Invest. — 2007. — V. 117, № 2. — P. 289-296.
15. Frost E.A. Preventing paralytic ileus: can the anesthesiologist help // Middle East J. Anaesthesiol. — 2009. — V. 20, № 2. — P. 159-165.
16. Systemic prokinetic pharmacologic treatment for postoperative adynamic ileus following abdominal surgery in adults / Traut U., Brügger L., Kunz R. et al. // Cochrane Database Syst. Rev. — 2008. — V. 1. — P. CD004930.
17. Прозерин: офіційна інструкція // Міністерство охорони здоров’я України. — http://moz.gov.ua
18. Метоклопрамід: офіційна інструкція // Міністерство охорони здоров’я України. — http://moz.gov.ua
19. European Medicines Agency recommends changes to the use of metoclopramide // EMA. — 2013. — https://www.ema.eu
20. Metoclopramide-induced extrapyramidal signs and symptoms — brief review of literature and case report / Valkova M., Stamenov B., Peychinska D. et al. // J. of IMAB. — 2014. — V. 20, № 6. — P. 539-541.
21. Аутогемотрансфузия в комплексном лечении заболеваний системы крови, в том числе у больных гемофилией: Методические рекомендации / Стариков А.В., Баронская Л.В., Гаврилюк Е.И. и др. — К.: Министерство здравоохранения Украины, Академия медицинских наук Украины, Украинский центр научно-медицинской информации и патентно-информационной работы, 2007. — 28 с.
22. Сорбілакт®: офіційна інструкція // Міністерство охорони здоров’я України. — http://moz.gov.ua
23. Трещинский А.И., Трещинская М.А. Реосорбилакт® и Сорбилакт® как препараты инфузионной терапии в неврологии // Мистецтво лікування. — 2006. — № 12. — С. 66-68.
24. Роль препарата Сорбилакт в раннем послеоперационном периоде у больных колопроктологического профиля / Захараш М.П., Кучер Н.Д., Пойда А.И., Яремчук И.А. // Мистецтво лікування. — 2004. — № 9. — С. 28-29.
25. Шлапак И.П., Малыш И.Р. Использование растворов многоатомных спиртов (препаратов Сорбилакт и Реосорбилакт) в интенсивной терапии при тяжелой политравме: Методические рекомендации. — К.: Министерство здравоохранения Украины, Киевская академия последипломного образования им. П.Л. Шупика, Украинский научно-практический центр экстренной медицинской помощи и медицины катастроф, Киевская городская клиническая больница скорой медицинской помощи, 2003. — 30 с.
26. Опыт лечения и профилактики пареза кишечника у детей в раннем послеоперационном периоде / Дубровин А.Г., Белебезьев Г.И., Яковлева И.П. и др. // Біль, знеболювання і інтенсивна терапія. — 2010. — № 2. — С. 48-51.
27. Использование сорбилакта у хирургических больных в раннем послеоперационном периоде / Миербеков Е.М., Жарасбаев А.М., Муханова С.Р. и др. // Medicine. — 2014. — № 7. — С. 93-96.
28. Куандыков Т.К., Мутагиров В.В., Достарбаев Б.Ж. Место малообъемной инфузионной терапии в лечении хирургических больных. — Алматы, 2018. https://slide-share.ru
29. Куандыков Т.К., Мутагиров В.В., Айдарбеков С. Место малообъемной инфузионной терапии в лечении хирургических больных // Медицина. — 2018. — № 4. — http://www.medzdrav.kz
30. Дин К.Е., Семенихин А.А., Абидов А.К. Сравнительная характеристика инфузионных растворов в профилактике острой почечной недостаточности в практике акушерства // Матеріали симпозіуму «Неінтенсивна інфузійна терапія у фтизіопульмонології та інших галузях медицини», 27–28 вересня, 2012, Донецьк, Україна // Український хіміотерапевтичний журнал. — 2012. — № 3. — С. 85-89.
31. Наследственная непереносимость фруктозы / Нагорная Н.В., Бордюгова Е.В., Дудчак А.П., Коваль А.П. // Здоровье ребенка. — 2014. — № 3. — С. 92-96.

/38-1.jpg)
/39-1.jpg)
/41-1.jpg)