Журнал «Почки» Том 8, №3, 2019
Вернуться к номеру
Добовий профіль артеріального тиску в дітей із хронічним пієлонефритом та хронічною хворобою нирок I–III стадій
Авторы: Вакуленко Л.І.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
Актуальність. У веденні пацієнтів із хронічною хворобою нирок (ХХН) важливе значення як для зниження традиційного серцево-судинного ризику, так і для збереження залишкової функції нирок протягом тривалого часу має контроль артеріального тиску (АТ). Мета роботи: вивчити особливості добового профілю артеріального тиску в дітей із хронічним пієлонефритом (ХПН) і І–ІІІ стадією ХХН. Матеріали та методи. Обстежені 94 дитини віком від 6 до 17 років із хронічним пієлонефритом поза загостренням і з ХХН I–III стадії. Проводили добове моніторування АТ із наступною математичною обробкою результатів. Результати. При порівняльному аналізі показників АТ, отриманих при разовому вимірюванні та при проведенні ДМАТ, виявлено їх розбіжність у 25,5 % випадків. За даними ДМАТ, у дітей з ХПН в цілому підвищений АТ реєструвався у 22,3 % хворих, АГ — у 34,0 %. Встановлено, що зі зниженням ниркових функцій (легкий або помірний ступінь ХХН) поступово збільшувалась відносна кількість хворих зі стабільною та лабільною АГ. Аналіз ступеня нічного зниження АТ у пацієнтів із ХПН виявив поступове зменшення відносної кількості пацієнтів з оптимальним рівнем зниження як систолічного АТ (від 61,7 % при ХХН І ст. до 47,1 % при ХХН ІІІ ст.), так і діастолічного АТ (53,2 і 11,8 % відповідно; р = 0,0049). Серед хворих із ХХН ІІІ стадії реєстрували пацієнтів night-peakers, які мали стійке підвищення систолічного (11,8 %) та діастолічного АТ (29,4 %) вночі. Висновки. Під час прогресування ХХН серед дітей із ХПН зростає кількість пацієнтів із підвищеним АТ та АГ. Характерними ознаками АГ у цієї категорії пацієнтів є суттєвіший внесок діастолічної складової та стійке підвищення нічного АТ.
Актуальность. В ведении пациентов с хронической болезнью почек (ХБП) важное значение как для снижения традиционного сердечно-сосудистого риска, так и для сохранения остаточной функции почек в течение длительного времени имеет контроль артериального давления (АД). Цель работы: изучить особенности суточного профиля АД у детей с хроническим пиелонефритом (ХПН) с І–ІІІ стадией ХБП. Материалы и методы. Обследованы 94 ребенка в возрасте от 6 до 17 лет с хроническим пиелонефритом вне обострения и ХБП I–III стадии. Проводилось суточное мониторирование артериального давления (СМАД) с последующей математической обработкой результатов. Результаты. При сравнительном анализе показателей АД, полученных при разовом измерении и при проведении СМАД, выявлено их расхождение в 25,5 % случаев. По данным СМАД, у детей с ХПН в целом повышенное АД регистрировалось у 22,3 % больных, АГ — у 34,0 %. Установлено, что со снижением функции почек (легкая или умеренная степень ХБП) постепенно увеличивалось относительное количество больных со стабильной и лабильной артериальной гипертензией (АГ). Анализ степени ночного снижения АД у пациентов с ХПН показал постепенное уменьшение относительного количества пациентов с оптимальным уровнем снижения как систолического АД (от 61,7 % при ХБП I стадии до 47,1 % при ХБП III стадии), так и диастолического АД (53,2 и 11,8 % соответственно; р = 0,0049). Среди больных с ХБП III стадии регистрировались пациенты night peakers, которые имели устойчивое повышение систолического (11,8 %) и диастолического АД (29,4 %) ночью. Выводы. Во время прогрессирования ХБП среди детей с ХПН увеличивается количество пациентов с повышенным АД и АГ. Характерными признаками АГ у этой категории пациентов являются существенный вклад диастолической составляющей и устойчивое повышение ночного АД.
Background. Blood pressure (BP) monitoring is important for the management of patients with chronic kidney disease (CKD), both for the conventional cardiovascular risk reduction and long-term preservation of kidney function. The purpose was to study the features of 24-hour blood pressure profile in children with chronic pyelonephritis (CPN) and CKD stages І–ІІІ. Materials and methods. A total of 94 patients aged from 6 to 17 years with chronic pyelonephritis in remission and CKD stages І–ІІІ were examined. 24-hour ambulatory blood pressure monitoring (ABPM) was carried out followed by mathematical processing. Results. Thus, a comparative analysis of the systolic (SBP) and diastolic BP (DBP) indicators obtained within a single ВР measurement and during 24-hour ABPM showed their differences in 25.5 % of cases. According to ABPM findings, 22.3 % of CKD children demonstrated elevated BP and 34.0 % — arterial hypertension (АН). It was found that the relative number of patients with sustained and labile AH gradually increased with a decrease in renal functions (mild-to-moderate CKD progression). The analysis of night-time BP dipping degree in patients with CKD revealed a gradual decrease in the relative number of patients with optimal BP dipping for both SBP (from 61.7 % in CKD stage I to 47.1 % in CKD stage III) and DBP (53.2 and 11.8 %, respectively; р = 0.0049). Night-peakers with night-time stable elevation of SBP (11.8 %) and DBP (29.4 %) were the patients with CKD stage III. Conclusions. The number of hypertensive patients increases among CPN children during CKD progression. AH in children with progressive nephropathy is characterized by a greater contribution from DBP and stable elevation of night-time BP.
артеріальний тиск; добове моніторування артеріального тиску; діти; хронічний пієлонефрит; хронічна хвороба нирок
артериальное давление; суточное мониторирование артериального давления; дети; хронический пиелонефрит; хроническая болезнь почек
blood pressure; 24-hour blood pressure profile; children; chronic pyelonephritis; chronic kidney disease
Вступ
На сьогодні патофізіологічні механізми, що приводять до підвищеного серцево-судинного ризику в пацієнтів із хронічною хворобою нирок (ХХН), повністю не вивчені, але є беззаперечні докази тісного зв’язку між серцем і ниркою [1–4]. Останнім часом досить широко обговорюється взаємозв’язок між захворюваннями нирок і серцево-судинною системою, відомий як «cardiorenal syndrome» [1–3]. Кардіоренальний синдром (КРС) охоплює спектр захворювань, які зачіпають як серце, так і нирки, при яких гостра або хронічна дисфункція в одному органі може викликати гостру або хронічну дисфункцію в іншому органі [3, 4]. КРС 4-го типу, або хронічний ренокардіальний синдром, визначений як «хронічна патологія нирок, що веде до серцевого пошкодження», являє собою ураження серцево-судинної системи на будь-якій стадії ХХН [1, 2, 4, 5]. Пацієнти з ХХН особливо схильні до розвитку серцевої дисфункції через високу поширеність серцево-судинних факторів ризику в цій популяції, але слід ураховувати внесок конкретних чинників ризику [5]. Найбільш важливим фактором ризику розвитку ренокардіальних порушень є підвищення артеріального тиску (АТ) як у дорослих, так і в дітей [1, 4, 6].
У низці досліджень було показано, що високий кров’яний тиск відіграє роль незалежного фактора ризику для більш швидкого зниження швидкості клубочкової фільтрації (ШКФ) у пацієнтів із нирковими захворюваннями [6–9]. Контроль АТ стає значущим у веденні пацієнтів із ХХН як для зниження традиційного серцево-судинного ризику, так і для збереження залишкової функції нирок протягом тривалого часу [8]. Для діагностики ураження органів-мішеней більшу прогностичну значущість мають параметри амбулаторного добового моніторування артеріального тиску (ДМАТ), ніж показники, визначені при разовому офісному/домашньому вимірюванні артеріального тиску [8, 10].
Нормальний рівень АТ при разовому офісному вимірюванні не дозволяє виключити приховану артеріальну гіпертензію (АГ), нічну гіпертонію та інші відхилення від норми в дітей з ХХН [8, 10].
У настанові 2017 року Американська академія педіатрії рекомендує в дітей і підлітків із ХХН, незалежно від рутинного контролю АТ, що базується на офісних вимірюваннях, проведення ДМАТ як мінімум один раз на рік [8, 11].
Метою нашої роботи було визначення особливостей добового профілю АТ у дітей із хронічним пієлонефритом (ХПН) та ХХН І–ІІІ стадії.
Матеріали та методи
Були обстежені 94 пацієнти віком 6–17 років (41 хлопчик, 53 дівчинки) із хронічним пієлонефритом та ХХН І–ІІІ стадії. Контрольну групу склали 78 умовно здорових дітей відповідного віку та статі. Усі пацієнти перебували на стаціонарному лікуванні у відділенні нефрології КЗ «Дніпропетровська обласна дитяча клінічна лікарня ДОР». Заплановане клінічне дослідження було затверджене комітетом з біоетики ДЗ «Дніпропетровська медична академія МОЗ України» та проведене відповідно до керівних принципів Гельсінської декларації (1975).
Критеріями включення хворих у дослідження були: наявність добровільної інформованої згоди дитини і її батьків на участь у клінічному дослідженні; вік пацієнтів від 6 до 17 років 11 міс. 29 днів; наявність верифікованого діагнозу ХПН та ХХН І–ІІІ стадій; відсутність клініко-лабораторних ознак загострення ХПН. Критеріями виключення хворих із дослідження були: відмова дитини або її батьків від участі в клінічному дослідженні; наявність вроджених вад серця або інших первинних серцевих захворювань, гострих інфекцій, цукрового діабету, есенціальної або нейроендокринної АГ.
Ураховуючи стан реальних функцій, дітей було розділено на відповідні групи: 1-ша група — 47 пацієнтів із ХХН І стадії; 2-га група — 30 обстежених із ХХН ІІ стадії; 3-тя група — 17 дітей із ХХН ІІІ стадії.
Офісне вимірювання АТ проводилося трикратно з інтервалом у 2–3 хвилини після сидіння пацієнта протягом 10–15 хвилин у розслабленій позі з використанням тонометра із відповідною до віку й окружності плеча манжеткою, у стані спокою, у положенні сидячи.
Моніторинг АТ протягом доби проводився за допомогою програмно-апаратного комплексу «Кардіотехника-04-АД-1» (ЗАО «ИНКАРТ», м. Санкт-Петербург, РФ). Під час аналізу результатів ДМАТ оцінювали кількісні параметри: середньодобові, середньоденні та середньонічні значення САТ і ДАТ, середній АТ, пульсовий АТ, ЧСС, максимальні та мінімальні значення САТ, ДАТ, ЧСС, індекси навантаження підвищеним САТ і ДАТ у денний і нічний час (індекс часу гіпертензії), величину й швидкість ранкового підйому САТ і ДАТ.
Варіабельність САТ і ДАТ у денний і нічний час визначали за стандартним відхиленням цих показників від середньої величини. Також ураховували ступінь нічного зниження АТ або добовий індекс (відношення середньоденних показників до середньонічних, добовий індекс САТ, добовий індекс ДАТ). Оцінювали середньодобові, середньоденні та середньонічні значення САТ і ДАТ за допомогою процентильних таблиць (5, 50, 90, 95-й процентилі) залежно від статі та зросту дитини.
При оцінці АТ виділяли нормальний, підвищений АТ та АГ, використовуючи настанови Американської академії педіатрії 2017 р. [11]. Стабільну АГ діагностували при рівні середньодобового АТ понад 95-го процентилю, індексі навантаження підвищеним АТ більше від 50 %. Лабільна АГ визначалася при індексі навантаження підвищеним АТ від 25 до 50 %, але при рівні середньодобового АТ нижче від 95-го процентилю.
За величиною добового індексу АТ виділяли 4 варіанти: dippers — добовий індекс 10–22 %; non-dippers — добовий індекс 0–10 %; over-dippers — добовий індекс понад 22 %; night-peakers — добовий індекс менше від 0 %.
Результати статистично опрацьовані з використанням програми Statistica 8.0. Перевірку розподілу на відповідність закону Гаусса виконували за допомогою критерію Шапіро — Уїлка. Ураховуючи, що більшість вибірок не відповідали закону Гаусса, результати наведено у вигляді медіани (Me) та інтерквартильного розмаху (Q25; Q75). Для порівняння груп використовували критерій Манна — Уїтні. Різницю між значеннями вважали статистично вірогідною при рівні критерію значущості p < 0,05.
Результати
За результатами разового вимірювання АТ підвищений АТ був діагностований в 9,6 %, а АГ — у 21,3 % хворих; при проведенні ДМАТ підвищення АТ реєстрували в 22,3 % хворих, а АГ — у 34,1 %. Отже, розбіжність показників САТ і ДАТ, отриманих при разовому вимірюванні АТ та при проведенні ДМАТ, виявлена в 25,5 % випадків. Приховану АГ реєстрували в 12,8 % хворих.
Структура АТ в обстежених дітей із ХПН та ХХН наведена в табл. 1.
Під час аналізу основних інтегральних показників, що визначалися при ДМАТ у дітей із ХПН та ХХН, встановлено, що зі зниженням ниркових функцій (легкий та помірний ступінь ХХН) поступово збільшувалась відносна кількість хворих з АГ. Максимальні патологічні зміни відбувались у групі дітей з ХПН та ХХН ІІІ стадії, у яких АГ реєстрували більше ніж у половини хворих (58,8 %). У структурі АГ переважала АГ І стадії (21,3, 26,7 та 41,2 % відповідно в групах із ХХН І, ІІ та ІІІ стадії).
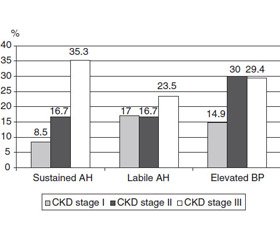
Поступово з прогресуванням ХХН у дітей із ХПН збільшувалась відносна кількість хворих зі стабільною та лабільною АГ (рис. 1).
У цілому в структурі АГ у хворих на ХПН переважала лабільна АГ (53,1 %), стабільну АГ визначали дещо рідше — у 46,9 % дітей. Питома вага пацієнтів з АГ (стабільна АГ + лабільна АГ) у групі дітей із ХХН ІІІ стадії була статистично значуще більшою, ніж у хворих із ХХН І (58,8 і 25,5 % відповідно; р = 0,0172) та ХХН ІІ стадії (58,8 і 33,4 % відповідно; р = 0,0290).
Аналіз ступеня нічного зниження АТ у пацієнтів із ХПН виявив поступове зменшення відносної кількості пацієнтів з оптимальним рівнем зниження (dippers) АТ при легкому та помірному ступені ХХН як для САТ (від 61,7 % при ХХН І ст. до 47,1 % при ХХН ІІІ ст.), так і для ДАТ (53,2 і 11,8 % відповідно; р = 0,0049) (рис. 2).
Навпаки, відносна кількість пацієнтів із недостатнім ступенем зниження АТ вночі (non-dippers) зростала для САТ (від 29,8 % при ХХН І ст. до 41,1 % при ХХН ІІІ ст.) і ДАТ (відповідно 25,5 і 58,8 %; р = 0,0172) (рис. 3).
Серед хворих із ХХН ІІІ стадії реєстрували пацієнтів night-peakers, які мали стійке підвищення САТ (11,8 %) та ДАТ (29,4 %) вночі.
Дослідження показників ранкової динаміки АТ, а саме величини й швидкості ранкового підйому САТ і ДАТ виявило ряд особливостей (табл. 2, 3).
Медіана ранкового підйому САТ в усіх групах обстежуваних не перевищувала нормативного значення
56,5 мм рт.ст. Медіана швидкості ранкового підйому ДАТ була підвищеною в усіх групах, тоді як медіана САТ була вище від нормативної лише в дітей з ХХН І стадії.
Під час детального аналізу було встановлено, що відносна кількість дітей із підвищеною величиною ранкового підйому САТ при ХХН ІІІ стадії вірогідно була статистично значуще більша, ніж при ХХН І ст. (29,4 і 4,2 %; р = 0,0057 ) та ХХН ІІ ст. (29,4 і 3,3 %; р = 0,0126) (табл. 3).
Питома вага дітей із підвищеною швидкістю ранкового підйому САТ і ДАТ статистично значуще не відрізнялася в обстежених групах, однак відносна кількість пацієнтів із підвищеною швидкістю ранкового підйому ДАТ була вірогідно більшою при ХХН ІІ ст. (63,3 і 33,3 %; р = 0,0256) та ХХН ІІІ ст. (58,8 і 23,5 %; р = 0,0465).
Обговорення
АГ вважається одним із головних чинників, що сприяє прогресуванню ХХН, підвищує ризик кардіоваскулярних ускладнень, пригнічує нейрокогнітивні функції [12, 13]. Результати проведених нами досліджень АТ дозволяють зробити висновок про зростаючу кількість хворих із АГ під час прогресування ХХН у напрямку термінальної стадії хронічної ниркової недостатності. Ці результати підкріплюються даними CKiD study, де визначене зростання кількості дітей із АГ та кардіоваскулярними ускладненнями при зниженні ренальних функцій [14].
При зіставленні результатів ДМАТ й офісного вимірювання АТ виявлено, що за даними ДМАТ у статистично значуще більшої кількості пацієнтів діагностовано як АГ (34,0 і 21,3 % відповідно; р = 0,0474), так і підвищений АТ (22,3 і 9,6 % відповідно; р = 0,0385). Отримані нами дані підтверджуються результатами, отриманими іншими дослідниками. Так, при порівнянні результатів офісного вимірювання АТ і ДМАТ у 359 дітей із ХХН та ШКФ не меншою за 30 мл/хв було визначено відносно більшу кількість хворих як із підвищеним АТ, так і з АГ [10].
При детальному аналізі добового профілю АТ у дітей із ХПН та ХХН було встановлено, що характерними ознаками АГ у дітей із ХХН є суттєвіший внесок діастолічної складової та наявність пацієнтів із стійким підвищенням нічного АТ. Проведені раніше дослідження також демонструють, що прихована АГ діагностується переважно за рахунок ДАТ [15] та виявлення ізольованого підвищення АТ в нічний час [16]. Ці дані можна вважати підґрунтям для висновку, що нормальний рівень разового офісного вимірювання АТ не дозволяє виключити приховану АГ у дітей з ХХН. Тому на цей час у всіх дітей із ХХН, незалежно від рівня разового офісного артеріального тиску, рекомендується проводити ДМАТ [17–19].
При аналізі ступеня нічного зниження АТ у пацієнтів із ХПН виявлене поступове зменшення відносної кількості пацієнтів з оптимальним рівнем зниження (dippers) АТ при прогресуванні ХХН і, відповідно, зростання пацієнтів non-dippers. Якщо прийняти до уваги, що профіль АТ non-dippers пов’язують із пригніченням парасимпатичної ланки та активацією симпатичної ланки вегетативної нервової системи вночі, можна думати про суттєвий вплив гіперсимпатикотонії не тільки на добовий профіль АТ, формування АГ, але й прогресування ХХН [20]. На думку більшості клініцистів, non-dipper циркадний ритм АТ у хворого з ХХН тісно пов’язаний із формуванням кардіоваскулярних ускладнень, насамперед гіпертрофії лівого шлуночка [21].
Хоча за даними більшості порівнянь статистично значущих групових відмінностей за показниками ранкового підйому АТ не було отримано, факт збільшення величини ранкового підйому та підвищення швидкості ранкового підйому АТ у дітей із ХПН при зниженні ренальних функцій заслуговує на увагу. Слід зазначити, що медіатором підвищення АТ в ранкові години є швидка активація симпатичної системи з розвитком вазоконстрикції [7, 22]. Також у ранковий час знижується ендотеліальна функція, підвищується рівень тромбогенних факторів [23, 24]. Усі процеси можуть привести до формування кардіоваскулярних подій у хворих на ХХН [25]. Таким чином, підвищений АТ і швидкий його підйом у ранкові години виокремлює пацієнтів із наявністю цієї ознаки не тільки в групу ризику щодо майбутнього формування кардіоваскулярних подій, а й свідчить про підвищений ризик ураження органів-мішеней.
Висновки
Серед дітей із хронічним пієлонефритом під час прогресування ХХН зростає кількість пацієнтів із АГ. Характерними для АГ в дітей з прогресуючими нефропатіями є суттєвіший внесок діастолічної складової та стійке підвищення нічного АТ. Підвищений АТ у нічний час можна розглядати як показник стабільності АГ та додатковий фактор ризику кардіоваскулярних ускладнень у цієї категорії хворих. Показники ДМАТ, особливо ті, що відображають циркадний ритм АТ, свідчать про суттєвий внесок дисфункції вегетативної нервової системи в розвиток і прогресування ХХН, а також формування серцево-судинної патології.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Рецензенти: завідувач кафедри педіатрії № 2 ХНМУ, д.мед.н., професор Макєєва Н.І.; завідувач кафедри сімейної медицини ДЗ «ДМА МОЗ України», д.мед.н., професор Височина І.Л.
1. Di Lullo L. Hypertension, type IV cardiorenal syndrome and chronic kidney disease: Pathophysiological and therapeutical approach. World. J. Hypertens. 2017. № 7 (1). Р. 10-18. doi: 10.5494/wjh.v7.i1.10.
2. Edmonston D., Morris J.D., Middleton J.P. Working Toward an Improved Understanding of Chronic Cardiorenal Syndrome Type 4. Advances in Chronic Kidney Disease. 2018. № 25(5). Р. 454-467. doi: 10.1053/j.ackd.2018.08.010.
3. Rangaswami J., Bhalla V., Blair J.E.A., Chang T.I., Costa S. L.K.L. et al. Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement from the American Heart Association. Circulation. 2019. № 139(16). e840-e878. doi: 10.1161/CIR.0000000000000664.
4. Kaddourah A., Goldstein S.L. Heart Failure in the Child and Young Adult. Chapter 31. Childhood Cardiorenal Syndrome. Academic Press. 2018. doi: 10.1016/C2014-0-01738-8
5. Pinheiro da Silva A.L., da Silva M.J. Type 4 cardiorenal syndrome. Rev. Port. Cardiol. 2016. № 35(11). Р. 601-616. doi: 10.1016/j.repc.2016.06.007.
6. Vidi S.R. Role of hypertension in progression of chronic kidney disease in children. Curr. Opin. Pediatr. 2018. № 30. Р. 247-251. doi: 10.1097/MOP.0000000000000595.
7. Bilo G., Grillo A., Guida V., Parati G. Morning blood pressure surge: pathophysiology, clinical relevance and therapeutic aspects. Integr. Blood Press. Control. 2018. № 11. Р. 47-56. doi: 10.2147/IBPC.S130277.
8. Gabriele M.M., Nogueira P.C.K. Management of Hypertension in CAKUT: Protective Factor for CKD. Front. Pediatr. 2019. № 7. Р. 222. doi: 10.3389/fped.2019.00222.
9. Waraby B.A., Abraham A.G., Schwartz G.J. et al. Predictors of rapid progression of glomerular and nonglomerular kidney disease in children and adolescents: the chronic kidney disease in children (CKiD) cohort. Am. J. Kidney Dis. 2015. № 65. Р. 878-788. doi: 10.1053/j.ajkd.2015.01.008.
10. Аксенова М.Е., Конькова Н.Е., Лепаева Т.В., Кырганова Т.А., Длин В.В. Диагностическое значение уровня разового артериального давления для выявления скрытой артериальной гипертензии у детей с хроническими болезнями почек. Российский вестник перинатологии и педиатрии. 2018. № 62 (2). С. 54-59.
11. Flynn J.T., Kaelber D.C., Baker-Smith C.M. et al. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents. Pediatrics. 2017. № 140. Р. 1-72. e20171904. doi: 10.1542/peds.2017-1904.
12. Hamrahian S.M., Falkner В. Hypertension in Chronic Kidney Disease. Adv. Exp. Med. Biol. 2017. № 956. Р. 307-325. doi: 10.1007/5584_2016_84.
13. Lande M.B., Mendley S.R., Matheson M.B. et al. Association of blood pressure variability and neurocognition in children with chronic kidney disease. Pediatr. Nephrol. 2016. № 31. Р. 2137-2144. doi: 10.1007/s00467-016-3425-2.
14. Barletta G.M., Flynn J., Mitsnefes M. et al. Heart rate and blood pressure variability in children with chronic kidney disease: a report from the CKiD study. Hypertension. 2018. № 71 (3). Р. 444-450. doi: 10.1007/s00467-013-2737-8.
15. Cilsal E., Koc A.S. Renal resistive index significantly increased in hypertensive children and it is independently related to the pulse pressure and left ventricular mass index. Clin. Exp. Hypertens. 2018. № 4. Р. 1-8. doi: 10.1080/10641963.2018.1523920.
16. Mitsnefes M.M., Piierce C., Flynn J. et al. For the CKiD study group. Can office blood pressure readings predict masked hypertension? Pediatr. Nephrol. 2016. № 31. Р. 163-166. doi: 10.1007/s00467-015-3212-5.
17. Andrade H., Pires A., Noronha N. et al. Importance of ambulatory blood pressure monitoring in the diagnosis and prognosis of pediatric hypertension. Rev. Port. Cardiol. 2018. № 37 (9). Р. 783-789. doi: 10.1016/j.repc.2017.09.026.
18. Gupta D., Chaturvedi S., Chandy S., Agarwal I. Role of 24-h ambulatory blood pressure monitoring in children with chronic kidney disease Indian. J. Nephrol. 2015. № 25 (6). Р. 355-361. doi: 10.4103/0971-4065.148305.
19. Peterson C.G., Miyashita Y. The Use of Ambulatory Blood Pressure Monitoring as Standard of Care in Pediatrics. Front. Pediatr. 2017. № 5. Р. 153. doi: 10.3389/fped.2017.00153.
20. Fedecostante M., Spannella F., Cola G., Espinosa E., Dessì-Fulgheri P., Sarzani R. Chronic kidney disease is characterized by “double trouble” higher pulse pressure plus night-time systolic blood pressure and more severe cardiac damage. PLoS One. 2014. № 9 (1). e86155. doi: 10.1371/journal.pone.0086155.
21. Che X., Mou S., Zhang W. et al. The impact of non-dipper circadian rhythm of blood pressure on left ventricular hypertrophy in patients with non-dialysis chronic kidney disease. Acta Cardiol. 2017. № 72 (2). Р. 149-155. doi: 10.1080/00015385.2017.1291133.
22. Johnson A.W., Hissen A.L., Macefield V.G., Brown R., Taylor C.E. Magnitude of Morning Surge in Blood Pressure Is Associated with Sympathetic but Not Cardiac Baroreflex Sensitivity. Front Neurosci. 2016. №10. Р. 412. doi: 10.3389/fnins.2016.00412.
23. Kıvrak A., Özbiçer S., Kalkan G.Y., Gür M. Morning blood pressure surge and arterial stiffness in newly diagnosed hypertensive patients. Blood Press. 2017. № 26 (3). Р. 181-190. doi: 10.1080/08037051.2017.1278678.
24. Mahfouz R.A., Goda M., Galal I., Ghareb M.S. Association of morning blood pressure surge with carotid intima-media thickness and cardiac dysfunction in patients with cardiac syndrome-X. Blood Press. 2018. № 27 (5). Р. 297-303. doi: 10.1080/08037051.2018.1476056.
25. Sheppard J.P., Hodgkinson J., Riley R., Martin U., Bayliss S., McManus R.J. Prognostic Significance of the Morning Blood Pressure Surge in Clinical Practice: A Systematic Review. Am. J. Hypertens. 2015. № 28 (1). Р. 30-41. doi: 10.1093/ajh/hpu104.

/20-1.jpg)
/20-2.jpg)
/21-1.jpg)
/22-1.jpg)