Журнал «Актуальная инфектология» Том 7, №5-6, 2019
Вернуться к номеру
Парвовирусная инфекция В19V: обзор литературы. Часть 1
Авторы: Кириенко В.Т. (1), Зайцев И.А. (1), Потий В.В. (2), Нестерук Е.С. (1)
1 - Национальный медицинский университет им. А.А. Богомольца, г. Киев, Украина
2 - Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
У статті наведені сучасні дані про різні аспекти проблеми парвовірусної інфекції. На підставі аналізу даних літератури описані етіологія, епідеміологія, шляхи передачі інфекції, особливості патогенезу у дорослої людини й фетальної парвовірусної інфекції. Наведені клінічні прояви основних форм захворювання.
В статье представлены современные сведения о различных аспектах проблемы парвовирусной инфекции. На основании анализа данных литературы описаны этиология, эпидемиология, пути передачи инфекции, особености патогенеза у взрослого человека и фетальной парвовирусной инфекции. Представлены клинические проявления основных форм заболевания.
The modern data about different aspects of the problem of parvovirus infection are presented in the article. Based on the analysis of literature data, the etiology, epidemiology, routes of infection, features of pathogenesis in an adult and fetal parvovirus infection are described. Clinical manifestations of the main forms of disease are presented.
парвовірусна інфекція; етіологія; епідеміологія; клінічні прояви
парвовирусная инфекция; этиология; эпидемиология; клинические проявления
parvovirus infection; etiology; epidemiology; clinical manifestations
Парвовирусная инфекция (ПВИ) В19V (инфекционная эритема, «пятая болезнь», «синдром пощечины») — широко распространенное заболевание в популяции, ассоциируется с рядом клинических проявлений, представляет собой серьезную проблему для иммунокомпрометированных лиц, пациентов с нарушениями кроветворения. У беременных эта патология ассоциируется с развитием спонтанных абортов, неиммунной водянки плода, внутриутробной гибели плода, в связи с чем ПВИ рассматривается как составная часть TORCH-комплекса [1].
Этиология. Парвовирус В19 (PVB19) содержит одноцепочечную ДНК, имеет форму двадцатигранника, диаметр 20–25 нм, безоболочечный, термо–стабильный, принадлежит к роду Erythrovirus, семейству Parvoviridae. Впервые был выделен в 1975 году Y. Cossart и соавт. из образца крови № 19 при скрининговом обследовании пациента на –вирусный гепатит В [2]. Геном парвовируса В19 кодирует: два капсидных протеина VP1 и VP2, не–структурный протеин NS-1, малые неструктурные протеины 11-Da, 9-Da и 7,5-kDa. Белок VP1 способствует инвазии вируса в ядро инфицированной клетки [3]. Протеин VP2 обеспечивает сборку вириона [4]. Белок NS1 обеспечивает репликацию вируса, обладает цитотоксическим действием, опосредуя апоптоз эритроидных и неэритроидных клеток [5, 6]. 11-Da-протеин также принимает участие в репликации вирусной ДНК и апоптозе инфицированных клеток [7]. PVB19 тропен к активно делящимся клеткам, которые содержат Р-антиген (глобозид, нейтральный сфинголипид). Лица, у которых генетически отсутствует Р-антиген (1 из 200 тыс. человек), устойчивы к заражению PVB19 [8].
В настоящее время выделяют 3 генотипа PVB19. Самый известный из них — парвовирус В19, относится к 1-му генотипу, распространен на всех континентах и доминирует на территориях большинства стран [9, 10]. Другие эритровирусы, заражающие человека, в частности генотипы 2 и 3, описаны сравнительно недавно, и сведения о них скудны [11]. Известно, что генотипы 1 и 2 чаще встречаются в США и Европе, генотип 3 — в основном в странах Африки и Южной Америки [12].
Эпидемиология. Парвовирус В19 широко распространен в популяции, выявление антител с возрастом увеличивается: среди детей до 5 лет — от 2 до 20 %, от 5 до 18 лет — 15–40 %, после 40 лет — до 80 %, среди женщин репродуктивного возраста — от 45 до 65 %. Характерна зимне-весенняя сезонность. Эпидемические подъемы заболеваемости ПВИ наблюдаются каждые 3–6 лет [13, 14]. После перенесенного заболевания сохраняется длительный иммунитет, описаны случаи персистенции инфекции у лиц с ослабленным иммунитетом [16].
Источник инфекции — человек (заразен в течение 24–48 часов до развития симптомов заболевания и до тех пор, пока не появится сыпь). Основным источником являются дети дошкольного и младшего школьного возраста, также особенно опасны больные с клиникой транзиторного апластического криза.
Среди путей передачи инфекции выделяют: [15, 16].
— воздушно-капельный — считается наиболее вероятным;
— вертикальный — от матери к плоду;
— трансфузионный — peaлизуется при переливании компонентов и/или препаратов крови [17].
Доноры крови, инфицированные PVB19, даже без каких-либо клинических проявлений болезни, могут иметь очень высокий уровень виремии — до 1012 вирусных частиц/мл крови [18]. Острая ПВИ развивается при введении компонентов крови, содержащих более 107 вирусных частиц/мл [19]. Частота выявления ДНК В19 в продуктах донорской крови: 1 в 3000 образцов — без эпидемии, 1 в 167 образцах — в период эпидемии.
С начала 2000-х годов на международном уровне введено тестирование плазмы на наличие ДНК В19V. В 2004 году на законодательном уровне в странах Евросоюза закреплена норма максимально допустимой концентрации ДНК В19V в производственном пуле на уровне не более 104 МЕ/мл. Европейская фармакопея (ЕР) и Центр по конт–ролю за пищевыми продуктами и лекарственными препаратами США (FDA) также рекомендуют проверку донорской крови на наличие PVВ19. Согласно их рекомендациям уровень ДНК PVB19 в плазме, используемой для производства продуктов крови, также не должен превышать 104 вирусных частиц/мл [20]. В настоящее время банки крови США, Германии, Австрии, Великобритании осуществляют тестирование донорской крови на наличие PVВ19. В Украине, к сожалению, тестирование донорской крови на парвовирус В19 не проводят.
В группе риска с вероятностью инфицирования и неблагоприятных исходов заболевания находятся беременные, люди с иммунодефицитными состояниями различной природы, лица, нуждающиеся в гемотрансфузиях или пересадке органов.
Патогенез парвовирусной инфекции
Парвовирус чаще всего попадает в организм человека воздушно-капельным путем через слизистые оболочки дыхательных путей, проникает в кровь, затем в костный мозг. Поражает преимущественно клетки-предшественники эритроцитов [22]. Сродство вируса обусловлено наличием на поверхности эритроцитов Р-антигена, который возбудитель использует в качестве клеточного рецептора [23]. Данный антиген также находится на поверхности мегакариоцитов, клеток эндотелия, эмбриональных клеток миокарда, гепатоцитов, плацентарных трофобластов и других клеток [24]. Р-антиген (глобозид, нейтральный сфинголипид) необходим для связывания вируса с поверхностью клетки, но недостаточен для его проникновения в клетку. Для внедрения вируса в клетки-мишени необходим корецептор. К таким корецепторам относятся α5β1-интегрин [25] и Ku80-аутоантиген [26], которые экспрессируются на клетках-предшественниках эритроцитов, что объясняет тропность PVB19 к ним и репликацию вируса именно в них [25, 27]. Вирионы высвобождаются из клетки путем ее лизиса. В других клетках-мишенях репликация PVB19 не происходит, тем не менее в результате иммуноопосредованного воздействия неструктурных белков вируса (преимущественно NS1) происходит их гибель [28].
Лизис предшественников эритроцитов приводит к угнетению эритропоэза, уменьшению числа эритроцитов периферической крови, снижению концентрации гемоглобина и развитию анемии. У иммунокомпетентных лиц, как правило, развивается легкая анемия, клинически малозаметная, так как снижение уровня гемоглобина обычно минимально за счет длительного периода полураспада эритроцитов (2–3 месяца). А у пациентов с усиленным гемопоэзом (врожденные гемолитические анемии, аутоиммунные анемии, массивное кровотечение, состояние после трансплантации почки или костного мозга) возникает апластический криз, который является результатом внезапного нарушения эритропоэза, развития тяжелой анемии.
Помимо анемии, заболевание может сопровождаться и другими видами цитопений. Выделяют тромбоцитопению центрального и периферического генеза. Первая происходит за счет подавления мегакариоцитопоэза в костном мозге, при этом обнаруживается белок NS1, ингибирующий образование колоний мегакариоцитов. Это указывает на тканевую тропность PVB19, выходящую за рамки эритроидных клеток-предшественников, и показывает, что для популяций клеток, которые непригодны для репликации вирусной ДНК, токсичными могут быть сами белки вируса. Тромбоцитопения периферического генеза развивается за счет образования антител к тромбоцитам с последующей чрезмерной гибелью тромбоцитов в ретикулоэндотелиальной системе [29].
Механизм поражения клеток печени парвовирусом при остром гепатите изучен недостаточно. Согласно одной из гипотез, вирус оказывает прямое повреждающее действие на гепатоциты, по другой — иммуноопосредованное [30, 31].
Для больных с врожденным или приобретенным иммунодефицитом характерно развитие хронической инфекции из-за неспособности иммунной системы к выработке достаточного количества нейтрализующих антител. Для этой группы больных характерны постоянная вирусемия и обнаружение вирусной ДНК в костномозговых клетках.
Влияние парвовируса на плод
Особенность патогенеза фетальной парвовирус–ной инфекции заключается в тропности возбудителя к быстро делящимся клеткам (клеткам-предшественникам эритроцитов, эмбриональным клеткам, плацентарным трофобластам), на поверхности которых присутствует Р-антиген [24]. Максимальный уровень Р-антигена на ворсинах трофобласта регистрируется в 1-м и особенно во 2-м триместре беременности, что и определяет трансплацентарную передачу вируса преимущественно в этот период [32]. В третьем триместре Р-антиген на поверхности клеток трофобласта практически отсутствует.
Поражение плода развивается через 3–6 недель после заражения матери. Существенную роль в патологическом процессе играют особенности кроветворения у плода. Особенность заключается в том, что парвовирус поражает большое количество клеток-предшественников эритроцитов, которые у плода имеют короткий клеточный цикл деления из-за недостаточно развитой иммунной системы [33]. Обусловлено это тем, что во 2-м триместре процесс кроветворения у плода переходит от желточного мешка к печеночному гемопоэзу. Вследствие повышения потребностей растущего плода происходит резкое увеличение количества эритроцитов, сопровождающееся одновременным сокращением продолжительности жизни красных кровяных клеток до 45–70 дней. Эти обстоятельства и делают плод особенно уязвимым для факторов, влияющих на эритропоэз [33]. Вследствие угнетения эритропоэза развивается тяжелая анемия, вплоть до апластического криза. Анемия является причиной развития сердечной недостаточности, неиммунной водянки плода, которые приводят к его гибели в 10–15 % случаев. Относительно низкий уровень осложнений у плода при внутриутробном инфицировании в третьем триместре, возможно, связан со снижением в этот период потребности плода в эритроцитах и увеличением продолжительности жизни этих клеток.
В основном тяжелые проявления ПВИ у плода являются результатом анемии, вызванной поражением эритроидного ростка кроветворения, но также могут быть обусловлены поражением эмбриональных клеток, на поверхности которых экспрессируется Р-антиген, что делает их уязвимыми. Развивается миокардит, плацентит, печеночная недостаточность, сопровождающаяся гипоальбуминемией. Функция печени у плода нарушается вследствие прямого повреждающего действия PVB19 на гепатоциты или косвенного (из-за отложений гемосидерина) [34]. Развитие сердечной недостаточности может быть как результатом тяжелой анемии, так и непосредственного воздействия PVB19 на миокардиоциты с последующим развитием миокардита у плода, который приводит к нарушению сердечного ритма, вплоть до остановки сердца [35]. Плацентит, закономерно возникающий в ответ на внедрение PVB19, может привести к дисфункции плаценты и неблагоприятному исходу беременности даже в отсутствие заражения плода. Причиной смерти плода в этом случае становится плацентарная недостаточность, сопровождающаяся развитием у него анемии [6, 36].
Иммунный ответ человека на парвовирус В19 [39]
Виремия возникает через 7–10 дней после инфицирования, и обычно ДНК PVB19 в плазме крови определяется в высоких концентрациях на первой неделе заболевания и быстро исчезает с появлением специфических IgM.
Антитела IgM обычно появляются на 2–3-й день после начала клинических проявлений острой инфекции (на 12–14-й день после заражения), достигая максимального уровня к 21–24-му дню, после чего концентрация их в плазме снижается. Персистенция IgM продолжается в течение 3–4 месяцев (иногда до 6 мес.) [6] (рис. 1). Важно помнить, что в первые 7–10 дней после инфицирования антитела IgM не определяются (серологическое окно), в этот период можно выявить лишь только ДНК B19.
Антитела IgG появляются через 5–7 дней с момента клинических проявлений ПВИ, после чего наблюдается нарастание их титра до максимальных значений (к 28–30-му дню с момента инфицирования). В течение последующих нескольких месяцев определяется высокий уровень АТIgG, затем их титр снижается. Персистируют специфические IgG в сыворотке крови пожизненно, реагируя повышением титра на повторное заражение тем же возбудителем.
Клинические проявления парвовирусной инфекции
По современным представлениям, клинические проявления ПВИ варьируют от бессимптомных форм до угрожающих жизни состояний [46–48]. Выраженность их зависит от возраста, гематологического и иммунного статуса пациентов. У иммунокомпетентных лиц ПВИ от 27 до 68 % протекает бессимптомно и представляет эпидемическую опасность, особенно для лиц из групп риска, так как сопровождается вирусовыделением и виремией при отсутствии клинических проявлений болезни, что способствует ее распространению. Традиционно выделяют 5 основных форм заболевания, связанных с PVB19:
— инфекционная эритема («пятая болезнь»);
— артропатия (артралгия или артрит);
— транзиторный апластический криз у пациентов с хроническими гемолитическими заболеваниями;
— апластическая анемия у лиц с ослабленным иммунитетом;
— врожденная инфекция, приводящая к неиммунной водянке плода, внутриутробной гибели плода или выкидышу.
В литературе также описан ряд других клинических проявлений, которые ассоциируются с ПВИ (гепатит, миокардит, васкулит, хронический артрит, нефрит, менингит и энцефалит, иммунная тромбоцитопения, гемофагоцитарный синдром, атипичная сыпь и др.). Однако причинно-следственная связь этих явлений с парвовирусами не всеми подтверждается окончательно. Мы приводим чаще встречающиеся формы ПВИ.
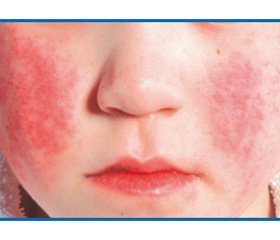
Инфекционная эритема — наиболее частое клиническое проявление ПВИ у детей 4–10-летнего возраста. Инкубационный период составляет от 4 до 20 дней (в среднем 7–14 дней). Продромальный период в большинстве случаев отсутствует или характеризуется: лихорадкой, недомоганием, головной болью, миалгией, умеренно выраженными катаральными явлениями верхних дыхательных путей, иногда диареей. Затем на лице появляются высыпания — мелкие красные пятна, которые быстро сливаются, образуя яркую эритему на щеках, что придает больному вид человека, получившего пощечину. Спустя несколько дней появляется пятнисто-папулезная сыпь, которая распространяется по всему телу с преимущественной локализацией на разгибательных поверхностях конечностей (рис. 2). Элементы сыпи сливаются и образуют эритематозные участки неправильной формы. Когда сыпь начинает в центре пятна бледнеть, она приобретает своеобразный сетчатый, похожий на кружево вид. В 70 % случаев высыпания сопровождаются зудом кожи. В течение 1–2 недель постепенно исчезают, не оставляя шелушения. Иногда сыпь имеет геморрагический характер. У части больных (около 20 %) возможно появление второй волны высыпаний после воздействия различных физических факторов внешней cреды (солнечное облучение, горячая ванна, холод и т.д.) [51, 52]. Транзиторная рецидивирующая сыпь может сохраняться неделями, однако это явление не означает обострения заболевания. Инфекционная эритема у детей обычно протекает нетяжело, самопроизвольно разрешаясь в течение 1–6 недель [53].
У взрослых патогномоничный «синдром пощечины» часто отсутствует. К другим дерматологическим синдромам, связанным с парвовирусной инфекцией, относят синдром пятнисто-папулезной сыпи в виде «перчаток и носков», который встречается чаще всего у подростков и взрослых. Обычно при данной форме заболевания за несколько дней до высыпаний могут возникнуть умеренно выраженные симптомы интоксикации. У некоторых больных температура достигает 39–40 °С, однако, несмотря на высоту лихорадки, общее состояние страдает мало. Клинически синдром «перчаток и носков» проявляется симметричной эритемой с четко выраженной локализацией в области запястных суставов и лодыжек, внешним видом напоминающей перчатки и носки (рис. 3). Быстро распространяющиеся пятнисто-папулезные высыпания, в ряде случаев с геморрагическим компонентом, сопровождаются артралгией, отеком кистей и стоп, иногда лимфаденопатией, зудом кожи [54–56]. Лимфаденопатия встречается в 15–25 % случаев (обычно с вовлечением шейных лимфатических узлов). В большинстве случаев характерна для детей. У части пациентов наблюдаются изменения в ротовой полости, при осмотре зева на слизистой твердого и мягкого неба, щек, языке, губах можно выявить петехии, везикулы, эрозии, афты [54–56].
ПВИ довольно часто сопровождается поражением суставов по типу артралгии и реже — полиартрита. Артропатия у взрослых встречается в 75 % случаев, чаще у женщин, чем у мужчин. У 10 % лиц боль в суставах появляется на фоне сыпи или после ее разрешения, однако в большинстве случаев является единственным проявлением заболевания. Непосредственно артропатией страдают до 50 % беременных, инфицированных парвовирусом. Чаще всего воспаляются мелкие суставы кисти, могут поражаться коленные, голеностопные, локтевые. Болевой синдром зависит от тяжести заболевания и может быть слабым и сильным, иногда затрудняющим самостоятельное передвижение. Суставы отечные, болезненные, горячие на ощупь. Доминирует боль (77 % в возрасте > 20 лет), реже припухлость (57 % в возрасте > 20 лет). Воспаление суставов возникает симметрично, проходит самостоятельно, обычно в течение 2–3 недель, иногда нескольких месяцев. У 20 % женщин синдром артралгии может сохраняться в течение нескольких лет, однако не приводит к повреждению суставов, течение благоприятное. У детей артриты возникают редко, приблизительно в 8 % случаев, могут быть несимметричными, более чем в 80 % случаев поражаются коленные суставы и голеностопные. По мнению ряда авторов, парвовирус B19V участвует в инициации и дальнейшем развитии ревматоидного артрита, синовита, приводящих к повреждению суставов [57].
Анемия и транзиторный апластический криз
У иммунокомпетентных лиц ПВИ обычно сопровождается развитием легкой анемии, с клинически малозаметными проявлениями. У пациентов с усиленным гемопоэзом (врожденные гемолитические анемии, аутоиммунные анемии, массивное кровотечение, состояние после трансплантации почки или костного мозга) парвовирус является основной причиной большинства внезапных апластических кризов, протекающих с симптомами тяжелой анемии. Уровень гемоглобина может упасть до угрожающего жизни предела, требующего неотложного переливания крови. Апластический криз также может сопровождаться развитием тромбоцитопении, нейтропении и даже панцитопении [58].
Поражение печени
Парвовирус В19 может вызывать острый гепатит, молниеносную печеночную недостаточность, хронический гепатит, гепатит-ассоциированную апластическую анемию, гепатит с гемофагоцитарным лимфогистиоцитозом [59, 60]. Острый гепатит встречается примерно у 4 % больных, чаще у детей [30, 61], проявляется у иммунокомпетентных или людей с иммунодефицитом, с гемолитическими нарушениями или без них [62, 63]. У взрослых заболевание протекает менее тяжело. Молниеносная печеночная недостаточность — довольно редкое клиническое проявление острой ПВИ, однако ее частота может быть занижена в связи с нечастым тестированием на ПВИ из-за недостаточной осведомленности врачей [25, 26]. При биопсии печени выявляют гепатоцеллюлярный и каналикулярный холестаз, апоптоз и некроз гепатоцитов [64]. Роль PVB19 при хроническом гепатите остается спорной.
Миокардит
В редких случаях PVB19 является причиной развития острого миокардита, приводящего к сердечной недостаточности. Тем не менее данный возбудитель может оказывать прямое цитопатическое действие на кардиомиоциты, что не исключает развития дилатационной кардиомиопатии [65, 66]. С внедрением в практику метода полимеразной цепной реакции (ПЦР) с гибридизационно-флюоресцентной детекцией PVB19 все чаще выделяли из материала, полученного при эндомиокардиальной биопсии от пациентов с миокардитом [65], однако данный патоген также обнаружен в сердцах пациентов без признаков миокардита или дилатационной кардиомиопатии [67, 68], в связи с чем роль PVB19 как причинного фактора данной патологии все еще является предметом обсуждения.
Поражение центральной нервной системы
PVB19-ассоциированные неврологические проявления включают энцефалит, энцефалопатию, менингит, мозжечковую атаксию, поперечный миелит, инсульт, периферическую невропатию и др. [69, 70].
Хроническая парвовирусная инфекция развивается у лиц с иммунодефицитом, сопровождается тяжелой анемией, требующей регулярных гемотрансфузий. Такая анемия описана при ВИЧ-инфекции, у больных лейкозами, у лиц, получающих химиотерапию, у пациентов после трансплантации органов или костного мозга, которые получают иммуносупрессивную терапию.
Выводы
Парвовирусная инфекция В19, широко распространенная в популяции, характеризуется многочисленными путями передачи, широким спектром клинических проявлений: от бессимптомных форм до угрожающих жизни состояний, к сожалению, не всегда диагностируется вовремя или совсем не распознается. Поэтому очевидным является тот факт, что проблема требует пристального внимания инфекционистов, семейных врачей, терапевтов, гинекологов и углубленного ознакомления их с актуальными аспектами парвовирусной инфекции В19.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Продолжение в следующем номере
1. Neu N. et al. TORCH Infections. Clin. Perinatol. 2015. 42. 77. Available from: [http://pngpaediatricsociety.org/wp-content/uploads/2016/03/Neu-N-TORCHinfections-Clinics-in-Perinatology-2015.pdf], last accessed Sept 13, 2018.
2. Cossart Y.E., Field A.M., Cаnt B., Widdows D. Parvovius-like particles in human sera. Lancet. 1975. 1 (7898). 72-73.
3. Zadori Z., Szelei J., Lacoste M.C. et al. A viral phospholipase A2 is required for parvovirus infectivity. Dev. Cell. 2001. 1. 291-302.
4. Kaufmann B., Chipman P.R., Kostyuchenko V.A. et al. Visualization of the externalized VP2 N termini of infectious human parvovirus B19. J. Virol. 2008. 82. 7306-7312.
5. Wan Z., Zhi N., Wong S. et al. Human parvovirus B19 causes cell cycle arrest of human erythroid progenitors via deregulation of the E2 F family of transcription factors. J. Clin. Invest. 2010. 120. 3530-3544.
6. Servant-Delmas A., Lefrère J.J., Morinet F., Pillet S. Advances in human B19 erythrovirus biology. J. Virol. 2010. 84 (19). 9658-65.
7. Chen A.Y. et al. The small 11 kDa non-structural protein of human parvovirus B19 plays a key role in inducing apoptosis du–ring B19 virus infection of primary erythroid progenitor cells. Blood. 2010. 115. 1070-1080.
8. Brown K.E., Hibbs J.R., Gallinella G. et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen). NEJM. 1994. 330. 1192-1196.
9. Kaufmann B. et al. The structure of human parvovirus B19. Proc. Natl. Acad. Sci. USA. 2004. 101. 11628-11633.
10. Schneider B., Höne A., Tolba R.H., Fischer Y.-P., Blümel J., Eis-Hübinger A.M. Simultaneous persistence of multiple genome variants of human parvovirus B19. J. Gen. Virol. 2008. 89. 164-176.
11. Servant A., Laperche S., Lallemand F. et al. Genetic diversity within human erythroviruses: identification of three genotypes. J. Virol. 2002. 76. 9124.
12. Parsyan A., Szmaragd C., Allain J.P., Candotti D. Identification and genetic diversity of two human parvovirus B19 genotype 3 subtypes. J. Gen. Virol. 2007. 88. 428.
13. Stelma F.F. et al. Occupational risk of human cytomegalovirus and parvovirus B19 infection in female day care personnel in the Netherlands; a study based on seroprevalence. Eur. J. Clin. Microbiol. Infect. Dis. 2009. 28. 393-397.
14. Anderson L.J. et al. Risk of infection following exposures to human parvovirus B19. Behring Inst. Mitt. 1990. 85. 60-63.
15. Jordan J., Tiangco B., Kiss J., Koch W. Human parvovirus B19: prevalence of viral DNA in volunteer blood donors and clinical outcomes of transfusion recipients. Vox Sang. 1998. 75. 97-102.
16. Lamont R.F., Sobel J., Vaisbuch E. et al. Parvovirus B19 infection in human pregnancy. BJOG. 2011. 118 (2). 175-186.
17. Климович Н.В., Матвеев В.Л., Романов О.М., Черновецкий М.А. Эпидемиологическая характеристика парвовирусной инфекции у детей с гематологическими заболеваниями. Охрана материнства и детства. 2011. 1. 42-46.
18. Kleinman S.H., Glynn S.A., Lee T.H., Tobler L., Montalvo L., Todd D., Kiss J.E., Shyamala V., Busch M.P. Prevalence and quantitation of parvovirus B19 DNA levels in blood donors with a sensitive polymerase chain reaction screening assay. Transfusion. 2007. 47 (10). 1756.
19. Kleinman S.H., Glynn S.A., Lee T.H., Tobler L.H., Schlumpf K.S., Todd D.S., Qiao H., Yu M.Y., Busch M.P. A linked donor-recipient study to evaluate parvovirus B19 transmission by blood component transfusion. Blood. 2009. 114 (17). 3677.
20. FDA Biologics Guidances. www. fda. Gov/Biologics Blood Vaccines/Guidance Compliance Regulatory information/Gui–dances/default.htm (Accessed on March 20, 2017).
21. Mossong J. et al. Parvovirus B19 infection in five European countries: seroepidemiology, force of infection and maternal risk of infection. Epidemiol. Infect. 2008. 136. 1059-1068.
22. Mortimer P.P., Humphries R.K., Moore J.G., Purcell R.H., YoungN.S. A human parvovirus-like virus inhibits haematopoietic colony formation in vitro. Nature. 1983. 302. 426.
23. Brown K.E., Anderson S.M., Young N.S. Erythrocyte P antigen: cellular receptor for B19 parvovirus. Science. 1993. 262. 114.
24. Lunardi C., Tinazzi E., Bason C., Dolcino M., Corrocher R., Puccetti A. Human parvovirus B19 infection and autoimmunity. Autoimmun. Rev. 2008. 8 (2). 116-20.
25. Weigel-Kelley K.A., Yoder M.C., Srivastava A. Alpha5beta1 integrin as a cellular coreceptor for human parvovirus B19: requirementof functional activation of beta1 integrin for viral entry. Blood. 2003. 102. 3927.
26. Munakata Y., Saito-Ito T., Kumura-Ishii K., Huang J., Kodera T., Ishii T., Hirabayashi Y., Koyanagi Y., Sasaki T. Ku80 autoantigen as a cellular coreceptor for human parvovirus B19 infection. Blood. 2005. 106. 3449.
27. Weigel-Van Aken K.A. Pharmacological activation of guanine nucleotide exchange factors for the small GTPase Rap1 recruits high-affinity beta1 integrins as coreceptors for parvovirus B19: improved ex vivo gene transfer to human erythroid progenitor cells. Hum. Gene Ther. 2009. 20 (12). 1665-78.
28. Seve P. et al. Systemic manifestations of Parvovirus B19 infections. Rev. Med. Interne. 2004 Oct. 25 (10). 740-51.
29. Heegaard E.D., Brown K.E. Human parvovirus B19. Clin. Microbiol. Rev. 2002. 15 (3). 485-505.
30. Abe K., Kiuchi T., Tanaca K., Edamoto Y., Ajba N., Sala T. Characterization of erythrovirus B19 genomes isolated in Iiver tissues from patients with fulminant hepatitis and biliary atresia who underwent liver transpanlatation. Int. J. Med. Sei. 2007. 4 (2). 105-109.
31. Левада А.И. Парвовирусная инфекция В19. Педиатр онлайн. 2012.
32. Ergaz Z., Ornoy A. Parvovirus B19 in pregnancy. Reproductive Toxicology. 2006. 21. 421-435.
33. Chiasaka H. et al. Parvovirus B19 and the pathogenesis of anaemia. Rev. Med. Virol. 2003 Nov-Dec. 13 (6). 347-59.
34. Harger J.H., Adler S.P., Koch W.C., and Harger G.F. Prospective evaluation of 618 pregnant women exposed to parvovirus B19: risks and symptoms. Obstet. Gynecol. 1998. 91. 413-420.
35. Caforio A.L.P., Bottaro S., Iliceto S. Dilated cardiomyopathy (DCM) and myocarditis: classification, clinical and autoimmune features. Applied Cardiopulmonary Pathophysiology. 2012. 16. 82-95.
36. Norja P. et al. Bioportfolio lifelong persistence of variant and prototypic erythrovirus DNA genomes in human tissue. Proc. Natl. Acad. Sci. USA. 2006. 103. 7450-7453.
37. Parvovirus B19 Infection in Pregnancy (2014). Avai–lable from: [https://sogc.org/wp-content/uploads/2014/12/gui 3161012E.pdf], last accessed Sept 13, 2018.
38. Neal S. Young, Kevin E. Brown. Parvovirus B19. The New England Journal of Medicine. 2004. 350. 586-97.
39. de Jong E.P., Walther F.J., Kroes A.C., Oepkes D. Parvovirus B19 infection in pregnancy: new insights and management. Prenat. Diagn. 2011. 31. 419-425.
40. Dijkmans A.C., de Jong E.P., Dijkmans B.A., Lopriore E., Vossen A., Walther F.J. et al. Parvovirus B19 in pregnancy: prenatal diagnosis and management of fetal complications. Curr. Opin Obstet. Gynecol. 2012. 24. 95-101.
41. O’Malley A. et al. Parvovirus infects cardiac myocytes in hydrops fetalis. Pediatr. Dev. Pathol. 2003. 6 (5). 414-420.
42. Lefrère J.J., Servant-Delmas A., Candotti D. et al. Persistent B19 infection in immunocompetent individuals: implications for transfusion safety. Blood. 2005. 106. 2890-2895.
43. Broliden K., Tolfvenstam T., Norbeck O. Clinical aspects of parvovirus B19 infection. J. Intern. Med. 2006. 260. 285-304.
44. Heegaard E.D., Petersen B.L., Heilmann C.J., Hornsleth A. Prevalence of parvovirus B19 and parvovirus V9 DNA and antibodies in paired bone marrow and serum samples from healthy individuals. J. Clin. Microbiol. 2002. 40 (3). 933-6.
45. Kurtzman G.J., Cohen B.J., Field A.M., Oseas R., Blaese R.M., Young N.S. Immune response to B19 parvovirus infection and an antibody defect in persistent viral infection. J. Clin. Invest. 1989. 84 (4). 1114-23.
46. Chisaka H., Ito K., Niikura H., Sugawara J., Takano T., Murakami T., Terada Y., Okamura K., Shiroishi H., Sugamura K., Yaegashi N. Clinical manifestations and outcomes of parvovirus B19 infection duting pregnancy in Tohoku. J. Exp. Med. 2006. 209. 277-283.
47. Corcioli F., Zakrzewska K., Fanci R., De Giorgi V., Innocenti M., Rotellini M., Di Lollo S., Azzi A. Human parvovirus PARV4 DNA in tissues from adult individuals: a comparison with human parvovirus B19 (B19V). Virol. J. 2010. 7. 272. Mode of access. http://www.virologyj.com/content/7/1/272 568-1.
48. Young N.S., Brown K.E. Mechanisms of disease: Parvovirus. N. Engl. J. Med. 2004. 350 (6). 586-597.
49. Noyola D.E., Lourdes Padilla-Ruiz M., Guadalupe Obregón-Ramos M. et al. Parvovirus B19 infection in medical students during a hospital outbreak. J. Med. Microbiol. 2004. 53. 141-146.
50. Tolfvenstam T., Broliden K. Parvovirus B19 infection. Semin. Fetal. Neonatal. Med. 2009. 14 (4). 218-221.
51. Anderson L.J. Role of parvovirus B19 in human disease. Pediatr. Infect. Dis. 1987. 6. 711-718.
52. Koch W.C. Fifth (human parvovirus) and sixth (herpesvirus 6) diseases. Curr. Opin. Infect. Dis. 2001. 14. 343-356.
53. Nicolay N. et al. Clinical and epidemiological aspects of parvovirus B19 infections in Ireland, January 1996-June 2008. Euro Surveill. 2009. 14. 1-5.
54. Valentin M.N., Cohen P.J. Pediatric Parvovirus B19: spectrum of clinical manifestations. Cutis. 2013. 92. 179-184.
55. Pavlovic M.D. Papular-purpuric «gloves and socks» syndrome caused by parvovirus B19. Vojnosanit Pregl. 2003. 60 (2). 223-225.
56. Heckler G.T., Dal Ri N.M.K., Almeida H.L. Jr. Case for diagnosis. An. Bras. Dermatol. 2012. 87 (5). 793-794.
57. Kumano K. Various clinical symptoms in human parvovirus B19 infection. Japanese Journal of Clinical Immunology. 2008. 31 (6). 448-453.
58. Muir K., Todd W.T., Watson W.H., Fitzsimons E. Viral-associated haemophagocytosis with parvovirus-B19-related pancytopenia. Lancet. 1992. 339. 1139-1140.
59. Poole B.D., Karetnyi Y.V., Naides S.J. Parvovirus B19-induced apoptosis of hepatocytes. Journal of virology. 2004. 78 (14). 7775-7783.
60. Bihari Ch., Rastogi A., Saxena P. et al. Parvovirus B19 associated hepatitis. Hindawi Publishing Corporation. Hepatitis Research and Treatment. 2013. Article ID 472027. 1-9.
61. Mihály I., Trethon A., Arányi Z. et al. Observations on human parvovirus B19 infection diagnosed in 2011. Orvosi Hetilap. 2012. 153 (49). 1948-1957. View at Google Scholar.
62. Sun L., Zhang J.-C. Acute fulminant hepatitis with bone marrow failure in an adult due to parvovirus B19 infection. Hepatology. 2012. 55 (1). 329-330.
63. Yang S.-H., Lin L.-W., Fang Y.-J., Cheng A.-L., Kuo S.-H. Parvovirus B19 infection-related acute hepatitis after rituximab-containing regimen for treatment of diffuse large B-cell lymphoma. Annals of Hematology. 2012. 91 (2). 291-294.
64. Hatakka A., Klein J., He R. et al. Acute hepatitis as a manifestation of parvovirus B19 infection. Journal of Clinical Microbiology. 2011. 49 (9). 3422-3424.
65. Kindermann I., Barth C., Mahfoud F. et al. Update on Myocarditis. Journal of the American College of Cardiology. 2012. 59 (9). 779-792.
66. Schultheiss H.-P., Kuhl U., Cooper L.T. The management of myocarditis. European Heart Journal. 2011; doi:10.1093. 1-13.
67. Lotze U., Egerer R., Gluck B., Zell R., Sigusch H., Erhardt C., Heim A., Kandolf R., Bock T., Wutzler P., Figulla H.R. Low level myocardial parvovirus B19 persistence is a frequent finding in patients with heart disease but unrelated to ongoing myocardial injury. J. Med. Virol. 2010. 82. 1449-1457.
68. Schenk T., Enders M., Pollak S., Hahn R., Huzly D. High prevalence of human parvovirus B19 DNA in myocardial autopsy samples from subjects without myocarditis or dilative cardiomyopathy. J. Clin. Microbiol. 2009. 47. 106-110.
69. Barah F., Whiteside S. et al. Neurological aspects of human parvovirus B19 infection: a systematic review. J. Rev. Med. Virol. 2014 May. 24 (3). 154-68.
70. Douvoyiannis M., Litman N., Goldman D.L. Neurologic manifestations associated with Parvovirus B19 Infection. CID. 2009. 48 (15). 1713-1723.
71. Alger L.S. Toxoplasmosis and parvovirus B19. Infect. Dis. Clin. North Am. 1997. 11. 55-75.
72. Waring G.J. Parvovirus B19 infection. Timely diagnosis in pregnancy essential. Case Rep. Womens Health. 2018. 18. e00057. DOI. 10.1016/j.crwh.2018. e00057
73. Ornoy A., Ergaz Z. Parvovirus. B19 infection during pregnancy and risks to the fetus. Birth. Defects Res. 2017. Mar 15. 109 (5). 311-323.
74. Courtier J., Schauer G.M., Parer J.T., Regenstein A.C., Callen P.W., Glenn O.A. Parvovirus. B19 infection during pregnancy and risks to the fetus. Ultrasound Obstet Gynecol. 2012. 40 (5). 604-6.
75. Röhrer C.I., Gärtner B., Sauerbrei A., Böhm, S., Hottenträger B., Raab U. et al. Seroprevalence of parvovirus B19 in the German population. Epidemiol. Infect. 2008. 136. 1564-1575.
76. Valeur-Jensen A.K., Pedersen C.B., Westergaard T., Jensen I.P., Lebech M., Andersen P.K. et al. Risk factors for parvovirus B19 infection in pregnancy. JAMA. 1999. 281. 1099-1105.
77. Centers for Disease Control (CDC). Risks associated with human parvovirus B19 infection. Morb. Mortal. Wkly. Rep. 1989. 38. 81-88 (93-7).
78. Gilbert N.L. et al. Seroprevalence of parvovirus B19 infection in daycare educators. Epidemiol. Infect. 2005. 133. 299-304.
79. Giorgio E., Antonietta De Oronzo M., Iozza I. Parvovirus B19 during pregnancy: a review. Journal of Prenatal Medicine. 2010. 4 (4). 63-66.
80. Schulert G.S., Walsh W.F., Weitkamp J.H. Polymicrogyria and congenital Parvovirus B19 infection. Am. J. Perinatol. Rep. 2011. 1. 105-110.
81. Crane J., Mundle W., Boucoiran I. Parvovirus B19 infection in pregnancy. 2014 Dec. 36 (12). 1107-1116.
82. Leduc L. SOGC Maternal-Fetal Medicine Committee. Stillbirth and bereavement: guidelines for stillbirth investigation. SOGC Clinical Practice Guidelines. J. Obstet. Gynaecol. Can. 2006. 28. 540-552.
83. Watt A.P., Brown M., Pathiraja M., Anbazhagan A., Coyle P.V. The lack of routine surveillance of parvovirus B19 infection in pregnancy prevents an accurate understanding of this regular cause of fetal loss and the risks posed by occupational exposure. J. Med. Microbiol. 2013. 62. 86-92.
84. Simms R.A., Liebling R.E., Patel R.R., Denbow M.L., Abdel-Fattah S.A., Soothill P.W. et al. Management and outcome of pregnancies with parvovirus B19 infection over seven years in a tertiary fetal medicine unit. Fetal. Diagn. Ther. 2009. 25. 373-378.
85. Enders M., Schalasta G., Baisch C., Weidner A., Pukkila L., Kaikkonen L. et al. Human parvovirus B19 infection during pregnancy-value of modern molecular and serological diagnostics. J. Clin. Virol. 2006. 35. 400-406.
86. Australasian Society for Infectious Diseases. Management of Perinatal Infection (2014). Available from: [https://www.asid.net.au/documents/item/368], last accessed Sept 13, 2018.
87. SOGC Clinical Practice guideline. Parvovirus B19 Infection in Pregnancy (2014). Available from: [https://sogc.org/wp-content/uploads/2014/12/gui3161012E.pdf], last accessed Sept 13, 2018.
88. Enders M., Weidner A., Zoellner I., Searle K., Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases. Prenat. Diagn. 2004. 24. 513-518.
89. Matsuda H., Sakaguchi K., Shibasaki T., Takahashi H. et al. Intrauterine therapy for parvovirus B19 infected sympto–matic fetus using B19 IgG-rich high titer gammaglobulin. J. Perinat. Med. 2005. 33 (6). 561-563.
90. Sarfraz A.A., Samuelsen S.O., Bruu A.L., Jenum P.A., Eskild A. Maternal human parvovirus B19 infection and the risk of fetal death and low birthweight: a case-control study within 35 940 pregnant women. BJOG. 2009. 116. 1492-8.
91. Smith J. Human parvovirus B19: a literature review and case study. Infant. 2008. 4 (5). 101-104.
92. de Haan T.R., van den Akker E.S., Porcelijn L., Oepkes D., Kroes A.C., Walther F.J. Thrombocytopenia in hyd–ropic fetuses with parvovirus B19 infection: incidence, treatment and correlation with fetal B19 viral load: BJOG. 2008. 115. 76-81.
93. Adler S. and Koch W.C. Human parvovirus B19. In: J.S. Remington, J.O. Klein (Eds.) Infectious diseases of the fetus and newborn infant. 7th ed. Saunders, Philadelphia. 2010. 845 (5).
94. Cohen B. Parvovirus B19: an expanding spectrum of di–sease. BMJ. 1995. 311. 1549-1552.
95. Levy R., Weissman A., Blomberg G., Hagay Z.J. Infection by parvovirus B19 during pregnancy: a review. Obstet. Gynecol. Surv. 1997. 52. 254-259.
96. Segata M., Chaoui R., Khalek N., Bahado-Singh R., Paidas M.J., Mari G. Fetal thrombocytopenia secondary to parvovirus infection. Am. J. Obstet. Gynecol. 2007. Jan. 196 (1). 61. e1-4.
97. Enders M., Weidner A., Zoellner I., Searle K., Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases. Prenat. Diagn. 2004 Jul. 24 (7). 513-8.
98. Markenson G.R., Yancey M.K. Parvovirus B19 infections in pregnancy. Semin. Perinatol. 1998. 22. 309-317.
99. Barton L.L., Lax D., Shehab Z.M., Keith J.C. Congenital cardiomyopathy associated with human parvovirus B19 infection. Am. Heart J. 1997. 133. 131-133.
100. Enders M., Weidner A., Rosenthal T., Baisch C., Hedman L., Söderlund-Venermo M., Hedman K. Improved diagnosis of gestational parvovirus B19 infection at the time of nonimmune fetal hydrops. J. Infect. Dis. 2008. 197. 58-62.
101. Health Protection Agency Rash Guidance Working Group. Guidance on viral rash in pregnancy: investigation, diagnosis and management of viral rash illness, or exposure to viral rash illness, in pregnancy. Health Protection Agency, London. 2011.
102. Miller E., Fairley C.K., Cohen B.J., Seng C. Immediate and long term outcome of human parvovirus B19 infection in pregnancy. Br. J. Obstet. Gynaecol. 1998. 105. 174-178.
103. Nyman M., Tolfvenstam T., Petersson K., Krassny C., Skjöldebrand-Sparre L., Broliden K. Detection of Human Parvovirus B19 Infection in First-Trimester Fetal Loss. Obstetrics & Gynecology. 2002. 99 (5). Part 1. 795-798.
104. von Kaisenberg C.S., Jonat W. Fetal parvovirus B19 infection. Ultrasound. Obstet. Gynecol. 2001. 18. 280-288.
105. Rodis J.F. Parvovirus infection. Clin. Obstet. Gynecol. 1999. 42. 107-120 (quiz 174-5).
106. Barrett J., Ryan G., Morrow R., Farine D., Kelly E., Mahony J. Human parvovirus B19 during pregnancy. J. Soc. Obstet. Gynaecol. Can. 1994. 16. 1253-1258.
107. Borna S., Mirzaie F., Hanthoush-Zadeh S., Khazar–doost S., Rahimi-Sharbaf F. Middle cerebral artery peak systolic velocity and ductus venosus velocity in the investigation of nonimmune hydrops. J. Clin. Ultrasound. 2009. 37. 385-388.
108. Chauvet A., Dewilde A., Thomas D., Joriot S., Vaast P., Houfflin-Debarge V. et al. Ultrasound diagnosis, management and prognosis in a consecutive series of 27 cases of fetal hydrops following maternal parvovirus B19 infection. Fetal. Diagn. Ther. 2011. 30. 41-47.
109. Delle Chiaie L., Buck G., Grab D., Terinde R. Prediction of fetal anemia with Doppler measurement of the middle cerebral artery peak systolic velocity in pregnancies complicated by maternal blood group alloimmunization or parvovirus B19 infection. Ultrasound Obstet Gynecol. 2001. 18. 232-236.
110. Morgan-Capner P. Guidelines on the management of, and exposure to, rash illness in pregnancy (including consideration of relevant antibody screening programmes in pregnancy). Commun. Dis. Public Health. 2002. 5. 59-71.
111. Koppelman M.H.G.M. et al. Quantitative real-time detection of parvovirus B19 DNA in plasma. Transfusion. 2004. 44. 97-103.
112. Rodis J.F., Hovick T.J. Jr., Quinn D.L., Rosengren S.S., Tattersall P. Human parvovirus infection in pregnancy. Obstet. Gynecol. 1988. 72. 733-738.
113. Bernstein D.I., Sahly H., Keitel W.A. et al. Safety and immunogenicity of a candidate Parvovirus B19 vaccine. Vaccine. 2011. 29 (43). 7357-7363.
114. Pickering L.K., Baker C.J., Kimberlin D.W. et al. Parvovirus B19. Report of the Committee on Infectious Diseases. American Academy of Pediatrics. 2009. 491-494.

/245-1.jpg)
/245-2.jpg)
/246-1.jpg)