Архив офтальмологии Украины Том 8, №1, 2020
Вернуться к номеру
Деякі імунологічні маркери як прогностичні чинники розвитку вікової макулярної дегенерації після факоемульсифікації катаракти
Авторы: Денисюк О.Ю.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
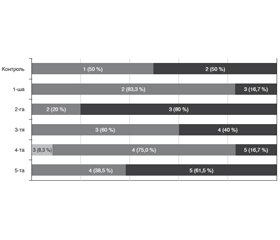
Актуальність. Вікова макулярна дегенерація (ВМД) є однією з поширених причин сліпоти серед осіб похилого віку. Залишається невирішеним питання, як впливає факоемульсифікація катаракти (ФЕК) на розвиток та прогресування ВМД. До імунних маркерів, які мають безпосереднє відношення до хронічного імунного паразапалення при ВМД, відносять IFN-γ (активатор специфічної і неспецифічної імунної відповіді), IP-9 (один з основних інтерфероніндукованих хемокінів, який має доведене відношення до розвитку ВМД) і IL-1β (маркер прозапального пошкодження). Мета дослідження: установити роль деяких імунологічних маркерів як прогностичних чинників розвитку вікової макулярної дегенерації після факоемульсифікації катаракти. Матеріали та методи. Під спостереженням перебували 86 пацієнтів (93 ока) віком від 60 до 82 років, яким була виконана ФЕК шляхом імплантації м’якої інтраокулярної лінзи на апараті Infiniti фірми Alcon (США). ВМД оцінювали за класифікацією Американської академії офтальмологів (AREDS, 2001). Пацієнтів обстежували протягом 18 місяців після операції. Визначення вмісту IFN-γ (пг/мл), IP-9 (нг/мл) та IL-1β (пг/мл) проводили імуноферментним методом у внутрішньоочній рідині, яку забирали під час операції ФЕК. Для статистичної обробки отриманих даних використовували програми Statistica 10 (StatSoft, Inc., США) та MedCalc Statistical Software 18 (MedCalc Software bvba, Бельгія). Результати. Вміст маркерів був суттєво вищим за наявності ВМД, ніж за її відсутності (контроль), із максимальними значеннями в 4-й та 5-й групах (при ВМД у пізній стадії — категорія 4 AREDS): вміст IFN-γ — у 4,8–5,4 раза; вміст ІР-9 — у 5,5–5,9 раза; вміст IL-1β — у 5,1–5,6 раза (p < 0,001). При стратифікації за прогресуванням ВМД було відзначено, що вміст IFN-γ і IP-9 був вищим за наявності прогресування, ніж без нього (відповідно у 2,0 та 1,2 раза; р < 0,05), тоді як за рівнем IL-1β різниці не виявлено (р = 0,514). При розвитку ВМД уперше після операції ФЕК суттєво збільшеним виявися вміст IFN-γ і ІР-9 за відсутності реакції IL-1β. Побудована прогностична модель ймовірності прогресування ВМД за вмістом IFN-γ у внутрішньоочній рідині з точністю 79,6 % (p < 0,001). Висновки. Активність імунного запалення, що відбиває вміст у внутрішньоочній рідині імунних маркерів, має прогностичну значущість для прогресування ВМД після операції ФЕК.
Актуальность. Возрастная макулярная дегенерация (ВМД) является одной из распространенных причин слепоты среди пожилых людей. Остается нерешенным вопрос, как влияет факоэмульсификация катаракты (ФЭК) на развитие и прогрессирование ВМД. К иммунным маркерам, которые имеют непосредственное отношение к хроническому иммунному паравоспалению при ВМД, относят IFN-γ (активатор специфического и неспецифического иммунного ответа), IP-9 (один из основных интерферониндуцированных хемокинов, имеющих доказанное отношение к развитию ВМД) и IL-1β (маркер провоспалительного повреждения). Цель исследования: установить роль некоторых иммунологических маркеров как прогностических факторов развития возрастной макулярной дегенерации после факоэмульсификации катаракты. Материалы и методы. Под наблюдением находились 86 пациентов (93 глаза) в возрасте от 60 до 82 лет, которым была выполнена ФЭК путем имплантации мягкой интраокулярной линзы на аппарате Infiniti фирмы Alcon (США). ВМД оценивали по классификации Американской академии офтальмологов (AREDS, 2001). Пациентов обследовали в течение 18 месяцев после операции. Определение содержания IFN-γ (пг/мл), IP-9 (нг/мл) и IL-1β (пг/мл) проводили иммуноферментным методом во внутриглазной жидкости, которую забирали во время операции ФЭК. Для статистической обработки полученных данных использовали программы Statistica 10 (StatSoft, Inc., США) и MedCalc Statistical Software 18 (MedCalc Software bvba, Бельгия). Результаты. Содержание маркеров было существенно выше при наличии ВМД, чем при ее отсутствии (контроль), с максимальными значениями в 4-й и 5-й группах (при ВМД в поздней стадии — категория 4 AREDS): содержание IFN-γ — в 4,8–5,4 раза; содержание IP-9 — в 5,5–5,9 раза; содержание IL-1β — в 5,1–5,6 раза (p < 0,001). При стратификации по прогрессированию ВМД было отмечено, что содержание IFN-γ и IP-9 было выше при наличии прогрессирования, чем без него (соответственно в 2,0 и 1,2 раза; р < 0,05), тогда как по уровню IL-1β разницы не обнаружено (р = 0,514). При развитии ВМД впервые после операции ФЭК существенно увеличенным оказалось содержание IFN-γ и IP-9 при отсутствии реакции IL-1β. Построена прогностическая модель вероятности прогрессирования ВМД по содержанию IFN-γ во внутриглазной жидкости с точностью 79,6 % (p < 0,001). Выводы. Активность иммунного воспаления, которое отражает содержание во внутриглазной жидкости иммунных маркеров, имеет прогностическую значимость для прогрессирования ВМД после операции ФЭК.
Background. Age-related macular degeneration (AMD) is one of the common causes of blindness in the elderly population. The question remains unsolved how cataract phacoemulsification influences the development and progression of AMD. Immune markers directly related to chronic immune parainflammation in AMD include interferon-γ (IFN-γ) (activator of a specific and nonspecific immune response), inducible protein-9 (IP-9) (one of the major interferon-induced chemokines, which is related to the development of AMD) and interleukin-1β (IL-1β) (marker of proinflammatory damage). The purpose of the study: to establish the role of some immunological markers as prognostic factors for the development of age-related macular degeneration after cataract phacoemulsification. Materials and methods. We have examined 86 patients (93 eyes) between the ages of 60 and 82 years who underwent cataract phacoemulsification by implanting a soft intraocular lens on Infiniti Alcon system (USA). AMD was evaluated by the American Academy of Ophthalmology (AREDS, 2001) classification. Patients were examined within 18 months after surgery. IFN-γ (pg/ml), IP-9 (ng/ml) and IL-1β (pg/ml) levels were determined by enzyme immunoassay in an intraocular fluid collected during cataract phacoemulsification. Statistica 10 (StatSoft, Inc., USA) and MedCalc Statistical Software 18 (MedCalc Software bvba, Belgium) were used for statistical processing of the obtained data. Results. Marker content was significantly higher in the presence of AMD than in its absence (control), with maximum values in groups 4 and 5 (in late-stage AMD — category 4 AREDS): IFN-γ content — 4.8–5.4 times; IP-9 level — 5.5–5.9 times; IL-1β content — 5.1–5.6 times (p < 0.001 higher. When stratifying by progression of AMD, it was noted that the content of IFN-γ and IP-9 was higher in the presence of progression than without it (2.0 and 1.2 times, respectively; p < 0.05), whereas in terms of IL-1β level, the difference was not detected (p = 0.514). With the development of AMD, for the first time after cataract phacoemulsification, the content of IFN-γ and IP-9 was significantly increased in the absence of IL-1β reaction. A prognostic model was created for the risk of AMD progression in terms of IFN-γ level in the intraocular fluid with an accuracy of 79.6 % (p < 0.001). Conclusions. The activity of immune inflammation, which reflects the content of immune markers in the intraocular fluid, has a prognostic significance for the progression of AMD after cataract phacoemulsification.
вікова макулярна дегенерація; факоемульсифікація катаракти; IFN-γ; IP-9; IL-1β
возрастная макулярная дегенерация; факоэмульсификация катаракты; IFN-γ; IP-9; IL-1β
age-related macular degeneration; cataract phacoemulsification; IFN-γ; IP-9; IL-1β
Вступ
Матеріали та методи
Результати та обговорення
/43.jpg)
Висновки
1. Flaxman S.R., Bourne R.R.A., Resnikoff S., Ackland P., Braithwaite T., Cicinelli M.V., Das A. et al. Vision Loss Expert Group of the Global Burden of Disease Study. Global causes of blindness and distance vision impairment 1990–2020: a systematic review and meta-analysis. Lancet Glob. Health. 2017 Dec; 5(12). Р. 1221-1234. doi: 10.1016/S2214-109X(17)30393-5. Epub, 2017 Oct 11.
2. Taylor H.R. Global Blindness: The Progress We Are Making and Still Need to Make. Asia Pac. J. Ophthalmol. (Phila). 2019 Nov-Dec. 8(6). Р. 424-428. doi: 10.1097/APO.0000000000000264.
3. Rappoport D., Goldberg M., Bukelman A., Katz H., Goldberg L., Pollack A. Phacoemulsifnication in eyes with neovascular age-related macular degeneration (AMD). Harefuah. 2017 Feb. 156(2). Р. 79-83.
4. Ho J.D., Xirasagar S., Kao L.T., Lin H.C. Neovascular age-related macular degeneration is associated with cataract surgery. Acta Ophthalmol. 2018 Mar. 96(2). Р. 213-217. doi: 10.1111/aos.13511.
5. Ehmann D.S., Ho A.C. Cataract surgery and age-related macular degeneration. Curr. Opin. Ophthalmol. 2017 Jan. 28(1). Р. 58-62.
6. Rim T.H., Lee C.S., Lee S.C., Kim S., Kim S.S. Epidemiologic Survey Committee Of The Korean Ophthalmological Society. Association between Previous Cataract Surgery and Age-Related Macular Degeneration. Semin. Ophthalmol. 2017. 32(4). Р. 466-473. doi: 10.3109/08820538.2015.1119861.
7. Klein B.E., Howard K.P., Lee K.E., Iyengar S.K., Sivakumaran T.A., Klein R. The relationship of cataract and cataract extraction to age-related macular degeneration: the Beaver Dam Eye Study. Ophthalmology. 2012 Aug. 119(8). Р. 1628-33. doi: 10.1016/j.ophtha.2012.01.050.
8. Ambati J., Atkinson J.P., Gelfand B.D. Immunology of age-related macular degeneration. Nat. Rev. Immunol. 2013 Jun. 13(6). Р. 438-451. doi: 10.1038/nri3459.
9. Qu S.C., Xu D., Li T.T., Zhang J.F., Liu F. iTRAQ-based proteomics analysis of aqueous humor in patients with dry age-related macular degeneration. Int. J. Ophthalmol. 2019, Nov 18. 12(11). Р. 1758-1766. doi: 10.18240/ijo.2019.11.15.
10. Doyle S.L., Campbell M., Ozaki E., Salomon R.G., Mori A., Kenna P.F., Farrar G.J., Kiang A.S. et al. NLRP3 has a protective role in age-related macular degeneration through the induction of IL-18 by drusen components. Nat. Med. 2012 May. 18(5). Р. 791-8. doi: 10.1038/nm.2717.
11. Tseng W.A., Thein T., Kinnunen K., Lashkari K., Gregory M.S., D’Amore P.A., Ksander B.R. NLRP3 inflammasome activation in retinal pigment epithelial cells by lysosomal destabilization: implications for age-related macular degeneration. Invest. Ophthalmol. Vis. Sci. 2013, Jan 7. 54(1). Р. 110-20. doi: 10.1167/iovs.12-10655.
12. Juel H.B., Faber C., Udsen M.S., Folkersen L., Nissen M.H. Chemokine expression in retinal pigment epithelial ARPE-19 cells in response to coculture with activated T cells. Invest. Ophthalmol. Vis. Sci. 2012, Dec 19. 53(13). Р. 8472-80. doi: 10.1167/iovs.12-9963.
13. Ding X., Patel M., Chana C.-C. Molecular pathology of age-related macular degeneration. Prog. Retin. Eye Res. 2009 Jan. 28(1). Р. 1-18. doi: 10.1016/j.preteyeres.2008.10.001.
14. Loetscher P., Pellegrino A., Gong J.-H., Mattioli I., Loetscher M., Bardi G., Baggiolini M., Clark-Lewis I. The Ligands of CXC Chemokine Receptor 3, I-TAC, Mig, and IP10, Are Natural Antagonists for CCR3. The Journal of Biological Chemistry. 2001. 276. 2986-91. doi: 10.1074/jbc.M005652200.
15. Sakurada Y., Nakamura Y., Yoneyama S., Mabuchi F., Gotoh T., Tateno Y., Sugiyama A., Kubota T., Iijima H. Aqueous humor cytokine levels in patients with polypoidal choroidal vasculopathy and neovascular age-related macular degeneration. Ophthalmic. Res. 2015. 53(1). Р. 2-7. doi: 10.1159/000365487.
16. Lin T., Walker G.B., Kurji K., Fang E., Law G., Prasad S.S., Kojic L., Cao S., White V., Cui J.Z., Matsubara J.A. Parainflammation associated with advanced glycation endproduct stimulation of RPE in vitro: implications for age-related degenerative diseases of the eye. Cytokine. 2013 Jun. 62(3). Р. 369-81. doi: 10.1016/j.cyto.2013.03.027.
17. Jiang K., Cao S., Cui J.Z., Matsubara J.A. Immuno-modulatory effect of IFN-gamma in AMD and its role as a possible target for therapy. J. Clin. Exp. Ophthalmol. 2013, Feb 26. Suppl 2. Р. 0071-0076. doi: 10.4172/2155-9570-S2-007.
18. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch. Ophthalmol. 2001 Oct. 119(10). Р. 1417-36.
19. Денисюк О.Ю. Спосіб оцінювання впливу хірургічного лікування катаракти на прогресування вікової макулярної дегенерації. Архів офтальмології України. 2018. 6(2). С. 58-61.
20. Денисюк О.Ю., Риков С.А., Могілевський С.Ю. Спосіб прогнозування розвитку макулярної дегенерації після хірургічного лікування катаракти. Патент на корисну модель 130989 Україна. Заявл. 06.04.2018. Опубл. 10.01.2019. Бюл. № 1.
21. Jonas J.B., Tao Y., Neumaier M., Findeisen P. Cytokine concentration in aqueous humour of eyes with exudative age-related macular degeneration. Acta Ophthalmol. 2012 Aug. 90(5). Р. 381-8. doi: 10.1111/j.1755-3768.2012.02414.x.
22. Ramos de Carvalho J.E., Verwoert M.T., Vogels I.M.C., Reits E.A., Van Noorden C.J.F., Klaassen I., Schlingemann R.O. Involvement of the ubiquitin-proteasome system in the expression of extracellular matrix genes in retinal pigment epithelial cells. Biochem. Biophys. Rep. 2018, Jan 28. 13. Р. 83-92. doi: 10.1016/j.bbrep.2018.01.005.
23. Ethen C.M., Hussong S.A., Reilly C., Feng X., Olsen T.W., Ferrington D.A. Transformation of the proteasome with age-related macular degeneration. FEBS Lett. 2007, Mar 6. 581(5). Р. 885-90. doi: 10.1016/j.febslet.2007.01.061.
24. Rivett A.J., Hearn A.R. Proteasome function in antigen presentation: immunoproteasome complexes, peptide production, and interactions with viral proteins. Curr. Protein. Pept. Sci. 2004 Jun. 5(3). Р. 153-61.
25. Saddala M.S., Lennikov A., Mukwaya A., Fan L., Hu Z., Huang H. Transcriptome-wide analysis of dIFNferentially expressed chemokine receptors, SNPs, and SSRs in the age-related macular degeneration. Hum. Genomics. 2019, Mar 20. 13(1). Р. 15. doi: 10.1186/s40246-019-0199-1.
26. Kerur N., Fukuda S., Banerjee D., Kim Y., Fu D., Apicella I., Varshney A. et al. cGAS drives noncanonical-inflammasome activation in age-related macular degeneration. Nat. Med. 2018 Jan. 24(1). Р. 50-61. doi: 10.1038/nm.4450.
27. Liu X., Zhang Z., Ruan J., Pan Y., Magupalli V.G., Wu H., Lieberman J. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores. Nature. 2016, Jul 7. 535(7610). Р. 153-8. doi: 10.1038/nature18629.
28. Kutty R.K., Samuel W., Boyce K., Cherukuri A., Duncan T., Jaworski C., Nagineni C.N., Redmond T.M. Proinflammatory cytokines decrease the expression of genes critical for RPE function. Mol. Vis. 2016, Oct 8. 22. Р. 1156-1168.

/39.jpg)
/40.jpg)
/40_2.jpg)
/41.jpg)
/41_2.jpg)
/42.jpg)