Розроблене на підставі керівництва ESPEN «Клінічне харчування при запальних захворюваннях кишечника».
Alastair Forbes, Johanna Escher, Xavier Hébuterne, Stanisław Kłęk, Zeljko Krznaric, Stéphane Schneider, Raanan Shamir, Kalina Stardelova, Nicolette Wierdsma, Anthony E. Wiskin, Stephan C. Bischoff
Clin. Nutrition. 2017. 36. 321-47.
Скорочення: ХК — хвороба Крона; ЕХ — ентеральне харчування; ЗЗК — запальні захворювання кишечника; ПХД — пероральні харчові добавки; ПХ — парентеральне харчування; ВК — виразковий коліт.
Вступ
Сьогодні запальні захворювання кишечника (ЗЗК), переважно виразковий коліт (ВК) і хвороба Крона (ХК), поширені у всіх розвинених країнах. Мальнутриція може виникати як при ВК, так і при ХК, але є значно більшою проблемою при ХК з огляду на здатність хвороби вражати будь-яку частину шлунково-кишкового тракту, на відміну від ВК, який обмежується товстою кишкою і має небагато прямих ефектів, що спричиняють мальабсорбцію. Як і в дорослих, мальнутриція є частою проблемою при ЗЗК у дітей, головним чином у фазі загострення захворювання, причому частіше при ХК, ніж при ВК. Оскільки пацієнти із ЗЗК піддаються високому ризику мальнутриції, вони потребують оцінки нутритивного статусу з подальшим оглядом і лікуванням. Нутритивна підтримка особливо важлива в лікуванні пацієнтів із ЗЗК і включає профілактику мальнутриції і дефіциту мікроелементів, запобігання остеопорозу й сприяння оптимальному зростанню й розвитку дітей.
Методологія
Чинне практичне керівництво складається із 40 рекомендацій і базується на керівництві ESPEN «Клінічне харчування при запальних захворюваннях кишечника» — практична версія (1а) і наукова версія (1b). Оригінальне керівництво було скорочене шляхом обмеження коментарів до зібраних доказів і літературних джерел, на яких базуються рекомендації. Рекомендації не були змінені (крім того, що термін «штучне харчування» було замінено на термін «лікувальне харчування», а мова була адаптована до американської англійської), але вигляд змісту був перетворений на графічне подання алгоритму прийняття рішень (у відповідних випадках). Оригінальне керівництво було розроблене відповідно до стандартної операційної процедури (СОП) для підготовки керівництв ESPEN [2]. Ця СОП базується на методології Шотландської міжуніверситетської мережі з розробки клінічних керівництв (SIGN). Був виконаний пошук літературних джерел, класифікованих за рівнем доказовості (від 1 до 4), після чого були створені рекомендації, розподілені на чотири класи (A/B/0/GPP). Усі рекомендації не тільки ґрунтувалися на доказах, а й пройшли процедуру досягнення консенсусу, внаслідок чого був досягнутий певний відсоток згоди (%). За можливості було залучено представників різних дисциплін (лікарів, дієтологів, медсестер тощо), а також представників пацієнтів. Процес розробки керівництва фінансувався виключно ESPEN. Оновлення керівництва і його подальше поширення частково фінансувалося Об’єднаною європейською гастроентерологічною асоціацією (UEG), а також ESPEN. Детальніша інформація щодо методології наведена в повній версії керівництва ESPEN [1] і СОП ESPEN [2].
Практичне керівництво ESPEN «Клінічне харчування при запальних захворюваннях кишечника» було структуроване відповідно до схеми, що охоплює всі аспекти харчування при ЗЗК (рис. 1).
Результати
I. Профілактика розвитку ЗЗК (рис. 2)
Рекомендація 1
Дієта, багата на фрукти й овочі, n-3 жирні кислоти, з низьким вмістом n-6 жирних кислот асоціюється зі зниженням ризику розвитку ХК і ВК, тому рекомендується.
Клас рекомендацій 0 — високий консенсус (90% згода)
Коментар
Куріння, застосування антибіотиків і дієта потенційно є оборотними факторами ризику виникнення ЗЗК. Численні дослідження оцінювали вплив дієти на ризик розвитку ЗЗК. Однак більшість із них є ретроспективними дослідженнями типу «випадок — контроль». У 2011 році Hou і співавтори опублікували перший систематичний огляд під назвою «Дієта і ризик розвитку ЗЗК» [3]. Вони використовували методологію, рекомендовану керівництвом, щоб оцінити зв’язок між отриманням перед розвитком захворювання поживних речовин (жирів, вуглеводів, білків) і груп харчових продуктів (фруктів, овочів, м’яса) і ризиком подальшого виявлення ЗЗК. Було включено 19 досліджень, які охопили 2609 пацієнтів із ЗЗК (1269 із ХК і 1340 із ВК) і понад 4000 контрольних пацієнтів. Основні результати: (i) підвищення ризику розвитку ВК і ХК при значному споживанні поліненасичених жирних кислот (ПНЖК), n-6 жирних кислот і м’яса; (ii) зниження ризику виникнення ХК, але не ВК при значному споживанні харчових волокон (> 22 г/д) і фруктів.
/93_2.jpg)
Харчові волокна, фрукти й овочі [4]. Порівняно з мінімальним споживанням харчових волокон із коригуванням на енергію в групі жінок споживання харчових волокон у найвищому квінтилі (медіана 24 г/д) асоціювалось зі значним зниженням ризику виникнення ХК (ВР 0,59; 95% ДІ 0,39–0,90), але не ВК.
У метааналізі, що охоплював 14 досліджень типу «випадок — контроль» [5], був визначений негативний зв’язок між споживанням овочів і ризиком ВК (ВР 0,71), але не ризиком ХК (ВР 0,66). Був визначений негативний зв’язок між споживанням фруктів і ризиком розвитку ВК (ВР 0,69) і ХК (ВР 0,57).
Жир у раціоні харчування [6]. Сукупне споживання загального жиру, насичених жирів, ненасичених жирів, n-6 і n-3 ПНЖК із коригуванням на енергію не асоціювалось із ризиком виникнення ХК чи ВК. Однак збільшення споживання довголанцюгових n-3 ПНЖК асоціювалось зі зниженням ризику ВК (ВР 0,72). І навпаки, значне тривале споживання трансненасичених жирних кислот було пов’язане зі збільшенням частоти виникнення ВК (ВР 1,34).
У дослідженні EPIC 229 702 учасники були набрані з дев’яти європейських центрів у період між 1991 і 1998 роками [7]. При наборі пацієнтів дієтичне споживання докозагексаєнових і жирних кислот вимірювали за допомогою валідованих опитувальників частоти споживання різних харчових продуктів. У когортному дослідженні типу «випадок — контроль» на кожного учасника, у якого виник інцидентний ВК (n = 126), припадало чотири контрольних учасники. Найвищий квартиль споживання лінолевої кислоти був пов’язаний із підвищеним ризиком ВК (ВР 2,49) зі значною тенденцією в усіх квартилях (ВР 1,32 на квартильний приріст).
Рекомендація 2
Можна рекомендувати грудне вигодовування, оскільки грудне молоко є оптимальною їжею для немовлят і знижує ризик виникнення ЗЗК.
Клас рекомендацій B — високий консенсус (93% згода)
Коментар
У систематичних оглядах від 2004 і 2009 рр. наголошувалося на користі грудного вигодовування [8, 9], а наступні дослідження підтвердили цей висновок. У новозеландському дослідженні типу «випадок — контроль» було зазначено, що годування груддю захищає від ЗЗК (для ХК ВР 0,55; 95% ДІ 0,41–0,74; для ВК ВР 0,71; 95% ДІ 0,52–0,96) з ефектом «тривалість — відповідь» [10]. Порівнянні дані були отримані в датському когортному дослідженні, у якому грудне вигодовування понад шість місяців зменшило шанс виникнення ЗЗК (ВР 0,50; 95% ДІ 0,23–1,11) [11]. Дві додаткові публікації, одна — із США, а друга — з Азіатсько-Тихоокеанського регіону, підтвердили наявність такого зв’язку [12, 13]. Грудне вигодовування протягом приблизно півроку або довше бажане для всіх немовлят [14].
II. Загальні аспекти (рис. 3)
Рекомендація 3A
Пацієнти із ЗЗК знаходяться у групі ризику, тому на момент встановлення діагнозу й регулярно після цього їм слід виконувати оцінку харчового статусу з метою виявлення мальнутриції.
Клас рекомендацій GPP — високий консенсус (96% згода)
Рекомендація 3B
Підтверджену мальнутрицію в пацієнтів із ЗЗК слід належним чином лікувати, оскільки вона погіршує прогноз, збільшує частоту ускладнень, смертність і негативно впливає на якість життя.
Клас рекомендацій GPP — високий консенсус (96% згода)
Коментар стосовно A/B
Дорослі із ЗЗК перебувають у групі високого ризику мальнутриції, причому в пацієнтів із ХК дефіцит зустрічається частіше, ніж у пацієнтів із ВК [15]. Пацієнти з ожирінням можуть мати прихований дефіцит безжирової маси, який може бути виявлений за допомогою таких інструментів, як вимірювання товщини шкірної складки. Пацієнти із ЗЗК у стадії загострення, особливо ті, захворювання яких погано реагує на медикаментозну терапію, піддаються найвищому ризику неповноцінного харчування. У дорослих ризик мальнутриції можна оцінити за допомогою валідованих інструментів скринінгу [16].
Пацієнти із ЗЗК з мальнутрицією піддаються більшому ризику госпіталізації після відвідування відділення екстреної допомоги [17] і госпіталізації через інфекцію [18]. У госпіталізованих пацієнтів мальнутриція є незалежним фактором ризику венозної тромбоемболії [19], непланової хірургічної операції [20], подовження терміну госпіталізації [15, 20] і збільшення смертності [15].
Мальнутриція в дітей. У дітей із ЗЗК мальнутриція є частою проблемою на момент встановлення діагнозу й може зберігатися, незважаючи на лікування основного захворювання [21]. Діти з ВК також піддаються ризику неповноцінного харчування, але дефіцит поживних речовин може не бути очевидним після вимірювання лише зросту й маси тіла [22]. Незважаючи на те, що існують різноманітні інструменти скринінгу, вони мають слабку здатність виявляти різні рівні нутритивного ризику в дітей із ЗЗК [23]. Неповноцінне харчування в дітей із ЗЗК сприяє порушенню розвитку в період статевого дозрівання й зниженню швидкості зростання, що може обумовити низький зріст у дорослому віці. Особливо важливим у дітей із ЗЗК є порушення зростання, що є результатом поєднання запалення й хронічної мальнутриції [24].
Рекомендація 4
Загалом енергетичні потреби пацієнтів із ЗЗК аналогічні здоровій популяції; отже, харчування має задовольняти такі потреби.
Клас рекомендацій GPP — високий консенсус (93% згода)
Коментар
Для наочності це питання можна сформулювати у два способи: по-перше, чи змінюється в пацієнтів із ЗЗК потреба в енергії порівняно зі здоровими людьми, по-друге, чи залежить потреба в енергії від активності захворювання?
Було проведено порівняно мало досліджень, що вивчали витрати енергії в пацієнтів із ВК, крім того, усі дослідження залучали лише невелику кількість пацієнтів. У періоди гострого тяжкого ВК може спостерігатись підвищення метаболічної активності порівняно з ремісією в дорослих [25, 26], це зрозуміло, якщо враховувати, що системні порушення (гарячка й тахікардія) є загальними. Однак збільшення витрат енергії в стані спокою, ймовірно, компенсується зменшенням фізичного навантаження. Значне зменшення обсягу харчування часто спостерігається при гострому ВК і може зумовити негативний енергетичний баланс [27].
В одному дослідженні, у якому вимірювали загальні витрати енергії в дорослих із ХК, були зареєстровані нормальні значення [28]. Було встановлено, що вимірювані витрати енергії в стані спокою на кілограм у дорослих пацієнтів перевищують показники в контрольних групах здорових добровольців [29] або є такими самими [30]. Водночас це може бути пов’язане з недостатнім врахуванням розмірів тіла й відносних пропорцій тканин різної метаболічної активності. Між активністю ХК і витратами енергії в стані спокою у дорослих не було відзначено послідовного зв’язку. У дітей із ХК виміряні витрати енергії в стані спокою відрізнялись незначною мірою. У проблемних випадках можна вимірювати витрати енергії в стані спокою за допомогою непрямої калориметрії.
Рекомендація 5A
При ЗЗК у стадії загострення потреба в білках зростає, тому споживання має бути збільшене (до 1,2–1,5 г/кг/добу в дорослих) порівняно з рекомендованим для загальної популяції.
Клас рекомендацій GPP — високий консенсус (96% згода)
Рекомендація 5B
Потреба в білках в умовах ремісії зазвичай не зростає, і харчування має бути аналогічним (приблизно 1 г/кг/добу у дорослих) рекомендованому для загальної популяції.
Клас рекомендацій GPP — високий консенсус (96% згода)
Коментар стосовно A/B
Пацієнти із ЗЗК зазнають відносного зменшення безжирової маси й збільшення ожиріння з часом. Це може статися через постійний дефіцит поживних речовин, зростання швидкості обміну білків і втрату поживних речовин у кишечнику під час загострення захворювання або внаслідок лікування. Кортикостероїди збільшують чисту втрату білка в дітей [31] і дорослих [32] із ХК. І навпаки, застосування елементних або полімерних сумішей для лікування ХК або як засобу нутритивної підтримки призводить до зниження протеолізу й збільшення об’єму нежирової тканини в дітей і дорослих [33–35].
Моніторинг антропометричних показників дає зрозуміти, у яких пацієнтів розвивається відносний дефіцит нежирової маси і які отримають користь від нутритивної підтримки. Немає переконливих доказів того, що добова потреба в білках у пацієнтів із ЗЗК відрізняється від потреби в здорових осіб контрольної групи, але, як зазначено в інших документах, поганий апетит та обмежене харчування є звичайним явищем. У пацієнтів, які отримують стероїди і яким рекомендований голод для забезпечення спокою шлунково-кишкового тракту (ШКТ), ентеральне харчування (ЕХ) може мати сприятливий вплив на обмін білків у разі відсутності негативного впливу на перебіг захворювання.
Немає переконливих доказів того, що добова потреба в білках у пацієнтів із ЗЗК відрізняється від потреби здорових осіб контрольної групи. Отже, споживання 1 г білка на кожен кілограм маси тіла є доцільним. Однак при активному запаленні протеолітична катаболічна реакція обґрунтовує збільшення необхідного споживання до 1,2–1,5 г/кг маси тіла [36, 37].
Рекомендація 6
Пацієнтів із ЗЗК слід регулярно обстежувати на наявність дефіциту мікроелементів, а в разі його виявлення — належним чином коригувати відповідний дефіцит.
Клас рекомендацій GPP — високий консенсус (100% згода)
Коментар
Пацієнти із ЗЗК вразливі до дефіциту мікроелементів через втрату кишкової флори внаслідок діареї і недостатнє споживання їжі внаслідок анорексії, що супроводжують загострення захворювання. Для забезпечення належного збалансованого харчування разом із нутритивною підтримкою також слід пропонувати добавки з полівітамінами й мікроелементами.
При інтерпретації результатів аналізу крові на вміст мікроелементів і мікросумішей необхідно враховувати, що багато сироваткових показників або маркерів статусу є позитивними чи негативними реагентами гострої фази. Сироваткові рівні підвищуються або знижуються в межах запальної реакції, наприклад, при запаленні рівні феритину й міді збільшуються, а рівні фолату, селену й цинку зменшуються [38]. У світлі цього деякі автори дослідили споживання мікроелементів у пацієнтів, які перебувають у стадії клінічної ремісії захворювання, і виявили дефіцит різноманітних мікроелементів [39, 40]. Крім того, дефіцит може бути присутнім навіть у людей, які харчуються належним чином [41]. Ці спостереження підкреслюють необхідність рутинного моніторингу (можливо, щорічного) для виявлення дефіциту. Щоденне застосування дієтичних добавок із полівітамінами може виправити більшість видів дефіциту, але не є гарантією достатності навіть у разі тривалого застосування; залізо, цинк і вітамін D потребують спеціальних замісних схем [42]. Для призначення дієтичних добавок із полівітамінами характерне погане дотримання схеми лікування, особливо в підлітків, тому важливе значення має просвіта пацієнтів з обґрунтуванням застосування таких дієтичних добавок [43].
Наслідки порушення споживання мікроелементів включають анемію, порушення лінійного зростання й порушення стану кісткової тканини. Останні дослідження були присвячені вітаміну D; він і його рецептор можуть мати деякі імуномодулюючі властивості, що додатково підкреслює необхідність приділяти особливу увагу споживанню мікроелементів пацієнтами із ЗЗК (рекомендація 11).
Рекомендація 7A
Усім пацієнтам із ЗЗК у разі наявності залізодефіцитної анемії рекомендується додаткове вживання заліза з метою нормалізації рівня гемоглобіну й запасів заліза.
Клас рекомендацій A — високий консенсус (100% згода)
Рекомендація 7B
Пероральні препарати заліза слід вважати методом лікування першої лінії в пацієнтів із легкою анемією, захворювання яких клінічно неактивне, і в тих, хто раніше не мав непереносимості перорального заліза.
Клас рекомендацій A — високий консенсус (100% згода)
Рекомендація 7C
Внутрішньовенні препарати заліза слід вважати методом лікування першої лінії в пацієнтів із клінічно активним ЗЗК, пацієнтів, які раніше мали непереносимість перорального заліза, пацієнтів із рівнем гемоглобіну нижче від 100 г/л, а також у пацієнтів, які потребують застосування стимуляторів еритропоезу.
Клас рекомендацій A — високий консенсус (93% згода)
Коментар стосовно A/B/C
Анемія, яка вважається найчастішим позакишковим проявом ЗЗК, зазвичай ускладнює перебіг як ВК, так і ХК. Усіх пацієнтів із ЗЗК незалежно від віку слід обстежувати на наявність анемії [44]. Основними формами анемії при ЗЗК є залізодефіцитна анемія, анемія хронічного захворювання й анемія змішаного походження [заява ECCO стосовно анемії 1A] [44]. Діагностичні критерії дефіциту заліза залежать від ступеня запалення. Для лабораторного обстеження слід використовувати загальний аналіз крові, аналіз на сироватковий феритин та аналіз на С-реактивний білок [заява ECCO стосовно анемії 1B]. У пацієнтів у стані ремісії або з легким захворюванням аналізи слід виконувати кожні шість-дванадцять місяців. В амбулаторних пацієнтів із захворюванням у стадії загострення такі аналізи слід виконувати не рідше ніж кожні три місяці [заява ECCO стосовно анемії 1B]. У пацієнтів, які не мають клінічних, ендоскопічних або біохімічних ознак загострення захворювання, сироватковий рівень феритину < 30 мкг/л є надійним показником залізодефіцитної анемії. За наявності запалення рівень феритину в сироватці до 100 мкг/л все ще може вказувати на дефіцит заліза [заява ECCO стосовно анемії 1D]. У разі наявності біохімічних або клінічних ознак запалення діагностичними критеріями анемії хронічного захворювання є сироватковий рівень феритину > 100 мкг/л і насиченість трансферином < 20 %. Якщо сироватковий рівень феритину становить від 30 до 100 мкг/л, можлива комбінація справжнього дефіциту заліза й анемії хронічного захворювання [заява ECCO стосовно анемії 1E].
Незалежно від віку вживання препаратів заліза рекомендується всім пацієнтам із ЗЗК у разі наявності залізодефіцитної анемії [заява ECCO стосовно анемії 2A]. При коригуванні анемії якість життя покращується, і таке покращення не залежить від клінічної активності захворювання [45]. У керівництві Європейської організації з вивчення хвороби Крона та виразкового коліту (ECCO) [44] робиться висновок, що «в/в залізо є ефективнішим, забезпечує швидшу відповідь і краще переноситься, ніж пероральне залізо», і заявлено, що в/в залізо слід вважати препаратом першої лінії в пацієнтів із клінічно активним ЗЗК з рівнем гемоглобіну нижче за 100 г/л, у яких спостерігається непереносимість перорального заліза, і в пацієнтів, які потребують стимуляторів еритропоезу; тим часом як пероральне залізо може застосовуватися пацієнтами з легкою анемією, захворювання яких не є клінічно активним і які раніше не мали непереносимості перорального заліза [44]. Оцінка потреби в залізі зазвичай ґрунтується на вихідних значеннях гемоглобіну й маси тіла (табл. 1) [46].
/96.jpg)
Після успішного лікування залізодефіцитної анемії внутрішньовенними препаратами заліза необхідність у повторному лікуванні внутрішньовенним залізом виникає, як тільки сироватковий рівень феритину зменшиться нижче за 100 мкг/л або кількість гемоглобіну — нижче за 12 або 13 г/дл відповідно до статі [заява ECCO стосовно анемії 3E].
III. Рекомендації щодо харчування при загостренні захворювання (рис. 4, 5)
Рекомендація 8
Не існує «особливої дієти при ЗЗК», яку можна рекомендувати для сприяння ремісії пацієнтам із ЗЗК у стадії загострення.
Клас рекомендацій GPP — високий консенсус (96% згода)
Коментар
На цей час все ще бракує даних рандомізованих контрольованих досліджень (РКД) стосовно впливу експериментальних дієт, таких як вуглеводні, палеолітичні, безглютенові, дієти з низьким вмістом ферментованих оліго-, ди- і моносахаридів і поліолів (FODMAP), або дієт, збагачених ω-3 ПНЖК, на кишкове запалення або індукцію ремісії. РКД із належною потужністю, яке оцінювало фруктоолігосахариди, не показало клінічної користі в пацієнтів із ХК у стадії загострення [47]. Див. також рекомендацію 31. Отже, не існує «особливого перорального раціону харчування при ЗЗК», який можна рекомендувати для сприяння ремісії пацієнтам із ЗЗК у стадії загострення. Ця рекомендація не заважає застосовувати до пацієнтів із ЗЗК індивідуальний підхід у складанні дієтичних рекомендацій, виходячи з особистої ситуації, бажано за умови активної участі спеціаліста-дієтолога або спеціаліста з питань харчування в умовах багатопрофільного підходу.
Рекомендація 9A
У пацієнтів із ЗЗК з вираженою діареєю або єюностомією чи ілеостомією необхідно контролювати втрату рідини та рівень натрію в сечі й організувати належне надходження рідини (зменшити об’єм гіпотонічних розчинів і збільшити об’єм фізіологічних розчинів) з урахуванням харчової непереносимості, яка може посилити втрату рідини.
Клас рекомендацій 0 — високий консенсус (93% згода)
Рекомендація 9B
У разі постійних стом зі значною втратою рідини можуть знадобитися парентеральні інфузійні розчини (для поповнення рідини й електролітів).
Клас рекомендацій 0 — високий консенсус (96% згода)
Коментар стосовно A/B
Постійна чи тяжка діарея або стома з високим відтоком може призвести до кишкової недостатності [48] з порушенням всмоктування, незрозумілим зниженням маси тіла, мальнутрицією, дефіцитом поживних речовин і/або зневодненням. Порушення всмоктування є важливим фактором, що сприяє недоїданню при ЗЗК [49]. Ретроспективне дослідження Бейкера за участю 687 пацієнтів зі стомою [50] показало, що ранній високий відтік (протягом трьох тижнів) з ілеостоми є поширеним явищем, і хоча в 49 % випадків відбувається спонтанне реверсування, 51 % пацієнтів потребують постійного медикаментозного лікування, зазвичай через короткий залишок тонкої кишки. 71 % пацієнтів обмежено отримували пероральний гіпотонічний розчин, фізіологічний розчин із глюкозою і протидіарейний препарат, щоб відлучитись від парентеральних інфузій, а 8 % мусили продовжувати парентеральне або підшкірне застосування фізіологічного розчину в домашніх умовах. Певна користь домашнього лікування з обмеженням застосування пероральних розчинів і моніторингом вмісту натрію в сечі була підтверджена понад 35 років тому [51]. Під час дослідження за участю 13 дорослих пацієнтів з (ілеальною) стомою з високим відтоком застосування пероральних розчинів для регідратації, що містили рисові мальтодекстрини, мало сприятливий вплив на баланс натрію і калію. Зв’язок між збільшенням маси тіла й зниженням сироваткової концентрації реніну також свідчить про відновлення водного балансу [52]. В іншому дослідженні вивчали використання трьох різних фізіологічних розчинів і/або розчинів глюкози в шести пацієнтів з єюностомією. На підставі даних, отриманих від цієї невеликої групи, розчин електролітів і глюкози був визнаний оптимальною схемою заміщення натрію в пацієнтів зі стомою з високим викидом [53]. РКД, які б вивчали дієтотерапію в лікуванні діареї, пов’язаної із ЗЗК або стомою з високим викидом, не проводились. На сьогодні опубліковані лише дослідження конкретних випадків лікування ХК у пацієнтів зі стомою з високим викидом, у яких було відзначено ефективність лікування з обмеженням гіпотонічних розчинів, застосування дієт, збагачених натрієм, виключного ентерального харчування і/або парентеральних інфузійних розчинів, що містили натрій.
Рекомендація 10
Пацієнтам із ХК із кишковими стриктурами або стенозом у поєднанні з обструктивними симптомами може бути рекомендована дієта з модифікованою текстурою або дистальне (постстенозне) ЕХ.
Клас рекомендацій GPP — високий консенсус (95% згода)
Коментар
Залежно від ступеня тяжкості (ступеня непрохідності) і місця кишкової стриктури пацієнти потребують нутритивної підтримки, поки очікуються ефекти лікування. Таке лікування може бути медикаментозним (із використанням лікарських засобів) у ситуаціях, коли звуження здебільшого є наслідком запалення, або механічним (шляхом балонної дилатації або хірургічного втручання), якщо присутні фіброзні рубці. Пацієнтам із безсимптомним стенозом кишечника, виявленим за допомогою рентгенографії, прийнято рекомендувати модифіковану дієту з низьким вмістом нерозчинної клітковини, але немає надійних даних, які підтверджують цей очевидно логічний підхід. У разі наявності симптомів може знадобитися вживання їжі м’якої консистенції, можливо, застосування розчинів поживних речовин.
Кишковий фіброз є загальною ознакою ХК і може проявлятися як стриктура, стеноз або кишкова непрохідність. Стенозуюча ХК призводить до значного погіршення якості життя уражених пацієнтів і зумовлює складнощі в лікуванні. Нещодавно проведене китайське проспективне спостережне дослідження за участю 59 дорослих пацієнтів із ХК із запальними стриктурами кишечника показало, що застосування виключного ЕХ протягом 12 тижнів може ефективно зняти запальні стриктури кишечника, причому 81,4 % досягли симптоматичної ремісії, 35 пацієнтів (53,8 %) — рентгенологічної ремісії, а 42 пацієнти (64,6 %) — клінічної ремісії [54]. Хоча зазвичай рекомендується модифікований раціон харчування зі зміненою консистенцією, переважно розчини поживних речовин, принаймні в пацієнтів зі стенозом (проксимального) відділу кишечника й обструктивними симптомами, виявленими за допомогою рентгенографії, або, у відповідних випадках, дистальне ЕХ, немає надійних даних, що підтверджують цей очевидно логічний підхід.
Рекомендація 11
У пацієнтів із ЗЗК (дорослих і дітей) у стадії загострення і тих, хто отримує стероїди, слід контролювати рівні сироваткового кальцію і 25(ОН)-вітаміну D і в разі потреби призначати відповідне додаткове споживання вітаміну D, щоб запобігти зниженню мінеральної щільності кісткової тканини. Остеопенію та остеопороз слід коригувати відповідно до чинних керівництв з остеопорозу.
Клас рекомендацій B — високий консенсус (96% згода)
Коментар
Значними факторами ризику зниження мінеральної щільності кісткової тканини, дослідженими в дорослих із ЗЗК (n = 116 і n = 205), є низький сироватковий вміст вітаміну D, чоловіча стать, монголоїдна раса, ХК, низький індекс маси тіла (ІМТ) і використання кортикостероїдів, тим часом як консенсус щодо впливу віку, у тому числі при встановленні діагнозу, не був досягнутий [55, 56]. У дітей і підлітків факторами ризику ЗЗК, пов’язаними зі зниженням мінеральної щільності кісткової тканини, є кумулятивна доза кортикостероїдів, індекс Z (співвідношення зросту/віку) та індекс Z ІМТ [57].
Загальний консенсус щодо статусу вітаміну D і необхідних заходів для дітей і підлітків із ЗЗК відсутній. У РКД за участю 132 дорослих пацієнтів з остеопенічною ХК спостерігалось збільшення мінеральної щільності кісткової тканини в поперековому відділі хребта після двох років застосування ризедронату 35 мг двічі на тиждень разом із добавками з кальцієм і вітаміном D [58]. У попередньому РКД при застосуванні лише дієтичних добавок із кальцієм (1 г на добу) не було відзначено суттєвого корисного впливу на мінеральну щільність кісткової тканини через один рік у пацієнтів із ЗЗК та остеопорозом, які отримували кортикостероїди [59]. При ЗЗК рекомендується оцінка дефіциту вітаміну D і забезпечення отримання належної кількості кальцію і вітаміну D, особливо в пацієнтів із ЗЗК, які отримують стероїди. Обмеження використання кортикостероїдів допомагає запобігти зниженню мінеральної щільності кісткової тканини.
Рекомендація 12A
Пацієнти із ХК, які отримують секвестранти, такі як холестирамін, піддаються мінімальному додатковому ризику порушення всмоктування жирів, тому не потребують зміни дієтотерапії порівняно з іншими пацієнтами з ХК.
Клас рекомендацій GPP — консенсус (86% згода)
Рекомендація 12B
Пацієнти із ЗЗК з гіпероксалурією також часто мають порушення всмоктування жирів, тому цим пацієнтам слід надати відповідну консультацію.
Клас рекомендацій GPP — консенсус (88% згода)
Коментар стосовно A/B
Поширеними причинами порушення всмоктування жовчних кислот при ХК є резекція клубової кишки й запалення термінального відділу клубової кишки. Зменшення повторного всмоктування кон’югованих жовчних кислот призводить до надлишкового їх надходження до товстої кишки, де відбувається декон’югація під впливом бактерій. Унаслідок цього можуть виникнути осмотична діарея і (при тяжкому порушенні всмоктування жовчних кислот) порушення всмоктування жирів [60]. Хологенну діарею можна контролювати за допомогою секвестрантів жовчних кислот, наприклад холестираміну [61, 62]. У подвійному сліпому перехресному дослідженні за участю 14 пацієнтів із ХК, які перенесли резекцію клубової кишки, не спостерігалося негативного впливу холестираміну на всмоктування жирів у порожній кишці. Однак у тяжких випадках порушення всмоктування жовчних кислот наявна стеаторея, яка може погіршуватися внаслідок лікування холестираміном [63].
Ентеральна (вторинна) гіпероксалурія (із підвищеним ризиком виникнення каменів у нирках) виникає при тяжкій ХК тонкої кишки, пов’язаній із порушенням всмоктування жирів і послідовним збільшенням всмоктування оксалатів у кишечнику. Після резекції клубової кишки може виникнути ентеральна гіпероксалурія. Наявність товстої кишки є важливим фактором, оскільки оксалат залишається доступним для всмоктування в товстій кишці внаслідок супутнього порушення всмоктування жирів і зв’язування кальцію [64]. Екскреція оксалатів із сечею корелює з екскрецією жирів, що спостерігалось в одному дослідженні в пацієнтів із ХК, які перенесли кишкову резекцію. Збільшення дієтичного споживання жирів у таких пацієнтів ще більше посилює сечову екскрецію оксалатів [65]. Значно нижчі середні значення екскреції оксалатів із сечею частіше спостерігались у дітей, ніж у дорослих із ХК [66]. Причиною цього може бути коротша тривалість ХК, що зазвичай також передбачає меншу кількість процедур кишкової резекції. Це означає, що пацієнтам із гіпероксалурією слід рекомендувати раціон харчування з низьким вмістом жирів та оксалатів і високим вмістом кальцію. Обмеження дієтичного споживання оксалатів (переважно чаїв і фруктів) видається обґрунтованим лише для пацієнтів із рецидивом утворення каменів у сечовивідних шляхах.
Рекомендація 13
Дієти з виключенням певних харчових продуктів не можна рекомендувати для досягнення ремісії при загостренні ХК, навіть якщо пацієнт страждає від індивідуальної непереносимості.
Клас рекомендацій GPP — високий консенсус (96% згода)
Коментар
Систематичне опитування не надало достатньо доказів, щоб сформулювати чіткі рекомендації щодо застосування дієт із виключенням певних харчових продуктів як індукційної терапії. Іноді дієти з виключенням певних харчових продуктів використовуються для полегшення симптомів [67], але лише деякі неконтрольовані дослідження повідомляють про індукцію ремісії [68, 69].
У РКД спостерігалась триваліша підтримка ремісії (після успішної індукції ремісії за допомогою елементної суміші) у пацієнтів, яким була призначена ступінчаста програма харчування, що виключала харчові продукти, які погіршували симптоми, порівняно з пацієнтами, які отримували кортикостероїди за схемою з поступовим зниженням дози під час дотримання звичайного раціону харчування [70]. Подібні результати щодо підтримки ремісії були зареєстровані у відкритому дослідженні, проведеному тією самою групою, що застосовувала індивідуальну дієту з виключенням певних харчових продуктів [71]. В іншому дослідженні повідомлялось про підтримку клінічної ремісії з використанням дієти з виключенням певних харчових продуктів із контролем IgG4 у дорослих із ХК [72].
Дієти з виключенням певних харчових продуктів є трудомісткими для персоналу й складними, тяжкими й часто неприємними для пацієнтів. Систематичне опитування не виявило жодних доказів того, що дієти з виключенням певних харчових продуктів небезпечні при застосуванні під наглядом лікаря. Докази того, що вони сприяють дефіциту поживних речовин, відсутні. Проте рекомендується ретельно контролювати потенційні дефіцити, які можуть бути результатом будь-якого конкретного набору виключень.
Рекомендація 14A
Можливість пробіотичної терапії із застосуванням штаму Lactobacillus reuteri або VSL#3*, але не обов’язково інших пробіотиків, можна розглянути для застосування в пацієнтів із легким і помірним ВК із метою індукції ремісії.
Клас рекомендацій 0 — високий консенсус (92% згода)
Рекомендація 14B
Пробіотики не слід застосовувати для лікування ХК у стадії загострення.
Клас рекомендацій B — високий консенсус (95% згода)
Коментар стосовно A/B
У двох клінічних випробуваннях за участю дітей із ВК спостерігався помірний ефект ректальної клізми, що містила Lactobacillus reuteri, при легкому дистальному ВК [73], і перорального препарату, раніше відомого під назвою VSL#3, при ВК у стадії загострення [74].
Систематичне опитування показало, що пробіотики зазвичай неефективні при ХК у стадії загострення.
IV. Лікувальне харчування при ЗЗК у стадії загострення (рис. 6, 7)
Рекомендація 15A
Пероральне додаткове харчування (ПДХ) є першим вибором, коли пацієнтам із ЗЗК призначають лікувальне харчування, але загалом воно являє собою незначну підтримувальну терапію, що використовується додатково до звичайної їжі.
Клас рекомендацій 0 — високий консенсус (92% згода)
Рекомендація 15B
Якщо перорального харчування недостатньо, слід розглянути можливість призначення ЕХ як підтримувальної терапії. Зазвичай слід віддавати перевагу ЕХ з використанням сумішей або розчинів перед ПХ у разі відсутності очевидних протипоказань.
Клас рекомендацій A — високий консенсус (100% згода)
Рекомендація 15C
ПХ призначене для пацієнтів із ЗЗК, (i) коли пероральне харчування або ЕХ не зовсім можливе (наприклад, у разі дисфункції ШКТ або короткої кишки при ХК), (ii) коли присутня непрохідність кишечника, при якій немає можливості розміщення зонда для штучного годування поза межами непрохідності, або в разі, коли таке розміщення не було успішним, або (iii) коли виникають інші ускладнення, такі як неспроможність анастомозу або кишкова фістула з високим викидом.
Клас рекомендацій B — високий консенсус (96% згода)
Коментар стосовно A/B/C
Рішення щодо оптимального шляху лікувального харчування при ЗЗК може бути складним і охоплювати декілька аспектів, включно зі здатністю пацієнта їсти, всмоктувальною здатністю ШКТ, нутритивним статусом пацієнта і цілями терапії. Пероральне додаткове харчування є першим вибором, але загалом воно являє собою незначущу підтримувальну терапію, яка використовується додатково до звичайної їжі. За допомогою ПХД можна досягти додаткового споживання до 600 ккал/добу без порушення нормального споживання їжі в дорослих. Якщо перорального харчування недостатньо, слід розглянути можливість годування пацієнта через назогастральний або назоентеральний зонд. Можливість ЕХ можна розглянути в пацієнтів із функціонуючим шлунково-кишковим трактом, які не здатні безпечно ковтати їжу [75, 76]. У ситуаціях, коли кишечник не може всмоктувати всі харчові продукти, слід намагатися застосовувати ЕХ із призначенням додаткового ПХ [41, 77, 78]. ПХ призначають у разі непрохідності кишечника, при якій немає можливості розмістити зонд для штучного годування поза межами непрохідності, або в разі, коли таке розміщення не було успішним. Воно необхідне пацієнтам із короткою петлею, що призводить до серйозного порушення всмоктування поживних речовин і/або втрати рідини й електролітів, які не вдається коригувати ентеральним шляхом. ПХ також показане у випадках хірургічного втручання, як зазначено вище, і в будь-якого пацієнта, у якого існує непереносимість ЕХ або харчування не може підтримуватися ентеральним шляхом [79]. Однак слід визнати, що такі пацієнти, які потребують ПХ, — це пацієнти з найскладнішим захворюванням [80].
/100.jpg)
Рекомендація 16
Виключне ЕХ є ефективним і рекомендується як лікування першої лінії для індукції ремісії в дітей і підлітків із ХК у стадії загострення.
Клас рекомендацій B — високий консенсус (92% згода)
Коментар
У всіх пацієнтів із ХК у стадії загострення слід зважити можливість призначення початкової дієтотерапії у формі виключного ЕХ. Це метод першого вибору в пацієнтів групи високого ризику, зумовленого альтернативною терапією, такою як стероїди. Попередні метааналізи показували перевагу кортикостероїдів перед виключним ЕХ в індукції ремісії в дорослих. Аргументи на користь виключного ЕХ є більш переконливими для пацієнтів дитячого віку, і зазвичай воно є першим вибором у багатьох центрах. По-перше, це зумовлене згубним впливом мальнутриції на зростання. По-друге, оскільки зростання настільки важливе для дітей, це збільшує можливість уникнути використання стероїдів або затримати їх призначення, що має першорядне значення. По-третє, і найголовніше, у педіатричних дослідженнях спостерігався вплив на індукцію ремісії, що свідчить про аналогічну ефективність стероїдів і виключного ЕХ [81], а також про те, що в дітей у деяких умовах (тобто при супутньому імуномодулюючому лікуванні) виключне ЕХ може навіть бути ефективнішим за кортикостероїди [82]. Однак ці дослідження мають методологічні обмеження. Рекомендації для дітей складаються лише з виключного ЕХ, оскільки обмежені дані дозволяють припустити, що часткове ЕХ може бути менш ефективним [60], хоча одне РКД виявило схожу ефективність [83]. Для дорослих дані менш переконливі, тому більшість центрів продовжуватимуть використовувати стероїди (чи біологічні препарати) як терапію першої лінії в разі відсутності очевидних протипоказань. Однак характеристики пацієнта й особливості захворювання теж сприяють прийняттю терапевтичних рішень, що також робить ЕХ терапією першої лінії в деяких дорослих пацієнтів із гострою ХК [84]. Слід віддавати перевагу ЕХ, оскільки не було встановлено, що ПХ забезпечує будь-яку перевагу при ХК, тому його слід використовувати лише для покращання нутритивного статусу перед хірургічним втручанням і в разі неможливості інших способів харчування [85].
Рекомендація 17A
У пацієнтів із ЗЗК для ЕХ можуть використовуватись назальні зонди або черезшкірний доступ.
Клас рекомендацій B — високий консенсус (96% згода)
Рекомендація 17B
ЕХ при ХК слід вводити через ентеральний насос для годування.
Клас рекомендацій B — високий консенсус (92% згода)
Коментар стосовно A/B
ЕХ можна безпечно доставляти за допомогою назогастрального зонда або черезшкірної ендоскопічної гастростоми [86–88]. Постійне ЕХ, яке вводиться через ентеральний насос для годування, і повільне збільшення до повного призначеного обсягу супроводжується нижчою частотою ускладнень, ніж болюсне введення [86–89]. Найчастішими при ЕХ є механічні (пов’язані із зондом), метаболічні й інфекційні ускладнення, але вони суттєво не відрізняються від тих, що спостерігаються при інших хронічних станах [88, 89].
Мало хто з пацієнтів із ВК потребуватиме ЕХ або ПХ, окрім як у період найбільш тяжких загострень і в періопераційний період. При гострому ВК ЕХ є найбільш доцільним і асоціюється зі значно нижчою частотою ускладнень, ніж ПХ. Лікувальне голодування шляхом внутрішньовенного харчування не має впливу на результат, проте специфічні протипоказання до застосування ПХ при ВК відсутні.
При ХК частіше потрібна нутритивна підтримка. Не існує протипоказань до застосування ПХ у пацієнтів із ХК порівняно з іншими захворюваннями, і відповідно до його очікуваної тривалості може бути обраний центральний або периферичний шлях. Немає достатньої кількості даних, щоб рекомендувати використання конкретних субстратів у складі ПХ при ХК. Однак необхідно пристосувати ПХ до потреб пацієнта. ПХ, особливо в домашніх умовах, слід розглядати як додаткове невиключне харчування, яке може бути скорочене до мінімального рівня після досягнення достатнього відновлення композиційного складу тіла.
Рекомендація 18A
Можна застосовувати стандартне ЕХ (полімерні суміші, помірний вміст жирів, відсутність специфічних добавок) для початкової і підтримувальної дієтотерапії при ЗЗК у стадії загострення.
Клас рекомендацій 0 — високий консенсус (96% згода)
Рекомендація 18B
При застосуванні ЕХ або ПХ у пацієнтів із ЗЗК не рекомендуються певні суміші або субстрати (наприклад, глютамін, n-3 жирні кислоти).
Клас рекомендацій B — високий консенсус (96% згода)
Коментар стосовно A/B
Кілька досліджень порівнювали ефективність різних типів ентеральних сумішей (елементних, напівелементних, олігомерних або полімерних) у веденні ХК у стадії загострення. Кокранівський метааналіз десяти випробувань не показав статистично значущої різниці між пацієнтами, які отримували елементну (n = 188) і неелементну суміш (напівелементну або полімерну; n = 146) [90]. Схоже, що білковий склад не впливає на терапевтичний потенціал ЕХ. Цей консенсус не виявив достатньо доказів, щоб надати чіткі рекомендації [90, 91]. Тому при призначенні початкової дієтотерапії рекомендується застосовувати стандартні харчові суміші.
Використання сумішей, доповнених факторами росту, із меншим рівнем емульгуючих речовин або олігомерних сумішей як альтернативи стандартним сумішам не обґрунтоване надійними даними. Водночас відсутні докази того, що будь-яка з цих альтернатив поступається за ефективністю стандартним полімерним сумішам [92].
Немає достатньої кількості даних, щоб рекомендувати використання конкретних субстратів у складі ПХ при ХК. Однак необхідно пристосувати ПХ до потреб пацієнта.
Рекомендація 19
З метою мінімізації ризику тромбоемболії в пацієнтів із ХК слід докласти всіх зусиль, щоб уникнути зневоднення.
Клас рекомендацій GPP — високий консенсус (100% згода)
Коментар
Хоча даних для призначення рутинної антикоагуляції недостатньо, можливість її призначення слід розглянути для всіх пацієнтів із ЗЗК, особливо для тих, які застосовують ПХ, докладаючи всіх зусиль, щоб уникнути зневоднення [93–97].
Рекомендація 20A
Пацієнти з ХК із дистальною фістулою (у нижніх відділах клубової або товстої кишки) і низьким викидом можуть отримувати нутритивну підтримку за допомогою ентерального шляху (харчові продукти).
Клас рекомендацій 0 — високий консенсус (100% згода)
Рекомендація 20B
Пацієнти з ХК із проксимальною фістулою і/або дуже високим викидом мають отримувати нутритивну підтримку шляхом часткового або виключного ПХ.
Клас рекомендацій B — високий консенсус (96% згода)
Коментар стосовно A/B
Пацієнти з ХК схильні до утворення фістул між двома ділянками кишечника або в ділянці від кишечника до іншого органа (особливо шкіри, сечового міхура й піхви). Більшість фістул виникають після хірургічного втручання. Було встановлено, що в хірургічних пацієнтів рання нутритивна підтримка, незалежно від способу введення, зменшує частоту виникнення й ступінь тяжкості фістул [84, 98, 99]. Мальнутриція з ІМТ < 20 кг/м2 виявляється незалежним фактором ризику [100].
Лікування кишкових фістул є досить складним, залежить від локалізації, масштабу й характеру симптомів і вимагає участі багатопрофільної групи, до якої входять гастроентеролог, хірург і дієтолог [99]. Пацієнти з дистальною фістулою (у нижніх відділах клубової або товстої кишки) можуть отримувати нутритивну підтримку за допомогою ентерального харчування [101–103]. У пацієнта з проксимальною фістулою і/або дуже високим викидом стан можна коригувати шляхом переведення на лікувальне голодування та повне ПХ [104, 105], але навіть тоді психологічна користь вживання їжі може бути підставою для його включення до складу дієтотерапії, незважаючи на мінімальні очікування щодо отримання поживних речовин [102]. У разі оптимізації нутритивного статусу перед операцією ймовірність успіху хірургічного втручання зростає [106].
Рекомендація 21
Якщо в пацієнтів із ХК харчова депривація триває протягом багатьох днів, застосування стандартних запобіжних заходів і заходів для уникнення розвитку синдрому відновленого годування є обов’язковим, особливо щодо рівнів фосфату й тіаміну.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар
Синдром відновленого годування не має стати проблемою для пацієнта із ЗЗК, який отримує належний догляд, проте нерідко має місце ситуація, коли харчова депривація продовжується протягом тривалого часу, отже, ця проблема є актуальною. Стандартні заходи безпеки й втручання є обов’язковими для цих пацієнтів із високим ризиком, особливо стосовно фосфату й тіаміну [107–109].
Рекомендація 22A
ЕХ є безпечним і, згідно зі стандартним підходом до лікувального харчування, може бути рекомендоване пацієнтам із тяжким ВК як підтримувальна терапія.
Клас рекомендацій GPP — високий консенсус (100% згода)
Рекомендація 22B
У разі відсутності кишкової недостатності не слід призначати ПХ пацієнтам із ВК.
Клас рекомендацій 0 — консенсус (88% згода)
Коментар стосовно A/B
ЕХ не було належним чином досліджене в пацієнтів із гострим ВК. Однак у пацієнтів із тяжким перебігом захворювання його застосування видається безпечним і може забезпечити належне отримання поживних речовин [110]. Його ефективність потребує перевірки в додаткових дослідженнях за участю великих когорт пацієнтів.
ПХ рекомендується пацієнтам, які страждають від мальнутриції, і пацієнтам із тяжким захворюванням, лише коли вони не здатні переносити ЕХ або не можуть ефективно харчуватися ні перорально, ні через ентеральний зонд [110–112].
V. Хірургічні аспекти харчування при ЗЗК (рис. 8, 9)
Рекомендація 23A
У більшості випадків планової хірургії доопераційне голодування з опівночі не показане, натомість можна використовувати протокол прискореної реабілітації після операції (ERAS).
Клас рекомендацій B, див. керівництво ESPEN стосовно хірургічного втручання [113] — високий консенсус (100% згода)
Коментар
ESPEN підготувала керівництво щодо харчування хірургічних пацієнтів [113], і більшість принципів однаковою мірою поширюються і на пацієнтів із ЗЗК, які перенесли хірургічне втручання. Інші рекомендації стосуються періопераційного періоду. З точки зору метаболізму й харчування до ключових аспектів періопераційної допомоги належать:
— уникнення тривалого періопераційного голодування;
— відновлення перорального годування якомога швидше після операції;
— інтеграція харчування в загальний процес ведення пацієнта;
— метаболічний контроль, тобто контроль рівня глюкози в крові;
— зниження впливу факторів, що посилюють катаболізм, пов’язаний зі стресом, або погіршують роботу ШКТ;
— рання мобілізація для полегшення синтезу білка та функцій м’язів.
Рекомендація 23B
У пацієнтів відділення невідкладної хірургії лікувальне харчування (ЕХ, ПХ) слід розпочинати, якщо пацієнт вже страждав від мальнутриції на момент проведення операції або якщо пероральне харчування не може бути відновлене протягом 7 днів після операції.
Клас рекомендацій B, див. керівництво ESPEN стосовно хірургічного втручання [113] — високий консенсус (88% згода)
Коментар
Нутритивна підтримка показана пацієнтам, які страждають від мальнутриції, і навіть пацієнтам без істотного недоїдання, якщо очікується, що пацієнт не зможе їсти понад сім днів після операції. Вона також показана пацієнтам, які понад десять днів не можуть отримувати перорально понад 60–75 % від рекомендованого споживання. У таких ситуаціях рекомендується негайно призначити нутритивну підтримку (бажано ентеральним шляхом).
Рекомендація 24A
Пацієнтів, які не задовольняють своїх потреб в енергії і/або білках шляхом споживання звичайної їжі, слід заохочувати приймати пероральне додаткове харчування у періопераційний період.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар
Недостатнє доопераційне споживання є показанням до консультування з питань харчування або застосування ПДХ, оскільки, як зазначили Kuppinger і співавт. [114], у пацієнтів, які перенесли хірургічну операцію на черевній порожнині, зменшення споживання перед госпіталізацією є незалежним фактором ризику післяопераційних ускладнень. У двадцяти чотирьох дослідженнях щодо застосування ПДХ та ЕХ повідомлялося про значні переваги ЕХ, зокрема щодо зменшення інфекційних ускладнень, тривалості перебування в лікарні та витрат. У шести РКД вивчали післяопераційне й післялікарняне застосування ПДХ [115–119]. Наявні дані не свідчать із достатнім ступенем впевненості про те, що рутинне застосування покращує результати, але вони вказують на користь з точки зору нутритивного статусу, частоти незначних ускладнень, добробуту й якості життя пацієнтів, які не можуть задовольнити свої харчові потреби від споживання звичайної їжі в домашніх умовах.
Рекомендація 24B
Пацієнти, які не задовольняють своїх потреб в енергії і/або білках шляхом споживання звичайної їжі та ПДХ, мають отримувати ЕХ у періопераційний період.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар
Як зазначено вище, недостатнє доопераційне споживання їжі впливає на частоту ускладнень. Тому якщо пероральне харчування є недостатнім, слід розпочати ЕХ незалежно від втручання (перорального харчування або ПДХ) [113]. У післяопераційний період слід продовжити/розпочати ЕХ, оскільки багато досліджень показали перевагу й доцільність годування через зонд, як вставлений дистально від анастомозу, наприклад голкову катетерну єюностому, так і вставлений через ніс із кінчиком, пропущеним дистально, під час операції (назоєюнеальний зонд) [120–125].
Рекомендація 24C
У разі виявлення мальнутриції слід відкласти хірургічну операцію з приводу ЗЗК на 7–14 днів (якщо це можливо) і використати цей час на інтенсивне лікувальне харчування.
Клас рекомендацій A, див. керівництво ESPEN стосовно хірургічного втручання [113] — високий консенсус (96% згода)
Коментар
Неповноцінне харчування має негативний вплив на клінічний перебіг, частоту післяопераційних ускладнень і підвищує ризик смертності [126–131]. Тому пацієнти із серйозним нутритивним ризиком отримають користь від дієтотерапії до проведення серйозних операцій, навіть якщо операція має бути відкладена. «Серйозний нутритивний ризик» був визначений робочою групою ESPEN (2006) як наявність хоча б одного з таких критеріїв:
— втрата маси тіла > 10–15 % протягом шести місяців;
— ІМТ < 18,5 кг/м2;
— рівень сироваткового альбуміну < 30 г/л (без ознак печінкової або ниркової дисфункції).
Рекомендація 25A
Слід завжди віддавати перевагу ЕХ перед парентеральним шляхом, але можливість поєднання ЕХ і ПХ слід розглянути в пацієнтів, яким показана нутритивна підтримка й у яких > 60 % енергетичних потреб не можуть бути задоволені ентеральним шляхом.
Клас рекомендацій A, див. керівництво ESPEN стосовно хірургічного втручання [113] — високий консенсус (100% згода)
Рекомендація 25B
У пацієнтів із ЗЗК ПХ у періопераційний період зазвичай слід застосовувати додатково до ЕХ.
Клас рекомендацій B — високий консенсус (96% згода)
Рекомендація 25C
ПХ слід застосовувати як єдине втручання, якщо ЕХ неможливе (відсутність доступу, сильне блювання або діарея) або протипоказане (обструкція кишечника або кишкова непрохідність, сильний шок, кишкова ішемія).
Клас рекомендацій A — високий консенсус (96% згода)
Коментар стосовно A/B/C
Завжди слід віддавати перевагу ентеральному шляху, за винятком випадків, коли присутнє одне або більше з таких протипоказань:
— обструкція кишечника або кишкова непрохідність;
— тяжкий шок;
— кишкова ішемія;
— фістула з високим викидом;
— тяжка кишкова кровотеча.
У цих випадках ПХ може потребуватись протягом декількох днів або тижнів, поки не відновиться функція шлунково-кишкового тракту. Для отримання додаткової інформації див. керівництво ESPEN з дієтичного харчування хірургічних пацієнтів [113].
Рекомендація 26A
Хірургічні пацієнти з ХК мають отримати ранню нутритивну підтримку, оскільки, незалежно від способу введення, це зменшує ризик післяопераційних ускладнень.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар
Переваги призначення ЕХ протягом 24 годин після операції порівняно з більш пізнім початком були відзначені у двох метааналізах (один систематичний кокранівський огляд) [132, 133].
Рекомендація 26B
У пацієнтів із ХК з тривалою шлунково-кишковою недостатністю (наприклад, у пацієнтів, у яких після резекції утворився короткий кишечник) ПХ є обов’язковим і рятує життя, принаймні на ранніх стадіях кишкової недостатності.
Клас рекомендацій B, див. керівництво ESPEN стосовно хірургічного втручання [113] — високий консенсус (92% згода)
Коментар стосовно A/B
Незважаючи на те, що ЕХ найбільш корисне майже для всіх груп пацієнтів, порівняно рідко його достатньо при гострій кишковій недостатності/зовнішніх кишкових фістулах через порушення цілісності шлунково-кишкового тракту. Тому ПХ часто є основним варіантом, окремо або в поєднанні з ЕХ (допоміжне ПХ) [72].
Рекомендація 27A
У більшості пацієнтів із ЗЗК нормальне споживання їжі або ЕХ можна розпочати відразу після операції.
Клас рекомендацій 0, див. керівництво ESPEN стосовно хірургічного втручання — високий консенсус (100% згода)
Рекомендація 27 B
Для забезпечення гемодинамічної стабільності воду й електроліти вводять відразу після проктоколектомії або колектомії.
Клас рекомендацій A, див. керівництво ESPEN стосовно хірургічного втручання [113] — високий консенсус (96% згода)
Коментар стосовно A/B
Як зазначено в керівництві щодо хірургічного втручання [113], нормальне споживання їжі або ЕХ на ранньому етапі, включно з прозорими розчинами в перший або другий післяопераційний день, не має негативного впливу на загоєння анастомозів у товстій або прямій кишці й призводить до значного скорочення тривалості перебування в лікарні. На цьому наголошувалося в кокранівському систематичному огляді [129]. Недавні метааналізи [133–135] вказують на значні переваги щодо післяопераційного одужання й частоти інфекцій. Раннє післяопераційне харчування асоціюється зі значним зменшенням загальної частоти ускладнень порівняно з традиційними методами післяопераційного харчування й не має негативного впливу на такі показники, як смертність, неспроможність анастомозу, відновлення роботи кишечника або тривалість перебування в лікарні [135].
V. Рекомендації щодо харчування в період ремісії (рис. 10, 11)
Рекомендація 28
Усі пацієнти із ЗЗК у стадії ремісії мають отримати консультацію дієтолога в рамках багатопрофільного підходу, щоб вдосконалити дієтотерапію та уникнути мальнутриції і порушень, пов’язаних із харчуванням.
Клас рекомендацій GPP — високий консенсус (100% згода)
Коментар
Оригінальні дані в цій галузі дуже обмежені, але щонайменше дев’ять статей містять заяви, які вказують на те, що може бути корисним внесок лікаря-дієтолога у лікуванні ЗЗК у дорослих і дітей; доказова база недостатня. Дефіцит поживних речовин, очевидно, є більш імовірним у пацієнтів із ХК, що вражає тонку кишку, ніж у пацієнтів з ізольованою хворобою товстої кишки або ВК, але останні також можуть бути вразливими [102]. У багатьох європейських країнах оцінку нутритивного статусу визнали обов’язковим компонентом ведення шлунково-кишкових захворювань, а сьогодні всім пацієнтам із ЗЗК рекомендується звертатися до дієтолога, який має досвід ведення таких пацієнтів.
Рекомендація 29
Під час ремісії ЗЗК немає необхідності дотримуватися особливої дієти.
Клас рекомендацій 0 — високий консенсус (96% згода)
Коментар
Загалом під час ремісії немає необхідності дотримуватися особливої дієти. Жоден з альтернативних раціонів харчування або напіввиключних раціонів харчування не є ефективним для досягнення ремісії. Однак у пацієнтів із ЗЗК часто спостерігаються випадки індивідуальної харчової непереносимості, наприклад, лактози й молочних продуктів, спецій, зелені, смаженої їжі, продуктів, що провокують утворення кишкових газів, і продуктів, багатих на клітковину [136–139].
/106.jpg)
Пацієнти з ХК зазвичай обирають раціон харчування з низьким вмістом клітковини й овочів, який часто містить недостатньо калорій та асоціюється з різними видами дефіциту мікроелементів [40]. Набутий дефіцит лактази особливо поширений у пацієнтів з проксимальною ХК і вимагає дієти з обмеженим вмістом лактози. Прихильники дієт з виключенням певних харчових продуктів вважають їх ефективними, але для досягнення найкращих результатів пропонується підібрати раціон харчування для конкретного пацієнта, щоб уникнути розвитку індивідуальної харчової непереносимості. Така стратегія ускладнює узагальнення даних, і сьогодні бракує сучасних досліджень дієт із виключенням певних харчових продуктів. Обмежені дані контрольованих досліджень обґрунтовують виключення лактози, молочних продуктів взагалі, спецій, трав, смаженої їжі, газоутворювальних і багатих на клітковину продуктів, але лише в разі поганої переносимості. Очікується, що їх виключення допоможе в подовженні тривалості ремісії [140]. Інші дослідження достатньої якості також передбачали зміну раціону харчування, але разом із використанням дієтичних добавок; ці дослідження розглядаються в наступних розділах. Застосування виключного ЕХ вочевидь є крайнім варіантом дієти з виключенням певних харчових продуктів.
Вважається, що ЕХ відіграє певну роль у запобіганні рецидиву в дітей з неактивною ХК [77, 90, 141, 142], і цей ефект також спостерігався в японському дослідженні дорослих пацієнтів із ХК [143–145]. За результатами спостереження за участю 145 пацієнтів із ХК (у яких ремісія була індукована з використанням повного ПХ) Esaki і співавт. [146] дійшли висновку, що в пацієнтів з ураженням тонкої кишки при застосуванні елементних/полімерних сумішей ризик рецидиву був меншим порівняно з пацієнтами з ураженням товстої кишки. Однак систематичне опитування показало, що загальне використання елементного ЕХ неефективне для підтримки ремісії при ХК. Отже, таке лікування не рекомендується. Експертна група вважає це суперечливим висновком, особливо з огляду на попередній висновок кокранівського аналізу стосовно того, що постійне ЕХ може сприяти підтримці ремісії та зменшенню використання кортикостероїдів при ХК [86, 146]. Тому не може бути сформульовано остаточних рекомендацій.
Рекомендація 30
Не слід рекомендувати використання дієтичних добавок з омега-3 жирними кислотами для підтримки ремісії в пацієнтів із ЗЗК.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар
Систематичні огляди містять висновки, що доповнення раціону харчування омега-3 поліненасиченими жирними кислотами є неефективним у підтримці ремісії пацієнтів із ВК [147, 149]. Тому таке лікування не рекомендується. Наведені вище дані були отримані під час обстеження дорослих. Екстраполяція висновків на педіатричну практику є доцільною. В останньому кокранівському огляді [149] було зроблено висновок, що омега-3 жирні кислоти неефективні для підтримки ремісії при ХК.
Рекомендація 31
Неспецифічні дієти з високим вмістом харчових волокон зазвичай не рекомендуються для підтримки ремісії при ЗЗК.
Клас рекомендацій 0 — високий консенсус (96% згода)
Коментар
Значна частина сучасної літератури стосується впливу конкретних засобів, обраних як пребіотики, і в цьому документі вони не розглядаються, але визнано, що багато форм харчових волокон (клітковини) матимуть істотний вплив на мікробіоту кишечника та, можливо, на підтримку ремісії при ЗЗК. За загальною точкою зору, застосування харчової клітковини недоцільне для пацієнтів, які мають кишкові стриктури (GPP), але дані останніх публікацій дозволяють припустити, що пребіотичні волокна можуть бути корисними для підтримки ремісії в деяких пацієнтів із ВК. Кілька невеликих контрольованих досліджень показали очевидну користь від додавання харчових волокон до раціону харчування пацієнтів із ВК [150–152]. З огляду на те, що ефекти в підтримці ремісії були схожими на ті, які спостерігались при використанні таких продуктів, як пророщений ячмінь, лузга й насіння Plantago ovata (подорожника яйцеподібного), можна зробити висновок, що це загальний ефект від збільшення споживання рослинних харчових волокон.
Дуже часто застосування харчових волокон відносно протипоказане при ХК через наявність стриктур, а клітковина у вигляді пребіотичного фруктоолігосахариду, очевидно, неефективна при ХК [47]. Однак у слабко контрольованому дослідженні в пацієнтів, які отримували добавки з пшеничною клітковиною, були відзначені покращення якості життя пацієнтів і відсутність явних небажаних явищ [153]. Ще одне нещодавнє неконтрольоване дослідження дієтичних добавок із харчовими волокнами, в якому використовували ововегетаріанську дієту, що містила понад 30 г харчових волокон на кожні 2000 ккал, також вказує на їх користь. Показник підтримки ремісії до одного року становив вражаючі 92 % [154]. Див. також рекомендацію 8.
Рекомендація 32A
Для підтримки ремісії при ВК слід розглянути можливість призначення пробіотичної терапії.
Клас рекомендацій B — високий консенсус (96% згода)
Рекомендація 32B
Не слід використовувати пробіотичну терапію для підтримки ремісії при ХК.
Клас рекомендацій 0 — високий консенсус (100% згода)
Коментар стосовно A/B
За даними метааналізу, штам E.coli Nissle 1917 і комбінований препарат, раніше відомий під назвою VSL#3*, ефективні в підтримці ремісії в пацієнтів із легким і помірним ВК, у тому числі в дітей [155], порівняно з 5-аміносаліцилатними сполуками [74, 156, 157]. Досліджувались інші пробіотичні препарати, але хоча вони зазвичай добре переносилися з досягненням певної користі, не була продемонстрована вірогідна ефективність [158, 159]. Існує попередження щодо штаму Lactobacillus rhamnosus GG, оскільки повідомлення про випадки як у дітей, так і в дорослих описують бактеріємію при застосуванні цього пробіотика в пацієнтів із гострим тяжким ВК [160, 161].
Пробіотики неефективні для запобігання рецидиву захворювання у пацієнтів із ХК [157]. Хоча були висловлені певні позитивні твердження, не було відзначено однозначної користі [162–167]. На сьогодні пробіотики не рекомендуються.
Рекомендація 33A
Пацієнтам з ілеоанальним резервуаром, які перенесли колектомію, слід призначити суміш пробіотиків (VSL#3*), якщо антибіотикотерапія була неуспішною.
Клас рекомендацій B — високий консенсус (96% згода)
Рекомендація 33B
Суміш пробіотиків VSL#3 можна використовувати для первинної і вторинної профілактики паучиту в пацієнтів з ВК, які перенесли колектомію і мають ілеоанальний резервуар.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар стосовно A/B
Антибіотики (ципрофлоксацин, метронідазол) є варіантом лікування гострого паучиту [168]. Два подвійних сліпих плацебо-контрольованих дослідження, проведених за участі дорослих пацієнтів, показали ефективність певної суміші пробіотиків, що містить 450 мільярдів колоній, які утворюють комбінацію, раніше відому під назвою VSL#3, із восьми молочнокислих бактерій: B.breve, B.longum, B.infantis, L.acidophilus, L.casei, L.delbrueckii, L.plantarum і Streptococcus salivarius subsp. thermophilus — у підтримці ремісії в пацієнтів із хронічним паучитом [169, 170]. Зведений аналіз цих двох досліджень (76 учасників) дозволяє припустити, що така пробіотична терапія може бути ефективнішою, ніж плацебо, для підтримки ремісії. У 85 % (34/40) пацієнтів групи активного лікування ремісія підтримувалась дев’ять-дванадцять місяців порівняно з 3 % (1/36) пацієнтів групи плацебо (ВР 20,24). Аналіз GRADE показав, що якість доказів, які підтверджують цей результат, була низькою через дуже обмежені дані (35 явищ) [171]. В іншому дослідженні [168] оцінювали ефекти такої бактеріотерапії як допоміжного засобу при стандартній терапії. Зниження показників активності захворювання при ВК (UCDAI) на 50 % або більше було більш вираженим у групі активного лікування, ніж у групі плацебо (63,1 проти 40,8; за протоколом P = 0,010). У групі активного лікування показник ремісії був вищим, ніж у групі плацебо (47,7 % проти 32,4 %; P = 0,069).
Профілактика паучиту. Результати невеликого дослідження (40 учасників) дозволяють припустити, що пробіотична терапія може бути ефективнішою, ніж плацебо, для профілактики виникнення паучиту [172]. У 90 % (18/20) пацієнтів групи активного лікування не було зареєстровано випадків гострого паучиту під час 12-місячного дослідження порівняно з 60 % (12/20) пацієнтів групи плацебо (ВР 1,50). Аналіз GRADE показав, що якість доказів, які підтверджують цей результат, була низькою через дуже обмежені дані (30 явищ). І навпаки, штам Lactobacillus rhamnosus GG не був ефективним у профілактиці рецидивів [173]. Керівництво ECCO пропонує використовувати VSL#3 як для підтримки ремісії, індукованої антибіотиками, так і для профілактики виникнення паучиту в дорослих [174], а також у дітей із ВК [175].
Рекомендація 34A
Ні ЕХ, ні ПХ не рекомендується як первинна терапія для підтримки ремісії при ЗЗК.
Клас рекомендацій GPP — високий консенсус (100% згода)
Рекомендація 34B
ПДХ або ЕХ можуть бути рекомендовані пацієнтам із ХК у стадії ремісії, якщо недостатнє харчування не може бути компенсоване належним чином за допомогою консультування щодо лікувального харчування.
Клас рекомендацій GPP — високий консенсус (100% згода)
Коментар стосовно A/B
Нутритивну підтримку не оцінювали як підтримувальну терапію при ВК, як і ПХ при ХК. Нещодавній систематичний огляд 12 РКД і нерандомізованих когортних досліджень [176] (1169 пацієнтів, у тому числі 95 дітей), більшість з яких мали хорошу якість, показав, що підтримувальне ЕХ було настільки ж ефективним, як і стратегія порівняння (стандартна дієта, 5-АСК або азатіоприн), або більш ефективним для запобігання рецидивам ХК протягом періоду від шести місяців до чотирьох років. Дослідження з найнижчим ризиком похибки порівнювало додаткове ЕХ (50 %) зі звичайним раціоном харчування в 51 дорослого пацієнта з ХК [177]. Пацієнти в кожній групі дослідження отримували подібні препарати (5-АСК або азатіоприн). Дослідження показало, що в середньому протягом 11,9 місяця у дев’яти з 26 пацієнтів (34 %) у групі ЕХ стався рецидив порівняно з 16 з 25 пацієнтів (64 %) у групі, яка не отримувала ЕХ (ВР = 0,40; 95% ДІ 0,16–0,98; Р < 0,01). Вивчення підтримувального ЕХ як допоміжного засобу при терапії інфліксимабом надало суперечливі результати, оскільки були опубліковані одне негативне [144] і два позитивних [178, 179] дослідження.
Найбільш дослідженими є елементні суміші. Систематичний огляд не показав істотної різниці в частоті ремісії між застосуванням елементної і полімерної сумішей [180]. Однак він виявив менший показник прихильності до застосування елементного ЕХ порівняно з необмеженим раціоном харчування. Європейські організації із ЗЗК і дитячої гастроентерології і харчування, ECCO та ESPGHAN, рекомендують використання часткового підтримувального ЕХ у пацієнтів із дуже легким захворюванням або низьким ризиком рецидиву, віддаючи перевагу полімерним сумішам, а елементні суміші радять резервувати лише на випадок алергії на білки коров’ячого молока [181].
Рекомендація 35
Пацієнти із ЗЗК у стадії ремісії мають дотримуватися стандартної дієти або отримувати ПДХ, у разі потреби приділяючи увагу нутритивному статусу й загальній нутритивній підтримці.
Клас рекомендацій: GPP — високий консенсус (95% згода)
Коментар
У дослідженнях вивчали небагато дієтичних добавок для підтримки ремісії в пацієнтів із ЗЗК з клінічними кінцевими точками. Відкрите багатоцентрове РКД у паралельних групах, у якому взяли участь 105 пацієнтів із ВК у стадії ремісії, показало, що застосування лузги насіння подорожника (10 г двічі на добу) було настільки ж ефективним, як месаламін (500 мг тричі на добу), для підтримки ремісії в період до одного року [151]. Кокранівський систематичний огляд проаналізував 6 досліджень (1039 пацієнтів) застосування добавок з ω-3 жирними кислотами [149]: була відзначена незначна користь терапії ω-3 в підтримці ремісії.
Рекомендація 36
У разі резекції понад 20 см дистального відділу клубової кишки в поєднанні з ілеоцекальним клапаном чи без нього пацієнтам із ХК слід призначити вітамін В12.
Клас рекомендацій A — високий консенсус (100% згода)
Коментар
Нещодавній систематичний огляд оцінював літературні джерела щодо поширеності, факторів ризику, оцінки й лікування дефіциту вітаміну В12 при ЗЗК [182]. ВК без резекції не асоціюється зі зниженням рівня B12 або дефіцитом B12. Поширеність дефіциту B12 при ХК коливається від 5,6 до 38 %. Резекція понад 30 см дистального відділу кишки, незалежно від поєднання з ілеоцекальним клапаном, піддає пацієнта ризику розвитку дефіциту B12. Резекція менше від 20 см зазвичай не викликає дефіциту B12 [183]. ХК з ураженням клубової кишки не завжди пов’язана з дефіцитом вітаміну B12 [184, 185], але його вплив важко виключити в разі ураження понад 30–60 см [182]. Пацієнти з ХК з ураженням клубової кишки, та/або з резекцією клубової кишки, та/або ознаками клінічного дефіциту повинні щорічно проходити обстеження з метою виявлення дефіциту вітаміну В12 [182].
Пацієнти з клінічним дефіцитом мають отримувати 1000 мкг вітаміну В12 шляхом внутрішньом’язової ін’єкції через день протягом тижня, а потім щомісяця протягом життя [186]. Пацієнти з резекцією клубової кишки понад 20 см також мають отримувати 1000 мкг вітаміну В12 щомісяця й безстроково [186]. Пероральна терапія може бути настільки ж ефективною, але вона недостатньо досліджена у пацієнтів із ХК. Ретроспективне відкрите нерандомізоване дослідження за участю 36 пацієнтів із ХК показало, що пероральний шлях (1200 мкг на добу для 33 пацієнтів, 2400 мкг на добу для трьох пацієнтів) є ефективним методом лікування дефіциту вітаміну В12 [187]. На сьогодні застосування парентеральних препаратів вітаміну В12 залишається еталоном, але в найближчі роки застосування пероральної саплементації може стати стандартом лікування.
Рекомендація 37
Деякі пацієнти із ЗЗК, ті, хто отримує сульфасалазин і метотрексат, мають додатково отримувати вітамін В9/фолієву кислоту.
Клас рекомендацій B — високий консенсус (100% згода)
Коментар
Дефіцит фолатів при ЗЗК зумовлений низкою причин, таких як зменшення споживання натуральних джерел фолатів, порушення всмоктування, надмірна утилізація фолатів через запалення слизової оболонки й застосування лікарських засобів. Поєднання цих факторів може спричинити дефіцит цього вітаміну. Деякі лікарські засоби є найбільш значущим фактором розвитку дефіциту фолатів унаслідок інгібування дигідрофолатредуктази, ферменту, який каталізує відновлення дигідрофолієвої кислоти до тетрагідрофолієвої кислоти (метотрексат) [188], або порушення всмоктування фолатів (сульфасалазин) [189]. Азатіоприн і 6-меркаптопурин також індукують макроцитоз, але завдяки мієлосупресивній активності.
Систематичний огляд і метааналіз 10 досліджень, що охоплювали дані 4517 пацієнтів, виявили загальний захисний ефект від застосування добавок із фолієвою кислотою на розвиток колоректального раку (зведене ВР 0,58; 95% ДІ 0,37–0,80) [190]. В італійському дослідженні порівнювали застосування 15 мг фолієвої або фолінієвої кислоти протягом одного місяця в 30 пацієнтів із ЗЗК, які отримували сульфасалазин [191]. Обидва препарати змогли відновити запаси фолатів в організмі, але фолієва кислота була більш ефективною. Керівництво ECCO-ESPGHAN з лікування ХК у дітей рекомендує пероральне застосування фолатів у пацієнтів, які отримують метотрексат, у дозі 5 мг раз на тиждень через 24–72 години після застосування aметотрексату або 1 мг на добу протягом 5 днів тижня [181]. Ця група експертів надає аналогічну рекомендацію і дорослим.
Рекомендація 38A
У вагітних пацієнток із ЗЗК слід регулярно контролювати рівень заліза й фолатів, а в разі дефіциту — призначити препарати заліза і/або вітаміну В9/фолієвої кислоти.
Клас рекомендацій: GPP — високий консенсус (95% згода)
Рекомендація 38B
У пацієнток із ЗЗК, які годують груддю, слід регулярно оцінювати нутритивний статус, а в разі дефіциту нутрієнтів — призначити відповідні добавки.
Клас рекомендацій: GPP — високий консенсус (100% згода)
Коментар стосовно A/B
У пацієнтів із ЗЗК наслідки анемії і дефектів нервової трубки [192] разом із частими дефіцитами вимагають регулярного обстеження з метою виявлення дефіциту заліза й фолатів під час вагітності, а також оцінки нутритивного статусу.
Інформація, що стосується жінок із ЗЗК, які розглядають можливість годування груддю, обмежена. Однак немає жодних доказів шкоди від призначення будь-якої дієтичної інтервенції, яка в інших випадках вважається доцільною для лікування породіллі.
Рекомендація 39
Усіх пацієнтів із ЗЗК слід заохочувати до регулярної фізичної активності. Пацієнтам із ЗЗК зі зниженою м’язовою масою і/або працездатністю м’язів слід рекомендувати відповідне фізичне навантаження.
Клас рекомендацій: GPP — високий консенсус (95% згода)
Коментар
Систематичний огляд 19 досліджень композиційного складу тіла, у яких взяли участь 926 пацієнтів із ЗЗК, виявив низьку нежирову масу у 28 % пацієнтів із ХК і 13 % пацієнтів із ВК [193]. Повідомлялося про низьку м’язову масу, силу й працездатність у дорослих когортах із ЗЗК [194, 195], причому в дітей спостерігались подібні результати [196]. Саркопенія, асоційована з остеопенією, була зареєстрована у 12 % пацієнтів із ЗЗК (середній вік — 31 рік) [194].
У німецькому дослідженні 30 пацієнтів віком 41 ± 14 років із легким чи помірним ЗЗК були рандомізовані для участі в контрольованій програмі бігу середньої інтенсивності тричі на тиждень протягом десяти тижнів або для участі в контрольній групі без фізичного навантаження. Якість життя, пов’язана зі здоров’ям, зазначена як загальний бал за шкалою IBDQ, покращилась на 19 % у групі втручання і на 8 % у контрольній групі, при цьому спостерігались значні відмінності в соціальному домені шкали IBDQ, показник якого істотно покращився в групі втручання порівняно з контрольною групою (p = 0,023) [197].
Стандартом лікування саркопенії, разом із достатнім споживанням білків, є силове тренування. Саме воно рекомендується при віковій саркопенії [198]. Однак цю рекомендацію не оцінювали в пацієнтів із ЗЗК. Проте група експертів рекомендує призначати силове тренування (гімнастичні вправи) пацієнтам із ЗЗК із саркопенією або ознаками саркопенії (такими як зменшення м’язової маси, сили та/або працездатності).
Рекомендація 40
Пацієнтам із ЗЗК з ожирінням слід рекомендувати зменшувати масу тіла лише в період стабільної ремісії, а потім — відповідно до чинних керівництв щодо ожиріння.
Клас рекомендацій: GPP — високий консенсус (100% згода)
Коментар
Надмірна вага й ожиріння на сьогодні є найчастішим розладом харчування в пацієнтів із ЗЗК. Їх поширеність різниться між країнами, вражаючи 32,7 % із 581 дорослого із ЗЗК (30,3 % пацієнтів із ХК і 35,2 % пацієнтів із ВК) [199] і 17 % зі 100 ірландських пацієнтів із ХК [200]. В американському дослідженні за участю 1494 пацієнтів із ЗЗК (31,5 % з ожирінням) було виявлено зв’язок між ожирінням і стандартними супутніми хворобами, низькою якістю життя й високим рівнем С-реактивного білка [201]. Однак ожиріння не було пов’язане зі збільшенням використання медичної допомоги або операцій, пов’язаних із ЗЗК. Жодне інтервенційне дослідження не вивчало лікування ожиріння в пацієнтів із ЗЗК. Проте висока поширеність як дефіциту мікроелементів, так і саркопенії, що свідчить про саркопенічне ожиріння, вказує на те, що пацієнт, який дотримується обмежувальної дієти, піддається ризику розвитку подальших дефіцитів і втрати м’язової маси, особливо в катаболічному стані, наприклад при спалаху ЗЗК. Тому експертна група не рекомендує низькокалорійні раціони харчування для пацієнтів із захворюванням у стадії загострення й рекомендує тренування витривалості як перший крок у намаганні схуднути.
Список литературы
1a. Bischoff S.C., Escher J., Hébuterne X., Kłęk S., Krznaric Z., Schneider S. et al. ESPEN guideline: Clinical nutrition in inflammatory bowel disease. Clin. Nutr. 2020. 39. 632-653.
1b. Forbes A., Escher J., Hébuterne X., Kłęk S., Krznaric Z., Schneider S. et al. Керівництва ESPEN: Клінічне харчування при запальному захворюванні кишечника. Clin. Nutr. 2017. 36. 321-47.
2. Bischoff S.C., Singer P., Koller M., Barazzoni R., Cederholm T., van Gossum A. Standard operating procedures for ESPEN guidelines and consensus papers. Clin. Nutr. 2015. 34. 1043-51.
3. Hou J.K., Abraham B., El-Serag H. Dietary Intake and Risk of Developing Inflammatory Bowel Disease: A Systematic Review of the Literature. Am. J. Gastroenterol. 2011. 106. 563-73.
4. Ananthakrishnan A.N., Khalili H., Konijeti G.G., Higuchi L.M., de Silva P., Korzenik J.R. et al. A prospective study of long-term intake of dietary fiber and risk of Crohn’s disease and ulcerative colitis. Gastroenterology. 2013. 145. 970-7.
5. Li F., Liu X., Wang W., Zhang D. Consumption of vegetables and fruit and the risk of inflammatory bowel disease: a meta-analysis. Eur. J. Gastroenterol. Hepatol. 2015. 27. 623-30.
6. Ananthakrishnan A.N., Khalili H., Konijeti G.G., Higuchi L.M., de Silva P., Fuchs C.S. et al. Long-term intake of dietary fat and risk of ulcerative colitis and Crohn’s disease. Gut. 2014. 63. 776-84.
7. Tjonneland A., Overvad K., Bergmann M.M., Nagel G., Linseisen J., Hallmans G. et al. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009. 58. 1606-11.
8. Klement E., Cohen R.V., Boxman J., Joseph A., Reif S. Breastfeeding and risk of inflammatory bowel disease: a systematic review with meta-analysis. Am. J. Clin. Nutr. 2004. 80. 1342-52.
9. Barclay A.R., Russell R.K., Wilson M.L., Gilmour W.H., Satsangi J., Wilson D.C. Systematic review: the role of breastfeeding in the development of pediatric inflammatory bowel disease. J. Pediatr. 2009. 155. 421-6.
10. Gearry R.B., Richardson A.K., Frampton C.M., Dodgshun A.J., Barclay M.L. Population-based cases control study of inflammatory bowel disease risk factors. J. Gastroenterol. Hepatol. 2010. 25. 325-33.
11. Hansen T.S., Jess T., Vind I., Elkjaer M., Nielsen M.F., Gamborg M. et al. Environmental factors in inflammatory bowel disease: a case-control study based on a Danish inception cohort. J. Crohn’s Colitis. 2011. 5. 577-84.
12. Guo A.Y., Stevens B.W., Wilson R.G., Russell C.N., Cohen M.A., Sturgeon H.C. et al. Early life environment and natural history of inflammatory bowel diseases. BMC Gastroenterol. 2014. 14. 216.
13. Ng S.C., Tang W., Leong R.W., Chen M., Ko Y., Studd C. et al. Asia-Pacific Crohn’s and Colitis Epidemiology Study ACCESS Group. Environmental risk factors in inflammatory bowel disease: a population-based case-control study in Asia-Pacific. Gut. 2015. 64. 1063-71.
14. Agostoni C., Braegger C., Decsi T., Kolacek S., Koletzko B., Michaelsen K.F. et al.; ESPGHAN Committee on Nutrition. Breast-feeding: A commentary by the ESPGHAN Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr. 2009. 49. 112-25.
15. Nguyen G.C., Munsell M., Harris M.L. Nationwide prevalence and prognostic significance of clinically diagnosable protein-calorie malnutrition in hospitalized inflammatory bowel disease patients. Inflamm. Bowel Dis. 2008. 14. 1105-11.
16. Sandhu A., Mosli M., Yan B., Wu T., Gregor J., Chande N. et al. Self-Screening for Malnutrition Risk in Outpatient Inflammatory Bowel Disease Patients Using the Malnutrition Universal Screening Tool (MUST). J. Parenter. Enteral Nutr. 2016. 40. 507-10.
17. Gajendran M., Umapathy C., Loganathan P., Hashash J.G., Koutroubakis I.E., Binion D.G. Analysis of hospital-based emergency department visits for inflammatory bowel disease in the USA. Dig. Dis. Sci. 2016. 61. 389-99.
18. Ananthakrishnan A.N., McGinley E.L. Infection-related hospitalizations are associated with increased mortality in patients with inflammatory bowel diseases. J. Crohn’s Colitis. 2013. 7. 107-12.
19. Wallaert J.B., De Martino R.R., Marsicovetere P.S., Goodney P.P., Finlayson S.R., Murray J.J. et al. Venous thromboembolism after surgery for inflammatory bowel disease: are there modifiable risk factors? Data from ACS NSQIP. Dis. Colon Rectum. 2012. 55. 1138-44.
20. Ananthakrishnan A.N., McGinley E.L., Binion D.G., Saeian K. A novel risk score to stratify severity of Crohn’s disease hospitalizations. Am. J. Gastroenterol. 2010. 105. 1799-807.
21. Vasseur F., Gower-Rousseau C., Vernier-Massouille G., Dupas J.L., Merle V., Merlin B. et al. Nutritional Status and Growth in Pediatric Crohn’s Disease: A Population-Based Study. Am. J. Gastroenterol. 2010. 105. 1893-900.
22. Hill R.J., Davies P.S. You look all right to me: compromised nutritional status in paediatric patients with ulcerative colitis. J. Pediatr. Gastroenterol. Nutr. 2013. 56. 385-9.
23. Wiskin A.E., Owens D.R., Cornelius V.R., Wootton S.A., Beattie RM. Paediatric nutrition risk scores in clinical practice: children with inflammatory bowel disease. J. Hum. Nutr. Diet. 2012. 25. 319-22.
24. Heuschkel R., Salvestrini C., Beattie R.M., Hildebrand H., Walters T., Griffiths A. Guidelines for the management of growth failure in childhood inflammatory bowel disease. Inflamm. Bowel Dis. 2008. 14. 839-49.
25. Inoue M., Sasaki M., Takaoka A., Kurihara M., Iwakawa H., Bamba S. et al. Changes in energy metabolism after induction therapy in patients with severe or moderate ulcerative colitis. J. Clin. Biochem. Nutr. 2015. 56. 215-9.
26. Sasaki M., Johtatsu T., Kurihara M., Iwakawa H., Tanaka T., Bamba S. et al. Energy expenditure in Japanese patients with severe or moderate ulcerative colitis. J. Clin. Biochem. Nutr. 2010. 47. 32-6.
27. Klein S., Meyers S., O’Sullivan P., Barton D., Leleiko N., Janowitz H.D. The metabolic impact of active ulcerative colitis. Energy expenditure and nitrogen balance. J. Clin. Gastroenterol. 1988. 10. 34-40.
28. Stokes M.A., Hill G.L. Total energy expenditure in patients with Crohn’s disease: measurement by the combined body scan technique. J. Parenter. Enteral Nutr. 1993. 17. 3-7.
29. Capristo E., Addolorato G., Mingrone G., Greco A.V., Gasbar–rini G. Effect of disease localization on the anthropometric and metabolic features of Crohn’s disease. Am. J. Gastroenterol. 1998. 93. 2411-9.
30. Zoli G., Katelaris P.H., Garrow J., Gasbarrini G., Farthing M.J. Increased energy expenditure in growing adolescents with Crohn’s disease. Dig. Dis. Sci. 1996. 41. 1754-9.
31. Steiner S.J., Noe J.D., Denne S.C. Corticosteroids increase protein breakdown and loss in newly diagnosed pediatric Crohn disease. Pediatric research. 2011. 70. 484-8.
32. O’Keefe S.J., Ogden J., Rund J., Potter P. Steroids and bowel rest versus elemental diet in the treatment of patients with Crohn’s disease: the effects on protein metabolism and immune function. Journal of parenteral and enteral nutrition. 1989. 13. 455-60.
33. Molodecky N.A., Soon I.S., Rabi D.M., Ghali W.A., Ferris M., Chernoff G. et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012. 142. 46-54.
34. Hannon T.S., Dimeglio L.A., Pfefferkorn M.D., Denne S.C. Acute effects of enteral nutrition on protein turnover in adolescents with Crohn disease. Ped. Res. 2007. 61. 356-60.
35. Royall D., Jeejeebhoy K.N., Baker J.P., Allard J.P., Habal F.M., Cunnane S.C. et al. Comparison of amino acid v peptide based enteral diets in active Crohn’s disease: clinical and nutritional outcome. Gut. 1994. 35. 783-7.
36. Griffiths R.D., Hinds C.J., Little R.A. Manipulating the metabolic response to injury. Br. Med. Bull. 1999. 55. 181-95.
37. Royall D., Greenberg G.R., Allard J.P., Baker J.P., Jeejeebhoy K.N. Total enteral nutrition support improves body composition of patients with active Crohn’s disease. J. Parenter. Enteral Nutr. 1995. 19. 95-9.
38. Gerasimidis K., Edwards C., Stefanowicz F., Galloway P., McGrogan P., Duncan A. et al. Micronutrient status in children with IBD: true deficiencies or epiphenomenon of the systemic inflammatory response. J. Pediatr. Gastroenterol. Nutr. 2013. 56. e50-1.
39. Filippi J., Al-Jaouni R., Wiroth J.B., Hébuterne X., Schneider S.M. Nutritional deficiencies in patients with Crohn’s disease in remission. Inflamm. Bowel Dis. 2006. 12. 185-91.
40. Geerling B.J., Badart-Smook A., Stockbrügger R.W., Brummer R.J. Comprehensive nutritional status in patients with long-standing Crohn disease currently in remission. Am. J. Clin. Nutr. 1998. 67. 919-26.
41. Vagianos K., Bector S., McConnell J., Bernstein C.N. Nutrition assessment of patients with inflammatory bowel disease. Jour. Рarenter. Enteral Nutr. 2007. 31. 311-9.
42. Santucci N.R., Alkhouri R.H., Baker R.D., Baker S.S. Vitamin and zinc status pretreatment and posttreatment in patients with inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2014. 59. 455-7.
43. Greenley R.N., Stephens K.A., Nguyen E.U., Kunz J.H., Janas L., Goday P. et al. Vitamin and mineral supplement adherence in pediatric inflammatory bowel disease. J. Pediatr. Psychol. 2013. 38. 883-92.
44. Dignass A.U., Gasche C., Bettenworth D., Birgegård G., Danese S., Gisbert J.P. et al. European Crohn’s and Colitis Organisation [ECCO]. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases. J. Crohns Colitis. 2015. 9. 211-22.
45. Wells C.W., Lewis S., Barton J.R., Corbett S. Effects of changes in haemoglobin level on quality of life and cognitive function in inflammatory bowel disease patients. Inflamm. Bowel Dis. 2006. 12. 123-30.
46. Evstatiev R., Marteau P., Iqbal T., Khalif I.L., Stein J., Bokemeyer B. et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterology. 2011. 141. 846-53, e1-2.
47. Benjamin J.L., Hedin C.R., Koutsoumpas A., Ng S.C., McCarthy N.E., Hart A.L. et al. Randomised, double-blind, placebo-controlled trial of fructo-oligosaccharides in active Crohn’s disease. Gut. 2011. 60. 923-9.
48. Pironi L., Arends J., Baxter J., Bozzetti F., Peláez R.B., Cuerda C. et al. Home Artificial Nutrition & Chronic Intestinal Failure; Acute Intestinal Failure Special Interest Groups of ESPEN. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clin. Nutr. 2015. 34. 171-80.
49. Hart J.W., Bremner A.R., Wootton S.A., Beattie R.M. Measured versus predicted energy expenditure in children with inactive Crohn’s disease. Clinical Nutrition. 2005. 24. 1047-55.
50. Baker M.L., Williams R.N., Nightingale J.M. Causes and management of a high-output stoma. Colorectal. Dis. 2011. 13. 191-7.
51. Grischkan D., Steiger E., Fazio V. Maintenance of home hyperalimentation in patients with high-output jejunostomies. Arch. Surg. 1979. 114. 838-41.
52. Pironi L., Guidetti C., Incasa E., Poggioli G., Paganelli F., Merli C. et al. Oral rehydration solution containing rice maltodextrins in patients with total colectomy and high intestinal output. Int. J. Clin. Pharmacol. Res. 2000. 20. 55-60.
53. Nightingale J.M., Lennard-Jones J.E., Walker E.R., Farthing M.J. Oral salt supplements to compensate for jejunostomy losses: comparison of sodium chloride capsules, glucose electrolyte solution, and glucose polymer electrolyte solution. Gut. 1992. 33. 759-61.
54. Hu D., Ren J., Wang G., Li G., Liu S., Yan D. et al. Exclusive enteral nutritional therapy can relieve inflammatory bowel stricture in Crohn’s disease. J. Clin. Gastroenterol. 2014. 48. 790-5.
55. Abraham B.P., Prasad P., Malaty H.M. Vitamin D deficiency and corticosteroid use are risk factors for low bone mineral density in inflammatory bowel disease patients. Dig. Dis. Sci. 2014. 59. 1878-84.
56. Bakker S.F., Dik V.K., Witte B.I., Lips P., Roos J.C., Van Bodegraven A.A. Increase in bone mineral density in strictly treated Crohn’s disease patients with concomitant calcium and vitamin D supplementation. J. Crohn’s Colitis. 2013. 7. 377-84.
57. Lopes L.H., Sdepanian V.L., Szejnfeld V.L., de Morais M.B., Fagundes-Neto U. Risk factors for low bone mineral density in children and adolescents with inflammatory bowel disease. Dig. Dis. Sci. 2008. 53. 2746-53.
58. Van Bodegraven A.A., Bravenboer N., Witte B.I., Dijkstra G., van der Woude C.J., Stokkers P.C. et al. Dutch Initiative on Crohn and Colitis (ICC). Treatment of bone loss in osteopenic patients with Crohn’s disease: a double-blind, randomised trial of oral risedronate 35 mg once weekly or placebo, concomitant with calcium and vitamin D supplementation. Gut. 2014. 63. 1424-30.
59. Bernstein C.N., Seeger L.L., Anton P.A., Artinian L., Geffrey S., Goodman W. et al. A randomized, placebo-controlled trial of calcium supplementation for decreased bone density in corticosteroid-using patients with inflammatory bowel disease: a pilot study. Aliment. Pharmacol. Ther. 1996. 10. 777-86.
60. Hebuterne X., Filippi J., Al-Jaouni R., Schneider S. Nutritional consequences and nutrition therapy in Crohn’s disease. Gastroenterol. Clin. Biol. 2009. 33. Suppl. 3. S235-44.
61. Jacobsen O., Højgaard L., Hylander Møller E., Wielandt T.O., Thale M. et al. Effect of enterocoated cholestyramine on bowel habit after ileal resection: a double blind crossover study. Br. Med. J. (Clin. Res. Ed.). 1985. 290. 1315-8.
62. Little K.H., Schiller L.R., Bilhartz L.E., Fordtran J.S. Treatment of severe steatorrhea with ox bile in an ileectomy patient with residual colon. Dig. Dis. Sci. 1992. 37. 929-33.
63. Westergaard H. Bile Acid malabsorption. Curr. Treat. Options Gastroenterol. 2007. 10. 28-33.
64. Hylander E., Jarnum S., Jensen H.J., Thale M. Enteric hyperoxaluria: dependence on small intestinal resection, colectomy, and steatorrhoea in chronic inflammatory bowel disease. Scand. J. Gastroenterol. 1978. 13. 577-88.
65. Andersson H., Filipsson S., Hultén L. Urinary oxalate excretion related to ileocolic surgery in patients with Crohn’s disease. Scand. J. Gastroenterol. 1978. 13. 465-9.
66. Hueppelshaeuser R., von Unruh G.E., Habbig S., Beck B.B., Buderus S., Hesse A. et al. Enteric hyperoxaluria, recurrent urolithiasis, and systemic oxalosis in patients with Crohn’s disease. Pediatr. Nephrol. 2012. 27. 1103-9.
67. Charlebois A., Rosenfeld G., Bressler B. The Impact of Dietary Interventions on the Symptoms of Inflammatory Bowel Disease: A Systematic Review. Crit. Rev. Food Sci Nutr. 2016. 56. 1370-8
68. Sigall-Boneh R., Pfeffer-Gik T., Segal I., Zangen T., Boaz M., Levine A. Partial enteral nutrition with a Crohn’s disease exclusion diet is effective for induction of remission in children and young adults with Crohn’s disease. Inflamm. Bowel Dis. 2014. 20. 1353-60.
69. Rajendran N., Kumar D. Food-specific IgG4-guided exclusion diets improve symptoms in Crohn’s disease: a pilot study. Colorectal. Dis. 2011. 13. 1009-13.
70. Riordan A.M., Hunter J.O., Cowan R.E., Crampton J.R., Davidson A.R., Dickinson R.J. et al. Treatment of active Crohn’s disease by exclusion diet: East Anglian multicentre controlled trial. Lancet. 1993. 342. 1131-4.
71. Jones V.A. Comparison of total parenteral nutrition and elemental diet in induction of remission of Crohn’s disease. Long-term maintenance of remission by personalized food exclusion diets. Dig. Dis. Sci. 1987. 32. 100S-107S.
72. Slonim A.E., Grovit M., Bulone L. Effect of exclusion diet with nutraceutical therapy in juvenile Crohn’s disease. J. Am. Coll. Nutr. 2009. 28. 277-85.
73. Oliva S., Di Nardo G., Ferrari F., Mallardo S., Rossi P., Patrizi G. et al. Randomised clinical trial: the effectiveness of Lactobacillus reuteri ATCC 55730 rectal enema in children with active distal ulcerative colitis. Aliment. Pharmacol. Ther. 2012. 35. 327-34.
74. Miele E., Pascarella F., Giannetti E., Quaglietta L., Baldassano R.N., Staiano A. Effect of a probiotic preparation (VSL#3) on induction and maintenance of remission in children with ulcerative colitis. Am. J. Gastroenterol. 2009. 104. 437-43.
75. Carter M.J., Lobo A.J., Travis S.P. Guidelines for the management of inflammatory bowel disease in adults. Gut. 2004. 53. Suppl. 5. V1-16.
76. Valentini L., Schaper L., Buning C., Hengstermann S., Koernicke T., Tillinger W. et al. Malnutrition and impaired muscle strength in patients with Crohn’s disease and ulcerative colitis in remission. Nutrition. 2008. 24. 694-702.
77. Sakamoto N., Kono S., Wakai K., Fukuda Y., Satomi M., Shimoyama T. et al. Dietary risk factors for inflammatory bowel disease: a multicenter case-control study in Japan. Inflamm. Bowel Dis. 2005. 11. 154-63.
78. Van Limbergen J., Haskett J., Griffiths A.M., Critch J., Huynh H., Ahmed N. et al. Toward enteral nutrition for the treatment of pediatric Crohn disease in Canada: A workshop to identify barriers and enablers. Can. J. Gastroenterol. Hepatol. 2015. 29. 351-6.
79. Nguyen G.C., Laveist T.A., Brant S.R. The utilization of pa–renteral nutrition during the in-patient management of inflammatory bowel disease in the United States: a national survey. Aliment. Pharmacol. Ther. 2007. 26. 1499-507.
80. Nguyen D.L., Parekh N., Bechtold M.L., Jamal M.M. National trends and in-hospital outcomes of adult patients with inflammatory bowel disease receiving parenteral nutrition support. J. Parenter. Enteral Nutr. 2016. 40. 412-6.
81. Dziechciarz P., Horvath A., Shamir R., Szajewska H. Meta-analysis: enteral nutrition in active Crohn’s disease in children. Aliment. Pharmacol. Ther. 2007. 26. 795-806.
82. Grover Z., Lewindon P. Two-Year Outcomes After Exclusive Enteral Nutrition Induction Are Superior to Corticosteroids in Pediatric Crohn’s Disease Treated Early with Thiopurines. Dig. Dis. Sci. 2015. 60. 3069-74.
83. Grogan J.L., Casson D.H., Terry A., Burdge G.C., El-Matary W., Dalzell A.M. Enteral feeding therapy for newly diagnosed pediatric Crohn’s disease: a double-blind randomized controlled trial with two years follow-up. Inflamm. Bowel Dis. 2012. 18. 246-253.
84. Li G., Ren J., Wang G., Hu D., Gu G., Liu S. et al. Preoperative exclusive enteral nutrition reduces the postoperative septic complications of fistulizing Crohn’s disease. Eur. J. Clin. Nutr. 2014. 68. 441-6.
85. Smith M.A., Smith T., Trebble T. Nutritional management of adults with inflammatory bowel disease: practical lessons from the available evidence. Frontline Gastroenterology. 2012. 3. 172-79.
86. Lochs H., Dejong C., Hammarqvist F., Hebuterne X., Leon-Sanz M., Shulz T. et al. ESPEN Guidelines on Enteral Nutrition: Gastroenterology. Clin. Nutr. 2006. 25. 260-274.
87. Fuchssteiner H., Nigl K., Mayer A., Kristensen B., Platzer R., Brunner B. et al. Nutrition and IBD: consensus of the Austrian working group of IBD (inflammatory bowel diseases) of the OGGH. Z. Gastroenterol. 2014. 52. 376-386.
88. August D., Teitelbaum D., Albina J., Bothe A., Guenter P., Heitkemper M. et al. ASPEN Guidelines for the Use of Parenteral and Enteral Nutrition in Adult and Pediatric Patients. JPEN. 2002. 26. 1SA-138SA.
89. Matsui T., Sakurai T., Yao T. Nutritional therapy for Crohn’s disease in Japan. J. Gastroenterol. 2005. 40. Suppl. 16. 25-31.
90. Akobeng A.K., Thomas A.G. Enteral nutrition for maintenance of remission in Crohn’s disease. Cochrane Database Syst. Rev. 2007. CD005984.
91. Nakahigashi M., Yamamoto T., Sacco R., Hanai H., Kobayashi F. Enteral nutrition for maintaining remission in patients with quiescent Crohn’s disease: current status and future perspectives. Int. J. Colorectal. Dis. 2016. 31. 1-7.
92. Yamamoto T., Shiraki M., Nakahigashi M., Umegae S., Matsumoto K. Enteral nutrition to suppress postoperative Crohn’s disease recurrence: a five-year prospective cohort study. Int. J. Colorectal. Dis. 2013. 28. 335-40.
93. Giannotta M., Tapete G., Emmi G., Silvestri E., Milla M. Thrombosis in inflammatory bowel diseases: what’s the link? Thromb. J. 2015. 13. 14.
94. Zezos P., Kouklakis G., Saibil F. Inflammatory Bowel Disease and thromboembolism. World J. Gastroenterol. 2014. 20. 13863-78.
95. Bhakta A., Tafen M., Ahmed M., Ata A., Abraham C., Bruce D. et al. Risk of catheter-associated deep venous thrombosis in inflammatory bowel disease. Dis. Colon. Rectum. 2014. 57. 1379-83.
96. Ha C., Magowan S., Accortt N.A., Chen J., Stone C.D. Risk of arterial thrombotic events in inflammatory bowel disease. Am. J. Gastroenterol. 2009. 104. 1445-51.
97. Papay P., Miehsler W., Tilg H., Petritsch W., Reinisch W., Mayer A. et al. Clinical presentation of venous thromboembolism in inflammatory bowel disease. J. Crohns Colitis. 2013. 7. 723-9.
98. Yan D., Ren J., Wang G., Liu S., Li J. Predictors of response to enteral nutrition in abdominal enterocutaneous fistula patients with Crohn’s disease. Eur. J. Clin. Nutr. 2014. 68. 959-63.
99. Visschers R.G., Olde Damink S.W., Winkens B., Soeters P., van Gemert W.G. Treatment strategies in 135 consecutive patients with enterocutaneous fistulas. World J. Surg. 2008. 32. 445-453.
100. Llop J.M., Cobo S., Padulles A., Farran L., Jodar R., Badia M.B. Nutritional support and risk factors of appearance of enterocutaneous fistulas. Nutr. Hosp. 2012. 27. 213-8.
101. Dignass A., Van Assche G., Lindsay J.O., Lémann M., Söderholm J., Colombel J.F. et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management. J. Crohn’s Colitis. 2010. 4. 28-62.
102. Forbes A., Goldesgeyme E., Paulon E. Nutrition in inflammatory bowel disease. J. Parent. Ent. Nutr. 2011. 35. 571-80.
103. Mowat C., Cole A., Windsor A., Ahmad T., Arnott I., Driscoll R. et al. Guidelines for the management of inflammatory bowel disease in adults. Gut. 2011. 60. 571-607.
104. Uchino M., Ikeuchi H., Matsuoka H., Matsumoto T., Takesue Y., Tomita N. Clinical features and management of duodenal fistula in patients with Crohn’s disease. Hepatogastroenterology. 2012. 59. 171-4.
105. Triantafillidis J.K., Papalois A.E. The role of total parenteral nutrition in inflammatory bowel disease: current aspects. Scand. J. Gastroenterol. 2014. 49. 3-14.
106. Ravindran P., Ansari N., Young C.J., Solomon M.J. Definitive surgical closure of enterocutaneous fistula: outcome and factors predictive of increased postoperative morbidity. Colorectal. Dis. 2014. 16. 209-18.
107. Akobeng A.K., Thomas A.G. Refeeding syndrome following exclusive enteral nutritional treatment in Crohn disease. J. Pediatr. Gastroenterol. Nutr. 2010. 51. 364-6.
108. Hernando A., Bretón I., Marín-Jimenez I., Menchén L. Refeeding syndrome in a patient with Crohn’s disease. J. Clin. Gastroenterol. 2008. 42. 430-1.
109. Krznaric Z., Vranesic Bender D., Ljubas Keleric D., Brinar M. Wernicke’s encephalopathy during parenteral nutrition in a Crohn’s disease patient. Nutrition. 2011. 27. 503-4.
110. Dignass A., Lindsay J.O., Sturm A., Windsor A., Colombel J.F., Allez M. et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 2: Current management. J. Crohn Colitis. 2012. 6. 991-1030.
111. Salinas H., Dursun A., Konstantinidis I., Nguyen D., Shellito P., Hodin R. et al. Does preoperative total parenteral nutrition in patients with ulcerative colitis produce better outcomes? Int. J. Colorectal. Dis. 2012. 27. 1479-83.
112. Schwartz E. Perioperative parenteral nutrition in adults with inflammatory bowel disease: a review of the literature. Nutr. Clin. Pract. 2016. 31. 159-70.
113. Weimann A., Braga M., Carli F., Higashiguchi T., Hübner M., Klek S. et al. ESPEN guideline: Clinical nutrition in surgery. Clin. Nutr. 2017. 36. 623-650.
114. Kuppinger D., Hartl W.H., Bertok M., Hoffmann J.M., Cederbaum J., Küchenhoff H. et al. Nutritional screening for risk prediction in patients scheduled for abdominal operations. Br. J. Surg. 2012. 99. 728-737.
115. Beattie A.H., Prach A.T., Baxter J.P., Pennington C.R. A randomised controlled trial evaluating the use of enteral nutritional supplements postoperatively in malnourished surgical patients. Gut. 2000. 46. 813-818.
116. MacFie J., Woodcock N.P., Palmer M.D., Walker A., Townsend S., Mitchell C.J. Oral dietary supplements in pre- and postoperative surgical patients: a prospective and randomized clinical trial. Nutrition. 2000. 16. 723-728.
117. Espaulella J., Guyer H., Diaz-Escriu F., Mellado-Navas J.A., Castells M., Pladevall M. Nutritional supplementation of elderly hip fracture patients. A randomized, double-blind, placebo-controlled trial. Age Ageing. 2000. 29. 425-431.
118. Smedley F., Bowling T., James M., Stokes E., Goodger C., O’Connor O. et al. Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and cost of care. Br. J. Surg. 2004. 91. 983-990.
119. Burden S., Todd C., Hill J., Lal S. Pre-operative nutrition support in patients undergoing gastrointestinal surgery. Cochrane Database Syst. Rev. 2012. 11. CD008879.
120. Braga M., Gianotti L., Gentilini O., Liotta S., Di Carlo V. Feeding the gut early after digestive surgery: results of a nine-year experience. Clin. Nutr. 2002. 21. 59-65.
121. Daly J.M., Bonau R., Stofberg P., Bloch A., Jeevanandam M., Morse M. Immediate postoperative jejunostomy feeding. Clinical and metabolic results in a prospective trial. Am. J. Surg. 1987. 153. 198-206.
122. Delany H.M., Carnevale N., Garvey J.W., Moss G.M. Postoperative nutritional support using needle catheter feeding jejunostomy. Ann. Surg. 1977. 186. 165-170.
123. Gabor S., Renner H., Matzi V., Ratzenhofer B., Lindenmann J., Sankin O. et al. Early enteral feeding compared with parenteral nutrition after oesophageal or oesophagogastric resection and reconstruction. Br. J. Nutr. 2005. 93. 509-513.
124. Gupta V. Benefits versus risks: a prospective audit. Feeding jejunostomy during esophagectomy. World J. Surg. 2009. 33. 1432-1438.
125. Kemen M., Senkal M., Homann H.H., Mumme A., Dauphin A.K., Baier J. et al. Early postoperative enteral nutrition with arginine-omega-3 fatty acids and ribonucleic acid-supplemented diet versus placebo in cancer patients: an immunologic evaluation of Impact. Crit. Care. Med. 1995. 23. 652-659.
126. Klein S., Kinney J., Jeejeebhoy K., Alpers D., Hellerstein M., Murray M. et al. Nutrition support in clinical practice: review of published data and recommendations for future research directions. Summary of a conference sponsored by the National Institutes of Health, American Society for Parenteral and Enteral Nutrition, and American Society for Clinical Nutrition. Am. J. Clin. Nutr. 1997. 66. 683-706.
127. Veterans Affairs Total Parenteral Nutrition Cooperative Study Group. Perioperative total parenteral nutrition in surgical patients. N. Engl. J. Med. 1991. 325. 525-532.
128. Bozzetti F., Gavazzi C., Miceli R., Rossi N., Mariani L., Cozzaglio L. et al. Perioperative total parenteral nutrition in malnourished, gastrointestinal cancer patients: a randomized, clinical trial. J. Parenter. Enteral Nutr. 2000. 24. 7-14.
129. Shukla H.S., Rao R.R., Banu N., Gupta R.M., Yadav R.C. Enteral hyperalimentation in malnourished surgical patients. Indian J. Med. Res. 1984. 80. 339-346.
130. Von Meyenfeldt M.F., Meijerink W.J., Rouflart M.M., Builmaassen M.T., Soeters P.B. Perioperative nutritional support: a randomised clinical trial. Clin. Nutr. 1992. 11. 180-186.
131. Heyland D.K., Montalvo M., MacDonald S., Keefe L., Su X.Y., Drover J.W. Total parenteral nutrition in the surgical patient: a meta-analysis. Can. J. Surg. 2001. 44. 102-111.
132. Andersen H.K., Lewis S.J., Thomas S. Early enteral nutrition within 24h of colorectal surgery versus later commencement of feeding for postoperative complications. Cochrane Database Syst. Rev. 2006. CD004080.
133. Lewis S.J., Andersen H.K., Thomas S. Early enteral nutrition within 24 h of intestinal surgery versus later commencement of feeding: a systematic review and meta-analysis. J. Gastrointest. Surg. 2009. 13. 569-575.
134. Mazaki T., Ebisawa K. Enteral versus parenteral nutrition after gastrointestinal surgery: a systematic review and meta-analysis of randomized controlled trials in the English literature. J. Gastrointest. Surg. 2008. 12. 739-755.
135. Osland E., Yunus R.M., Khan S., Memon M.A. Early versus traditional postoperative feeding in patients undergoing resectional gastrointestinal surgery: a meta-analysis. J. Parenter. Enteral Nutr. 2011. 35. 473-487.
136. Cohen A.B., Lee D., Long M.D., Kappelman M.D., Martin C.F., Sandler R.S. et al. Dietary patterns and self-reported associations of diet with symptoms of inflammatory bowel disease. Dig. Dis. Sci. 2013. 58. 1322-8.
137. Zvirbliene A., Kiudelis G., Zalinkevicius R., Kupcinskas L. Dietary characteristics of patients with inflammatory bowel diseases. Kaunas: Medicina, 2006. 42. 895-9.
138. Banos Madrid R., Salama Benerroch H., Moran Sanchez S., Gallardo Sanchez F., Albadalejo Merono A. et al. Lactose malabsorption in patients with inflammatory bowel disease without activity: would it be necessary to exclude lactose products in the diet of all patients? Anales de Medicina Interna. 2004. 21. 212-14.
139. Triggs C.M., Munday K., Hu R., Fraser A.G., Gearry R.B., Barclay M.L. et al. Dietary factors in chronic inflammation: food tolerances and intolerances of a New Zealand Caucasian Crohn’s disease population. Mutat. Res. 2010. 690. 123-38.
140. Jones V.A., Dickinson R.J., Workman E., Wilson A.J., Freeman A.H., Hunter J.O. Crohn’s disease: maintenance of remission by diet. Lancet. 1985. 2. 177-80.
141. Turner D., Zlotkin S.H., Shah P.S., Griffiths A.M. Omega 3 fatty acids (fish oil) for maintenance of remission in Crohn’s disease. Cochrane Database Syst. Rev. 2009. CD006320.
142. Cashman K.D., Shanahan F. Is nutrition an aetiological factor for inflammatory bowel disease? Eur. J. Gastroenterol. Hepatol. 2003. 15. 607-13.
143. Tanaka T., Takahama K., Kimura T., Mizuno T., Nagasaka M., Iwata K. et al. Effect of concurrent elemental diet on infliximab treatment for Crohn’s disease. J. Gastroenterol. Hepatol. 2006. 21. 1143-9.
144. Yamamoto T., Nakahigashi M., Umegae S., Matsumoto K. Prospective clinical trial: enteral nutrition during maintenance infliximab in Crohn’s disease. J. Gastroenterol. 2010. 45. 24-9.
145. Maconi G., Ardizzone S., Cucino C., Bezzio C., Russo A.G., Bianchi Porro G. Pre-illness changes in dietary habits and diet as a risk factor for inflammatory bowel disease: a case-control study. World J. Gastroenterol. 2010. 16. 4297-304.
146. Esaki M., Matsumoto T., Hizawa K., Nakamura S., Jo Y., Mibu R. et al. Preventive effect of nutritional therapy against postoperative recurrence of Crohn disease, with reference to findings determined by intra-operative enteroscopy. Scand. J. Gastroenterol. 2005. 40. 1431-7.
147. Richman E., Rhodes J.M. Review article: evidence-based dietary advice for patients with inflammatory bowel disease. Aliment. Pharmacol. Ther. 2013. 38. 1156-71.
148. Cabré E., Mañosa M., Gassull M.A. Omega-3 fatty acids and inflammatory bowel diseases — a systematic review. Br. J. Nutr. 2012. 107. Suppl. 2. S240-52.
149. Lev-Tzion R., Griffiths A.M., Leder O., Turner D. Omega 3 fatty acids (fish oil) for maintenance of remission in Crohn’s disease. Cochrane Database Syst. Rev. 2014. 2. CD006320.
150. Hallert C., Kaldma M., Petersson B.G. Ispaghula husk may relieve gastrointestinal symptoms in ulcerative colitis in remission. Scand. J. Gastroenterol. 1991. 26. 747-50.
151. Fernández-Bañares F., Hinojosa J., Sánchez-Lombraña J.L., Navarro E., Martínez-Salmerón J.F., García-Pugés A. et al. Randomized clinical trial of Plantago ovata seeds (dietary fiber) as compared with mesalamine in maintaining remission in ulcerative colitis. Spanish Group for the Study of Crohn’s Disease and Ulcerative Colitis (GETECCU). Am. J. Gastroenterol. 1999. 94. 427-33.
152. Hanai H., Kanauchi O., Mitsuyama K., Andoh A., Takeuchi K., Takayuki I. et al. Germinated barley foodstuff prolongs remission in patients with ulcerative colitis. Int. J. Mol. Med. 2004. 13. 643-7.
153. Brotherton C.S., Taylor A.G., Bourguignon C., Anderson J.G. A high-fiber diet may improve bowel function and health-related quality of life in patients with Crohn disease. Gastroenterol. Nurs. 2014. 37. 206-16.
154. Chiba M., Tsuji T., Nakane K., Komatsu M. High amount of dietary fiber not harmful but favorable for Crohn disease. Perm. J. 2015. 19. 58-61.
155. Fujiya M., Ueno N., Kohgo Y. Probiotic treatments for induction and maintenance of remission in inflammatory bowel diseases: a meta-analysis of randomized controlled trials. Clin. J. Gastroenterol. 2014. 7. 1-13.
156. Kruis W., Fric P., Pokrotnieks J., Lukas M., Fixa B., Kascak M. et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut. 2004. 53. 1617-23.
157. Floch M.H., Walker W.A., Sanders M.E., Nieuwdorp M., Kim A.S., Brenner D.A. et al. Recommendations for Probiotic Use — 2015 Update: Proceedings and Consensus Opinion. J. Clin. Gastroenterol. 2015. 49. Suppl. 1. S69-73.
158. Ishikawa H., Matsumoto S., Ohashi Y., Imaoka A., Setoyama H., Umesaki Y. et al. Beneficial effects of probiotic bifidobacterium and galacto-oligosaccharide in patients with ulcerative colitis: a randomized controlled study. Digestion. 2011. 84. 128-33.
159. Yoshimatsu Y., Yamada A., Furukawa R., Sono K., Osamura A., Nakamura K. et al. Effectiveness of probiotic therapy for the prevention of relapse in patients with inactive ulcerative colitis. World J. Gastroenterol. 2015. 21. 5985-94.
160. Meini S., Laureano R., Fani L., Tascini C., Galano A., Antonelli A. et al. Breakthrough Lactobacillus rhamnosus GG bacteremia associated with probiotic use in an adult patient with severe active ulcerative colitis: case report and review of the literature. Infection. 2015. 43. 777-81.
161. Vahabnezhad E., Mochon A.B., Wozniak L.J., Ziring D.A. Lactobacillus bacteremia associated with probiotic use in a pediatric patient with ulcerative colitis. J. Clin. Gastroenterol. 2013. 47. 437-9.
162. Prantera C., Scribano M.L., Falasco G., Andreoli A., Luzi C. Ineffectiveness of probiotics in preventing recurrence after curative resection for Crohn’s disease: a randomised controlled trial with Lactobacillus GG. Gut. 2002. 51. 405-9.
163. Schultz M., Sartor R.B. Probiotics and inflammatory bowel diseases. Am. J. Gastroenterol. 2000. 95. S19-21.
164. Guslandi M., Giollo P., Testoni P.A. A pilot trial of Saccharomyces boulardii in ulcerative colitis. Eur. J. Gastroenterol. Hepatol. 2003. 15. 697-8.
165. Rolfe V.E., Fortun P.J., Hawkey C.J., Bath-Hextall F. Probiotics for maintenance of remission in Crohn’s disease. Cochrane Database Syst. Rev. 2006. CD004826.
166. Campieri M., Rizzello F., Venturi A., Poggioli G., Ugolini F., Helwig U. Combination of antibiotic and probiotic treatment is efficacious in prophylaxis of post operative recurrence of Crohn’s disease: a randomized controlled study vs mesalazine. Gastroenterology. 2000. 118. A4179.
167. Garcia Vilela E., De Lourdes De Abreu Ferrari M., Oswaldo Da Gama Torres H., Guerra Pinto A. et al. Influence of Saccharomyces boulardii on the intestinal permeability of patients with Crohn’s disease in remission. Scand. J. Gastroenterol. 2008. 43. 842-8.
168. Singh S., Stroud A.M., Holubar S.D., Sandborn W.J., Pardi D.S. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst. Rev. 2015. 11. CD001176.
169. Mimura T., Rizzello F., Helwig U., Poggioli G., Schreiber S., Talbot I.C. et al. Once daily high dose probiotic therapy (VSL#3) for maintaining remission in recurrent or refractory pouchitis. Gut. 2004. 53. 108-14.
170. Gionchetti P., Rizzello F., Venturi A., Brigidi P., Matteuzzi D., Bazzocchi G. et al. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology. 2000. 119. 305-9.
171. Tursi A., Brandimarte G., Papa A., Giglio A., Elisei W., Giorgetti G.M. et al. Treatment of relapsing mild-to-moderate ulcerative colitis with the probiotic VSL#3 as adjunctive to a standard pharmaceutical treatment: a double-blind, randomized, placebo-controlled study. Am. J. Gastroenterol. 2010. 105. 2218-27.
172. Gionchetti P., Rizzello F., Helwig U., Venturi A., Lammers K.M., Brigidi P. et al. Prophylaxis of pouchitis onset with probiotic therapy: a double-blind, placebo-controlled trial. Gastroenterology. 2003. 124. 1202-9.
173. Kuisma J., Mentula S., Kahri A., Kahri A., Saxelin M., Farkkila M. Effect of Lactobacillus rhamnosus GG on ileal pouch inflammation and microbial flora. Aliment. Pharmacol. Ther. 2003. 17. 509-515.
174. Biancone L., Michetti P., Travis S., Escher J.C., Moser G., Forbes A. et al. European evidence-based Consensus in the management of ulcerative colitis: special situations. J. Crohns Colitis. 2008. 2. 63-92.
175. Turner D., Levine A., Escher J.C., Griffiths A.M., Russell R.K., Dignass A. et al. European Crohn’s and Colitis Organization; European Society for Paediatric Gastroenterology, Hepatology, and Nutrition. Management of pediatric ulcerative colitis: joint ECCO and ESPGHAN evidence-based consensus guidelines. J. Pediatr. Gastroenterol. Nutr. 2012. 55. 340-61.
176. El-Matary W., Otley A., Critch J., Abou-Setta A.M. Enteral Feeding Therapy for Maintaining Remission in Crohn’s Disease: A Systematic Review. J. Parenter. Enteral Nutr. 2015. 41. 550-561.
177. Takagi S., Utsunomiya K., Kuriyama S., Yokoyama H., Takahashi S., Iwabuchi M. et al. Effectiveness of an ‘half elemental diet’ as maintenance therapy for Crohn’s disease: A randomized-controlled trial. Aliment. Pharmacol. Ther. 2006. 24. 1333-40
178. Hirai F., Ishihara H., Yada S., Esaki M., Ohwan T., Nozaki R. et al. Effectiveness of concomitant enteral nutrition therapy and infliximab for maintenance treatment of Crohn’s disease in adults. Dig. Dis. Sci. 2013. 58. 1329-34.
179. Sazuka S., Katsuno T., Nakagawa T., Saito M., Saito K., Matsumura T. et al. Concomitant use of enteral nutrition therapy is associated with sustained response to infliximab in patients with Crohn’s disease. Eur. J. Clin. Nutr. 2012 Nov. 66. 1219-23.
180. Tsertsvadze A., Gurung T., Court R., Clarke A., Sutcliffe P. Clinical effectiveness and cost-effectiveness of elemental nutrition for the maintenance of remission in Crohn’s disease: a systematic review and meta-analysis. Health Technol. Assess. 2015. 19. 1-138.
181. Ruemmele F.M., Veres G., Kolho K.L., Griffiths A., Levine A., Escher J.C. et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J. Crohns Colitis. 2014. 8. 1179-207.
182. Battat R., Kopylov U., Szilagyi A., Saxena A., Rosenblatt D.S., Warner M. et al. Vitamin B12 deficiency in inflammatory bowel disease: prevalence, risk factors, evaluation, and management. Inflamm. Bowel Dis. 2014. 20. 1120-8.
183. Duerksen D.R., Fallows G., Bernstein C.N. Vitamin B12 malabsorption in patients with limited ileal resection. Nutrition. 2006. 22. 1210-3.
184. Headstrom P.D., Rulyak S.J., Lee S.D. Prevalence of and risk factors for vitamin B(12) deficiency in patients with Crohn’s disease. Inflamm. Bowel Dis. 2008. 14. 217-23.
185. Yakut M., Ustün Y., Kabaçam G., Soykan I. Serum vitamin B12 and folate status in patients with inflammatory bowel diseases. Eur. J. Intern. Med. 2010. 21. 320-3.
186. Stabler S.P. Clinical practice. Vitamin B12 deficiency. N. Engl. J. Med. 2013. 368. 149-160.
187. Plener I., Ferguson C., Kashkooli S., Saibil F. Oral B12 replacement in Crohn’s disease — is B12 by injection obsolete? Aliment. Pharmacol. Ther. 2014. 40. 1365-6.
188. Hornung N., Ellingsen T., Stengaard-Pedersen K., Poulsen J.H. Folate, homocysteine, and cobalamin status in patients with rheumatoid arthritis treated with methotrexate, and the effect of low dose folic acid supplement. J. Rheumatol. 2004. 31. 2374-81.
189. Halsted C.H., Gandhi G., Tamura R. Sulphasalazine inhibits the absorption of folates in ulcerative colitis. N. Engl. J. Med. 1981. 305. 1513-7.
190. Burr N.E., Hull M.A., Subramanian V. Folic Acid Supplementation May Reduce Colorectal Cancer Risk in Patients With Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. J. Clin. Gastroenterol. 2017. 51. 247-253.
191. Pironi L., Cornia G.L., Ursitti M.A., Dallasta M.A., Miniero R., Fasano F. et al. Evaluation of oral administration of folic and folinic acid to prevent folate deficiency in patients with inflammatory bowel disease treated with salicylazosulfapyridine. Int. J. Clin. Pharmacol. Res. 1988. 8. 143-8.
192. Honein M.A., Paulozzi L.J., Mathews T.J., Erickson J.D., Wong L.Y. Impact of folic acid fortification of the US food supply on the occurrence of neural tube defects. JAMA. 2001. 285. 2981-6.
193. Bryant R.V., Trott M.J., Bartholomeusz F.D., Andrews J.M. Systematic review: body composition in adults with inflammatory bowel disease. Aliment. Pharmacol. Ther. 2013. 38. 213-25.
194. Bryant R.V., Ooi S., Schultz C.G., Goess C., Grafton R., Hughes J. et al. Low muscle mass and sarcopenia: common and predictive of osteopenia in inflammatory bowel disease. Aliment. Pharmacol. Ther. 2015. 41. 895-906.
195. Wiroth J.B., Filippi J., Schneider S.M., Al-Jaouni R., Horvais N., Gavarry O. et al. Muscle performance in patients with Crohn’s disease in clinical remission. Inflamm. Bowel Dis. 2005. 11. 296-303.
196. Werkstetter K.J., Ullrich J., Schatz S.B., Prell C., Koletzko B., Koletzko S. Lean body mass, physical activity and quality of life in paediatric patients with inflammatory bowel disease and in healthy controls. J. Crohns Colitis. 2012. 6. 665-73.
197. Klare P., Nigg J., Nold J., Haller B., Krug A.B., Mair S. et al. The impact of a ten-week physical exercise program on health-related quality of life in patients with inflammatory bowel disease: a prospective randomized controlled trial. Digestion. 2015. 91. 239-47.
198. Cruz-Jentoft A.J., Landi F., Schneider S.M., Zúñiga C., Arai H., Boirie Y. et al. Prevalence of and interventions for sarcopenia in ageing adults: a systematic review. Report of the International Sarcopenia Initiative (EWGSOP and IWGS). Age Ageing. 2014. 43. 748-59.
199. Flores A., Burstein E., Cipher D.J., Feagins L.A. Obesity in Inflammatory Bowel Disease: A Marker of Less Severe Disease. Dig. Dis. Sci. 2015. 60. 2436-45.
200. Nic Suibhne T., Raftery T.C., McMahon O., Walsh C., O’Morain C., O’Sullivan M. High prevalence of overweight and obesity in adults with Crohn’s disease: associations with disease and lifestyle factors. J. Crohns Colitis. 2013. 7. e241-8.
201. Seminerio J.L., Koutroubakis I.E., Ramos-Rivers C., Hashash J.G., Dudekula A., Regueiro M. et al. Impact of Obesity on the Management and Clinical Course of Patients with Inflammatory Bowel Disease. Inflamm. Bowel Dis. 2015. 21. 2857-63.
/93_2.jpg)
/96.jpg)

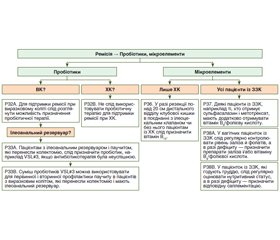
/93.jpg)
/94.jpg)
/97.jpg)
/100.jpg)
/103.jpg)
/105.jpg)
/106.jpg)