Вступ
Протягом останніх років значно збільшилося застосування рентгеноконтрастних препаратів (РКП) під час проведення урографії, ангіографії, комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ) та операційних процедур. Щорічно в світі використовується більше 80 млн доз РКП, але, незважаючи на використання більш нових і менш нефротоксичних препаратів, ризик контраст-індукованих уражень нирок залишається значним, особливо в пацієнтів із попередніми порушеннями ниркових функцій. Контраст-індуковане ураження нирок вважається серйозною причиною гострого ураження нирок та являє собою актуальну проблему в клінічній практиці. Гострі ураження нирок, що можуть виникати після внутрішньосудинного (в/в) введення йодовмісних рентгеноконтрастних препаратів, нагадують гострі ураження нирок, зумовлені іншими причинами. Тому гостре ураження нирок, що розвивається після внутрішньосудинного введення рентгеноконтрастних препаратів, зараз прийнято називати «контраст-індуковане гостре ниркове ураження» (КІ-ГНУ).
Контраст-індуковане гостре ниркове ураження — це ятрогенне гостре ураження нирок, що розвивається протягом декількох днів після внутрішньосудинного (внутрішньовенного, внутрішньоартеріального) застосування йодовмісних рентгеноконтрастних препаратів, за винятком інших альтернативних причин.
Для діагностики КІ-ГНУ доцільно використовувати міжнародну систему класифікації гострої ниркової недостатності (KDIGO) з оцінкою стадії тяжкості. КІ-ГНУ діагностується за наявності одного із нижченаведених критеріїв:
— підвищення концентрації креатиніну сироватки на 26,5 мкмоль/л і більше від вихідного рівня протягом 48 годин після введення РКП, або
— підвищення концентрації креатиніну сироватки в 1,5 раза порівняно з відомим вихідним рівнем протягом тижня до рентгеноконтрастного дослідження.
Якщо значення концентрації креатиніну протягом тижня не досліджувались, то використовують найменше його значення протягом останніх трьох місяців [5]. Незважаючи на те, що сироваткова концентрація креатиніну вважається найбільш чутливим показником ураження нирок, цей показник має низьку специфічність, бо може змінюватися залежно від дегідратації і під дією медикаментозних препаратів. Недавно проведені дослідження показали, що найбільш точним прогностичним фактором розвитку КІ-ГНУ виявилося наростання концентрації креатиніну сироватки крові через 12 годин після введення контрастного препарату порівняно з вихідним рівнем. Збільшення концентрації креатиніну сироватки крові на 5 % порівняно з вихідним рівнем дозволяє з 75% чутливістю і 72% специфічністю прогнозувати розвиток ранньої стадії КІ-ГНУ і порушення ниркових функцій протягом 30 днів (р < 0,001) [2]. За збережених функцій нирок (навіть у хворих з цукровим діабетом) ризик розвитку КІ-ГНУ невеликий і становить 1–2 % [4]. Однак у пацієнтів з уже існуючими порушеннями ниркових функцій або за наявності таких факторів ризику, як поєднання хронічної хвороби нирок (ХХН) з цукровим діабетом, хронічною серцевою недостатністю, похилим віком, прийомом нефротоксичних препаратів, частота КІ-ГНУ може зростати до 25 % [2]. Було показано, що в госпіталізованих хворих КІ-ГНУ спостерігається в 11 % випадків і займає третє місце серед основних найбільш частих причин гострої ниркової недостатності (ГНН), уступаючи тільки зниженню перфузії нирок і застосуванню нефротоксичних препаратів [3]. Після проведення КТ з в/в введенням низькоосмолярних рентгеноконтрастних препаратів у пацієнтів відділень інтенсивної терапії з нормальними вихідними показниками концентрації креатиніну сироватки збільшення концентрації креатиніну плазми більше ніж на 25 % спостерігалось у 18 % випадків. У контрольній групі у хворих, яким КТ проводилося без контрастування, концентрація креатиніну сироватки не змінювалась. Це дослідження продемонструвало, що у хворих, які знаходяться в критичному стані, навіть за вдаваного збереження функцій нирок в/в введення йодовмісних РКП супроводжується суттєвим збільшенням частоти розвитку КІ-ГНУ [2].
Рентгеноконтрастні препарати не реабсорбуються в ниркових канальцях. Їх період напіввиведення у разі внутрішньосудинного введення у пацієнтів з нормальними функціями нирок становить близько 2 годин. Протягом 4 годин екскретується 75 %, а протягом 24 годин — 98 % застосованої дози. У пацієнтів з нормальними функціями нирок приблизно через 150 хвилин після в/в введення концентрація РКП стрімко знижується, але у пацієнтів з вираженими порушеннями функцій нирок ця фаза може тривати до тижня [7].
Рентгеноконтрастні препарати за структурою молекул поділяють на іонні та неіонні, мономери та димери. До групи препаратів, що мають іонну димерну структуру, відносяться ioxaglate meglumine та ioxaglate sodium, які містять 320 мг/мл йоду, мають осмоляльність 600 мосм/кг Н2О і в’язкість 7,5 мПа × с за t = 37 °С. Ці препарати відносяться до РКП з низькою осмоляльністю.
До групи препаратів з низькою осмоляльністю, що мають неіонну мономерну структуру, відносяться:
— іopamidol — вміст йоду — від 200 до 370 мг/мл, осмоляльність — 413–796 мосм/кг Н2О, в’язкість — від 2,0 до 9,4 мПа × с за t = 37 °С;
— іohexol — осмоляльність — 322–520 мосм/кг Н2О;
— іopromide — осмоляльність — 328–483 мосм/кг Н2О;
— іoversol — осмоляльність — 502–651 мосм/кг Н2О;
— іobitridol — осмоляльність — 585 мосм/кг Н2О.
Вищеперераховані рентгеноконтрастні препарати мають меншу кількість побічних ефектів, меншу гостру нефротоксичність, тому широко використовуються в клінічній практиці. Побічні реакції відмічені у 1–3 % хворих з необтяженим анамнезом, у 16 % пацієнтів групи ризику.
До групи ізоосмоляльних препаратів, що мають неіонну димерну структуру, відноситься іodixanol: вміст йоду — 270–320 мг/мл, осмоляльність — 280–290 мосм/кг Н2О, в’язкість — 6,3–11,8 мПа × с за t = 37 °С. Цей рентгеноконтрастний препарат викликає менший осмотичний діурез, натрійурез і, відповідно, меншою мірою знижує об’єм циркулюючої крові. У разі застосування йодиксанолу не знижується артеріальний тиск (АТ), не виникають порушення ритму серця, зрідка спостерігаються алергічні реакції.
Визначення факторів ризику розвитку КІ-ГНУ
Серед факторів ризику розвитку КІ-ГНУ, пов’язаних з променевою процедурою, мають значення:
— тип контрастного препарату (його осмоляльність і в’язкість);
— технологія застосування — об’єм (доза), спосіб введення (внутрішньовенний або внутрішньоартеріальний);
— повторне введення протягом короткого проміжку часу — менше 24 годин (за винятком екстрених ситуацій) або багаторазове застосування протягом декількох днів;
— наявність ускладнень після попереднього застосування.
Фактори ризику розвитку КІ-ГНУ, які пов’язані з особливостями пацієнта, включають (2А):
— вік старше 75 років;
— захворювання нирок в анамнезі, що проявляються альбумінурією/протеїнурією, стійкими змінами в осаді сечі, змінами нирок, зафіксованими візуалізаційними методиками дослідження нирок, стійким зниженням швидкості клубочкової фільтрації (ШКФ) < 60 мл/хв/1,73 м2;
— трансплантація нирки, єдина нирка, рак нирки, операції на нирці;
— цукровий діабет;
— відоме або запідозрене гостре ниркове ураження;
— гіповолемія, дегідратація, нестабільна гемодинаміка, артеріальна гіпотензія, шок;
— хронічна серцева недостатність (клас 3–4 за NYHA), низька фракція викиду;
— гострий інфаркт міокарда (менше 24 годин з моменту розвитку);
— множинна мієлома;
— анемія;
— застосування нефротоксичних препаратів (циклоспорину А, аміноглікозидів, амфотерицину В, цисплатину, нестероїдних протизапальних препаратів, діуретиків та ін.).
Вважається, що за збереження функцій нирок (навіть у хворих з цукровим діабетом) ризик розвитку КІ-ГНУ невеликий і становить 1–2 % випадків. Однак у пацієнтів з попередніми порушеннями функцій нирок або наявністю певних факторів ризику (наприклад, поєднання хронічної хвороби нирок і цукрового діабету) частота КІ-ГНУ може зростати до 25 %.
У багатьох дослідженнях було показано, що у хворих з КІ-ГНУ підвищений ризик смерті або подовження термінів госпіталізації.
Механізми нефротоксичної дії рентгеноконтрастних препаратів, що вводяться внутрішньосудинно
У разі в/в введення рентгеноконтрастні речовини накопичуються в високих концентраціях у місцях з високою перфузією тканин, таких як нирки, печінка, головний мозок. Ці препарати практично не зв’язуються з білками плазми і мають період напіввиведення від 90 до 120 хвилин, але він може подовжуватися до 1 тижня у пацієнтів з вихідним порушенням ниркових функцій. У пацієнтів, у яких після внутрішньосудинного введення рентгеноконтрастних речовин розвивається КІ-ГНУ, смертність зростає до 20 % [1]. Крім того, КІ-ГНУ подовжує термін госпіталізації, виникає необхідність в проведенні замісної ниркової терапії, що підвищує вартість лікування [7].
Вважається, що безпосередні механізми ураження нирок рентгеноконтрастними речовинами зумовлені їх гіперосмолярною нефротоксичною дією на епітелій ниркових канальців. Це призводить до втрати епітеліальними клітинами ниркових канальців функцій, до їх апоптозу і, зрештою, до їх некрозу. Ці ефекти зумовлені біохімічними і фізичними властивостями кожного конкретного рентгеноконтрастного препарату.
На рівні окремого нефрона початкове ураження епітеліальних клітин ниркових канальців характеризується втратою ними мембранного потенціалу через вихід із ладу їх мембранної Na+/K+-АТФази, яка перерозподіляється від базолатеральної до просвітної поверхні епітеліальних клітин ниркових канальців, що призводить до порушення нормального транспорту іонів через клітинні мембрани та збільшення доставки натрію (а відповідно, і хлору) в дистальні звивисті канальці, де цей феномен порушує реабсорбцію калію. Таким чином, створюються умови для виникнення електролітних розладів у вигляді гіпонатріємії, гіпокаліємії, гіпохлоремії і, ймовірно, метаболічного алкалозу. Це явище призводить до стимуляції синтезу реніну завдяки тубулогломерулярному зворотному зв’язку з подальшим звуженням ниркових судин за рахунок стимуляції синтезу ангіотензину ІІ та альдостерону. Із прогресуванням клітинного ушкодження епітеліальні клітини відділяються від базальних мембран і викликають обструкцію просвіту ниркових канальців, підвищення тиску в них і, нарешті, зменшення швидкості клубочкової фільтрації.
Ішемічне ураження нирок посилюється пошкоджуючим впливом рентгеноконтрастних речовин на ендотелій ниркових судин за рахунок їх високої осмоляльності і в’язкості з порушенням продукції подразненими/ураженими ендотеліоцитами монооксиду азоту, простацикліну і надмірною продукцією подразненими/ураженими ендотеліоцитами ендотеліну І. Таким чином, рентгеноконтрастні агенти можуть призвести до внутрішньониркової вазоконстрикції, що, в свою чергу, може супроводжуватися зниженням рівня клубочкової фільтрації і доставки кисню метаболічно-активним структурам нефрона. Крім того, рентгеноконтрастні речовини збільшують в’язкість крові, що погіршує мікроциркуляторний кровотік, а підвищення осмоляльності крові, в свою чергу, погіршує здатність еритроцитів змінювати свою форму, що сумарно підвищує ризик тромбозу ниркових мікросудин. Ці механізми зумовлюють тривалу ішемію мозкового прошарку нирок [5, 7].
Таким чином, КІ-ГНУ виникає в результаті двох механізмів: прямої цитотоксичної дії рентгеноконтрастних речовин на епітелій ниркових канальців і ниркової ішемії/гіпоперфузії. Ці чинники також збільшують продукцію та звільнення активних кисневих радикалів, що токсично впливають на епітеліальні клітини ниркових канальців. В поєднанні зі зниженням продукції монооксиду азоту ендотелієм ниркових судин ці механізми зумовлюють ішемію нирок і нефропатію. Пряма цитотоксична дія рентгеноконтрастних речовин на епітеліальні клітини ниркових канальців зумовлена їх осмотичним зневодненням, некрозом або вакуолізацією, які свідчать про апоптоз епітеліальних клітин ниркових канальців після їх безпосереднього контакту з йодовмісними контрастними речовинами [5, 7].
Запобігання виникненню контраст-індукованого гострого ниркового ураження
Для запобігання виникненню КІ-ГНУ KDIGO рекомендується проведення профілактичних заходів.
1. Усім пацієнтам, яким планується процедура з внутрішньосудинним введенням йодовмісного РКП, необхідно оцінити ризик можливого розвитку КІ-ГНУ і проводити обстеження на предмет наявності вже існуючого порушення функції нирок (1С).
2. Пацієнти, які не мають вищеперерахованих факторів ризику розвитку КІ-ГНУ, яким планується стандартне рентгеноконтрастне дослідження, не потребують визначення вихідного рівня креатиніну сироватки перед внутрішньосудинним введенням йодовмісного РКП (2А).
3. У пацієнтів з високим ризиком розвитку КІ-ГНУ доцільно розглянути можливість використання альтернативних візуалізаційних методів діагностики, наприклад променевих методів дослідження без використання йодовмісних РКП за умови забезпечення ними достатньої інформації (2В).
4. Не рекомендується використовувати гадоліній-вмісних РКП при проведенні рентгенографії, КТ або ангіографії для того, щоб уникнути ризику КІ-ГНУ, пов’язаного з введенням йодовмісних РКП (1С).
5. У всіх пацієнтів, які мають ризик нефротоксичної дії РКП, до його введення повинен бути визначеним вихідний рівень креатиніну сироватки, і якщо він патологічно завищений, то процедура повинна бути відкладена до тих пір, поки цей показник не нормалізується. Винятком є ті ситуації, коли користь від термінового контрастного дослідження/втручання перевищує ризик його відтермінування (1А).
6. Пацієнтам, які знаходяться на замісній нирковій терапії і не входять в групу ризику КІ-ГНУ, може проводитися внутрішньосудинне введення йодовмісного РКП (2D).
7. Ризик розвитку КІ-ГНУ залежить від наявності у пацієнтів факторів ризику та зростає пропорційно збільшенню їх кількості (2В).
8. Не рекомендується застосування рентгеноконтрастних препаратів у пацієнтів з серцевою й судинною недостатністю, електролітними порушеннями до тих пір, доки не будуть скориговані гемодинамічні показники й електролітні відхилення в сироватці крові (1А).
9. Рекомендується відмінити прийом потенційно нефротоксичних препаратів за 1–2 дні (оптимально — за 3–4 дні) до проведення дослідження з використанням РКП (2С).
10. Пацієнтам з цукровим діабетом, які приймають метформін, не рекомендується припиняти лікування метформіном на період дослідження з використанням йодовмісних РКП, якщо ШКФ перевищує 45 мл/хв/1,73 м2. Після завершення дослідження рекомендується контролювати рівень креатиніну плазми (1А).
11. На період проведення рентгеноконтрастного дослідження лікування метформіном повинне бути тимчасово припиненим терміном на 48 годин, якщо ШКФ становить 30–44 мл/хв/1,73 м2 (1А).
12. Після проведення дослідження рекомендується контролювати показники ниркових функцій до тих пір, поки вони не нормалізуються і не стануть сприятливими для відновлення лікування метформіном (1А).
13. Рекомендується у пацієнтів високого ризику слідкувати за симптомами лактат-ацидозу (сонливість, млявість, гіперпное, спрага, анорексія, блювання, діарея, рН < 7,25, лактат плазми ≥ 5 ммоль/л) (2А).
14. Застосування метформіну та йодовмісних РКП протипоказано за ШКФ нижче 30 мл/хв/1,73 м2, наявності інтеркурентних захворювань з порушенням функції печінки, наявності серцевої недостатності, ішемії міокарда або периферичних м’язів, сепсису, тяжких інфекцій (1А).
15. У пацієнтів високого ризику рекомендуються повторні визначення концентрації креатиніну плазми через 48 і 72 години після рентгеноконтрастного дослідження (2D).
16. У пацієнтів з факторами ризику розвитку КІ-ГНУ рекомендується використання ізоосмолярних (іodixanol) або низькоосмолярних (іopamidol) йодовмісних РКП (1В).
17. У пацієнтів із значними порушеннями функцій нирок перевагу слід віддавати використанню ізоосмолярних йодовмісних препаратів (2С).
18. У пацієнтів високого ризику з порушеними функціями нирок не рекомендується використовувати гадолінійвмісні РКП (у дозах, що забезпечують порівнянний рівень рентгеноконтрастності, вони більш нефротоксичні) (2В).
19. Рекомендується використовувати мінімально можливі дози РКП, які дозволяють досягнути необхідного діагностичного результату.
Додаткові заходи/рекомендації для зниження ризику розвитку КІ-ГНУ:
— якщо можливо, до прийняття остаточного рішення про необхідність в/в введення РКП проведіть КТ-дослідження без контрастування; ретельно проаналізуйте результати та обговоріть їх з лікарем, який направив хворого на дослідження;
— з метою зниження кількості використаного контрасту у худорлявих пацієнтів дозуйте препарат на масу тіла;
— під час проведення КТ-ангіографії адаптуйте тривалість введення препарату до тривалості сканування так, щоб введення контрасту не продовжувалось після закінчення сканування;
— у пацієнтів з низьким ризиком розвитку КІ-ГНУ рекомендується використовувати пероральний шлях регідратації, якщо впевнені, що рідина й електроліти засвоюються у разі прийому всередину (2С);
— у пацієнтів з високим ризиком розвитку КІ-ГНУ з метою регідратації рекомендується використовувати інфузійну терапію паралельно з пероральним прийомом рідини (2С);
— у пацієнтів з підвищеним ризиком розвитку КІ-ГНУ з метою регідратації рекомендується використовувати адекватну інфузійну терапію 0,9% розчином натрію хлориду зі швидкістю 1,0–1,5 мл/кг/год протягом 6–12 годин до і після процедури (1А);
— гідратація 0,9% розчином натрію хлориду вважається більш ефективною порівняно з гідратацією 0,45% розчином натрію хлориду (1А);
— у пацієнтів з високим ризиком розвитку КІ-ГНУ можлива альтернативна гідратація розчином натрію бікарбонату (154 mEq/l в 5% розчині глюкози) зі швидкістю 3 мл/кг/год за 1 годину до і 1 мл/кг/год протягом 6 годин після введення йодовмісного РКП (1А);
— механізм дії натрію бікарбонату вивчений недостатньо, однак вважається, що інфузія натрію бікарбонату дозволяє знизити утворення вільних радикалів за рахунок збільшення рН вмісту ниркових канальців;
— інфузія натрію бікарбонату також сприяє видаленню потужного оксиданту — пероксинітриту, який утворюється із монооксиду азоту після його взаємодії з атомарним киснем на фоні зниженої активності супероксиддисмутази, яка в нормі перетворює атомарний кисень у молекулярний. Активні форми кисню разом із медіаторами запалення пошкоджують епітелій проксимальних канальців;
— інфузійна терапія розчином натрію бікарбонату не рекомендується пацієнтам з цукровим діабетом (1В);
— у пацієнтів з низьким ризиком розвитку КІ-ГНУ може бути ефективним використання N-ацетилцистеїну в поєднанні з ентеральним прийомом рідини (2D).
Не рекомендується використовувати для запобігання або лікування КІ-ГНУ: низькі дози допаміну (1A); фенолдопам (1С); передсердний натрійуретичний пептид (1C); антагоністи аденозину (теофілін) (2C); блокатори каналів кальцію (1С). Використання петльових діуретиків і манітолу збільшує ризик розвитку КІ-ГНУ, тому застосування їх в профілактиці КІ-ГНУ не виправдане (1B). Не рекомендовано використовувати сечогінні препарати для збільшення кількості сечі за встановленого ГНУ, за винятком водного навантаження (2C).
У пацієнтів з термінальною ХНН в стадії анурії, які знаходяться на замісній нирковій терапії діалізом, може здійснюватись внутрішньосудинне введення йодовмісних РКП без ризику додаткового пошкодження нирок (1А). У діалізних пацієнтів слід уникати осмотичного навантаження за рахунок внутрішньосудинного введення йодовмісних РКП і перенавантаження рідиною (1А).
Гідратацію у пацієнтів, які знаходяться на перитонеальному діалізі, слід проводити тільки після оцінки водного статусу пацієнта (1В). Час проведення наступного сеансу не залежить від часу введення йодовмісного РКП (1А). Для видалення йодовмісного РКП не має потреби в проведенні додаткового сеансу гідратації (1А).
Профілактичне проведення гідратації у пацієнтів з вихідним порушенням функцій нирок не зменшує ризик розвитку КІ-ГНУ (1С).
Гемофільтрація, проведена перед і після рентгеноконтрастного дослідження пацієнтам групи дуже високого ризику з ХХН 5-ї стадії, більш ефективна для запобігання ГНН, ніж гідратація сольовими розчинами (1С).
Рекомендують не використовувати з профілактичною метою видалення РКП за допомогою інтермітуючих гемодіалізів або гемофільтрацій (1С) [4, 5].
Клінічне спостереження
Хвора В., 68 років, була госпіталізована до відділення нефрології клінічної лікарні № 3 за актом самозвернення 07.09.2018 р. з діагнозом «гіперазотемія». Скарги на виражену загальну слабкість, нудоту, неприємний запах з роту. Вважала себе хворою впродовж 2 місяців, коли виникли загальна слабкість і нудота. У червні обстежувалась в клініці «Борис», куди надійшла швидкою допомогою. Були виконані МРТ головного мозку з контрастуванням і визначені рівні гормонів, які відображали функцію гіпофіза, щитоподібної залози і наднирників. Були діагностовані: багатовузловий еутиреоїдний зоб, мікроаденома гіпофіза (нормотропінома), вторинний гіперкортицизм?
Гормональне дзеркало: тиреотропний гормон (ТТГ) — 2,07 мкМО/мл (норма — 0,4–4,0); тироксин (вільний) — 19,1 пмоль/л — норма, соматотропний гормон — 0,18 — норма; адренокортикотропний гормон (АКТГ) — 51,0 пг/мл (норма — 6–58); кортизол — 693,6 нмоль/л (норма: ранок — 190–690; вечір — 51–250); К+ плазми — 3,5; Са++ плазми — 1,18 ммоль/л (концентрація інших електролітів плазми у виписці не подається); глікований гемоглобін — 5,6 %.
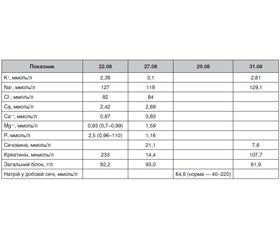
Стан хворої не покращувався, і 22.08.2018 р. хвору госпіталізують до гастроентерологічного відділення клінічної лікарні «Феофанія». Під час госпіталізації виражена слабкість, нудота, які обумовлені водно-електролітними порушеннями: гіпокаліємією, гіпонатріємією та підвищеним вмістом сечовини і креатиніну крові, виражена артеріальна гіпотонія. Біохімічні аналізи крові під час госпіталізації і в процесі лікування наведені в табл. 1.
Лікування протягом 10 днів: дієта № 5 з підвищеним вмістом солі; розчин Рінгера 400,0 + розчин трисоль 400,0 + 10% розчин NaCl 40,0 + 4% KCl 40,0 + реосорбілакт 400,0; аспаркам, бетаргін, проксіум, кортексин, перорально: атоксіл, проксіум, хофітол, аторвастатин, відвар насіння льону, АЦЦ.
31.08.2018 р. стан хворої покращився, електролітні порушення потребують продовження лікування амбулаторно практично в тому ж обсязі, що й у стаціонарі.
Діагноз під час виписки: виразкова хвороба дванадцятипалої кишки в стадії загострення, рецидивуючий перебіг, конкремент правої нирки. Астеноневротичний синдром, соматогенно-обумовлений. Аденома гіпофізу?
І нічого про причину електролітних порушень, про гіперазотемію. Ніякого діагнозу!
Тому через тиждень, 07.09.2018 р., хвора звернулася в клінічну лікарню № 3 зі скаргами, що були описані вище.
У процесі лікування спостерігалась така динаміка біохімічних аналізів крові (табл. 2).
Добова сеча від 17.09.2018 р.: К+ — 63 ммоль (норма — 25–120); Na+ — 94,7 ммоль (норма — 90–220); Cl — 144 ммоль (норма — 95–195); Ca++ — 4,84 ммоль (норма — 2,5–7,5).
Таким чином, клініка захворювання пацієнтка складалась: з гіпокаліємії, гіпонатріємії, гіпохлоремії, гіпокальціємії, нормомагніємії; транзиторної гіперазотемії; суттєвої гіперренінемії, нормоальдестеронізму, гіперпаратиреоїдизму, гіперкортицизму за нормальної концентрації АКТГ; низького АТ, м’язової слабкості, гіперлактатемії, яка, можливо, нівелювала вихідний метаболічний алкалоз.
Лікування: з 07.09 по 10.09 (нефрологія): 5% глюкоза 400,0 + інсулін 6 ОД + 4% КCl 40,0 × 4 р/добу; 0,9% NaCl 400,0 + 10% CaCl2 20,0 × 2 р/добу.
На фоні такого неповноцінного лікування стан хворої продовжував погіршуватись і 10.09 біохімічні аналізи крові погіршились: К+ плазми — 1,8 ммоль/л; Na+ плазми — 113 ммоль/л; Cl плазми — 72 ммоль/л; сечовина плазми — 30,0 ммоль/л; креатинін плазми — 338 мкмоль/л. В зв’язку з цим хвора переводиться до блоку реанімації та інтенсивної терапії (БРІТ), де хворій була призначена повноцінна терапія, спрямована на корекцію електролітних порушень.
Програма інтенсивної терапії у БРІТ
10.09: 0,9% NaCl 400,0 + 10% NaCl 50,0 + 4% KCl 50,0 + 10% кальцію глюконат (CaGl) 30,0 × 3 р/добу, діурез — 2200 мл.
11.09: 0,9% NaCl 400,0 + 10% NaCl 50,0 + 4% KCl 50,0, діурез — 1900,0 мл.
12.09: 0,9% NaCl 400,0 + 10% NaCl 20,0 + 4% KCl 50,0 × 3 р/добу, АТ — 100/60 мм рт.ст., діурез — 1400,0 мл.
13.09: 0,9% NaCl 400,0 + 10% NaCl 20,0 + 4% KCl 50,0 × 4 р/добу, частота серцевих скорочень (ЧСС) — 79/хв, діурез — 1500 мл.
14.09: 0,9% NaCl 400,0 + 4% KCl 50,0 + CaGl 10,0 × 4 р/добу, АТ — 90/60 мм рт.ст., ЧСС — 66–105/хв.
15.09: 0,9% NaCl 400,0 + 4% KCl 50,0 + CaGl 10,0 × 4 р/добу, АТ — 90/60 мм рт.ст., ЧСС — 74–84/хв, діурез — 1700 мл.
На фоні вищевказаного лікування електролітні порушення були повністю скориговані: К+ — 4,3 ммоль/л; Na+ — 144 ммоль/л; Cl — 108 ммоль/л, азотемія знижувалася, концентрація креатиніну плазми — 77 мкмоль/л, сечовини плазми — 3,2 ммоль/л.
13.09.2018 р. хвора консультована професором-нефрологом О. Івановим. Діагноз: контраст-індуковане гостре ниркове ураження. Вторинний гіперпаратиреоз.
20.09.2018 р. хвора виписана із стаціонару в задовільному стані.
Обговорення клінічного спостереження
Таким чином, у даному клінічному випадку мало місце контраст-індуковане ураження нирок після проведення МРТ головного мозку з контрастуванням, яке протягом 2 місяців проявлялось суттєвою азотемією (рівень креатиніну сироватки коливався від 233 мкмоль/л 22.08.2018 р. до 710 мкмоль/л 07.09.2018 р.) і критичними порушеннями електролітного обміну у вигляді критичної гіпонатріємії — 113 ммоль/л, критичної гіпокаліємії — 1,8 ммоль/л, критичної гіпохлоремії — 72 ммоль/л (аналізи від 10.09.2018). Незважаючи на такі небезпечні показники гіпонатріємії в плані розвитку набряку мозку, клінічних ознак набряку мозку не реєструвалось. Вказана критична гіпокаліємія не супроводжувалась життєво небезпечними порушеннями серцевого ритму. Критична гіпохлоремія супроводжувалась мінімальними лабораторними ознаками метаболічного алкалозу: рН — 7,48, рСО2 — 32,5 мм рт.ст., АВ — 25,0 ммоль/л, ВЕ — 0,8 (аналіз від 10.09.2018). Незважаючи на існування протягом більше 2 місяців у даної пацієнтки всіх лабораторних ознак контраст-індукованого гострого ниркового ураження, діагноз своєчасно не був установлений, що опосередковано може свідчити про недостатню обізнаність практикуючих лікарів з діагностикою КІ-ГНУ. На ліквідацію цієї прогалини в медичній освіті лікарів і направлений зміст даної лекції.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/37.jpg)
/38.jpg)
/39.jpg)