Архив офтальмологии Украины Том 8, №2, 2020
Вернуться к номеру
Маркери апоптозу й прогресування глаукомної оптичної нейропатії після хірургічного лікування первинної відкритокутової глаукоми
Авторы: Могілевський С.Ю.(1), Сердюк А.В.(1), Зябліцев С.В.(2)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
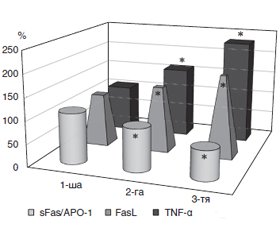
Актуальність. Механізми апоптозу нейронів зорового нерва при первинній відкритокутовій глаукомі (ПВКГ) продовжують вивчатися; встановлено, що певними маркерами цього процесу є фактор некрозу пухлини α (TNF-α), Fas-ліганд (FasL) і розчинна форма Fas-рецептора (sFas/АРО-1). Мета дослідження: дослідити зв’язок маркерів апоптозу (TNF-α, FasL і sFas/АРО-1) з прогресуванням глаукомної оптичної нейропатії після хірургічного лікування первинної відкритокутової глаукоми. Матеріали та методи. Обстежено 69 пацієнтів (69 очей) із ПВКГ І–ІІІ стадій, яким виконували трабекулектомію з імплантацією шунта Ex-Press. У внутрішньоочній рідині (ВОР) визначали зазначені маркери методом імуноферментного аналізу. Повторне офтальмологічне обстеження проводили через 3 і 6 місяців і 1 рік. Контрольну групу становили 25 пацієнтів (25 очей), яких було прооперовано з приводу вікової катаракти. У цих пацієнтів також був вивчений вміст маркерів апоптозу у ВОР. Статистичний аналіз проводили за допомогою пакета програм SPSS 11.0, MedStat. Результати. Внутрішньоочний тиск через три місяці після операції за наявності або відсутності післяопераційного прогресування оптичної нейропатії не відрізнявся. Уміст TNF-α найвищим був при 3-й стадії ПВКГ і перевищував значення в контролі у 2,3 раза (p < 0,001). Аналогічні різниці відмічені за вмістом у ВОР FasL, який був максимальним при 3-й стадії і перевищував контроль у 1,9 раза (p < 0,001). Уміст sFas/APO-1 відповідно до стадії ПВКГ був нижчим (р < 0,001). Уміст у ВОР TNF-α і FasL був вищим при прогресуванні оптичної нейропатії, тоді як вміст sFas/APO-1 був меншим (p < 0,001). Максимальна абсолютна різниця була наявна для sFas/APO-1 (у 2,5 раза), була меншою для TNF-α (у 1,7 раза) і FasL (у 1,6 раза). Висновки. Зіставлення отриманих даних з літературними вказує на важливу патогенетичну роль маркерів апоптозу й може свідчити про можливість їх використання для прогнозування розвитку й прогресування глаукомної оптичної нейропатії при ПВКГ і після її хірургічного лікування.
Актуальность. Механизмы апоптоза нейронов зрительного нерва при первичной открытоугольной глаукоме (ПОУГ) продолжают изучаться; установлено, что маркерами этого процесса являются фактор некроза опухоли α (TNF-α), Fas-лиганд (FasL) и растворимая форма Fas-рецептора (sFas/АРО-1). Цель исследования: исследовать связь маркеров апоптоза (TNF-α, FasL и sFas/АРО-1) с прогрессированием глаукомной оптической нейропатии после хирургического лечения первичной открытоугольной глаукомы. Материалы и методы. Обследовано 69 пациентов (69 глаз) с ПОУГ I–III стадий, которым выполняли трабекулэктомию с имплантацией шунта Ex-Press. Во внутриглазной жидкости (ВГЖ) определяли указанные маркеры методом иммуноферментного анализа. Повторное офтальмологическое обследование проводили через 1 год. Контрольную группу составили 25 пациентов, прооперированных по поводу возрастной катаракты. Статистический анализ проводили с помощью программ SPSS 11.0, MedStat. Результаты. Внутриглазное давление через три месяца после операции при наличии или отсутствии послеоперационного прогрессирования оптической нейропатии не отличалось. Содержание TNF-α было максимальным при 3-й стадии ПОУГ и превышало значение в контроле в 2,3 раза (p < 0,001). Аналогичные различия отмечены по содержанию FasL, которое было максимальным при 3-й стадии и превышало контроль в 1,9 раза (p < 0,001). Содержание sFas/APO-1 по стадиям ПОУГ было ниже (р < 0,001). Уровень TNF-α и FasL был выше при послеоперационном прогрессировании оптической нейропатии, тогда как содержание sFas/APO-1 было меньше (p < 0,001). Максимальная абсолютная разница отмечена для sFas/APO-1 (в 2,5 раза), меньшая — для TNF-α (в 1,7 раза) и FasL (в 1,6 раза). Выводы. Сопоставление полученных данных с литературными указывает на важную патогенетическую роль маркеров апоптоза и возможность их использования для прогнозирования развития ПОУГ и ее прогрессирования после хирургического лечения.
Background. The mechanisms of apoptosis of optic nerve neurons in primary open-angle glaucoma (POAG) continue to be studied. It was found that markers of this process are tumor necrosis factor α (TNFα), Fas-ligand (FasL) and soluble form of Fas-receptor (sFas/APO-1). The purpose of the study was to investigate the relationship of apoptosis markers (TNFα, FasL and sFas/APO-1) with the progression of glaucomatous optic neuropathy after surgical treatment for primary open-angle glaucoma. Materials and methods. Sixty-nine patients (69 eyes) with POAG stages I–III were examined, they underwent trabeculectomy with Ex-Press shunt implantation. The content of specified markers in the intraocular fluid was determined by enzyme-liked immunoassay. Repeated ophthalmologic examination was performed in 3 and 6 months and after one year. The control group consisted of 25 patients (25 eyes) who underwent surgery for age-related cataracts. The content of apoptosis markers in the intraocular fluid was also studied in these patients. Statistical analysis was performed using the software packages SPSS 11.0, MedStat. Results. The intraocular pressure did not differ 3 months after surgery in the presence or absence of postoperative progression of optic neuropathy. The content of TNFα was highest in POAG stage III and exceeded that of in the control group by 2.3 times (p < 0.001). Similar differences are noted for the FasL content, which was maximal in stage III and 1.9-fold higher than in controls (p < 0.001). The level of sFas/APO-1 according to POAG stage was lower (p < 0.001). The content of TNFα and FasL in the intraocular fluid was higher with the progression of optic neuropathy, while the level of sFas/APO-1 was lower (p < 0.001). The maximum absolute difference is observed for sFas/APO-1 (2.5 times), it was smaller for TNFα (1.7 times) and FasL (1.6 times). Conclusions. Comparison of the obtained data with literature indicates an important pathogenic role of apoptosis markers and may indicate the possibility of their use to predict the development and progression of glaucomatous optic neuropathy in POAG and after its surgical treatment.
первинна відкритокутова глаукома; глаукомна оптична нейропатія; хірургічне лікування; TNF-α; Fas-ліганд; sFas/АРО-1
первичная открытоугольная глаукома; глаукомная оптическая нейропатия; хирургическое лечение; TNF-α, Fas-лиганд; sFas/АРО-1
primary open-angle glaucoma; glaucomatous optic neuropathy; surgical treatment; tumor necrosis factor α; Fas-ligand; sFas/APO-1
Вступ
Матеріали та методи
Результати та обговорення
/31.jpg)
Висновки
- Нестеров А.П. Глаукома. 2-е изд. Москва: Медицинское информационное агентство, 2014. 360 с.
- EGS Guidelines 4th ed. European Glaucoma Society. URL: https://www.eugs.org/eng/egs_guidelines_reg.asp?l = 1.
- Могілевський С.Ю., Зябліцев С.В., Денисюк Л.І. Прогресування первинної відкритокутової глаукоми в залежності від клінічних показників, визначених при первинному обстеженні. Офтальмологічний журнал. 2017. № 1. С. 15-19.
- US Eye disease statistics. American academy of ophthalmology. URL: https://www.aao.org/eye-disease-statistics.
- Вітовська О.П. Організаційне та ресурсне забезпечення реалізації в Україні Національної стратегії боротьби із первинною глаукомою. Україна. Здоров’я нації. 2010. № 1. C. 40-47.
- Tham Y.C., Li X., Wong T.Y., Quigley H.A., Aung T., Cheng C.Y. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014. Vol. 121. № 11. P. 2081-2090.
- Youngblood H., Hauser M.A., Liu Y. Update on the genetics of primary open-angle glaucoma. Exp. Eye Res. 2019. Vol. 188. № 13. P. 107795.
- Rusciano D., Pezzino S., Mutolo M.G., Giannotti R., Librando A., Pescosolido N. Neuroprotection in glaucoma: Old and new promising treatments. Adv. Pharmacol. Sci. 2017. 2017. P. 4320408.
- Mudassar Imran Bukhari S., Yew K.K., Thambiraja R., Sulong S., Ghulam Rasool A.H., Ahmad Tajudin L.S. Microvascular endothelial function and primary open angle glaucoma. Ther. Adv. Ophthalmol. 2019. Vol. 22. № 11. P. 2515841419868100.
- Михейцева И.Н. Глаукомная оптическая нейропатия — основные аспекты патогенеза. Архів клінічної та експериментальної медицини. 2009. Vol. 18. № 2. P. 235-240.
- Apoptosis — an overview. Science Direct Topics. Retrieved 2019-03-19. URL: https://www.sciencedirect.com.
- Chen Q., Xi Х., Zeng Y., He Z., Zhao J., Li Y. Acteoside inhibits autophagic apoptosis of retinal ganglion cells to rescue glaucoma-induced optic atrophy. J. Cell. Biochem. 2019. Vol. 120. № 8. P. 13133-13140.
- Levkovitch-Verbin H. Retinal ganglion cell apoptotic pathway in glaucoma: Initiating and downstream mechanisms. Prog. Brain Res. 2015. Vol. 220. P. 37-57.
- Сердюк В.М. Клініко-експериментальне обґрунтування нейропротекції в комплексі лікування хворих на первинну відкритокутову глаукому: Автореф. дис… д-ра мед. наук / Нац. акад. мед. наук України, Ін-т оч. хвороб і тканинної терапії ім. В.П. Філатова. Одеса. 14.01.18 — офтальмологія. 2015. 35 с.
- Слепова О.С., Фролов М.А., Морозова Н.С., Фролов А.М., Ловпаче Дж.Н. Маркеры Fas-опосредованного апоптоза при первичной открытоугольной глаукоме и возможности их фармакологической коррекции. Вестник офтальмологии. 2012. № 4. C. 27-31.
- Мисюрин В.А. Структура и свойства основных рецепторов и лигандов внешнего пути апоптоза. Рос. биотерапевт. журн. 2015. Т. 14. № 2. P. 23-30.
- Курышева Н.И. Глаукомная оптическая нейропатия (обзор литературы). Москва: МЕДпресс-информ, 2006. 136 с.
- Sun Y., Zhang B., Zhou R., Wang T., Deng J. Trabeculectomy and EX-PRESS implantation in open-angle glaucoma: An updated meta-analysis of randomized controlled trials. J. Ophthalmol. 2019. Vol. 2019. P. 2071506.
- Могілевський С.Ю., Сердюк О.В. Прогресування глаукомної оптичної нейропатії після різних видів антиглаукоматозних операцій. Вісник проблем біології і медицини. 2019. Вип. 4. Т. 2. С. 195-199.
- Петров С.Ю., Фокина Н.Д., Шерстнева Л.В., Вострухин С.В., Сафонова Д.М. Этиология первичной глаукомы: современные теории и исследования. Офтальмологические ведомости. 2015. Т. 8. № 2. С. 47-56.
- Белецкая И.С., Астахов С.Ю. Роль матриксных металлопротеиназ в патогенезе глаукомы. Офтальмологические ведомости. 2015. Т. 8. № 3. C. 28-43.
- Соколов В.А., Леванова О.Н. Роль матриксных металлопротеиназ в патогенезе первичной открытоугольной глаукомы. Рос. медико-биол. вестник имени академика И.П. Павлова. 2013. № 2. C. 136-141.
- Williams P.A., Marsh-Armstrong N., Howell G.R. Neuroinflammation in glaucoma: A new opportunity. Exp. Eye Res. 2017. Vol. 157. P. 20-27.
- He S., Stankowska D.L., Ellis D.Z., Krishnamoorthy R.R., Yorio T.J. Targets of neuroprotection in glaucoma. J. Ocul. Pharmacol. Ther. 2018. Vol. 34. № 1–2. P. 85-106.
- Pinazo-Durán M.D., Zanón-Moreno V., García-Medina J.J., Gallego-Pinazo R. Evaluation of presumptive biomarkers of oxidative stress, immune response and apoptosis in primary open-angle glaucoma. Curr. Opin. Pharmacol. 2013. Vol. 13. № 1. P. 98-107.
- Razeghinejad M.R., Kamali-Sarvestani E. Aqueous humor levels of soluble Fas and Fas-ligand in patients with primary open angle and pseudoexfoliation glaucoma. Iran J. Immunol. 2007. Vol. 4. № 4. P. 215-219.

/31_2.jpg)
/32.jpg)