Вступ
Рак молочної залози (РМЗ) залишається лідером у структурі онкологічної захворюваності й смертності жіночого населення від злоякісних новоутворень, вражаючи 2,1 мільйона жінок щорічно. За даними Всесвітньої організації охорони здоров’я (WHO), у 2018 році від РМЗ померло 627 000 жінок — це приблизно 15 % всіх випадків смерті від раку серед жінок. Хоча рівень захворюваності вищий у більш розвинених країнах, він збільшується майже в усіх регіонах світу.
За даними канцер-реєстру України за 2018 рік, серед 10 нозологічних форм злоякісних новоутворень у структурі захворюваності й смертності серед жіночого населення перше місце посідає РМЗ — 20,6 % серед захворілих і 20,5 % — серед померлих від злоякісних новоутворень [1].
Незважаючи на успіхи протипухлинної терапії, появу таргетної та імунотерапії, РМЗ залишається актуальною медичною і соціальною проблемою. Одним із шляхів підвищення ефективності лікування є пошук мішеней для ефективних протипухлинних впливів. Значний інтерес становить пролактин (Прл) як фактор виникнення, прогресування й можливої таргетної терапії РМЗ. Уже мали місце декілька сплесків інтересу вчених до вивчення цієї ролі Прл, останній спостерігається в наш час.
Пролактин у 70-ті роки ХХ століття атрибутувався як гормон, що відіграє суттєву роль у патогенезі й прогресуванні РМЗ у гризунів. Однак клінічні дослідження, проведені у 80-х роках у когорті пацієнток із РМЗ, довели неефективність протипухлинного застосування пролактин-інгібуючих засобів. Ці дані переконали багатьох онкологів переглянути потенційну роль Прл при неопластичному процесі в молочній залозі (МЗ), особливо як агента авто- і паракринних впливів. Упродовж останнього десятиріччя наукова періодика збагатилась новими роботами, короткі відомості з яких ми висвітлюємо в цьому огляді [15].
Були відібрані публікації (огляди, оригінальні статті, дані доклінічних і клінічних досліджень, метааналізи), отримані при використанні пошукових баз даних Pubmed, Medline, Medscape за ключовими словами breast cancer, prolactin, prolactin receptor, hyperprolactinemia, review. Публікації охоплювали 1970–2020 роки.
Уперше пролактин був відкритий як «лактогенна субстанція», присутня в гіпофізі корів, у 1928 році. Як окрема молекула людський Прл був виділений А. Францем і Д. Кляйнбергом тільки в 1970 році [2].
Фізіологія пролактину
Пролактин є одним із гіпофізарних гормонів і має властивості молекулярного поліморфізму. Це один із найбільш філогенетично давніх гормонів, який секретує аденогіпофіз. Він виконує близько 100 різних функцій у різних тварин (рептилій, амфібій, птахів, ссавців) [2].
Він є поліпептидним гормоном, що складається з 199 амінокислот і має молекулярну масу 23,5 кДа; послідовність амінокислот подібна до такої в соматотропного гормону. Синтез і секреція Прл відбуваються переважно в лактотрофах аденогіпофізу; їх кількість коливається від 10 до 30 % усього клітинного пулу останнього. Встановлені численні локуси позагіпофізарного синтезу Прл: тимус, лімфовузли, потові залози, молочна залоза, ендо- та міометрій, селезінка, печінка, трофобласт [3, 5] (табл. 1).
Відомі 4 ізоформи циркулюючого Прл [4]:
1. Низькомолекулярний Прл (16 кДа) бере участь у процесах росту й розвитку молочних залоз, ангіогенезі та відіграє незначну роль у регуляції репродуктивної функції.
2. «Малий» Прл (23 кДа) — форма гормону з високою рецепторною здатністю й біологічною активністю, його роль — регуляція репродуктивних процесів і лактація.
3. Глікозильована форма (G-пролактин) (25 кДа) характеризується найбільшою біологічною активністю, є основною складовою фракцією Прл при аденомах гіпофіза.
4. «Великий» (bіg) (молекулярна маса 50 кДа) — вплив на організм людини чітко не визначений.
5. Макропролактин («дуже великий», big-big) — з молекулярною масою 150 кДа.
Біологічні ефекти Прл пов’язують з активністю саме мономерних низькомолекулярних ізоформ (16, 23, 25 кДа), вони мають високу афінність. «Великий» і макропролактин мають більш низьку біологічну активність і більш низьку спорідненість до рецепторів. При цьому імуногенність різних форм Прл однакова.
Слід зауважити, що рутинні радіоімунологічні методи визначають загальну концентрацію всіх фракцій Прл. Відсутність клінічних проявів при гіперпролактинемії при високих показниках сироваткового Прл може бути обумовлена значним превалюванням саме високомолекулярних ізоформ Прл, що мають низьку спорідненість до рецепторів, а отже, низьку біоактивність [5]. У подібних клінічних випадках є необхідність у визначенні окремих фракцій Прл.
Синтез і секреція
Фізіологічна секреція Прл має імпульсний характер протягом доби. Виявлені чіткі зміни секреції протягом дня, що не відповідають циркадному ритму: постійне підвищення Прл відмічається під час сну незалежно від часу доби. Підвищення рівня Прл відмічається через 60–90 хвилин після засипання. Стадія сну не впливає на його концентрацію. Максимум секреції спостерігається між 5–7-ю годинами ранку. Концентрація знижується з 10–11-ї години ранку й опівдні досягає мінімуму. Період напіврозпаду в крові становить 20–30 хв [11, 34].
Синтез Прл перебуває під безпосереднім контролем гіпоталамуса, проте контроль гіпоталамо-пролактинової осі відрізняється від інших гіпофізарних регуляторних систем. До таких особливостей можна віднести наступні:
1. Синтез Прл регулюється не за системою класичного зворотного зв’язку, притаманного більшості інших гормонів, а особливим зворотним зв’язком — за типом «короткої петлі».
2. Гіпоталамічна система регуляції Прл не стимулююча, а інгібуюча.
3. Регуляторною молекулою є не пептидний гормон гіпоталамуса, а катехоламінергічний нейротрансмітер — дофамін.
4. Як указано вище, підвищена концентрація Прл стимулює секрецію дофаміну. На сьогодні залишається до кінця незрозумілим, як макромолекула Прл проникає через гематоенцефалічний бар’єр (ГЕБ) у nucleus arcuata й еminentia mediana гіпоталамуса. Існують думки, що вказані анатомічні структури можуть мати недосконалий ГЕБ.
5. Прл — єдиний гормон передньої частки гіпоталамуса, що не має ендокринного органа-мішені. Це молекула з широким спектром фізіологічних ефектів.
Стимулятори й інгібітори
Дофамін гальмує виділення Прл, а тиреотропін-рилізинг-гормон є гормоном-стимулятором. Менша інгібіторна дія притаманна адреналіну, норадреналіну, соматостатину, простагландинам. До ендогенних стимуляторів секреції належать мелатонін, серотонін, гамма-аміномасляна кислота, ендорфіни й енкефаліни [5, 6]. Синтез і секрецію також стимулюють ендогенні й екзогенні естрогени.
До фізіологічних станів, що призводять до підвищення рівня пролактину, належить вагітність, стимуляція сосків, грудне вигодовування, статевий акт, сон, стрес, загальна анестезія і хірургічні втручання. Можливе підвищення рівня Прл при низці патологічних станів, таких як ендометріоз, синдром полікістозних яєчників, синдром «пустого» турецького сідла, метастатичне ураження головного мозку, гіпотиреоз і гіпертиреоз, синдром Аддісона, цироз печінки й хронічна ниркова недостатність.
До фармакологічних препаратів, що найчастіше призводять до гіперпролактинемії, належать опіати й антагоністи опіатів, антагоністи кальцію, комбіновані оральні контрацептиви, нейролептики й антидепресанти, антагоністи дофаміну [3, 5].
«Коротка петля»
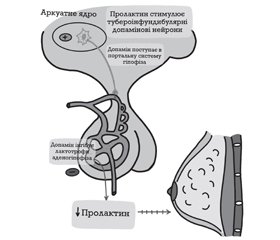
Головним пролактин-інгібуючим фактором є дофамін, який синтезується в аркуатному ядрі гіпоталамуса, по тубероінфундибулярному дофамінергічному тракту транспортується до еminentia mediana гіпоталамуса, далі надходить у портальну судинну систему аденогіпофіза й прямує до лактотрофів, інгібуючи їх проліферацію, синтез і секрецію Прл. Секреція регулюється за принципом «короткої петлі», тобто рівень гіпофізарного Прл регулює секрецію дофаміну в гіпоталамусі (рис. 1).
Секреція і регуляція при вагітності й лактації
З 20-го тижня вагітності рівень Прл значно підвищується (до 200–320 нг/мл). Під час вагітності лактація відсутня, незважаючи на високий вміст Прл, через високу концентрацію естрогенів і прогестерону. Пусковим механізмом лактації є падіння концентрації прогестерону після народження плаценти. До 4–6-го тижня післяпологового періоду рівень Прл знижується до 20 нг/мл.
Подразнення механорецепторів сосків при прикладанні до грудей дитини передається через спинний мозок по аферентним нейронам у гіпоталамус, який гальмує виділення дофаміну, що сприяє збільшенню концентрації Прл у крові. Пролактин стимулює розвиток секреторного апарату молочної залози в період вагітності. Вазопресин і окситоцин, що синтезуються в паравентрикулярному й супраоптичному ядрах гіпоталамуса, підвищують рівень Прл в сироватці крові. Відомо, що Прл бере участь у поведінкових реакціях, загострює материнський інстинкт. Зовнішні стимули, такі як крик дитини, через вплив на кору головного мозку стимулюють синтез Прл (рис. 2) [34].
Значення в клініці гіперпролактинемічних станів
У загальній популяції гіперпролактинемія зустрічається менше ніж в 1 % населення. Вираженість варіює від асимптомного лабораторного феномену до станів, що вимагають хірургічного лікування (макропролактинома). У 25–40 % усіх випадків вона є причиною жіночого безпліддя. Гіперпролактинемія зустрічається в 10 % жінок з аменореєю, у 20–30 % — із галактореєю і в 70 % пацієнток, які мають ці два симптоми [31, 32].
Незалежно від причини гіперпролактинемії надлишкова секреція Прл призводить до порушення виділення лютеїнового і фолікулостимулюючого гормонів, і як наслідок, до гіпогонадизму й безпліддя. З боку репродуктивної системи в жінок спостерігається галакторея, порушення менструального циклу (аменорея, олігоопсоменорея, ановуляторні цикли, недостатність лютеїнової фази), безпліддя, зниження лібідо. У чоловіків проявами гіперпролактинемії можуть бути зниження чи відсутність лібідо й потенції, безпліддя внаслідок олігоспермії, гінекомастія. Пацієнти з макропролактиномами мають симптоми, пов’язані з наявність об’ємного утворення: головний біль, підвищення внутрішньочерепного тиску, звуження полів зору [33].
Внутрішньоклітинний сигнальний каскад реалізації ефекту пролактину
JAK/STAT — один із найважливіших сигналів передачі Прл, крім того, це ланцюг взаємодії між білками в клітині, що регулює процеси імунітету, поділу й апоптозу клітин, бере участь у канцерогенезі [8].
Зв’язування Прл з рецептором викликає фосфорилювання цитоплазматичної тирозинкінази JAK 2 (Janus kinase). Це, у свою чергу, призводить до фосфорилювання білків — переносників сигналів і активаторів транскрипції STAT (Signal transducter and activator of transcription). Після фосфорилювання білки сімейства STAT транслокуються в ядро клітини й активують експресію відповідних рецепторів (рис. 3) [9].
Пролактин у канцерогенезі молочної залози
Канцерогенез МЗ є багатоетапним послідовним процесом, що починається з гіперплазії епітелію з подальшим утворенням протокової і лобулярної карциноми in situ і наступним прогресуванням до інвазивного й метастатичного РМЗ [7].
Дослідження in vitro та in vivo
У дослідженні E. Ginsburg та співавт. (2010) на тваринних моделях доведено, що три специфічні ізоформи Прл експресуються як у нормальних, так і в ракових клітинах і тканинах МЗ у кролів [12].
Пролактин є не тільки гормоном, але й цитокіном. Експресія пролактину і його рецепторів у ракових клітинах підтверджує його дію як авто- і паракринного фактора росту [14].
Був виявлений факт підвищеної секреції Прл жировою тканиною. З урахуванням того, що жирова тканина становить більшу частину строми МЗ, вона є потенційно найбагатшим локальним джерелом Прл. У ній виробляється й депонується велика кількість цитокінів, зокрема і Прл, і гормонів, які діють місцево або віддалено. Адипоцити можуть бути джерелом відносно високої концентрації Прл у ділянці формування пухлини, забезпечуючи таким чином основні ланки канцерогенезу МЗ [35].
Пролактин регулює ремоделювання актину й підсилює рух клітин РМЗ, що стосується прогресування пухлини [13].
Численні дослідження вказують на роль Прл у підвищенні сприйнятливості до хімічних канцерогенів у МЗ гризунів. Експресія Прл з підвищеною активацією пролактинових рецепторів достатня для індукції канцерогенезу МЗ у трансгенних мишей [15].
Дані дослідження [19] свідчать про те, що коекспресія прогестерону й Прл при РМЗ впливає на експресію генів за більш складним механізмом, ніж вважалося раніше, і, ймовірно, за допомогою регуляторів транскрипції. Передача Прл при РМЗ практично не залежить від STAT5A/B.
Відомо, що Прл здатний стимулювати ангіогенез. Механізм дії полягає як у безпосередній стимуляції проліферації клітин ендотелію, так і в активації вироблення різних проангіогенних факторів (фактор росту ендотелію судин, англ. VEGF), що є фундаментальним етапом росту й метастазування [10].
Епітеліально-мезенхімальний перехід (ЕМП) — це важливий процес, який впливає на пухлинну прогресію, метастазування й резистентність до протипухлинного лікування. При аналізі 102 зразків РМЗ I.Y. Hackim і співавт. (2019) оцінювали прогностичне значення коекспресії рецепторів Прл (супресора ЕМП), TGFβRI і TGFβRII (активаторів ЕМП) із різними клініко-морфологічними параметрами пухлини. З’ясовано, що тканина злоякісних пухлин мала значно нижчий рівень експресії цих рецепторів, ніж доброякісна й нормальна тканина МЗ. Вищі рівні експресії зазначених рецепторів спостерігались при менш агресивних РМЗ, зокрема при високому диференціюванні пухлини, люмінальних підтипах РМЗ і менш поширених стадіях захворювання. Крім того, результати свідчать, що експресія генних сигнатур PRLR/TGFβRI/TGFβRII більше корелює з високим диферціюванням пухлини і може бути визначена як більш сприятливий клінічний варіант серед люмінальних B і Her/2-neu-позитивних підтипах РМЗ. Знижена експресія цих показників є індикатором агресивності й поганого клінічного прогнозу [17].
Позитивна кореляція експресії Прл була пов’язана з більш високим диференціюванням пухлини, її меншим розміром і відсутністю віддалених метастазів, це продемонстровано в дослідженні [18]. Пацієнтки, хворі на РМЗ, з більш високими рівнями мРНК мали тривалу безрецидивну виживаність. На думку авторів, висока експресія Прл є фактором сприятливого прогнозу.
I.Y. Hachim та співавт. (2016) зафіксували протипухлинні ефекти Прл на Her/2-neu-позитивні й люмінальні В-клітини РМЗ. Дія Прл викликала вірогідну редукцію ALDH- (альдегіддегідрогеназа) позитивних стволових пухлинних клітин і знижувала їх здатність до утворення клітинних мікросфер. На молекулярному рівні продемонстровано, що ALDH супресує ген-експресор синтезу молекул, що задіяні в регуляції поділу стволових пухлинних клітин, їх ініціації, медикаментозної резистентності, і, нарешті, є маркером поганого прогнозу РМЗ у пацієнток із підвищеною субпопуляцією стволових ALDH-позитивних пухлинних клітин. Результати дослідження демонструють, що Прл перешкоджає росту пухлин HER/2-neu-позитивних ксенотрансплантатів і пригнічує експресію проліферативного маркера Ki-67 [29].
За допомогою імуногістохімічного дослідження (ІГХ) і мультигенного аналізу ця ж група дослідників виявила, що Прл-рецептори і рівні мРНК суттєво знижені при трипл-негативному РМЗ (ТНРМЗ). На підставі цих даних запропоновано виділити підгрупу пацієнтів із ТНРМЗ і експресією рецепторів Прл, у яких пухлини демонстрували епітеліальне люмінальне диференціювання. Важливим висновком є те, що експресія компонентів сигнального шляху (JAK/STAT) і їх генні сигнатури є предиктивними факторами вірогідно сприятливого прогнозу при ТНРМЗ. Відновлення/активація шляху JAK/STAT у клітинах ТНРМЗ, які належать до мезенхімальної підгрупи або TNBC-PRLR підгрупи, пригнічує канцерогенез. На думку авторів, це може забезпечити новітні підходи до персоніфікованого лікування пацієнтів із ТНРМЗ [38].
T.S. Kalinina та співавт. (2020) відзначають, що при люмінальному А і В з гіперекспресією Her/2-neu Прл може діяти як стимулятор прогресування пухлини, а при люмінальному B без Her/2-neu-експресії і ТНРМЗ — відігравати роль інгібітору пухлини. Методом полімеразної ланцюгової реакції було виявлено високі рівні експресії Прл-рецепторів при люмінальних підтипах, особливо люмінальному А. При Her2/neu-позитивновному ER-, PR-негативному РМЗ рівні мРНК Прл були знижені в тканині РМЗ порівняно з нормальною тканиною. При люмінальному В Her/2-neu-негативному РМЗ високі рівні Прл корелюють з меншими розмірами пухлини. При ТНРМЗ і люмінальному РМЗ експресія Прл корелювала з експресією андрогенових рецепторів. Експресія Прл-рецепторів мала вікову залежність: при люмінальному А була підвищена в осіб до 65 років, при люмінальному В Her/2-neu-негативному — знижена в пацієнток, молодших за 40 років, і при ТНРМЗ — знижена в жінок, молодших за 50 років [28].
Дані in vivo переконливо підтверджують вирішальну роль Прл у стимуляції росту пухлин МЗ, проте він продемонстрував тільки слабку проліферативну дію на ракові клітини in vitro [20].
Дані літератури [21–23] свідчать, що пролактин-індукований білок, пов’язаний з РМЗ, експресується в більшості пухлин МЗ і відіграє важливу роль у біології цього захворювання. Важливість пролактин-індукованого білка в проліферації клітин була продемонстрована тим фактом, що він сприяє росту клітин раку молочної залози, стимуляції інвазії, а його експресія необхідна для проліферації клітинних ліній.
Більш висока експресія мРНК пролактин-індукованого протеїну (ПІП) характеризувалася значно більш тривалою безрецидивною виживаністю (DFS, p = 0,0093), а також виживаністю без метастазування (MFS, p = 0,0144). Крім того, рівень експресії мРНК ПІП значно вищий при люмінальному A, ніж в інших молекулярних підтипах. Більш висока експресія спостерігалася у випадках карцином МЗ G1, G2 порівняно з G3 (р = 0,0027 і р = 0,0013 відповідно) [24].
Доклінічні дослідження [25, 26] підтверджують внесок передачі сигналів рецептора Прл у канцерогенезі МЗ і простати, механізми прогресування. Передача сигналів PRLR/STAT5 діє як проонкогенний шлях. Зокрема, він сприяє ампліфікації стійких до лікування стовбурових клітин/клітин-попередників простати, є предиктором раннього рецидиву раку й сприяє метастазуванню. Навпаки, сигнальний шлях PRLR/STAT5 при РМЗ прогнозує сприятливі клінічні результати.
Сигнальний каскад Прл з огляду на його важливість для патології обох захворювань став потенційною мішенню для лікування. Проте гуманізоване антитіло (АТ) LFA102 у І фазі клінічного дослідження в пацієнтів з метастатичним раком передміхурової залози і РМЗ не виявило протипухлинної активності як монотерапія [27].
Невтішні результати цього дослідження стали поштовхом для розробки біспецифічного антитіла (PRLR-DbsAb), направленого як на антиген Прл-рецепторів, так і на поверхневі CD3 T-клітини. У дослідженнях in vitro це АТ викликає активацію і міграцію Т-клітин, продукцію ними Th-1-асоційованих цитокінів (IFN-γ і TNF-α), які призводять до загибелі клітин, що експресують рецептори Прл. На мишиних моделях РМЗ з використанням клітинних ліній (T47D, NOD/SCID) інтраперитонеальне введення АТ інгібувало ріст пухлини і більш тривалу виживаність порівняно з мишами, які не отримували моноклональне АТ PRLR (mLb PRLR), що може стати перспективою для лікування [30].
Епідеміологічні дослідження
З’ясування ризику Прл завдячує двом великим проспективним дослідженням Nurses’ Health Study і Nurses’ Health Study II, які були проведенні у 1989–1995 роках. При координації вчених декількох провідних медичних центрів, зокрема Гарвардської медичної школи, були відібрані медичні сестри віком 35–55 років, які погодились на участь у дослідженні й обробку персональних даних. Дослідження почалось у 1976 році. Вивчався вплив різних факторів, зокрема методу контрацепції, фізичної активності, менопаузального статусу, вагітності й лактації, тютюнопаління [16, 39].
У рамках дослідження S.S. Tworoger та співавт. (2013) було вивчено зв’язок концентрації Прл з ризиком РМЗ у жінок 42–55 років (з яких 68 % перебували в пременопаузі). Після забору зразків крові й до червня 2000 року було діагностовано 377 випадків РМЗ. Була виявлена незначна позитивна кореляція між рівнем Прл і ризиком РМЗ. Оцінка ризику не залежала від менопаузального статусу, інвазивності пухлини й наявності естрогенових рецепторів у ній. В об’єднаному аналізі з іншими когортами жінок NHS I і NHS II (n = 1539 випадків, 2681 — у контрольній групі, вік 32–70 років) встановлено, що відносний ризик становив 1,3 (95% ДІ 1,1–1,6; p = 0,002) і не залежав від менопаузального статусу, збільшуючись при ER-позитивних пухлинах [16]. При додатковому аналізі (Tworoger S.S. і співавт., 2007) було з’ясовано, що відносний ризик РМЗ корелює з підвищенням рівня Прл протягом 10 років після постановки діагнозу. Не було виявлено статистично значущих відмінностей між протоковим і часточковим раками, інвазивним і раком in situ [39].
K. Tikk і співавт. (2015) методом «випадок — конт–роль» дослідили європейську когорту EPIC, що включала 366 521 жінку у 1992–2000 роках з 10 європейських країн. Був вивчений зв’язок між рівнем Прл і ризиком неінвазивного РМЗ з урахуванням менопаузального статусу й використання замісної гормональної терапії (ЗГТ). У загальній когорті жінок був знайдений статистично вірогідний зв’язок між високим рівнем циркулючого Прл і ризиком РМЗ in situ незалежно від менопаузального статусу й застосування ЗГТ. Згаданий статистичний зв’язок був більш виражений у постменопаузальних жінок, які використовували ЗГТ, порівняно з тими, які її не використовували, а також у жінок, у яких неінвазивний РМЗ був діагностований < 4 років порівняно з > 4 років після здачі аналізу, і в пацієнток, які не народжували. Відомо, що наявність пологів в анамнезі є захисним фактором, пов’язаним з повільним зниженням рівня Прл після вагітності [37].
У метааналізі [36] результати 7 досліджень виявили позитивний зв’язок між рівнями Прл у плазмі й ризиком РМЗ серед пацієнток у постменопаузі, але не в пременопаузі. Крім того, існує позитивна кореляція між рівнями Прл у плазмі й ризиком РМЗ серед пацієнток з ER+/PR+ (відносний ризик (ВР) (95% довірчий інтервал (ДІ)) — 1,26, хоча ER–/PR– (ВР (95% ДІ) — 1), що, ймовірно, вказує на синергічний ефект Прл та естрадіолу на проліферацію клітин.
Дані епідеміологічних досліджень подані в табл. 2.
Висновки
Прл — це не лише плейотропний гормон передньої частки гіпофізу, але й молекула із широким спектром регуляторної активності, що має також властивості нейропептиду, цитокіну. Існують численні тканинні локуси позагіпофізарної секреції Прл.
Прл залучений у різні ланки канцерогенезу, зокрема ріст, проліферацію пухлинних клітин, їх диференціацію і апоптоз, метастазування, у механізмі ангіогенезу й медикаментозної резистентності.
Встановлено зв’язок експресії Прл у пухлинній тканині з клініко-морфологічними формами, молекулярно-генетичними варіантами, стадією РМЗ, віком хворих і їх менопаузальним статусом.
Експресія пролактинових рецепторів може бути прогностичним фактором сприятливого прогнозу в пацієнток із РМЗ. На даний момент триває низка досліджень, направлених на уточнення ролі Прл у механізмах прогресування пухлини в молочній залозі та пошук пролактин-опосередкованих впливів для оптимізації результатів протипухлинного лікування РМЗ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.

/59.jpg)
/60.jpg)
/61.jpg)
/62.jpg)
/64.jpg)
/65.jpg)