Журнал «Медицина неотложных состояний» Том 16, №6, 2020
Вернуться к номеру
Нейронспецифічна єнолаза як маркер пошкодження мозкової тканини у пацієнтів з ішемічним інсультом
Авторы: Стаднік С.М., Сайко О.В., Думченко О.І.
Військово-медичний клінічний центр Західного регіону, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
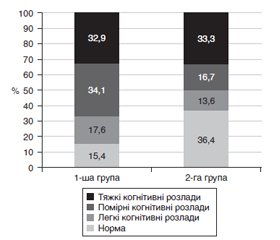
Актуальність. Перспективним напрямком у сучасній ангіоневрології є дослідження маркерів пошкодження мозкової тканини у сироватці крові пацієнтів у гострому періоді ішемічного інсульту та їх зіставлення з ініціальним рівнем неврологічного дефіциту і наслідком інсульту. Як маркер пошкодження мозкової тканини активно вивчаються функції нейронспецифічної єнолази (НСЄ). Мета — дослідити рівень НСЄ у гострому періоді ішемічного інсульту. Матеріали та методи. У клінічне дослідження включений 151 пацієнт (середній вік 61,5 ± 8,2 року), які розподілені на 2 групи: до 1-ї групи ввійшли 85 пацієнтів з гострим ішемічним інсультом; до 2-ї групи — 66 пацієнтів з хронічною ішемією мозку. Усім пацієнтам визначали рівень НСЄ у плазмі крові. Аналізували кореляції НСЄ з вираженістю неврологічного дефіциту за NIHSS, функціональною активністю за шкалою Бартел, рівнем інвалідизації за шкалою Ренкіна, вираженістю когнітивних розладів за MMSE. Визначали взаємозв’язки між рівнем НСЄ і виживаністю пацієнтів з ішемічним інсультом. Результати. У пацієнтів 1-ї групи рівень НСЄ перевищував показник пацієнтів 2-ї групи в 3,8 раза (p < 0,001). Встановили вірогідні відмінності рівня НСЄ залежно від локалізації вогнища ішемії — у басейні лівої середньої мозкової артерії і вертебробазилярному басейні (p = 0,04). У пацієнтів з тяжким неврологічним дефіцитом рівень НСЄ перевищував показник пацієнтів із середнім і легким неврологічним дефіцитом в 1,3 (p = 0,251) і в 2,3 (p = 0,007) раза відповідно. Встановили кореляційний зв’язок між рівнем НСЄ та ступенем вираженості неврологічного дефіциту (r = 0,67, p = 0,027), що свідчить про пряму залежність ступеня ішемічного ушкодження та неврологічних розладів. У пацієнтів з тяжкими когнітивними розладами рівень НСЄ перевищував показник пацієнтів із помірними і легкими когнітивними розладами в 1,2 (p = 0,444) і в 1,9 (p = 0,037) раза відповідно. При оцінці взаємозв’язку рівня НСЄ з наслідками інсульту виявлена тенденція до більш високих показників НСЄ у померлих (p = 0,083). Визначили граничний рівень НСЄ у крові пацієнтів з ішемічним інсультом — 40 нг/мл. Висновки. Визначення НСЄ у плазмі крові підтверджує ступінь пошкодження нейронів і є інформативним показником наявності неврологічного дефіциту у хворих з гострим ішемічним інсультом. Отримані результати свідчать про потенційну роль визначення вмісту НСЄ у поліпшенні стратифікації ризику летального наслідку у пацієнтів з ішемічним інсультом.
Актуальность. Перспективным направлением в современной ангионеврологии является исследование маркеров повреждения мозговой ткани в сыворотке крови пациентов в остром периоде ишемического инсульта и их сопоставление с инициальным уровнем неврологического дефицита и исходом инсульта. В качестве маркера повреждения мозговой ткани активно изучаются функции нейронспецифической енолазы (НСЕ). Цель — исследовать уровень НСЕ в остром периоде ишемического инсульта. Материалы и методы. В клиническое исследование включен 151 пациент (средний возраст 61,5 ± 8,2 года), которые распределены на 2 группы: в 1-ю группу вошли 85 пациентов с острым ишемическим инсультом; во 2-ю группу — 66 пациентов с хронической ишемией мозга. Всем пациентам определяли уровень НСЕ в плазме крови. Анализировали корреляции НСЕ с выраженностью неврологического дефицита по NIHSS, функциональной активностью по шкале Бартел, уровнем инвалидизации по шкале Ренкина, выраженностью когнитивных расстройств по MMSE. Определяли взаимосвязи между уровнем НСЕ и выживанием пациентов с ишемическим инсультом. Результаты. У пациентов 1-й группы уровень НСЕ превышал показатель пациентов 2-й группы в 3,8 раза (p < 0,001). Установили достоверные различия уровня НСЕ в зависимости от локализации очага ишемии — в бассейне левой средней мозговой артерии и вертебробазилярном бассейне (p = 0,04). У пациентов с тяжелым неврологическим дефицитом уровень НСЕ превышал показатель пациентов со средним и легким неврологическим дефицитом в 1,3 (p = 0,251) и в 2,3 (p = 0,007) раза соответственно. Установили корреляционную связь между уровнем НСЕ и степенью выраженности неврологического дефицита (r = 0,67, p = 0,027), что свидетельствует о прямой зависимости степени ишемического повреждения и неврологических расстройств. У пациентов с тяжелыми когнитивными расстройствами уровень НСЕ превышал показатель пациентов с умеренными и легкими когнитивными расстройствами в 1,2 (p = 0,444) и в 1,9 (p = 0,037) раза соответственно. При оценке взаимосвязи уровня НСЕ с исходом инсульта выявлена тенденция к более высоким показателям НСЕ у умерших (p = 0,083). Определили пороговое значение уровня НСЕ в крови пациентов с ишемическим инсультом — 40 нг/мл. Выводы. Определение НСЕ в плазме крови подтверждает степень повреждения нейронов и является информативным показателем наличия неврологического дефицита у больных с острым ишемическим инсультом. Полученные результаты свидетельствуют о потенциальной роли определения содержания НСЕ в улучшении стратификации риска летального исхода у пациентов с ишемическим инсультом.
Background. A promising direction in modern angioneurology is the study of markers of brain tissue damage in the blood serum of patients in the acute period of ischemic stroke and their comparison with the initial level of neurologic deficit and stroke outcome. As a marker of brain tissue damage, the functions of neuron-specific enolase (NSE) are being actively studied. To evaluate the level of NSE in the acute period of ischemic stroke was the purpose of the work. Materials and methods. The clinical trial included 151 patients (mean age 61.5 ± 8.2 years), who were divided into 2 groups: group 1 consisted of 85 patients with acute ischemic stroke; group 2 — of 66 patients with chronic cerebral ischemia. Plasma NSE level was evaluated in all patients. We analyzed the correlations of NSE with the severity of neurologic deficit according to the National Institutes of Health Stroke Scale, functional activity — using Barthel index, the level of disability — on the modified Rankin scale, and the severity of cognitive impairment — according to the Mini-Mental State Examination. The relationships between the level of NSE and the survival of patients with ischemic stroke were determined. Results. In patients of group 1, the level of NSE exceeded that of the patients in group 2 by 3.8 times (p < 0.001). We established significant differences in the level of NSE depending on the location of the ischemic focus — involving the left middle cerebral artery and the vertebrobasilar bed (p = 0.04). In patients with severe neurologic deficit, NSE level exceeded that of patients with moderate and mild neurologic deficit by 1.3 (p = 0.251) and 2.3 (p = 0.007) times, respectively. A correlation was found between the level of NSE and the severity of neurologic deficit (r = 0.67, p = 0.027), which indicates a direct relationship between the degree of ischemic injury and neurological disorders. In patients with severe cognitive impairment, the level of NSE exceeded that of patients with moderate and mild cognitive impairment by 1.2 (p = 0.444) and 1.9 (p = 0.037) times, respectively. When assessing the relationship between the level of NSE and stroke outcome, a tendency to higher NSE was revealed in the group of deceased people (p = 0.083). The threshold NSE value in the blood of patients with ischemic stroke was determined — 40 ng/ml. Conclusions. Determination of NSE in plasma confirms the degree of damage to neurons and is an informative indicator for the presence of neurologic deficit in patients with acute ischemic stroke. The results indicate the potential role of evaluating the content of NSE in improving the stratification of the risk of death in patients with ischemic stroke.
ішемічний інсульт; хронічна ішемія мозку; нейронспецифічна єнолаза; неврологічний дефіцит; когнітивні розлади
ишемический инсульт; хроническая ишемия головного мозга; нейронспецифическая енолаза; неврологический дефицит; когнитивные расстройства
ischemic stroke; chronic brain ischemia; neuron-specific enolase; neurologic deficit; cognitive disorders
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Hankey G.J. Stroke. Lancet. 2016. https://doi.org/10.1016/S0140-6736(16)30962-X.
- Суслина З.А., Гулевская Т.С., Максимова М.Ю., Моргунов В.А. Нарушения мозгового кровообращения: диагностика, лечение, профилактика. М.: МЕДпресс-информ, 2016. 536 с.
- Ярош А.С., Пирогова Л.А., Филина Н.А. Современное состояние проблемы острых нарушений мозкового кровообращения. Журнал Гродненского ГМУ. 2014. № 3. С. 17-20.
- Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Клинико-эпидемиологические исследования — перспективное направление изучения церебральной патологии (сообщение первое). Анналы клинической и экспериментальной неврологии. 2009. Т. 3. № 3. С. 4-11. https://annaly-nevrologii.com/journal/index.php/pathID/issue/view/36.
- Lopez A.D., Mathers C.D., Ezzati M. Global and regional burden of disease and risk factors, 2001: Systematic analysis of population health data. Lancet. 2006. Vol. 367. P. 1747-1757. DOI: 10.1016/S0140-6736(06)68770-9.
- Сыскина Е.Н. Биохимические маркеры состояния ткани мозга и гемостаз у больных с тяжелыми формами инфарктов мозга в артериях каротидной системы: Автореф. дис... канд. мед. наук. 14.01.11 — «Нервные болезни», 03.01.04 — «Биохимия». М., 2011. 24 с.
- Шабалина А.А. Гемостаз и биохимические маркеры повреждения ткани мозга при атеротромботическом и лакунарном подтипах ишемического инсульта: Автореф. дис... канд. мед. наук. 14.00.13 — «Нервные болезни», 03.00.04 — «Биологическая химия». М., 2008. 31 с.
- Koh P.O. Proteomic analysis of focal cerebral ischemic injury in male rats. J. Vet. Med. Sci. 2010. Vol. 72. № 2. Р. 181-185. DOI: 10.1292/jvms.09-0364.
- Whiteley W., Tseng M.C., Sandercock P. Blood biomarkers in the diagnosis of ischemic stroke. A systematic review. Stroke. 2008. Vol. 39. P. 2902-2909. DOI: 10.1161/STROKEAHA.107.511261.
- Jauch E.C., Lindsell C., Broderick J. Association of serial biochemical markers with acute ischemic stroke. The National Institute of Neurological Disorders and Stroke recombinant tissue plasminogen activator stroke study. Stroke. 2006. Vol. 37. P. 2508-2513. DOI: 10.1161/01.STR.0000242290.01174.9e.
- Butterworth R.J., Wassif W.S., Sherwood R.A. Serum neuron-specific enolase, carnosinase, and their ratio in acute stroke. An enzymatic test for predicting outcome? Stroke. 1996. Vol. 27(11). P. 2064-2068. DOI: 10.1161/01.str.27.11.2064.
- Zierath D., Thullbery M., Hadwin J. CNS immune responses following experimental stroke. Neurocrit. Care. 2010. Vol. 12(2). P. 274-284. DOI: 10.1007/s12028-009-9270-4.
- Pandey A., Saxena K., Verma M. Correlative study between neuron-specific enolase and blood sugar level in ischemic stroke patients. J. Neurosci. Rural. Pract. 2011. Vol. 2(1). P. 50-54. DOI: 10.4103/0976-3147.80099.
- Nayak A.R., Badar S.R., Lande N. Prediction of outcome in diabetic acute ischemic stroke patients: a hospital-based pilot study report. Ann. Neurosci. 2016. Vol. 23. P. 199-208. https://doi.org/10.1159/000449480.
- Rodrigues-Yaňez M., Castellanos M., Sobrino T. Interleukin-10 facilitates the selection of patients for systemic thrombolysis. BMC Neurol. 2013. Vol. 13. 62 р. DOI: 10.1186/1471-2377-13-62.
- Jung C.S., Lange B., Zimmermann M. CSF and serum biomarkers focusing on cerebral vasospasm and ischemia after subarachnoid hemorrhage. Stroke research and treatment. 2013. DOI: 10.1155/2013/560305.
- Alatas Ö.D., Gűrger M., Ateşcelik M. Neuron-specific enolase, S100 calcium-binding protein B, and heat shock protein 70 levels in patients with intracranial hemorrhage. Medicine. 2015. Vol. 94(45). P. 1-5. DOI: 10.1097/MD.0000000000002007.
- Дементьева О.В., Старикова Н.Л. Клинические корреляции показателя нейрон-специфической энолазы у пациентов с первым в жизни ишемическим инсультом после системного тромболизиса. Уральский медицинский журнал. 2017. № 1(145). С. 32-36. https://www.elibrary.ru/contents.asp?issueid = 1818287.
- Brouns R., De Vil B., Cras P. Neurobiochemical markers of brain damage in cerebrospinal fluid of acute ischemic stroke patients. Clinical Chemistry. 2010. Vol. 56(3). P. 451-458. DOI: 10.1373/clinchem.2009.134122.
- Anand N., Stead L.G. Neuron-specific enolase as a marker for acute ischemic stroke: a systematic review. Cerebrovasc. Dis. 2005. Vol. 20. P. 213-219. DOI: 10.1159/000087701.
- Bharosay A., Bharosay V.V., Varma M. Correlation of brain biomarker neuron specific enolase (NSE) with degree of disability and neurological worsening in cerebrovascular stroke. Ind. J. Clin. Biochem. 2012. Vol. 27(2). P. 186-190. DOI: 10.1007/s12291-011-0172-9.
- Kawle A.P., Nayak A.R., Lande N.H. Comparative evaluation of risk factors, outcome and biomarkers levels in young and old acute ischemic stroke patients. Annals of Neurosciences. 2015. Vol. 22(2). P. 70-77. DOI: 10.5214/ans.0972.7531.220204.
- Zaheer S., Beg M., Rizvi I. Correlation between serum neuron specific enolase and functional neurological outcome in patients of acute ischemic stroke. Ann. Indian Acad. Neurol. 2013. Vol. 16(4). P. 504-508. DOI: 10.4103/0972-2327.120442.
- Gonzalez-Garcia S., Gonzalez-Quevedo A., Fernandez O. Concepcion Short-term prognostic value of serum neuron specific enolase and S100B in acute stroke patients. Clin. Biochem. 2012. Vol. 45. P. 1302-1307. DOI: 10.1016/j.clinbiochem.2012.07.094.
- Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. Руководство для врачей. М.: Медкнига, 2004. 456 с.
- Торопова Н.Е., Дорофеева Е.А., Дворянинова С.П., Васиева Ж.П. Оценка информативности нейрон-специфической енолазы определяемой, иммуноферментным методом. Клинич. лаб. диагностика. 1995. № 1. С. 15-17.

/74.jpg)