Резюме
Актуальність. Актуальність проблеми післяопераційної когнітивної дисфункції (ПОКД) обумовлена високою частотою її розвитку (до 30 % у некардіохірургічних пацієнтів), потребою в соціальній адаптації таких пацієнтів у подальшому, а також відповідними істотними економічними витратами на відновлення когнітивних функцій. Мета: виявити та проаналізувати фактори ризику розвитку ПОКД після отоларингологічних оперативних втручань в умовах загальної анестезії з керованою гіпотензією. Матеріали та методи. У дослідження було включено 127 хворих. Крім загальноклінічних і лабораторних аналізів, проведено до- та післяопераційне тестування нейрокогнітивних функцій, досліджено періопераційні показники стану антиоксидантної системи та активності вільнорадикального окислення ліпідів і протеїнів, рівні нейронспецифічних і запальних маркерів у крові. Результати. Рання ПОКД розвинулась у 31 (24,4 %) пацієнта. У пацієнтів із ПОКД та без такої виявлені відмінності (p < 0,05) між показниками: вік, рівень освіти, повторна операція, тривалість операції та анестезії, керованої інтраопераційної гіпотензії, глибина інтраопераційної седації, результати оцінки когнітивного статусу після операції, рівні продуктів перекисного окислення білків і ліпідів, нейронспецифічної енолази, інтерлейкіну-18 у крові, наявність післяопераційної інфекції. Висновки. Встановлено, що незалежними факторами ризику розвитку ранньої ПОКД після отоларингологічних оперативних втручань і загальної анестезії з керованою гіпотензією в регресійному аналізі є: похилий вік, низький рівень освіти, повторна операція, тривалість керованої інтраопераційної гіпотензії, глибина інтраопераційної седації.
Актуальность. Актуальность проблемы послеоперационной когнитивной дисфункции (ПОКД) обусловлена высокой частотой ее развития (до 30 % у некардиохирургических пациентов), что влечет за собой ряд психосоматических осложнений с потребностью в последующем социальной адаптации таких пациентов, а также существенными экономическими затратами на лечение этих больных. Цель: выявить и проанализировать факторы риска развития ПОКД после отоларингологических оперативных вмешательств в условиях общей анестезии с управляемой гипотонией. Материалы и методы. В исследование включены 127 больных. Кроме общеклинических и лабораторных данных, проведено до- и послеоперационное тестирование нейрокогнитивных функций, исследованы периоперационные показатели состояния антиоксидантной системы и активности свободнорадикального окисления липидов и протеинов, показатели нейронспецифических и воспалительных маркеров в крови. Результаты. Ранняя ПОКД развилась у 31 (24,4 %) пациента. Различия между пациентами с ПОКД и без ПОКД обнаружены (p < 0,05) между такими показателями: возраст, уровень образования, повторная операция, продолжительность операции, анестезии, управляемой интраоперационной гипотензии, глубина интраоперационной седации, результаты оценки когнитивного статуса после операции, уровни продуктов перекисного окисления белков и липидов, нейронспецифической энолазы, интерлейкина-18 в крови, наличие послеоперационной инфекции. Выводы. Установлено, что независимыми факторами риска развития ранней ПОКД после отоларингологических оперативных вмешательств в условиях общей анестезии с управляемой гипотензией в регрессионном анализе являются: пожилой возраст, низкий уровень образования, повторная операция, продолжительность управляемой интраоперационной гипотензии, глубина интраоперационной седации.
Background. Postoperative cognitive dysfunction (POCD) is an impairment of higher mental functions that may occur postoperatively and are related to the surgery and anesthesia. Medical and social impact of POCD is undoubted due to its high incidence (up to 30 % after non-cardiac surgery), high expenses related to the restoration of cognitive functions, as well as the need in social adaptation of the patients. Therefore, the question of the pathogenetically based method of choice for correction of cognitive dysfunction in the perioperative period remains a controversial issue. Purpose of the study is to identify and analyze risk factors for the development of POCD after otolaryngological surgeries under general anesthesia with controlled hypotension. Materials and methods. A prospective study was conducted in 127 otolaryngological patients (77 men and 50 women) undergoing surgical intervention under general anesthesia with controlled hypotension. Age of the patients was 40.17 ± 14.96 years. In addition to general clinical and laboratory data, pre- and postoperative testing of neurocognitive functions was performed, perioperative indicators of antioxidant systems and the activity of free radical oxidation of lipids and proteins were investigated, as well as indicators of neuron-specific and inflammatory markers in the blood. Statistical processing of the obtained data was performed in the statistical package SPSS 20 (SPSS Inc.). Results. Early POCD developed in 31 (24.4 %) patients. Differences between individuals with POCD and without POCD were found (p < 0.05) among the following indicators: age, level of education, reoperation, duration of surgery and anesthesia, intraoperative controlled hypotension, depth of intraoperative sedation, results of assessment of cognitive status after surgery, levels of products of protein and lipid peroxidation, neuron-specific enolase, interleukin-18 in the blood, the presence of postoperative infection. No differences were found (p > 0.05) among the following indicators: sex, body mass index, smoking, the presence of comorbid pathology, assessment of surgical and anesthestic risk in accordance with the American Society of Anesthesiologists, the level of intraoperative controlled hypotension, perioperative levels of glucose, lactate, neuron-specific enolase in the blood, perioperative assessment of anxiety and depression, preoperative levels of antioxidant system indicators and the activity of free radical oxidation of lipids and proteins in the blood. Conclusions. Patients with early POCD are characterized by significant changes in oxidative stress, both in the dynamics compared to baseline and in comparison with individuals without POCD. Early POCD is also characterized by worse results of neuropsychological testing in the postoperative period than in patients without POCD. Increased levels of interleukin-18 and a marker of neuronal damage — neuron-specific enolase versus baseline values is a typical perioperative dynamics. It was found that independent risk factors for early POCD after otolaryngological surgery and general anesthesia with controlled hypotension in the regression analysis are: old age, low level of education, reoperation, duration of intraoperative controlled hypotension, depth of intraoperative sedation.
Вступ
Післяопераційна когнітивна дисфункція (ПОКД) належить до частих клінічних ускладнень хірургічних втручань та включає широкий спектр когнітивних розладів, а саме: порушення пам’яті, мовлення, гнозису, праксису, уваги, інтелекту. Отже, ПОКД — це зниження когнітивних функцій хворих після перенесеного хірургічного втручання та анестезії у порівнянні з доопераційними показниками. Робоча група, що складається з фахівців різних спеціальностей, на початку 2018 року запропонувала новий термін «періопераційні нейрокогнітивні розлади» [1, 2].
Щорічно у світі проводиться понад 100 млн оперативних втручань в різних галузях хірургії та з використанням різних методів знеболювання. Цікаво, що рівень ПОКД залишається практично незмінним, незважаючи на зниження кількості інших ускладнень [3]. Згідно з літературними даними, після загальнохірургічних втручань частота ПОКД у ранньому післяопераційному періоді становить у середньому 17 % [2] і більше серед пацієнтів старших вікових категорій. Так, у пацієнтів середнього та похилого віку частота ПОКД може досягати 40 % через 7 днів після операції та 10–13 % через 3 місяці або довше після операції [4, 5]. Доведеним фактом є асоціація ПОКД із тривалістю перебування в лікарні, збільшенням смертності та зниженням довгострокової якості життя [6].
Упродовж останніх десятиліть метою багатьох досліджень є вивчення патофізіології ПОКД, але її етіологія й досі залишається незрозумілою. Вважається, що механізм виникнення ПОКД, зазвичай, є багатофакторним та включає поєднання хірургічних, анестезіологічних і особистих факторів пацієнта. Протягом останніх років з’явилися повідомлення про наявність певного зв’язку між загальною анестезією в умовах керованої артеріальної гіпотензії та ПОКД [7]. Зниження артеріального тиску дозволяє зменшити кровоточивість тканин у хірургічному полі, мінімізувати крововтрату, покращити візуалізацію і, отже, умови виконання і тривалість оперативного оториноларингологічного втручання [7]. Проте гіпотензивна анестезія асоціюється з ризиком зниження перфузії важливих органів і тканин, зокрема головного мозку [8]. Приблизно у третини пацієнтів, яким проводилась загальна анестезія з використанням керованої гіпотензії, були помітні когнітивні порушення у вигляді зниження пам’яті, погіршення концентрації уваги, швидкої втомлюваності. Ці дані обумовлюють актуальність дослідження можливостей зниження ризику когнітивних порушень шляхом визначення факторів ризику виникнення ПОКД та їх модифікації.
Метою цієї роботи було визначення актуальності проблеми ПОКД для отоларингологічних пацієнтів після виконання оперативних втручань в умовах загальної анестезії з використанням керованої інтраопераційної артеріальної гіпотензії та встановлення факторів ризику ранньої ПОКД.
Матеріали та методи
На базі отоларингологічного відділення КНП «Вінницька обласна клінічна лікарня ім. М.І. Пирогова ВОР» проведено проспективне контрольоване дослідження, в якому взяли участь 127 отоларингологічних хворих (77 чоловіків, 50 жінок), яким здійснено оперативні втручання під загальною анестезією з використанням керованої гіпотензії. Вік хворих — від 18 до 65 років (у середньому 40,17 ± 14,96 року); медіана віку — 40,0; інтерквартильний розмах — 25-й та 75-й процентилі — 28,0–54,0 року).
Критеріями включення в дослідження були: вік понад 18 років; заплановане отоларингологічне оперативне втручання під загальною анестезією тривалістю 1 година або більше із застосуванням керованої гіпотензії; анестезіологічний ризик за ASA (Американське товариство анестезіологів) — ІІ–ІІІ; відсутність у пацієнтів супутніх вад слуху та зору, деменції різного генезу (вихідна оцінка за шкалою MMSE — менше 23 балів), психічних захворювань; інформована згода хворого на участь у дослідженні.
Отоларингологічні оперативні втручання проводилися з приводу викривлення перетинки носа та хронічного гіпертрофічного/вазомоторного риніту, гострого пансинуситу/гемісинуситу, хронічного поліпозного пансинуситу, хронічного декомпенсованого тонзиліту, гострого гнійного середнього отиту, ускладненого мастоїдитом, хронічного мезотимпаніту, хронічного епітимпаніту, сторонніх тіл та остеом приносових порожнин. Операційно-анестезіологічний ризик оцінювали за шкалою ASA. Усім пацієнтам проводилась комбінована анестезія: індукція — пропофол (1,5–3 мг/кг), фентаніл (1 мкг/кг); підтримка анестезії — севофлуран (0,7–2,4 МАК) та фентаніл 0,05–0,5 мкг/кг/год; міорелаксація — атракуріум 0,5 мг/кг. Для досягнення керованої артеріальної гіпотензії під час операції вводили інфузійний розчин — 20 мл 0,5% розчину урапідилу за допомогою інфузійного насоса. Глибину седації контролювали за BIS-моніторингом.
У всіх пацієнтів оцінювали рівні тривоги та депресії за шкалами Спілбергера — Ханіна та Бека, когнітивні функції — методом коректурної проби (тест Бурдона) для дослідження концентрацiї уваги, з використанням тесту Лурія для оцінки стану короткострокової механічної пам’яті та тесту Струпа для визначення гнучкості когнітивного мислення в передопераційному періоді та на 7-й день після операції. Згідно з рекомендаціями Міжнародної робочої групи з номенклатури періопераційних когнітивних розладів, ПОКД реєстрували при зниженні показників нейропсихологічного тестування на 10 % і більше від вихідного рівня [1, 2].
Стан ферментативної антиоксидантної системи вивчали за активністю супероксиддисмутази та рівнем протеїнових сульфгідрильних груп (SH-груп). Активність супероксиддисмутази визначали за ступенем гальмування окислення кверцитину, рівень SH-груп у сироватці крові визначали за реакцією з реактивом Елмана — 5,5’-дитіобіс (2-нітробензоатом). Активність вільнорадикального окислення ліпідів оцінювали за вмістом первинних і вторинних продуктів ліпопероксидації, відповідно, дієнових кон’югатів та малонового діальдегіду в крові; активність процесів окисної модифікації протеїнів оцінювали на основі визначення вмісту карбонільних груп протеїнів у сироватці крові. Вміст дієнових кон’югатів оцінювали за світлопоглинанням ліпідного екстракту крові в ультрафіолетовій зоні спектра, рівень малонового діальдегіду — за реакцією з тіобарбітуровою кислотою за допомогою набору «ТБК-Агат» («Биоконт», РФ), рівень карбонільних груп окисно-модифікованих протеїнів — за реакцією з 2,4-динітрофенілгідразином. Імуноферментний метод використовували для визначення в сироватці крові рівня інтерлейкіну-18 (ІЛ-18) за набором «Интерлейкин-18-ИФА-БЕСТ» («Вектор-БЕСТ», РФ), рівня нейронспецифічної енолази — за набором «НСЕ-ІФА» («Хема», Україна).
Статистична обробка отриманих даних проводилась у статистичному пакеті SPSS 20 (SPSS Inc.) з використанням параметричних та непараметричних методів оцінки отриманих результатів. Дані подано у вигляді M ± σ (середнє значення ± середнє квадратичне відхилення). Відмінності між змінними оцінювали за допомогою t-критерію Стьюдента або U-критерію Манна — Уїтні для двох груп незалежних сукупностей (хі-квадрат). Для виявлення факторів ризику ПОКД застосовували логістичний регресійний аналіз. Критерієм значущості був показник імовірності помилки, або ймовірності прийняття помилкової гіпотези (p) — не більше 5 % (p < 0,05).
Результати
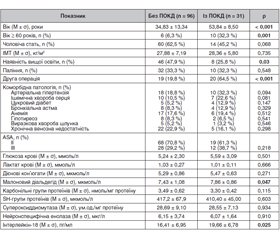
Розподіл на групи з ранньою ПОКД і без неї здійснювали згідно з результатами нейропсихологічного тестування, на 7-й день після операції (інтерквартильний інтервал Р5–Р95 знаходиться в діапазоні 3–11 днів). До групи ранньої ПОКД зарахували 31 (24,4 %) з 127 пацієнтів, у яких визначили зниження показників нейропсихологічного тестування на 10 % і більше від вихідного рівня (табл. 1).
Згідно з табл. 1, при аналізі вихідних відмінностей у групах із ПОКД і без неї виявили, що отоларингологічні хворі з ПОКД були вірогідно старше від пацієнтів без ПОКД (р < 0,001), рідше мали вищу освіту (співвідношення шансів (СШ) 0,38; 95% довірчий інтервал (ДІ) 0,15–0,93; р = 0,03) та частіше мали в анамнезі оперативні втручання під загальним знеболюванням (СШ 6,02; 95% ДІ 2,51–14,43; р < 0,001). Також виявлена тенденція до більш високого вмісту ІЛ-18 у крові в групі ПОКД (р = 0,025).
Порівняльний аналіз результатів нейропсихологічного тестування до і після операції показав відсутність вірогідних відмінностей у вихідних даних тестування. При порівнянні даних післяопераційного тестування визначили тенденцію до погіршення результатів тестів у хворих із ПОКД (табл. 2).
Відповідно до табл. 2, при порівнянні результатів тестування до і після операції всередині кожної групи виявили вірогідне погіршення результатів коректурної проби, тесту Лурія та тесту Струпа в групі з ПОКД (р < 0,01), тоді як у групі хворих без ПОКД такої динаміки відзначено не було. Звертає на себе увагу вірогідне зниження вираженості реактивної тривоги у пацієнтів обох груп (р < 0,001), натомість середній рівень особистої тривоги значущо знизився тільки в групі пацієнтів із ПОКД.
Під час аналізу були виявлені відмінності в періопераційних клінічних і лабораторних даних у пацієнтів обох груп (табл. 3).
/112.jpg)
За даними табл. 3, у групі пацієнтів із ПОКД була вірогідно більшою тривалість операції, анестезії та керованої інтраопераційної артеріальної гіпотензії (р < 0,05). Натомість розподіл хворих за ступенем контрольованої інтраопераційної артеріальної гіпотензії значущо не відрізнявся між аналізованими групами. Частота випадків із глибоким пригніченням свідомості за методом BIS-моніторингу була значуще меншою в групі хворих із ПОКД (СШ 0,21; 95% ДІ 0,08–0,52; р < 0,001), що зумовило вірогідні відмінності між середніми значеннями BIS-індексу в аналізованих групах (р = 0,040). Також у післяопераційному періоді виявили тенденції до більш високих рівнів малонового діальдегіду, карбонільних груп протеїнів, нейронспецифічної енолази та ІЛ-18 (р < 0,01) у крові хворих цієї групи. У післяопераційному періоді в групі з ПОКД була вірогідно більшою частота післяопераційних інфекцій (СШ 10,2; 95% ДІ 1,02–101,7; р = 0,017) (табл. 3).
Згідно з результатами мультиваріантного логістичного регресійного аналізу, факторами ризику ранньої ПОКД (через тиждень після операції) є похилий вік, низький рівень освіти, повторна операція, тривалість керованої інтраопераційної гіпотензії, глибина інтраопераційної препарат-індукованої депресії свідомості (табл. 4).
Обговорення
Згідно з результатами нашого дослідження, частота виникнення ранньої ПОКД після отоларингологічних оперативних втручань в умовах загальної анестезії з керованою гіпотензією може становити до 24,4 %. Реальну поширеність ПОКД важко оцінити, адже не завжди здійснюється нейропсихологічне обстеження пацієнтів у періопераційному періоді, легкі та середні форми ПОКД можуть не діагностуватися. За даними Alaa A. Niazi (2015), частота післяопераційної когнітивної дисфункції після септопластики в умовах керованої гіпотензії становила 23,3 % через 30 хв після завершення операції, 13,3 % через 60 хв і 6,6 % через 24 год [9]. Ці результати були порівнянними з результатами більш раннього дослідження, в якому вивчався вплив керованої гіпотензії під час загальної анестезії на ПОКД з використанням шкали MMSE як інструмента оцінки когнітивної функції [10]. У більшості хворих покращення когнітивної функції відбувається протягом наступних трьох місяців, проте існує прямий зв’язок між розвитком ПОКД і збільшенням тривалості госпіталізації, зниженням задоволеності пацієнтів якістю надання допомоги, погіршенням їх працездатності та якості життя, а також підвищенням летальності у людей похилого віку [6]. Отже, результати нашого дослідження та даних сучасної літератури однозначно свідчать про те, що наркоз та операція спричиняють розлади когнітивних функцій [4] і ризик розвитку таких порушень збільшується з віком. Так, у нашому дослідженні серед 31 хворого з післяопераційними когнітивними порушеннями третина хворих були віком 60 років і старше (32,3 %). Результати міжнародних проспективних рандомізованих контрольованих досліджень International Study of Post-Operative Cognitive Dysfunction (ISPOCD 1 та ISPOCD 2) також продемонстрували, що інцидентність як ранньої, так і пізньої (через 3 місяці після операції) ПОКД зростає з віком [4, 5]. Крім того, в дослідженні ISPOCD 1 [4], як і в наших спостереженнях, виявлено асоціацію ПОКД з низьким рівнем освіти та повторним оперативним втручанням в умовах загальної анестезії.
Ще одним фактором ризику, згідно з результатами нашого дослідження, є глибина інтраопераційної препарат-індукованої депресії свідомості. Так, частота ранньої ПОКД була істотно нижчою у пацієнтів, які перенесли глибоку анестезію з цільовим BIS-індексом у межах 30–45; частота розвитку ПОКД становила 11,8 % (8/68) при цільовому BIS-індексі 30–45 проти 38,9 % (23/59) при цільовому BIS-індексі 45–60 (р < 0,001). Такі дані підтримують загальну тенденцію, виявлену в попередніх дослідженнях у цій галузі [6, 11].
Натепер при отоларингологічних втручаннях в умовах загальної анестезії широко використовується метод керованої гіпотензії, що був запропонований Harvey Cushing у 1917 році. Інтраопераційна керована гіпотензія забезпечується шляхом введення гіпотензивних препаратів, таких як β-блокатори, блокатори кальцієвих каналів, судинорозширюючі засоби, або наркозними препаратами (наприклад, пропофол, опіоїди, інгаляційні анестетики) [12]. У нашому дослідженні ми використовували урапідил, який має центральний та периферичний механізми дії; на периферії — переважно блокує постсинаптичні α1-адренорецептори і таким чином блокує судинозвужувальну дію катехоламінів; на центральному рівні модулює активність центру регуляції кровообігу; запобігає рефлекторному збільшенню тонусу симпатичної нервової системи чи зниженню симпатичного тонусу; призводить до зниження систолічного та діастолічного тиску шляхом зниження периферичного опору.
Фармакологічна блокада судинного тонусу у поєднанні з положенням хворого на операційному столі (положення Фовлера), при якому операційне поле розташовується максимально високо (постуральна ішемія), дає можливість істотно зменшити кровоточивість тканин в оперативній оториноларингології [7]. Водночас достеменно відомо, що гіпотензивна анестезія пов’язана з ризиком зниження перфузії важливих органів і тканин, зокрема головного мозку [8]. Проте існують дослідження, в яких продемонстровано подібну частоту ПОКД у групах як гіпотензивної, так і нормотензивної анестезії [13], адже після операції пацієнти можуть зазнати зниження когнітивних функцій через різноманітні причини, зокрема, залишкову дію анестетиків, післяопераційний біль, запальну або метаболічну стресову відповідь, асоційовану з оперативним втручанням, тривалістю наркозу, наявністю післяопераційної інфекції тощо. Як і в дослідженні S. Nowak et al. (2016), ми не виявили статистично значущого впливу ступеня контрольованої інтраопераційної гіпотензії на результати психометричних тестів [6]. Натомість ми виявили асоціацію між тривалістю керованої інтраопераційної гіпотензії та ранньою ПОКД: 91,42 ± 28,66 хв у хворих із ПОКД проти 76,48 ± 27,74 хв у хворих без ПОКД (р = 0,014).
У багатьох працях описано кореляцію зниження когнітивної функції з реактивними формами кисню та окислювальним стресом [14]. Також одним із найбільш обговорюваних механізмів патогенезу ПОКД є розвиток системної запальної реакції [15]. У нашому дослідженні в пацієнтів із ПОКД виявлено вірогідне підвищення рівня прозапального цитокіну ІЛ-18 та маркерів окисної пероксидації білків та ліпідів, а значимість цього була підтверджена односпрямованим підвищенням рівня маркера нейронального пошкодження — нейронспецифічної енолази. Проте проведений множинний регресійний аналіз не підтвердив зв’язку між когнітивним станом та рівнями у крові малонового діальдегіду, карбонільних груп протеїнів та ІЛ-18, що, ймовірно, пояснюється їх взаємозв’язком з іншими незалежними змінними, включеними в цей аналіз.
За допомогою опитувальника Спілбергера — Ханіна було виявлено, що наші пацієнти відчували помірний рівень тривожності, оскільки рівень їх реактивної та особистісної тривожності, в середньому, перевищував нормальні значення і був у межах 31–44 балів. Цікаво, що наявність у хворих когнітивних розладів асоціювалась зі зниженням особистісної тривоги (р = 0,041), що підтверджено встановленим негативним кореляційним зв’язком між показниками нейропсихологічного тестування та шкалою Спілбергера — Ханіна (р < 0,05), при цьому кореляцій між рівнем реактивної тривоги, депресії та ПОКД виявлено не було.
Крім клінічних факторів, які піддаються аналізу як предиктори розвитку ПОКД, проводяться активні пошуки інформативних біохімічних маркерів, що відображають ступінь нейронального пошкодження і мають прогностичну цінність. Найбільш загальноприйнятими маркерами ураження головного мозку є протеїн S-100 і нейронспецифічна енолаза, яка є внутрішньоклітинним ферментом, що бере активну участь в енергетичному метаболізмі головного мозку. Як було зазначено вище, нами виявлено вірогідні відмінності в рівні нейронспецифічної енолази у пацієнтів із ПОКД та без неї, що відповідає результатам деяких досліджень [5].
Наведені дані є важливими та клінічно значущими. Наявність виявлених взаємозв’язків між рівнями біомаркерів і клініко-лабораторними показниками періопераційного періоду свідчить про можливість здійснення профілактики ПОКД на основі доступних у рутинній практиці даних і своєчасної їх корекції.
Висновки
Для пацієнтів із ранньою ПОКД характерними є значні зміни показників оксидативного стресу у динаміці як у порівнянні з вихідними даними, так і в порівнянні з пацієнтами без ПОКД. Для пацієнтів з ранньою ПОКД також характерні гірші, ніж у хворих без ПОКД, результати нейропсихологічного тестування в післяопераційному періоді.
Характерною періопераційною динамікою як прозапального ІЛ-18, так і маркера нейронального пошкодження нейронспецифічної енолази є підвищення їх рівня щодо вихідних значень.
Факторами ризику ранньої ПОКД (через тиждень після операції), інцидентність якої після отоларингологічних оперативних втручань в умовах гіпотензивної загальної анестезії становить 24,4 %, є похилий вік, низький рівень освіти, повторна операція, тривалість керованої інтраопераційної гіпотензії, глибина інтраопераційної препарат-індукованої депресії свідомості.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/111.jpg)
/112.jpg)
/113.jpg)