Журнал «Актуальная инфектология» Том 9, №1, 2021
Вернуться к номеру
Клініко-патогенетичне значення ясенної мікробіоти при ревматоїдному артриті
Авторы: Синяченко О.В., Єрмолаєва М.В., Гавілей Д.О., Лівенцова К.В., Верзілов С.М.
Донецький національний медичний університет, м. Лиман, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
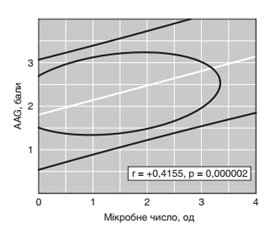
Актуальність. Тригерними чинниками щодо розвитку ревматоїдного артриту (РА) можуть бути інфекції, пов’язані з носійством в порожнині рота актиноміцетів, кампілобактерів, мікоплазм, порфіромонів, преводелів, протея, селемонів, стрептококів і фузобактерій, але їх роль у патогенезі захворювання вимагає уточнення. Зі свого боку, при РА вірогідно підвищується число випадків коморбідної інфекційної патології. Мета дослідження: вивчити якісний і кількісний склад мікробіоти порожнини рота при РА, оцінити роль окремих бактерій у патогенетичних побудовах захворювання. Матеріали та методи. Обстежений 121 хворий на РА віком 18–76 років (в середньому 49 років), серед яких було 19 % чоловіків і 81 % жінок. Тривалість РА від першої маніфестації захворювання становила в середньому 10 років. Частота серопозитивності РА за ревматоїдним фактором у крові становила 81 %, а за антитілами до цитрулінового циклічного пептиду — 75 %. І, ІІ і ІІІ ступені активності хвороби констатовані в 13, 45 та 42 % випадків відповідно, а співвідношення I, II, III і IV стадій патологічного процесу становило 1 : 5 : 5 : 3. Для оцінки кількості аеробних і факультативно-анаеробних мікроорганізмів, що вегетують на слизовій оболонці ясен, використовувалася методика стерильних паперових дисків. Застосовувалися набори «Мікро-ЛА-Тест», «СТРЕПТОтест 16», «АНАЕРОтест 23», «НЕФЕРМтест 24». Результати. Вегетацію асоціацій аеробів на яснах виявлено у 96,7 % від числа хворих, анаеробних бактерій — у 91,7 %, число яких було тісно пов’язане з клінічними, лабораторними та рентгеносонографічними ознаками РА, при цьому на інтегральний пейзаж ясенної мікробіоти впливає тяжкість перебігу коморбідного хронічного генералізованого пародонтиту, що діє на наявність в порожнині рота мораксел, сарцинів, стрептококів та еубактерій, причому число анаеробів відображає ступінь активності РА та мінеральну щільність кістки, а в патогенетичних побудовах окремих ознак захворювання (характер суглобового синдрому й ураження періартикулярних тканин) беруть участь аерококи, кандиди, клостридії, мегасфери, пропіонібактерії, сарцини, фузобактерії й еубактерії. Висновки. Отримані дані диктують необхідність розроблення нових підходів до медичної технології індивідуальної етіопатогенетичної терапії РА з коморбідним пародонтитом, визначення критеріїв, що дозволяють оцінювати активність патологічного процесу, прогнозувати характер перебігу хвороби й ефективність лікувальних заходів.
Актуальность. Триггерными факторами в отношении развития ревматоидного артрита (РА) могут быть инфекции, связанные с носительством в полости рта актиномицетов, кампилобактеров, микоплазм, порфиромонов, преводел, протея, селемонов, стрептококков и фузобактерий, но их роль в патогенезе заболевания требует уточнения. В свою очередь, при РА достоверно повышается число случаев коморбидной инфекционной патологии. Цель исследования: изучить качественный и количественный состав микробиоты полости рта при РА, оценить роль отдельных бактерий в патогенетических построениях заболевания. Материалы и методы. Обследованы 121 больной РА в возрасте 18–76 лет (в среднем 49 лет), среди которых было 19 % мужчин и 81 % женщин. Продолжительность от первой манифестации заболевания составила в среднем 10 лет. Частота серопозитивности РА по ревматоидному фактору в крови составила 81 %, а по антителам к цитруллиновому циклическому пептиду — 75 %. І, ІІ и ІІІ степени активности болезни констатированы в 13, 45 и 42 % случаев соответственно, а соотношение I, II, III и IV стадий патологического процесса составило 1 : 5 : 5 : 3. Для оценки количества аэробных и факультативно-анаэробных микроорганизмов, вегетирующих на слизистой оболочке десен, использовалась методика стерильных бумажных дисков. Применяли наборы «Микро-ЛА-Тест», «СТРЕПТОтест 16», «АНАЭРОтест 23», «НЕФЕРМтест 24». Результаты. Вегетация ассоциаций аэробов на деснах обнаружена у 96,7 % от числа больных, анаэробных бактерий — у 91,7 %, число которых тесно связано с клиническими, лабораторными и рентгеносонографическими признаками РА, при этом на интегральный пейзаж десенной микробиоты оказывает воздействие тяжесть течения коморбидного хронического генерализованного пародонтита, которая влияет на присутствие в полости рта моракселл, сарцинов, стрептококков и эубактерий, причем число анаэробов отражает степень активности РА и минеральную плотность кости, а в патогенетических построениях отдельных признаков заболевания (характер суставного синдрома и поражения периартикулярных тканей) участвуют аэрококки, кандиды, клостридии, мегасферы, пропионибактерии, сарцины, фузобактерии и эубактерии. Выводы. Полученные данные диктуют необходимость разработки новых подходов к медицинской технологии индивидуальной этиопатогенетической терапии РА с коморбидным пародонтитом, выделению критериев, позволяющих оценивать активность патологического процесса, прогнозировать характер течения болезни и эффективность лечебных мероприятий.
Background. The trigger factors of the development of rheumatoid arthritis (RA) may be infections associated with the carriage in the oral cavity of Actinomycetes, Campylobacter, Mycoplasma, Porphyromonas, Transducers, Proteus, Selemons, Streptococci, and Fusobacteria, but their role in the disease pathogenesis requires clarification. In turn, the quantity of cases of comorbid infectious pathology significantly increases in RA. The purpose was to study the qualitative and quantitative composition of the oral microbiota in RA, to assess the role of individual bacteria in the pathogenetic structures of the disease. Materials and methods. There were examined 121 RA patients aged 18–76 years (on average 49 years old), among whom there were 19 % men and 81 % women. The duration from the first manifestation of the disease averaged 10 years. The frequency of seropositivity of RA for rheumatoid factor in the blood was 81 %, and for antibodies to cyclic citrullinated peptide — 75 %. I, II, and III degrees of disease activity were determined in 13, 45, and 42 % of cases, respectively, and the ratio of I, II, III, and IV stages of the pathological process was 1 : 5 : 5 : 3. To assess the number of aerobic and facultative anaerobic microorganisms growing on the gingival mucosa, the technique of sterile paper discs was used. The kits “Mikro-La-Test”, “Streptotest-16”, “Anaero-Test 23”, “Neferm Test 24” were used. Results. The vegetation of associations of aerobes on the gums was found in 96.7 % of patients, anaerobic bacteria — in 91.7 %, the number of which is closely related to clinical, laboratory, and X-ray signs of RA, while the integral landscape of the gingival microbiota is influenced by the severity of the comorbid chronic generalized periodontitis, which affects the presence of Moraxella, Sarcina, Streptococci, and Eubacteria in the oral cavity, moreover, the number of anaerobes reflects the degree of RA activity and bone mineral density, and in the pathogenetic constructions of individual signs of the disease (the nature of the articular syndrome and damage to the periarticular tissues), Aerococci, Candida, Clostridia, Megasphaera, Propionibacteria, Sarcina, Fusobacteria, and Eubacteria are involved. Conclusions. The obtained data dictate the need to develop new approaches to medical technology for individual etiopathogenetic therapy of RA with comorbid periodontitis, to identify criteria that allow assessing the activity of the pathological process, predicting the nature of the course of the disease and the effectiveness of therapeutic measures.
артрит ревматоїдний; ясна; мікробіота; етіологія; патогенез
артрит ревматоидный; десна; микробиота; этиология; патогенез
rheumatoid arthritis; gingiva; microbiota; etiology; pathogenesis
Вступ
Матеріали і методи
Результати
Обговорення
Висновки
- Park J., Mendy A., Vieira E.R. Various types of arthritis in the United States: prevalence and age-related trends from 1999 to 2014. Am. J. Public Health. 2018. 108(2). 256-8. doi: 10.2105/AJPH.2017.304179.
- Silman A.J., Pearson J.E. Epidemiology and genetics of rheumatoid arthritis. Arthritis Res. 2018. 4(3). 265-72. doi: 10.1186/ar578.
- Oton T., Carmona L. The epidemiology of established rheumatoid arthritis. Best Pract. Res. Clin. Rheumatol. 2019. 33(5). 101477. doi: 10.1016/j.berh.2019.101477.
- Galushko E.A., Gordeev A.V. The concept of barrier organ disease in the pathogenesis of spondyloarthritis. Rheumatol. Sci Pract. 2016. 54(2). 199-205. doi: 10.14412/1995-4484-2016-199-205.
- Gabriel S.E. The epidemiology of rheumatoid arthritis. Rheum. Dis. Clin. North Am. 2017. 27(2). 269-81. doi: 10.1016/s0889-857x(05)70201-5.
- Pischon N., Pischon T., Krüger J. Association among rheumatoid arthritis, oral hygiene, and periodontitis. J. Periodontol. 2018. 79(6). 979-86. doi: 10.1902/jop.2008.070501.
- Mensch K., Nagy G., Nagy Á., Bródy A. Characteristics, diagnosis and treatment of the most common bacterial di–seases of the oral cavity. Orv. Hetil. 2019. 160(19). 739-46. doi: 10.1556/650.2019.31377.
- Silman A.J., Pearson J.E. Epidemiology and genetics of rheumatoid arthritis. Arthritis Res. 2018. 4(3). 265-72. doi: 10.1186/ar578.
- Engström M., Eriksson K., Lee L., Hermansson M., Johansson A., Nicholas A.P. et al. Increased citrullination and expression of peptidylarginine deiminases independently of P. gingivalis and A. actinomycetemcomitans in gingival tissue of patients with periodontitis. J. Transl. Med. 2018. 16(1). 214-9. doi: 10.1186/s12967-018-1588-2.
- Han Y.W., Wang X. Mobile microbiome: oral bacteria in extra-oral infections and inflammation. J. Dent. Res. 2018. 92(6). 485-91. doi: 10.1177/0022034513487559.
- Vitkov L., Hannig M., Minnich B., Herrmann M. Periodontal sources of citrullinated antigens and TLR agonists related to RA. Autoimmunity. 2018. 51(6). 304-9. doi: 10.1080/08916934.2018.1527907.
- Van Winkelhoff A.J., Loos B.G., van der Reijden W.A., van der Velden U. Porphyromonas gingivalis, Bacteroides forsythus and other putative periodontal pathogens in subjects with and without periodontal destruction. J. Clin. Periodontol. 2002. 29(11). 1023-8. doi: 10.1034/j.1600-051X.2002.291107.x.
- Gordeev A.V., Galushko E.A., Savushkina N.M., Lila A.M. Is periodontitis a harbinger of rheumatoid arthritis? Rheumatol. Sci Pract. 2018. 56(5). 613-21. doi.org/10.14412/1995-4484-2018-613-621.
- Moen K., Brun J.G., Madland T.M. Immunoglobulin G and A antibody responses to Bacteroides forsythus and Prevotella intermedia in sera and synovial fluids of arthritis patients. Clin. Diagn. Lab. Immunol. 2013. 10(6). 1043-50.
- Martinez-Martinez R.E., Abud-Mendoza C., Patino-Marin N., Rizo-Rodríguez J.C., Little J.W., Loyola-Rodríguez J.P. Detection of periodontal bacterial DNA in serum and synovial fluid in refractory rheumatoid arthritis patients. J. Clin. Periodontol. 2009. 36(12). 1004-10. doi: 10.1111/j.1600-051X.2009.01496.x.
- Rams T.E., Listgarten M.A., Slots J. Utility of 5 major putative periodontal pathogens and selected clinical parameters to predict periodontal breakdown on maintenance care. J. Clin. Peridontol. 2016. 23(4). 346-54. doi: 10.1111/j.1600-051X.2016.tb00556.x.
- Ouedraogo D.D., Tiendrebeogo J., Guiguimde P.L. Periodontal disease in patients with rheumatoid arthritis in SubSaharan Africa: A case-control study. Joint Bone Spine. 2017. 84(1). 113-4. doi: 10.1016/j.jbspin.2016.02.014.
- Havemose-Poulsen A., Sorensen L.K., Stoltze K. Cytokine profiles in peripheral blood and whole blood cell cultures associated with aggressive periodontitis, juvenile idiopathic arthritis, and rheumatoid arthritis. J. Periodontol. 2015. 76(12). 2276-85. doi: 10.1902/jop.2015.76.12.2276.
- Graves D.T., Corrêa J.D., Silva T.A. The oral microbiota is modified by systemic diseases. J. Dent. Res. 2019. 98(2). 148-56. doi: 10.1177/0022034518805739.
- Konkel J.E., O’Boyle C., Krishnan S. Distal consequences of oral inflammation. Front. Immunol. 2019. 25(10). 1403. doi: 10.3389/fimmu.2019.01403.
- Kumar P.S. From focal sepsis to periodontal medicine: a century of exploring the role of the oral microbiome in systemic disease. J. Physiol. 2017. 595(2). 465-76. doi: 10.1113/JP272427.
- Grevich S., Lee P., Leroux B., Ringold S., Darveau R., Henstorf G. et al. Oral health and plaque microbial profile in juvenile idiopathic arthritis. Pediatr. Rheumatol. Online J. 2019. 17(1). 81-9. doi: 10.1186/s12969-019-0387-5.
- Rajkarnikar J., Thomas B.S., Rao S.K. Inter-relationship between rheumatoid arthritis and periodontitis. Kathmandu Univ. Med. J. 2018. 11(41). 22-6. doi: 10.3126/kumj.v11i1.11018.
- Correa J.D., Fernandes G.R., Calderaro D.C., Mendonça S.M.S., Silva J.M., Albiero M.L. et al. Oral microbial dysbiosis linked to worsened periodontal condition in rheumatoid arthritis patients. Sci Rep. 2019. 9(1). 8379. doi: 10.1038/s41598-019-44674-6.
- Fuggle N.R., Smith T.O., Kaul A., Sofat N. Hand to mouth: a systematic review and meta-analysis of the association between rheumatoid arthritis and periodontitis. Front. Immunol. 2016. 2(7). 80. doi: 10.3389/fimmu.2016.00080.
- Correa M.G., Pires P.R., Ribeiro F.V., Pimentel S.P., Cirano F.R., Napimoga M.H. et al. Systemic treatment with resveratrol reduces the progression of experimental periodontitis and arthritis in rats. PLoS One. 2018. 13(10). 0204414. doi: 10.1371/journal.pone.0204414.
- Gamel E.B., Hashim N.T., Satti A., Gismalla B.G. Salivary TNFα levels in groups of subjects with rheumatoid arthritis and chronic periodontitis. BMC Res. Notes. 2017. 10(1). 34-9. doi: 10.1186/s13104-016-2341-7.
- Li R., Tian C., Postlethwaite A., Jiao Y., Garcia-Godoy F., Pattanaik D. et al. Rheumatoid arthritis and periodontal disease: What are the similarities and differences? Int. J. Rheum. Dis. 2017. 20(12). 1887-901. doi: 10.1111/1756-185X.13240.
- Issaranggun Na Ayuthaya B., Everts V., Pavasant P. The immunopathogenic and immunomodulatory effects of interleukin-12 in periodontal disease. Eur. J. Oral. Sci. 2018. 126(2). 75-83. doi: 10.1111/eos.12405.
- Smolik I., Robinson D., El-Gabalawy H.S. Periodontitis and rheumatoid arthritis: epidemiologic, clinical, and immunologic associations. Compend. Contin. Educ. Dent. 2009. 30(4). 188-94. PMID: 19441735.

/59.jpg)
/60.jpg)
/61.jpg)